围产期奶牛脂肪肝生物标志物受试者工作特征曲线分析
2022-02-15卢立叶牛富贵王中华林雪彦侯秋玲
卢立叶,牛富贵,王中华,林雪彦,王 云,侯秋玲
(山东农业大学动物科技学院,泰安 271000)
脂肪肝是围产期奶牛高发的一种代谢紊乱疾病,尤其是高产奶牛。围产期奶牛处于能量负平衡状态导致体脂过量动员,造成肝脏甘油三酯(TG)堆积从而形成脂肪肝[1]。奶牛患脂肪肝使产奶量下降[2],产犊间隔延长[3],降低全身免疫力并且伴随其他疾病发生[4],如乳房炎、酮病、子宫内膜炎、胎衣不下、蹄病、皱胃变位等,对奶牛的生产繁殖能力、寿命以及经济效益会产生巨大影响。因此,准确诊断脂肪肝既有利于奶牛健康又可以减少牧场经济损失。
奶牛产前21 d至产后21 d为围产期,此时奶牛面临胎儿分娩、子宫修复、激素紊乱、抵抗力下降以及泌乳等生理和代谢的巨大改变[5-6],因此,机体对能量、蛋白质、矿物质等营养物质的需求增加了数倍[7]。在此期间,奶牛采食量降低,通过饲粮摄入的营养物质不能满足泌乳需求,从而导致严重的能量负平衡。饲粮提供的生糖前体物质不足使能量缺乏,最终导致血清葡萄糖(Glu)和胰岛素(Ins)浓度降低,体脂发生动员,体内脂肪以非酯化脂肪酸(NEFA)的形式运输到肝脏,直至在肝脏氧化产生能量。然而,随着脂肪的分解,血浆中NEFA浓度升高。与奶牛患脂肪肝有关的因素众多[8],包括围产期奶牛处于能量负平衡状态、围产期奶牛特殊的生理阶段和代谢变化、肥胖程度、年龄、胎次、饲养管理和遗传等方面的因素。
目前,脂肪肝的检测方法有肝脏活检[9]、血清生理生化[10]、蛋白质组学和代谢组学[11]、数字化图像技术[12]等。在临床上,通过血清生理生化诊断奶牛脂肪肝是比较容易实现的方法,目前比较认可的诊断方法为Reid提出的Y值法[13],但是需要3项指标进行计算,不能直接判断,所以不适合规模化牧场。因此,本研究初步筛选与脂肪肝有关血清指标作为生物标志物,用受试者工作特征(ROC)曲线评估生物标志物及诊断敏感性、特异性、准确性和最佳临界值,以期为快速、准确诊断脂肪肝提供新依据。
1 材料与方法
1.1 材料
1.1.1 试验动物 在山东泰安金兰牧场、山东济南高速牧场随机选取77头产后7 d中国荷斯坦奶牛,奶牛平均胎次为2.18胎,平均年龄为3.67岁。分娩后每天挤奶2次,早晚各饲喂1次全混合饲粮(TMR),全天自由饮水。
1.1.2 样品采集 晨饲前2 h尾根静脉采集奶牛血液10 mL,放入促凝管内室温静置30 min,3 500 r/min离心10 min,用移液枪吸出血清,分装于1.5 mL离心管中,一式3份,-20 ℃保存。
1.1.3 主要试剂及仪器 谷丙转氨酶(ALT)、谷草转氨酶(AST)、碱性磷酸酶(ALP)、白蛋白(ALB)、Glu、TG、总胆固醇(TCHO)、高密度脂蛋白胆固醇(HDL-C)、低密度脂蛋白胆固醇(LDL-C)测定试剂盒均购自四川省迈克科技有限责任公司;NEFA ELISA试剂盒购自南京建成生物技术有限公司;Ins、胰高血糖素(Gln)、载脂蛋白B(ApoB)、转化生长因子-β(TGF-β)ELISA试剂盒均购自南京奥青生物技术有限公司。全自动生化分析仪(7020)购自日立有限公司。
1.2 方法
1.2.1 奶牛分组 检测采集的77头奶牛血清中AST、Glu、NEFA的含量,根据公式Y=-0.51-0.003NEFA+2.84Glu-0.528AST 计算出Y值,将Y>1作为正常组奶牛,Y<1为脂肪肝组奶牛[13]。
1.2.2 血清生理生化指标检测 用全自动生化分析仪检测血清中ALT、AST、ALP、TP、ALB、Glu、TG、TCHO、HDL-C、LDL-C、NEFA、Ins、Gln、ApoB和TGF-β等的含量。
1.2.3 脂肪肝生物标志物筛选 用Spearman法分析血清ALT、AST、ALP、TP、ALB、Glu、TG、TCHO、HDL-C、LDL-C、NEFA、Ins、Gln、ApoB、TGF-β、FGF-21与Y值的相关性,将相关性和组间差异显著的血清指标作为诊断脂肪肝的生物标志物。
1.2.4 ROC曲线评估 将生物标志物进行ROC曲线评估,曲线下面积(AUC)值>0.5[14]的指标具有诊断意义,经ROC曲线分析后获得生物标志物诊断脂肪肝的敏感性与特异性,根据敏感性与特异性计算出约登指数(Youden),不同的敏感性与特异性对应不同的约登指数,其中最大约登指数对应的即为生物标志物的最佳临界值、敏感性与特异性。
1.2.5 生物标志物准确性验证 用Reid方程计算的Y值诊断脂肪肝的准确率为100%做标准,利用实验室前期检测的461头奶牛血清AST和NEFA数据,验证本试验结果得出的NEFA和AST最佳临界值对脂肪肝诊断的准确率,NEFA诊断准确率(%)=NEFA临界值检出奶牛脂肪肝阳性数量/Y值检出脂肪肝阳性数量×100%;AST诊断准确率(%)=AST临界值检出的奶牛脂肪肝阳性数量/Y值检出脂肪肝阳性数量×100%;NEFA+AST诊断准确率(%)=NEFA、AST临界值共同检出的脂肪肝阳性数量/Y值检出脂肪肝阳性数量×100%。
1.3 数据统计与分析
用SPSS 26.0统计软件检验数据是否符合正态分布,结果用平均值±标准差表示,用非参数检验与独立样本t检验进行组间比较,用Spearman法进行相关性分析,用ROC曲线分析各检测指标的诊断统计意义,P<0.05表示差异显著,P<0.01表示差异极显著。 通过比较指标的ROC曲线下面积判断指标诊断的准确性,根据Youden指数确定生物标志物的最佳临界值,并计算敏感性、特异性及准确度。
2 结 果
2.1 奶牛生理生化指标检测结果
采集分娩后7 d的77头奶牛的血清,检测NEFA、Glu、AST含量,Reid方程诊断结果表明,脂肪肝奶牛有11头,正常奶牛有66头。奶牛的常规生理生化指标检测结果表明,NEFA、Glu、AST、ALT含量在两组间差异极显著(P<0.01),TP含量在两组间差异显著(P<0.05);血清中部分激素及细胞因子与载脂蛋白检测结果表明,两组间没有显著性差异(P>0.05)(表1)。

表1 不同组奶牛血清生理生化指标检测结果

续表
2.2 脂肪肝生物标志物筛选
通过Spearman法相关性分析可见,血清NEFA、Glu、AST、TP、TG、Gln与Y值之间存在极显著相关(P<0.01),NEFA、AST、ALT、Gln与Y值之间呈负相关(r=-0.63、r=-0.37、r=-0.28、r=-0.30);Glu、TP、TG、LDL-C、Ins与Y值之间呈正相关(r=0.69、r=0.50、r=0.35、r=0.29、r=0.25),结合表1中血清组间差异结果将NEFA、Glu、AST、ALT、TP、TG、LDL-C、Ins、Gln定为脂肪肝生物标志物(表2)。除血清NEFA、Glu、TP之外,其他指标相关系数绝对值都在0.50以下,相关性较低。

表2 血清指标与Y值间的相关性分析
2.3 ROC曲线评估生物标志物诊断性能
将生物标志物进行ROC曲线评估,以AUC值>0.50作为诊断标准,由表3可知,NEFA、AST、ALT和Gln的AUC值分别为0.91、0.75、0.75和0.56,可以用来准确诊断脂肪肝,诊断敏感性分别为81.8%、72.7%、63.6%和54.5%,诊断特异性分别为92.8%、89.4%、84.8%和69.7%,诊断最佳临界值分别为471.74 μmol/L、95.50 U/L、46.50 U/L和64.60 ng/mL。其他相关因子AUC值均在0.50以下,不能准确诊断脂肪肝。NEFA的AUC值最高,说明诊断的准确性也最高,敏感性与特异性也高于AST、ALT和Gln。
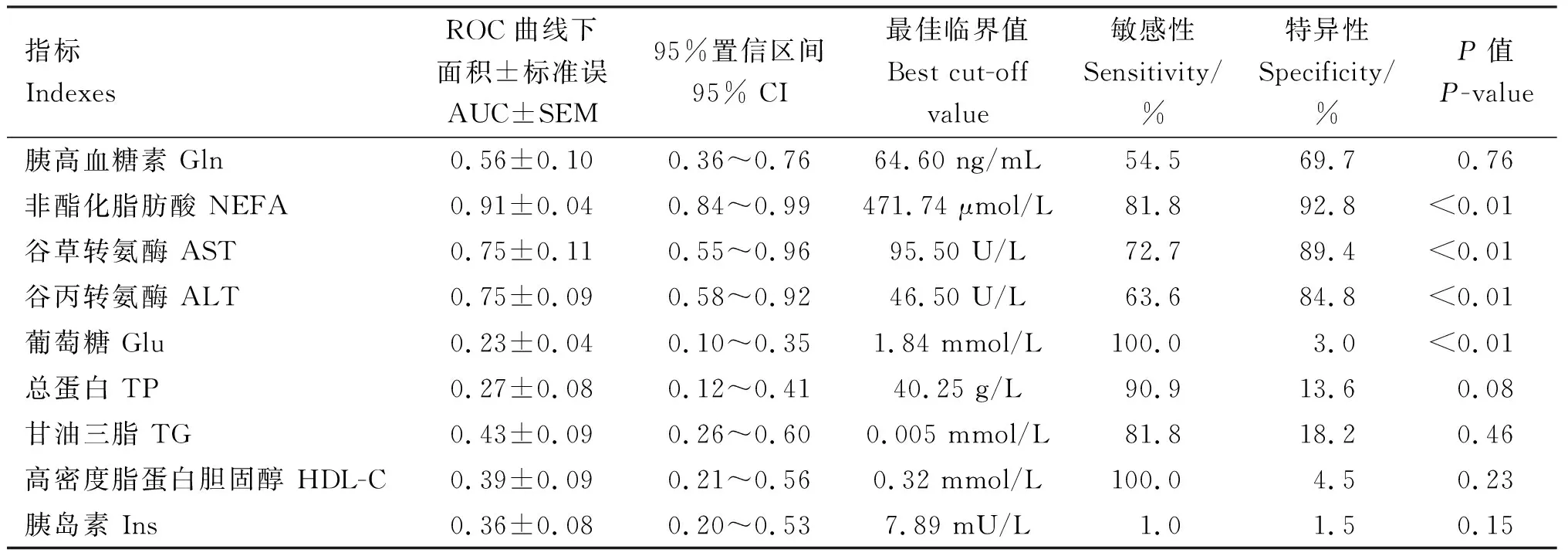
表3 血清生物标志物ROC曲线诊断效能
2.4 NEFA和AST诊断性能验证
461头奶牛血清NEFA和AST的检测结果表明,NEFA、AST和NEFA+AST的诊断准确率分别为89.96%、73.49%和69.08%(表4)。Y值诊断发病率为54.01%,NEFA、AST和NEFA+AST诊断发病率分别为48.59%、39.70%和37.31%。

表4 NEFA和AST最佳临界值对脂肪肝的诊断准确率
3 讨 论
Bobe等[15]研究表明,奶牛产犊天数与脂肪肝的发生密切相关,一般产后3~5 d开始发病,第2周发病较为严重,产后30 d内脂肪肝发病率达到35%~50%;也有研究表明,产后10 d奶牛脂肪肝发病率达到65%[16];Shen等[17]研究表明产后9 d奶牛脂肪肝发病率高达60.64%。本研究检测461头奶牛血清发现,产后7 d奶牛脂肪肝发病率高达54.01%,与以上研究结果相符。试验所选牧场对产后7 d奶牛进行集中管理,为了方便采样所以选择产后7 d为采血时间。
本研究将Reid基于血清学提出的回归公式作为诊断脂肪肝的方法,相较于其他方法,只需采集血清检测所需指标,用公式计算即可判断奶牛是否患脂肪肝。肝脏活检是诊断脂肪肝的金标准,Reid公式诊断脂肪肝的准确率仅次于肝脏活检,具有较高的诊断准确率,同时能够避免对奶牛造成损伤,目前为多数研究人员所使用[18]。肝脏活检会造成奶牛损伤,而Reid方程诊断脂肪肝需要多项指标进行公式计算,在临床使用受到限制。在医学领域,ROC曲线普遍用于疾病准确性诊断[19-20],尤其是生物标志物诊断,所以本试验用ROC曲线评估生物标志物最佳临界值来直接诊断脂肪肝。
通过生理生化指标间差异与相关性分析可筛选出作为生物标志物的生理生化指标。从生理生化结果来看,脂肪肝奶牛产后干物质摄入量急剧下降,使奶牛处于能量负平衡状态,导致NEFA浓度升高、Glu浓度降低。Glu是机体主要能量来源,奶牛开始泌乳后乳糖合成增多,乳腺对Glu的需求增加,为满足营养需求,Glu被合理分配于各组织器官,导致脂肪肝奶牛血液Glu降低。 Du等[10]对产后3~9 d的15头健康奶牛和轻度脂肪肝奶牛进行肝脏脂质代谢与线粒体适应研究表明,脂肪肝奶牛Glu低于正常奶牛,轻度脂肪肝奶牛的Glu为3.07 mmol/L,正常奶牛为3.75 mmol/L。 本研究中正常奶牛Glu含量为3.30 mmol/L,脂肪肝奶牛为2.67 mmol/L,脂肪肝奶牛Glu低于正常奶牛,与以上研究结果相符。AST、ALT主要通过肝脏产生,奶牛发生脂肪肝后,肝脏脂肪过度沉积、肝脏严重坏死或被破坏时造成AST、ALT升高。本研究中脂肪肝组TP低于正常组,说明脂肪肝奶牛体内能量低于正常奶牛,也进一步说明脂肪肝奶牛肝脏分泌TP的能力降低。
从相关性分析来看,血清NEFA、Glu、AST、ALT、TP、TG、LDL-C、Ins、Gln与Y值具有相关性,这些指标待进一步进行ROC分析。除NEFA、Glu、TP之外,其他生理生化指标与脂肪肝相关性普遍较低,可能是脂肪肝奶牛患病较轻,属于轻度脂肪肝,与正常奶牛之间的数值差距较小。
本研究经过ROC分析确定NEFA、AST、ALT和Gln可作为脂肪肝诊断的生物标志物。Jorritsma等[21]研究表明,产后6~17 d脂肪肝奶牛的NEFA浓度显著升高,可作为奶牛肝脂血症的指标;Samanc等[22]研究发现,产后2 d奶牛会发生脂肪肝,认为产犊前后肝脏NEFA的酯化与TG的聚集随着脂质动员增加[8];当肝脏发生严重坏死或脂肪过度沉积时AST、ALT浓度升高[6,23],表明AST、ALT可作为诊断奶牛脂肪肝的生物标志物;Sakowski等[24]研究表明,ALT的增加可能与产后奶牛能量负平衡引起的肝脏损伤有关。与ALT类似,AST浓度的增加表明围产期奶牛代谢变化增强。Gln对脂肪肝诊断的准确性低于NEFA、AST和ALT,可能是由于激素变化反映围产期奶牛全身代谢状态,不只代表肝脏,但不排除Gln可作为诊断脂肪肝的生物标志物。总之,NEFA升高、Glu降低时奶牛处于能量负平衡状态,AST、ALT升高是肝细胞以及线粒体发生破坏导致的,围产期脂肪肝奶牛NEFA、AST、ALT和Gln发生显著变化,说明其可以作为诊断围产期脂肪肝的生物标志物。
在验证部分,用NEFA、AST和NEFA+AST诊断脂肪肝的发病率均低于Y值诊断的结果,可能与Y值的诊断结果由3个生理生化指标共同得出有关,也有可能是本试验采样时间选自产后1周,奶牛未发展至重度脂肪肝,所以未在试验中做脂肪肝分级有关。单独用NEFA和AST最佳临界值诊断时阳性检出率高,而NEFA+AST的诊断准确率低于单独使用,但也具有较高的诊断准确率,可见通过最佳临界值可以更直接、快速、简便地用于规模化牧场诊断脂肪肝。
4 结 论
经过ROC曲线评估后表明NEFA、AST、ALT、Gln能作为诊断围产期奶牛脂肪肝的生物标志物。NEFA、AST、ALT、Gln作为生物标志物诊断脂肪肝具有明确的临床最佳临界值和较高的诊断敏感性与特异性,最佳临界值分别为471.74 μmol/L、95.50 U/L、46.50 U/L和64.60 ng/mL。
