病毒性动物疫病诊断技术研究进展
2022-02-15杨旭琼杨金易
杨旭琼,杨金易,王 弘
(华南农业大学食品学院,广东省食品质量与安全重点实验室,广州 510642)
近年来,随着畜牧业的发展动物疫病也逐渐增加,一些严重危害动物健康的疫病接连大批、大范围暴发,动物发病率和死亡率较高,严重影响畜牧业的发展,并造成巨大的经济损失。尽管新疫苗的开发和生物安全措施的实施对动物疫病的防控有一定的帮助,但动物疫病仍对动物卫生健康、动物源性食品安全、国民经济和环境构成严重威胁。病毒性疫病的增加使得动物疫病更加复杂,流行趋势更加严峻。根据世界动物卫生组织(OIE)发布的一份关于全球非洲猪瘟(African swine fever,ASF)形势的报告可看出:自2016年以来,全球范围内的ASF疫情明显增加;非洲、亚洲、欧洲是ASF主要暴发区,在2016-2020年造成全球生猪损失高达800多万头,特别是亚洲生猪损失比例最大,占全球报告损失总数的82%[1]。中国自2018年8月首次暴发高毒性ASF以来,疫情在全国范围内快速蔓延,仅5个月的时间因ASF造成生猪损失数目高达90多万头[2]。由于中国是世界上最大的猪肉生产国和消费国,猪肉产量约占全球供应量的53%,一旦大规模的ASF疫情暴发将对全球猪肉食品体系如饲料、生猪、猪肉产品的供应和价格等方面产生巨大影响[3]。目前,ASF在亚洲和欧洲一些国家尚未得到有效控制,对全球养猪业依然构成严重威胁。由于目前还没有商业化的非洲猪瘟病毒(African swine fever virus,ASFV)疫苗,中国的ASF防控策略在很大程度上依赖于严格的生物安全体系,与此同时,开发安全有效的动物疫苗将有助于控制和根除野猪和家猪的ASF[4]。但在有效疫苗或抗病毒治疗药物未成功研制出的情况下,动物疫病诊断技术的建立则是一种很好的防控措施。
传统的动物疫病病原体分离培养方法费时费力,一般需几天或十几天的时间才能得知检测结果,不利于疫病防控工作的开展,难以满足对突发疫情防控的要求,且需集中的实验室、大型设备和经验丰富的操作人员[5]。基于免疫血清学方法的病原体检测相对简便快速,但存在检测窗口期,不能及时做出早期诊断,且需特异性和高亲和力抗体,不易得到有效结果[6]。自PCR技术发明以来,其很快成为学术研究和临床诊断的热点技术,同时给病原体的诊断检测带来了革命性的变化[7]。第一代PCR技术应用成熟,第二代实时荧光定量PCR及第三代数字PCR技术相继实现了病原体核酸检测的相对定量和绝对定量[8]。不依赖于热循环设备的核酸等温扩增技术的出现及引入微机电系统(micro-electro-mechanical systems,MEMS)的微流控芯片加工平台突飞猛进的发展助力病原体核酸检测进入了一个新阶段,实现动物疫病全自动即时检验(point-of-care test,POCT)分子诊断“样本进,结果出”的现场快速检测[9-10]。随着动物疫病诊断技术的不断优化革新(图1),发展快速、灵敏、特异、高效可实施的诊断检测技术在当下显得尤为迫切,学科间相互渗透融合的高通量诊断技术则成为众多研究者关注的热点。有效的动物疫病诊断检测可及时预防和控制常见动物疫病的传播,从而保护动物及人类的健康和安全。笔者就主要的病毒性动物疫病诊断技术及其研究进展进行了综述,以期为动物疫病快速诊断提供更多的方案思路,提升动物疫病的防控能力。
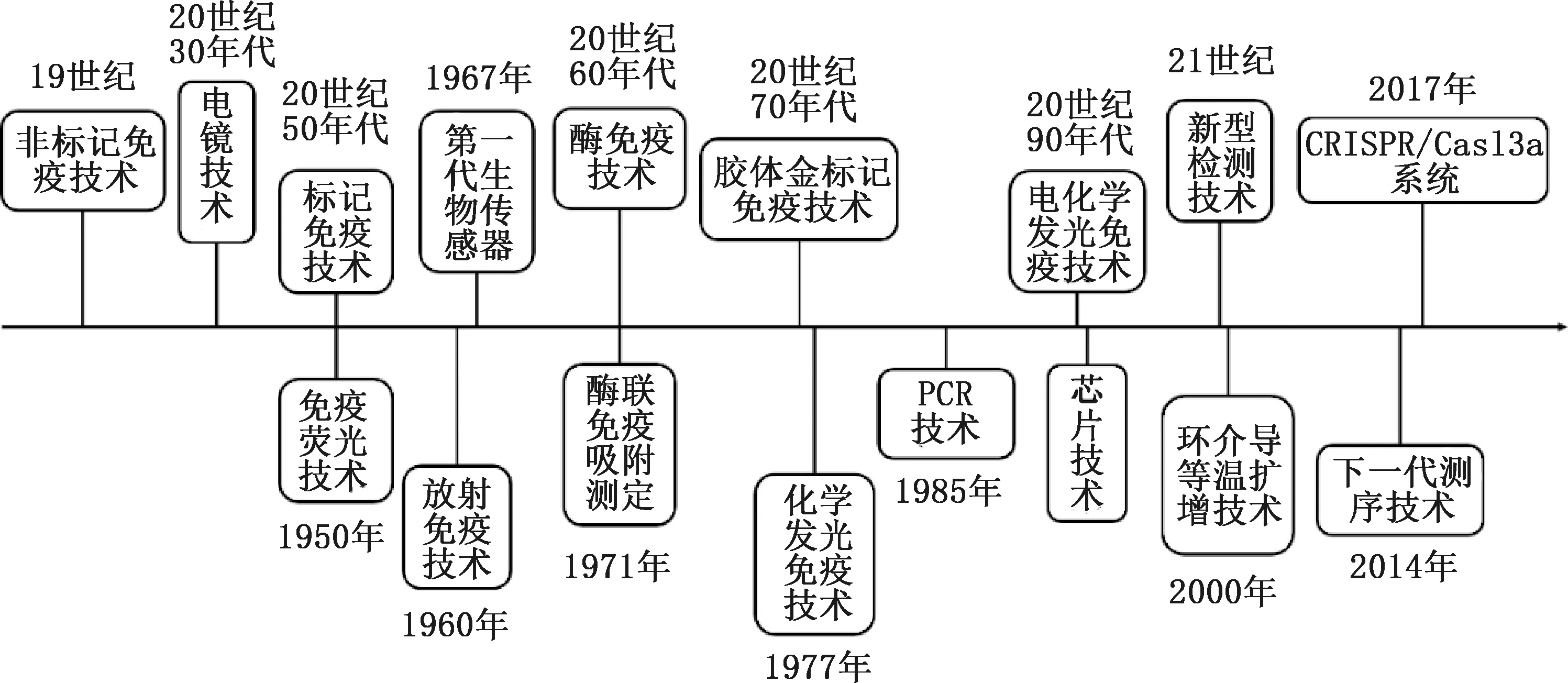
图1 诊断检测技术的发展历程Fig.1 Development process of detection technology
1 病原学诊断
病原学诊断主要用于传染病的诊断,指从病料中分离病毒、细菌和寄生虫等病原体。病毒性疫病如口蹄疫、非洲猪瘟、高致病性禽流感等重大动物疫病对人畜危害严重,需采取紧急、严厉的强制预防、控制和扑灭措施。自19世纪末人类发现病毒以来,科学家们一直在努力阐明病毒结构,电镜技术的发展为其提供了便利。透射电镜是检测和分析病毒复制的重要工具,具有高分辨力和全面捕获表征病毒结构的特点,用于常规检测及初始筛查诊断,通过鉴定不同种属的病毒,对后续检测方法的选择做出判断[11]。在20世纪60年代,透射电镜的使用促成了多种新型病毒的发现,并作为诊断工具用于临床样本或从细胞中培养分离后病毒的表征[12]。通常,负染电镜法检测所需病毒粒子含量相对较高,临床样本一般达不到检测要求,且难以鉴别较小的、无明显形态特征的病毒;离子捕获电镜法则可浓缩和纯化病毒粒子,提高病毒粒子含量,敏感性相对较高;免疫电镜法基于免疫血清学原理,无需纯化抗体,可直接用于常规电镜诊断后进一步病毒鉴定[11,13]。在病毒的分离培养过程中需排除无致病性病原体的干扰,在细胞无病变的情况下很难确定是否感染病毒,且不同毒株对细胞的适应性存在差异,一些病毒不能在细胞系中快速增殖,易受到病毒滴度的影响而导致试验周期过长[14]。鉴于某些病毒分离培养较难,同时受实验设备的限制且需要专业的高技能人员,使得常规病原学诊断难以大范围推广应用。尽管如此,病原学常规检测方法如目标菌种的分离培养、涂片染色镜检等在动物疫病相关研究和生产预防中依然被合理的应用,且发挥着重要作用。
2 免疫血清学诊断
动物疫病诊断主要针对病原体的抗原、病原体诱导产生的抗体及病原体的遗传物质进行检测和鉴别。标记免疫作为一类典型的免疫血清学诊断技术,基于抗原抗体特异性识别免疫反应,结合信号放大标记物来捕获样本中存在的抗原或抗体。根据标记物的不同可分为放射免疫(radio immunoassay,RIA)、酶免疫、荧光免疫等,相比非标记免疫技术如凝集反应、沉淀反应、补体结合试验、中和试验等,标记免疫技术灵敏度整体较高。其中,RIA依据放射性核素信号可进行超微量分析,且放射性同位素种类多,选择性较广[15]。但放射性标记物不稳定,对人体健康及环境存在一定的损害污染风险,在实施中需做好防护措施。此外,用于RIA检测样本的分离方法落后,难以实现操作和检测的自动化,因此,对于动物疫病诊断检测更偏向选择非放射标记免疫技术。
2.1 酶联免疫吸附试验
酶联免疫吸附试验(enzyme-linked immunosorbent assay,ELISA)因酶标记物的高频率催化效应,使得ELISA具有较高的敏感度,通过优化检测参数、增加信号强度等可进一步提高ELISA的灵敏性和特异性[16]。ELISA能一次性进行大量样本的检测,且操作简单,可对畜群进行普检。ELISA凭借其经济、快速的检测优点,现已成为动物疫病抗体检测试剂盒研发的首选。根据ELISA微量板底部包被材料的不同可分为直接法、间接法、夹心法及阻断法等。
间接ELISA法即利用固相载体包被抗原,结合比色法和分光光度法测定样品中特异性抗体的含量。易华山等[17]以蓝舌病病毒(Bluetongue virus,BTV)的NS4蛋白作为包被抗原建立了BTV抗体间接ELISA方法,检测敏感性可达1∶1 600;批内和批间重复性变异系数均<10%;检测76份重庆地区牛群血清样品,阳性符合率为98%,阴性符合率为100%。传统的ELISA一般采用单一辣根过氧化物酶或碱性磷酸酶作为反应标记物,对于某些诊断而言有可能达不到检测需求。为进一步提高灵敏度,Wu等[18]利用二氧化硅纳米微球负载辣根过氧化物酶进行信号放大,对传统的ELISA方法进行了改进,并将其用于猪圆环病毒2型(Porcine circovirus type 2,PCV2)抗体的检测,该方法表现出极高的检测灵敏度,检测限可达0.05 ng/mL。ELISA具有一次性检测大量样本的优点,这对不同养殖场疫病感染情况的普检及阴阳性血清样本数据的获取非常有利。Lin等[19]针对不同猪场的368份血清样品以间接免疫荧光试验(indirect immunofluorescence assay,IFA)作对比检测,采用间接ELISA检测出了213份猪流行性腹泻病毒(Porcine epidemic diarrhea virus,PEDV)阳性,IFA检测出了206份PEDV阳性,ELISA检测方法总符合率为96.74%,证明了建立的间接ELISA方法具有良好的诊断敏感性和特异性。Houston等[20]利用ELISA和IFA检测方法建立了猪群中A型塞内卡病毒病流行率基线数据,对不同商品猪场的2 433份母猪血清样本进行了A型塞内卡病毒(Senecavirus A,SVA)抗体检测,结果显示,2种方法的阳性检测率分别是26.2%和15.9%,ELISA检测方法明显优于IFA。尽管不同的ELISA方法被广泛用于病毒性动物疫病检测,但这些检测方法是基于特异性单克隆抗体或多克隆抗体,而这2种抗体制备过程较为繁琐且存在一定的局限性,表达率低、稳定性差,且需更多的支持成本。 纳米抗体以其分子质量小(约15 ku)、高亲和力、高稳定性、高溶解度、高表达、易于进化等独特的优势广泛应用于动物疫病诊断和治疗领域。Ma等[21]建立了一种新的快速、特异、低成本的基于体外生物素化纳米抗体(biotin ligase nanobody,BiNb)的阻断ELISA检测方法(图2),可快速检测猪临床血清中抗PEDV抗体;通过检测临床血清样本发现,该方法与常规商业化ELISA试剂盒相比,其检测敏感性和特异性分别为100%和93.18%,两者的符合率达94%。该研究表明,基于纳米抗体建立的阻断ELISA是一种快速、低成本、可靠的检测方法,不仅可用于临床病毒抗体的检测,也可用于疫苗效力的血清学评估及病毒感染的间接诊断。
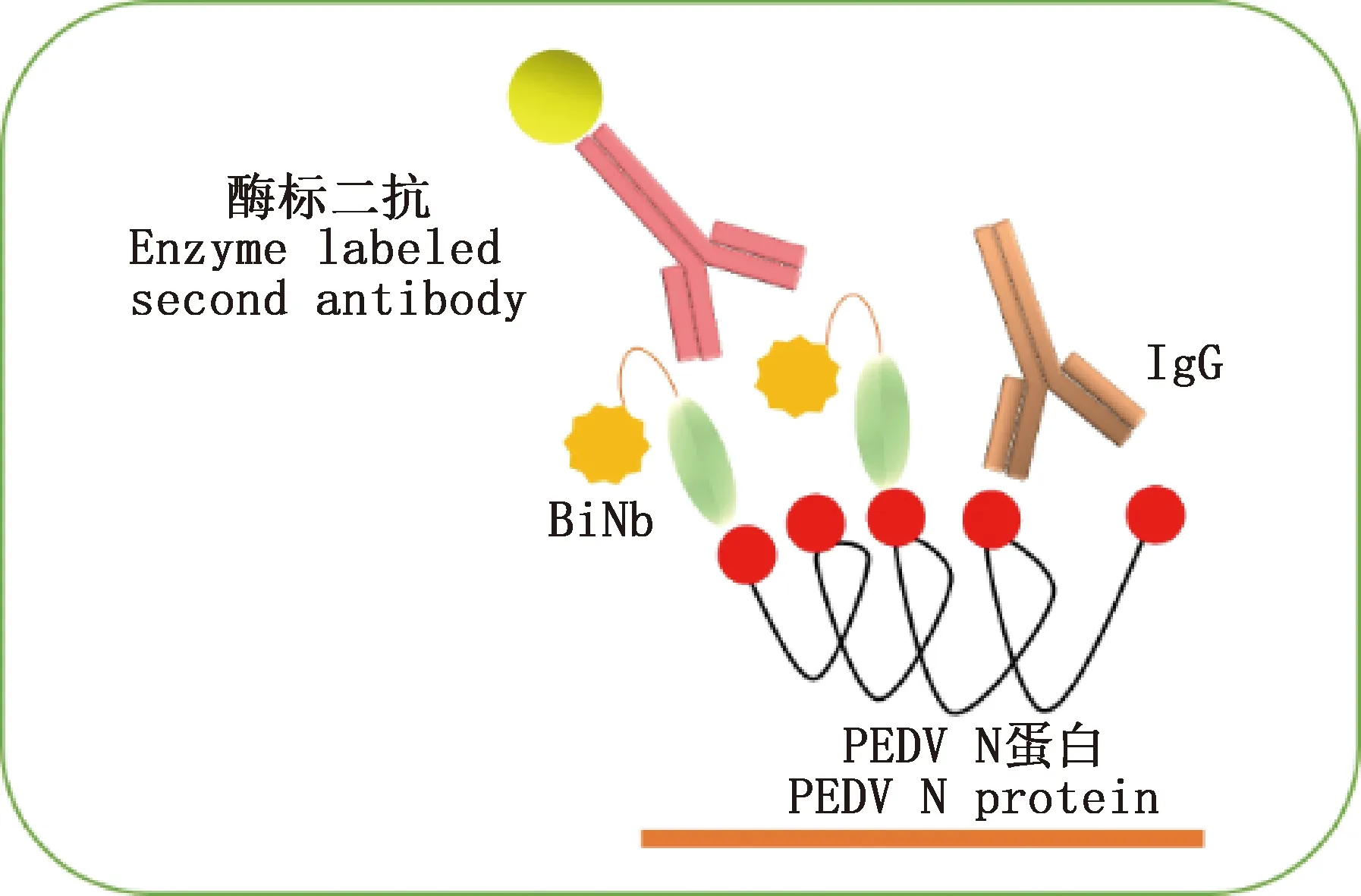
图2 阻断ELISA技术检测抗PEDV抗体Fig.2 Detection of anti-PEDV antibodies by blocking ELISA technology
尽管基于抗原抗体特异性识别的ELISA检测方法在病毒性动物疫病检测中很流行,适用性较广,但获取特异性和高亲和力抗体是高灵敏度、高特异性检测方法建立的重要条件,特别是针对复杂病原体感染的情况下,有效抗体的制备显得尤为关键。
2.2 化学发光免疫分析
化学发光免疫分析(chemiluminescence immu-noassay,CLIA)以光信号强度指示标记抗体或抗原,是标准ELISA的全自动变体,包含免疫反应系统和化学发光分析系统,根据标记方法的不同有化学发光标记免疫分析法和化学发光酶免疫分析法。 电化学发光免疫分析法(electro-chemiluminescence immunoassay,ECLI)结合了化学发光,是一种在电极表面由电化学引发的特异性化学发光反应,与CLIA相比其更易精确控制,灵活性较高。这2种技术具有背景荧光信号值低、线性范围宽等优势,在灵敏度、精确度和检测效率上明显优于ELISA方法,是推广最快的标记免疫分析技术之一,现已广泛应用于免疫分析等各个领域[22]。CLIA虽然有较强的特异性,但光信号持续时间短、光源稳定性差,致使其灵敏度不高。任雪建等[23]建立了一种小反刍兽疫病毒(Peste des petits ruminants virus,PPRV)抗体化学发光酶免疫分析检测方法,用鲁米诺作为发光底物代替传统的四甲基联苯胺(TMB)底物,避免了光源不稳定的干扰,从而提高了CLIA检测敏感性和稳定性。Liu等[24]针对口蹄疫病毒(Foot-and-mouth disease virus,FMDV)抗原表位3A和3B全长蛋白建立了一种新的CLIA抗体检测方法,具有较高的诊断灵敏度和特异性,检测接种了5次的免疫牛产生的假阳性率为0,检测接种15次的免疫牛产生的假阳性率低于6%,可高精度检测FMDV。该方法的建立有效解决了基于FMDV蛋白3ABC检测的商业化ELISA试剂盒或其他ELISA方法因非结构蛋白对灭活疫苗污染而导致较高假阳性率的问题。
近年来,一些纳米材料的兴起促进了ECLI的快速发展,如金纳米粒子、二氧化硅纳米粒子、碳纳米管、量子点及复合纳米结构等,在化学发光检测方法构建中作为信号标签被广泛应用[25]。化学发光免疫分析方法构建过程中选择合适的信号标签是实现高灵敏度和高稳定性的关键,当前针对ECLI信号标签放大策略的研究主要集中在增强基于酶的纳米材料方面[26]。邵康[27]以金-石墨烯纳米复合材料、二氧化硅纳米粒子和生物素/链霉亲和素构建了三重和多重信号放大检测猪伪狂犬病病毒(Pseudorabies virus,PRV)抗体的ECLI传感器,与ELISA和荧光免疫分析方法相比,其最低检测限可达0.40 pg/mL,灵敏度更高,检测线性范围更宽,重现性和稳定性更好。Ma等[28]提出了一种新的多路径信号放大策略,利用金纳米粒子修饰石墨烯纳米片作为底物,构建了简单、灵敏的PEDV抗体定量分析ECLI平台,最低检测限可达0.05 pg/mL;这种新检测方法的开发弥补了一些检测技术在复杂仪器的使用、操作繁琐和耗时费力等方面的局限性,在动物疫病抗体检测中表现出良好的适用性。
3 分子生物学诊断
3.1 基于PCR的检测技术
自1985年PCR技术发明以来,它已成为科学研究、临床和法医学研究中不可缺少的一项基础分子生物技术[7]。PCR技术的多功能性和快速性使分子诊断学的研究发生了革命性的变化,其以特异性强、灵敏度高等优点被广泛应用于病原检测、食品微生物检测、疾病诊断等领域,是病原诊断检测的金标准[29]。随着分子生物技术的不断发展和检测需求的多样性,基于普通PCR的各种衍生技术应运而生。PCR技术不仅仅局限于对靶基因进行体外无限扩增,而是由定性检测转向了定量检测。
实时荧光定量PCR技术同时具备PCR的高灵敏度和DNA分子杂交的高特异性以及光谱技术的高精确度相对定量等优点,相比普通PCR技术,实时荧光定量PCR在病毒性动物疫病检测方面应用较广泛。借助荧光信号对PCR进程进行实时监测是检测和鉴别致病性病毒的一种强有力的方法[30]。Chen等[31]基于SYBR染料法针对PCV3高度保守区建立了实时荧光定量PCR检测方法,其检测拷贝数为1.73×102拷贝/μL,与普通PCR相比,阳性检出率高出4倍,能对PCV3做出有效诊断及流行病学调查。在实际生产中多病原的多重感染或混合感染已是疾病发生的普遍规律,畜群发病常常不是由某单一的病原体引起,而是多种病原体共同感染作用的结果。如引起猪肠道疾病的病毒种类众多,临床症状相似。多重PCR技术检测效率高、特异性强、灵敏度高的优点是此类病毒确诊的首选手段。Huang等[32]建立了一种基于TaqMan探针的多重RT-实时荧光定量PCR(reverse transcription-qPCR,RT-qPCR)方法诊断流行性猪肠道冠状病毒,弥补了此前没有可同时检测和鉴别4种猪肠道冠状病毒的技术空缺,对猪病毒性腹泻的预防控制和流行病学调查具有重要意义。但实时荧光定量PCR的结果依赖于阈值循环数(Ct值)和校准物,受样品中抑制剂影响较大,且其无法解决不同反应间的竞争性抑制。由于反应体系内荧光背景较高,导致无法准确检测低丰度样品,这在一定程度上制约了其使用。
数字PCR(digital PCR,dPCR)作为第三代PCR技术能实现低丰度DNA绝对定量分析,只对一个靶分子扩增,消除竞争性抑制,检测结果判定不依赖阈值所需的Ct值,不受扩增效率影响,且无需使用校准曲线,可检测复杂样品中的微量核酸[8](图3)。尤其在缺乏合适参考物或校准物的情况下,数字PCR这一优势显得愈发明显,但当分析物中模板的浓度极低时,会因不同分区反应体系中模板的随机化分布差异而引起其精确性降低[33]。数字PCR最初多应用于肿瘤液体活检的相关研究,现已在病毒性动物疫病检测方面得到成功应用。实时荧光定量PCR的多重检测依赖于荧光通道数量或熔解曲线,数字PCR则提供了与实时荧光定量PCR不一样的多重检测策略,即根据荧光通道数量和微单元荧光信号强度差异来检测多个指标。Ren等[34]针对PRV建立了一种快速检测PRV野生型分离毒株和基因缺失病毒疫苗株的数字PCR方法,研究发现数字PCR与TaqMan实时荧光定量PCR定量检测病毒样本均具有良好的线性和重复性,但数字PCR能在低浓度下仍符合线性区域,检测限为4.75拷贝/μL,且灵敏度较实时荧光定量PCR高16倍,数字PCR在临床血清样本分析中更为灵敏。Yang等[35]基于猪繁殖与呼吸综合征病毒(Porcine reproductive and respiratory syndrome virus,PRRSV)的ORF7区建立了数字PCR方法,与实时荧光定量PCR方法相比,2种方法均显示出高度的线性相关性(R2≈1)和定量相关性,但数字PCR比实时荧光定量PCR敏感10倍左右,对125份疑似感染PRRSV的临床样本检测结果发现,数字PCR方法比实时荧光定量PCR多检测出了9份阳性样本。以上研究表明,数字PCR技术具有更高的灵敏度和更低的检测限,可用于超敏定量检测,有利于疫病的监测与防控,尤其在新型冠状病毒的诊断检测方面显示出潜在的应用价值和前景。
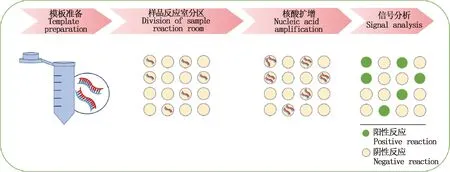
图3 数字PCR的原理示意图Fig.3 Schematic diagram of digital PCR
3.2 环介导等温扩增技术
2000年日本科学家Notomi等[36]发明了环介导等温扩增技术(loop mediated isothermal amplification,LAMP),其是一种新型的体外等温扩增特异性核酸片段的技术。基于PCR的核酸检测体系预混物均需在不同温度之间重复循环才能完成有效扩增,受检测设备的限制,较难推广运用到现场检测。LAMP技术可克服这一缺陷,其不需要热循环以及繁琐的凝胶电泳程序,即可在60~65 ℃等温条件下延伸,完成高质量链置换扩增,达到诊断目的,而且具有结果可视化、操作简单、不受样品中非靶标DNA的影响、易于适应任何现场环境等优势,最短可10 min完成检测,扩增长度为700~10 000 bp,其是理想的POCT分子生物学检测方法[37-39]。Wang等[40]建立了适用于现场检测ASFV的实时LAMP和可视化LAMP检测方法,结果表明构建的2种LAMP方法能准确、特异地检测ASFV,检出限为30拷贝/μL,为ASF的防控和监测提供了有效可实施的方案。常规的用于检测FMDV的LAMP方法存在一定的局限性,包括无法进行信号放大、不能对所有的FMDV的7种血清型进行检测等。针对上述局限性,Bath等[41]取消了样品稀释步骤以简化试验设置,设计了内部阳性对照降低假阴性率,进而建立了一种新的泛血清型反转录LAMP方法用于现场检测FMDV;同时该研究利用未提取核酸的现场口腔拭子样本来验证LAMP的现场使用性能,结果显示新建立的反转录LAMP方法可作为群体诊断工具,其检测诊断特异性达99%,检测灵敏度为79%,该方法能由未经实验室培训的工作人员直接用于疑似病例的即时现场检测。虽然LAMP非常适用于现场快速检测,较其他核酸扩增技术具有显著的优势,但LAMP技术需要针对单个核酸片段的几个区域设计4~6对引物,这种引物设计较为复杂,同时也增加了非特异性扩增的可能性,会对检测结果的特异性产生影响;此外,该技术较难实现多路复用,且扩增产物经过凝胶电泳后会出现连续的几个条带,很难定位检测每个条带,因此其结果可靠性还有待提高[42]。针对LAMP多路复用开发,建议采用微流控芯片技术的便携式生物分析系统,将LAMP与离心式微流控技术相结合,可对多项指标同时进行检测分析,能有效解决LAMP技术多路复用的问题。
4 高通量诊断
基于免疫血清学或分子生物学的诊断技术可简单、快速识别病原体。然而,大多数的检测方法一次只能检测到一个或几个病原体,且冗长的试验流程、专业的设备降低了检测技术立即干预突发疫情的能力及诊断相关性,同时无法满足某些检测分析需求。高通量诊断技术具有同时监测、检测和表征成百上千个靶点的能力,能满足当下快速检测的需求,是生命科学发展过程中一种重要的生物学检测手段。
4.1 生物芯片技术
4.1.1 固液相芯片 基因芯片也称DNA芯片,由于该技术能将大量核苷酸探针同时固定于固相载体上,可实现多个病原核酸的自动化快速检测,因此解决了传统核酸印迹杂交技术操作复杂、自动化程度低、操作序列数量少、检测效率低等问题。通过设计不同的探针阵列,使用特定的分析方法可使该技术具有多种不同的应用价值,如分析病毒基因组变化、分离毒株差异性、病毒溯源等,在畜禽疫病诊断检测中的应用已较成熟。特别地,针对畜禽生产具有重大威胁的人畜共患病的检测显示出明显优势。由不同病原诱发的猪腹泻在临床症状及病理变化方面非常相似,常规的检测方法难以鉴定出正确的诱发病原体,基因芯片技术则能够将引起仔猪发生腹泻症状的几种病毒进行准确区分,可针对病毒的混合感染做出有效诊断。与基因芯片不同的是,蛋白芯片由固相载体上的抗原、抗体及标志蛋白微阵列化组成,通过Cy3、Cy5、化学发光物、免疫胶体金等标记物放大抗原抗体反应,具有高通量、高灵敏度、高特异性等特点。Wu等[43]使用环氧涂层玻璃载玻片作为诊断材料,建立了2种可视化蛋白质芯片检测方法用于血清中猪细小病毒(Porcine parvovirus,PPV)抗体的检测。对于常规ELISA方法而言,待检样本通常需要含有200~1 000 ng抗原蛋白,而蛋白芯片仅需0.5~2 ng抗原蛋白,2种方法的最低检测限分别为6 000倍稀释和12 800倍稀释[43]。这说明蛋白质芯片技术是一种快速、灵敏、有效的诊断工具,在定量检测和新标志物的发现中有着广泛的应用前景。值得注意的是,基因芯片技术和蛋白芯片技术均是固相载体上探针与标记样品的杂交反应,从而实现病原体的诊断检测。液相芯片即荧光微球免疫分析(fluorescent microsphere immunoassays,FMIA)则结合了激光技术、流式细胞仪、数字信号处理和传统化学技术以不同荧光编码的聚苯乙烯微球作为探针载体偶联不同的检测分子,借助流式细胞仪在液相中可以对小量单个样本中存在的多种抗原或抗体进行定性定量分析,不仅实现了高通量多重检测,且极大地提高了样品的利用率[44-45]。与常规免疫学或分子生物学检测技术相比,FMIA可在同一反应孔中实现多达100种不同的生物学反应,能够检测体系含量少至1 μL的待测样本,适用于小量稀有样品分析。基于液相反应动力学,其可快速简便地完成检测,得到特异性强、准确性高、重复性好的检测结果。Feichtner等[46]建立了首个用于检测禽腺病毒(Fowl adenovirus,FAdV)的多路复用FMIA血清学诊断检测方法,该方法涵盖了所有FAdV临床相关血清型,可在单一反应中同时检测和分化相应的抗体,具有高通量筛选的优势。 液相芯片技术作为一项新型的检测工具,广泛应用于禽类、哺乳动物中,能同时检测和分析致病性病毒、细菌、寄生虫和真菌及抗原或抗体[45]。
4.1.2 微流控芯片 微流控芯片利用单个微米级通道芯片容纳微量流体来实现微小型生化实验室,集待检样品的制备、基因扩增、核酸标记及检测等相关步骤为一体的微流控芯片技术是一种便携式生物分析系统,可形象地称之为“微缩芯片实验室”。该技术属于多学科交叉技术,其与毛细管电泳、质谱检测、免疫检测、电化学检测及光学检测的结合在动物疫病诊断中被灵活应用,实现了单芯片高通量、自动化、无污染、高灵敏度诊断检测[37]。因其系统集成、低样品消耗,可利用空间编码技术在芯片上实现多路检测的特点,受到了科研人员的广泛关注。其中,三维纳米结构和生物传感器的发展为微流控技术的应用提供了诸多便利,Yu等[47]研制了一种新型的氧化锌纳米棒集成微流控芯片,其能在免疫功能化的氧化锌纳米棒表面捕获禽流感病毒(Avian influenza virus,AIV),并通过多重夹心免疫分析进一步检测病原体,整个检测过程可在1.5 h内完成,检测下限为3.6×103EID50/mL,检测灵敏度是常规ELISA方法的22倍。该平台通过在同一氧化锌纳米棒集成微芯片上对不同抗体进行空间编码,展示了可同时检测多种病毒病原体的能力。据报道,LAMP的原理及多路复用反应机制略微复杂[48],但鉴于LAMP显著的优势特性,其在其他技术方面的应用值得研究人员进一步探索。不论是基于PCR的检测技术还是LAMP技术均离不开核酸提取、基因扩增、产物分析等多个步骤,而微流控芯片与LAMP技术的结合能简化与集成这些繁琐步骤,成为应用于现场快速检测的关键技术[10]。Ye等[49]建立了一种便携式离心微流控芯片荧光探针介导的LAMP检测系统,该系统利用BstDNA聚合酶和DNase Ⅰ进行特异性扩增和荧光信号释放;同时,该研究采用微注射成型技术制备微流控芯片,这种新颖的设计保证了高特异性信号的产生和高灵敏度的荧光检测,可克服其他扩增方法的缺点,具有检测设备小、简单、吞吐量高、便于现场使用等优点;检测限低至10拷贝/μL,灵敏度为92.73%。这表明,该技术能快速、准确地检测病原体,LAMP技术和微流控芯片的结合在多路复用和高通量筛查方面具有良好的应用前景。
4.2 新型生物传感器
生物传感器分析系统由生物识别分子和物理化学探测器组成,具有接收器与转换器的功能,其通过抗体、核酸、多糖、凝集素、酶、组织、全细胞等固定化传感元件来识别病原体所特有的靶生物标记物,通过信号转导将生物分子间的相互作用转化为可测量的显示信号(图4)。Narang等[50]研究表明,基于微流控芯片技术的新型生物传感器可快速检测病原体,且能准确分析检测结果并即时生成检测报告。这种特定生物识别传感系统与微流控芯片结合,能实现对病原体阵列化、高通量、定性及定量分析[5]。 随着纳米技术、电子信息技术的快速发展,基于化学发光、表面等离子体共振、电化学等新型生物传感器在病原体快速、高灵敏度诊断检测中被广泛应用[51-52]。 Luo等[53]利用包覆金纳米微球的倾斜光栅制备了一种检测新城疫病毒(Newcastle disease virus,NDV)的无标记免疫传感器,病毒最小可检测量约为5 pg,该系统通过金纳米微球局域表面等离子体共振效应大大增强了分析物对光纤包层模式的影响,从而提高了免疫传感器的检测限和灵敏度。由于临床样本复杂的基质特性,目前大多数生物传感器诊断多用于实验室研究,但相信未来基于纳米材料能提升生物传感器光学和电化学的功能,将会开发更多可供兽医或疫病防控机构现场使用的便携式、小型化和多目标智能化的生物传感器设备。值得注意的是,大多数生物传感器对环境因素的变化高度敏感,如温度、pH等[54]。总的来说,生物传感器检测动物疫病病原体,开发几种新的方法来克服样本基质效应是非常有必要的,在检测适用性上仍有提高的空间,需科研工作者在这个领域进行更多的研究。
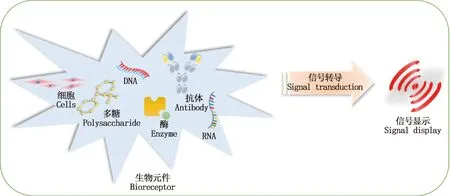
图4 生物传感器原理示意图Fig.4 Schematic diagram of biosensor
4.3 下一代测序技术
一般而言,未知病毒的发现和检测往往受到细胞培养过程中病毒对细胞侵染能力的限制,下一代测序(next-generation sequencing,NGS)技术的出现及其与生物信息学的结合为新病原的发现、溯源与传播机制、毒力、药物敏感性等研究开辟了另一条途径[55]。NGS在2014年被引入疫病诊断,适用于动物疫病流行病学调查和高抗性微生物的基因分型,为传染性疫病诊断带来了革命性的变化[56]。NGS不仅是用于物种转录组和基因组全貌解析的强有力工具,且是当前用于发现未知病原体吞吐量最大的诊断工具。与传统的金标准Sanger测序技术相比,NGS技术以更低的成本提供了更多的测序读数,可同时对DNA或RNA样本数百万个碱基进行快速测序,超深度覆盖病毒基因组,实现样本检测多路复用[56]。NGS技术检测流程主要有3个环节:模板制备,通过离心、过滤、捕捉等物理方法对病毒粒子进行富集;样品文库制备,包括克隆扩增;数据分析,通过对测序的原始数据进行质控和过滤后,去除宿主的基因序列,鉴定病毒的组成与丰度,拼接病毒序列,最后构建分子进化树进行分析比对[57]。NGS技术能灵敏、特异地检测和区分单个宿主内的混合感染及鉴定变异毒株。秦毅斌等[58]应用NGS技术对PEDV分离毒株的全基因组序列进行测序,证明了分离获得的新毒株是PEDV地方流行性变异毒株,该发现为PEDV新型高效疫苗的研发提供了候选毒株。He等[59]基于NGS平台对Ⅵ型NDV特性进行研究,揭示了该病毒未知的遗传多样性,并提供了其持续进化的证据。NGS技术可一次性获取临床样本中病毒核酸序列,通过序列比对获得样本中病毒的序列信息,有利于未知病毒的发现。2019年,Wu等[60]利用NGS技术首次公布了新型冠状病毒全基因组序列,为后续相关研究的顺利展开提供了强有利的先决条件。由于NGS流程复杂,数据量大,大多数针对病毒诊断的NGS平台都将重点放在提高序列读取和数据分析上,且需要生物信息学专业人员对数据进行分析,一般需要2~3 d,所以NGS目前仅在科研机构应用广泛。尽管NGS技术能获取大量测序数据,但根据平台和应用不同,约有0.1%~15%的高错误率,这往往会阻碍罕见突变的检测[61]。为了纠正这种关键性错误,已开发了用于变体调用的生物信息学工具,以研究病毒变体及测量2个相似病毒准种之间的遗传距离[62]。随着测序技术的发展,其在新发病原的鉴定和流行病学研究中发挥非常关键的作用,但去宿主基因、测序灵敏度和覆盖度、标准化分析等还需完善。此外,该技术作为诊断检测其运行成本较高,需要复杂的设备。但鉴于NGS平台的快速准确性和多能性等特点,未来NGS诊断方法很可能成为疫病诊断的常规技术。
4.4 CRISPR/Cas系统
尽管当前已开发出了很多疫病诊断检测的方法,但更快速、更廉价、更特异、更灵敏的技术仍然是动物疫病诊断检测领域不断追求的目标。CRISPR/Cas是一种细菌和古细菌抵御噬菌体、质粒入侵的适应性免疫防御系统,近年来随着基因编辑技术的发展,该系统被广泛应用于提高家畜繁殖效率、生产性能、抗病性及动物模型构建等研究中,并创制了一批基因编辑牛羊育种新材料[63-64]。在疫病诊断检测方面,CRISPR/Cas系统与NGS技术相比仅适用于对已知病毒的诊断检测,但在检测时间上其明显优于NGS技术,更加快速灵敏。2017年,Gootenberg等[65]建立了一种新型的病毒检测技术SHERLOCK(specific high sensitivity enzymatic reporter unlocking,SHERLOCK),可特异、灵敏地检测样本中的超微量病毒,灵敏度达到了渺摩尔水平。2018年Gootenberg等[66]对SHERLOCK诊断平台进行一系列优化改进,开发出了一种微型试纸条测试方法,可肉眼观察检测结果,无需使用昂贵设备,突出了其作为多路复用、便携式、快速和定量核酸检测平台的潜力。通常CRISPR诊断依赖于对靶标RNA的预扩增,进而通过Cas蛋白完成检测[67]。SHERLOCK平台中的Cas13a属于第二大类CRISPR/Cas系统,其与CRISPR RNA(crRNA)靶标配对形成核糖核蛋白复合物从而表现出高特异性,Cas13a附带的切割效应引起信号放大额外增加了检测灵敏度[68]。Fozouni等[67]设计了一种基于CRISPR/Cas13a系统的新型冠状病毒定量检测方法,该方法不需要靶标RNA预扩增,且检测结果可通过电子移动设备直接读出,实现了快速、低成本、定点筛查。 Qin等[69]建立了一种基于CRISPR/Cas13a的全溶液等温微流控芯片诊断埃博拉病毒的自动化检测系统,因检测仪器小,并且Cas13a易于在纸上发生重组,所以非常适用于现场诊断检测;现场检测可在5 min内完成,这种基于溶液的等温诊断方法具有快速、简单和高灵敏的特点,不需要复杂的固相萃取和纯化等步骤。同样地,基于CRISPR/Cas13a系统的检测技术在动物源疫病诊断检测方面也有报道。 Chang等[70]利用基于CRISPR的SHERLOCK诊断系统,通过结合Cas13a附带切割效应及重组聚合酶扩增技术,建立了一种能够在37 ℃恒温条件下进行PRRSV可视化核酸检测的方法。该方法具有恒温反应、灵敏、特异、直观、利于现场操作等特点。由于SHERLOCK具有高度错配敏感性,可检测到一个碱基的突变,能够对序列高度同源的病毒毒株进行有效区分。CRISPR/Cas13a系统的发展为病毒的诊断检测提供了一条新的分子途径,具有广阔的应用前景。几种动物疫病诊断技术对比情况见表1。

表1 几种动物疫病诊断技术对比
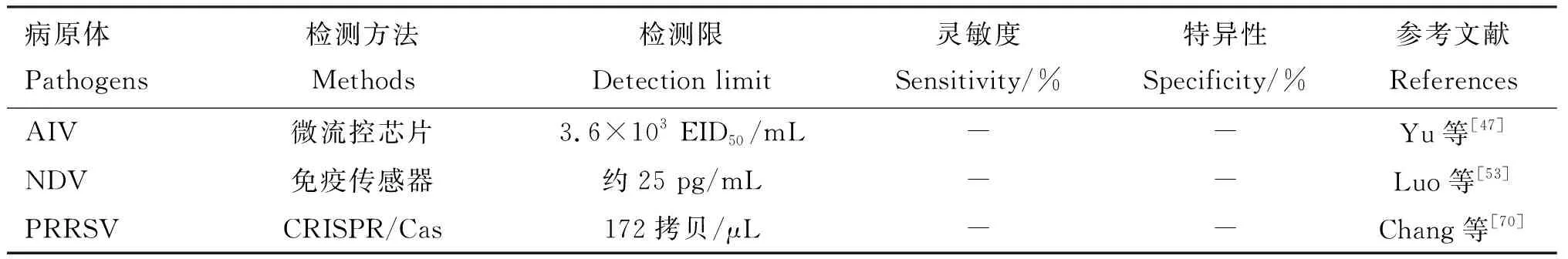
续表
5 小结与展望
随着畜牧业的规模化和集约化发展,动物疫病对畜牧业的影响日益加大,还会严重危害人类健康。研究人员也在不断开发更多能满足当下诊断检测需求的快速检测技术,不断向自动化、精密化、多元化、高通量方向发展,病原体的鉴定不再局限于外部形态和生理特性。学科间相互渗透融合的高通量诊断技术则成为众多研究者的关注热点。
纵观以上病毒性动物疫病诊断技术,各种检测技术在病毒性疫病检测中各有特点。常规病原学诊断方法较为费时费力,操作复杂、试验要求性高,不利于疫病防控工作的开展,且需集中的实验室、大型设备和经验丰富的操作人员,在实际应用中制约诊断检测的可实施性[5]。尽管免疫血清学诊断在动物疫病临床检测中很流行,适用性较广,但需特异性和高亲和力抗体,特别是在复杂病原体感染的情况下,不易得到有效结果。分子生物学诊断主要存在外来核酸源污染的风险和非特异性扩增的问题,且通常需几个小时才能完成检测,难以用于紧急生物识别的检测。这些缺陷限制了它们作为常规检测的使用。因此,发展快速、灵敏的早期诊断检测技术对预防及控制动物疫病的传播具有重要的社会和经济效益。从长远来看,多重核酸扩增技术、微流控芯片技术、结合纳米材料的生物传感诊断技术、下一代高通量测序分析以及基于CPISPR/Cas13a系统的诊断技术将成为控制和预防动物疫病暴发的有效诊断监测系统。另一方面,在诊断检测技术不断开发优化革新的同时,强化诊断技术的标准化管理及提升诊断技术的体系建设表现出一定的必要性。融合生物安全考量的新发病原检测技术,特别是能提高检测效率的技术,将会是未来的发展趋势。将研究性和实用性有效结合,相辅相成,为动物疫病的诊断和防控奠定良好的技术基础。
