DHA对高脂饲粮诱导肝脏脂肪积累的预防作用
2022-02-15安晓羽孙利婷杨丹妮李喻瞳张智精杨慧娣
安晓羽,郝 伟,孙利婷,杨丹妮,常 悦,赵 婷,李 康,李喻瞳,张智精,杨慧娣
(1.内蒙古医科大学基础医学院,呼和浩特 010110;2.内蒙古医科大学第三临床学院,呼和浩特 010110;3.内蒙古医科大学第一临床学院,呼和浩特 010110;4.湖北中医药高等专科学校,荆州 434020)
肥胖是一种在世界范围内发生率很高的疾病,它与许多代谢性疾病有关,如Ⅱ型糖尿病和非酒精性脂肪肝[1]。肥胖是由于能量平衡态(能量的摄入与能量消耗)的失衡,从而导致脂肪在身体不同区域的过度积累。肝脏脂肪积累过多会导致脂肪变性,其特征是肝细胞中甘油三酯(TG)的积累。此外,肝脏新生的脂肪也会产生TG,这个过程由转录因子调节,如固醇调节元件结合蛋白1c(SREBP-1c)。新生的脂肪增多可使脂肪肝和肥胖的发生率增加3倍[1-2]。
腺苷激活蛋白激酶(AMPK)是一种内源性和中枢的代谢传感器,脂肪细胞中的AMPK对维持线粒体完整性和对热应激的反应以及改善非酒精性脂肪肝至关重要[3]。在白色脂肪组织中,磷酸化的AMPK通过调节新生脂肪和脂肪酸氧化的关键代谢酶来改变细胞的代谢状态,这些酶包括乙酰辅酶A羧化酶(ACC)、脂肪酸合成酶(FAS)和过氧化物酶体增殖物激活受体α(PPARα)[3-4]。最近,有证据证明,AMPK在调节棕色和米色脂肪组织的代谢活性中发挥着重要作用,棕色和米色脂肪可以增加细胞的产热,是预防肥胖发生的靶细胞[3,5]。在大鼠中已经发现,中药桑叶激活AMPK通路后,腹股沟脂肪的几种棕色脂肪细胞标记基因解偶联蛋白-1(UCP1)、过氧化物酶体增殖物激活受体γ辅激活因子1α(PGC-1α)、PPARα和PR结构域蛋白16(Prdm16)表达均被上调[5]。但有关AMPK对肝脏脂肪细胞褐色化的作用还不清楚。
应用饮食中的化合物来减少体重和体脂的增加正成为一种预防肥胖的新方法。以前的研究发现,ω-3多不饱和脂肪酸(ω-3 PUFAs)是减少肥胖诱导代谢综合征的有效饮食成分之一[6]。如在啮齿动物中,ω-3 PUFAs激活脂肪酸的β-氧化,调节脂肪生成相关酶的活性,上调相关基因氧化磷酸化的表达。同时,ω-3 PUFAs参与各种线粒体的生化过程[7-10],特别是二十二碳六烯酸(DHA)能刺激线粒体基因的表达、激活脂肪酸氧化的关键酶肉碱棕榈酰转移酶1A(CPT1A)和抑制脂肪酸合成基因的表达[9]。研究发现,饲喂DHA后,C57BL/6小鼠内脏脂肪的UCP1、PGC-1α、PPARγ和Prdm16 mRNA的表达被激活[7]。然而,大多数的研究都聚焦于DHA对白色脂肪组织代谢的异常,但是,DHA对肝脏脂质代谢异常的机制还不清楚。 本试验通过给C57BL/6小鼠饲喂高脂饲粮或高脂饲粮添加不同剂量的DHA,利用实时荧光定量PCR和Western blotting等方法,研究DHA在高脂饲粮诱导的体脂增加对肝脏脂质代谢的作用及调节机制,为进一步理解DHA对高脂饲粮诱导的肝脏脂质紊乱的预防作用提供理论依据。
1 材料与方法
1.1 材料
1.1.1 试验动物 32只雄性SPF级C57BL/6小鼠,体重14~16 g,购自北京维通利华实验动物技术有限公司【许可证号:SCXK(京)2016-0006】,饲养在内蒙古大学实验动物中心【许可证号:SYXK(蒙)2014-0002】。在温度为(23±1)℃,光照为12L∶12D (Light∶Dark,12 h∶12 h)的动物房内饲养。动物进行单笼(30 cm×15 cm×20 cm)饲养适应1周,自由取食和饮水。所有操作遵循内蒙古医科大学动物使用相关伦理要求【YKD201901028】,在内蒙古大学省部共建国家重点实验室完成。
1.1.2 试验动物饲粮 脂肪普通饲粮(D12450K):100 g饲粮中含2 g猪油、2.5 g大豆油、20 g蛋白质、70 g碳水化合物,复合维生素和复合矿物质共5.5 g;高脂饲粮(D12451):100 g饲粮中含20.68 g猪油、2.91 g大豆油、20 g蛋白质、50.91 g碳水化合物,复合维生素和复合矿物质共5.5 g。两种饲粮均购自Research Diets公司。
1.1.3 主要试剂 TGELISA检测试剂盒(YS-H5445)购自上海研生实业有限公司;脂联素ELISA检测试剂盒(JL23094)购自上海江莱生物科技有限公司;RNAiso Plus Total试剂盒(9109)和PrimeScript RT Reagent试剂盒(3733)均购自TaKaRa公司;一抗兔抗α-tubulin抗体(F2168)、兔抗AMPK抗体(SAB4502329)、兔抗p-AMPK抗体(pThr172,SAB4503754)、兔抗pACC抗体(Ser79,07-303)、兔抗AKT抗体(SAB4500797)、兔抗p-AKT(pSer 473,SAB4504331)抗体均购自Sigma公司;二抗羊抗兔IgG(ab6721)购自Abcam公司。
1.2 方法
1.2.1 试验动物分组及处理 试验共分为4组:饲喂普通饲粮的对照组(Con),饲喂高脂饲粮的模型组(Model)及在高脂饲粮中添加0.2 g DHA(DHAL)和1.0 g DHA(DHAH)组,试验周期为20周。第21周眼眶取血后,颈椎脱臼处死动物取肝脏。
1.2.2 体重和摄食量测定 每天上午08:00-09:00用电子天平称量动物的体重(精确到0.1 g)。食物摄入采用食物平衡法测定。试验开始时称量动物体重,定时、定量放入足够的饲料。3 d后于相同时间称量食物重量。 用电子天平称食物重量(精确到0.001 g)。72 h平均摄食量=(提供的食物重量-剩余食物重量)/3。
1.2.3 体脂含量测定 动物的胴体(不包含胃、小肠和盲肠等器官)在60 ℃烘箱内烘干后,用索氏抽提法(Soxhlet)测定体脂含量。 将取出内脏各器官和消化道后(保留消化道上的脂肪)的动物尸体称重,作为胴体鲜重,然后置于烘箱中60 ℃烘干至恒重,称重,作为胴体干重。将烘干后的动物胴体剪成小块,用粉碎机磨碎后充分混匀,称取1~2 g样品,作为样品重,包于滤纸包内(提前1 d烘干滤纸),用棉线将其系紧,然后称重,作为抽提前样总重;然后放入抽提筒内。样品脂肪的抽提用福斯脂肪抽提仪(Soxtex Avanti 2050,Foss公司)。详细操作步骤参照说明书。将抽提完毕的样品置于烘箱中(60 ℃)烘至恒重,作为抽提后样品总重。体脂重量的计算公式如下:
体脂重量(g)=胴体干重(g)×[(抽前样总重-抽后样总重)/样品重]
1.2.4 肝脏中TG、脂联素含量测定 按照ELISA试剂盒说明书测定肝脏中TG和脂联素含量。采用分光光度计读数,根据标准曲线换算成样品TG和脂联素的浓度。TG的含量以mmol/L表示,脂联素含量以ng/mL表示。
1.2.5 实时荧光定量PCR 用RNAiso Plus Total试剂盒提取肝脏的总RNA,反转录合成cDNA。用PrimeScript RT Reagent试剂盒进行实时荧光定量PCR扩增。 根据GenBank中登录的PPARα、CPT-1A、ACOX、PPARγ等基因的序列信息,利用Primer Premier 5.0软件设计各基因PCR特异性引物(表1),引物均由生工生物工程(上海)股份有限公司合成。PCR反应体系、扩增条件和计算均参照Sheng等[5]方法进行。
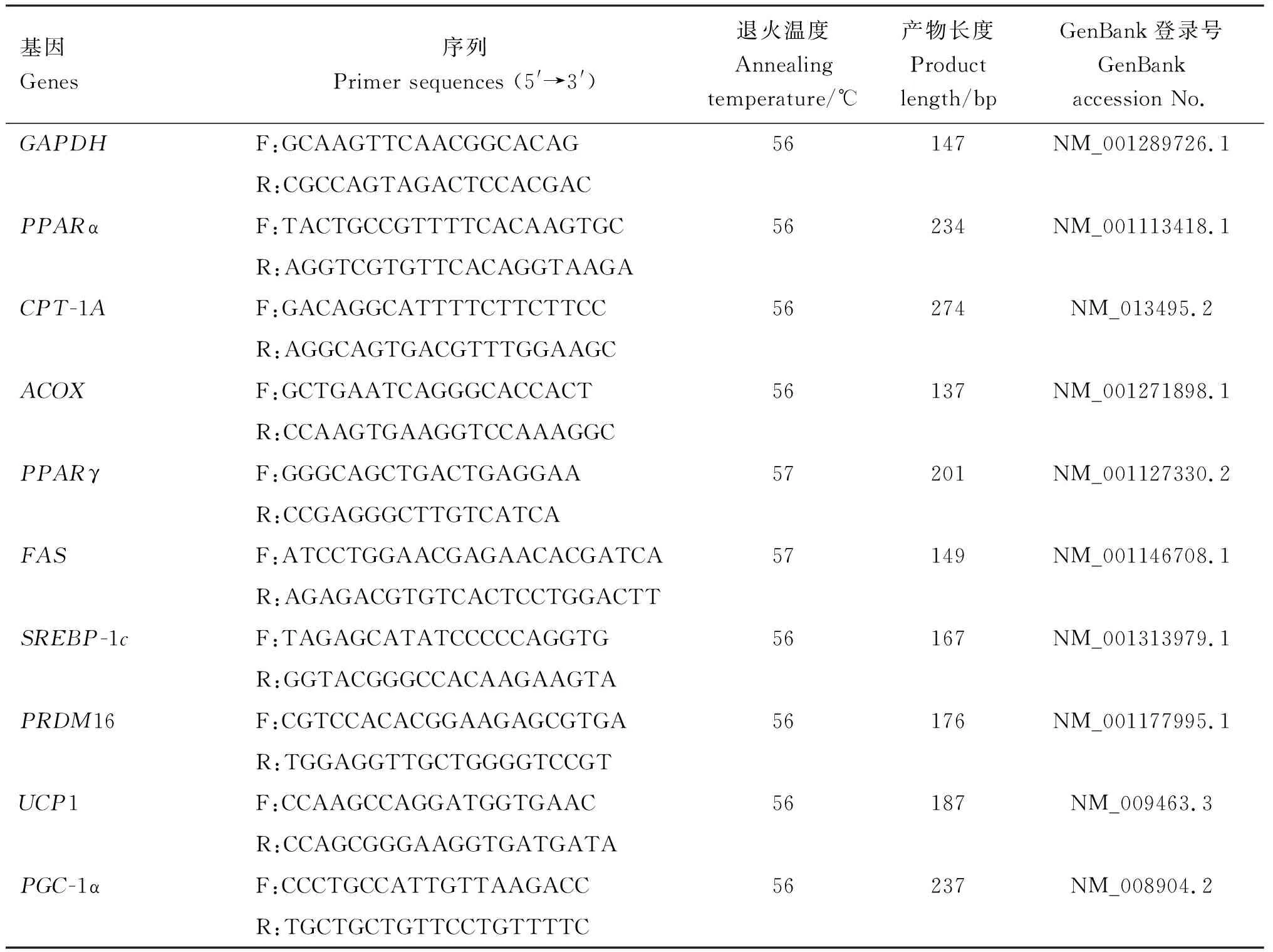
表1 引物信息
1.2.6 Western blotting 取肝脏组织0.2 g,研磨,直至粉末状,加入1 mL蛋白裂解液和PMSF的混合液,震荡混匀,裂解30 min,然后4 ℃、12 000 r/min离心20 min,转移上清液至1.5 mL离心管,-80 ℃保存。用BCA蛋白定量分析试剂盒测定蛋白样品浓度。将肝脏组织蛋白样品进行SDS-PAGE,转膜,加一抗(α-tubulin 1∶4 000,AMPK 1∶1 000,p-AMPK 1∶1 000,pACC 1∶1 000,AKT1∶1 000,p-AKT1∶1 000),4 ℃孵育过夜;加二抗(1∶10 000),常温孵育2 h。利用Supersignal West Pico化学底物显影,在Invitrogen iBright CL750凝胶成像分析系统下拍照,用Image LabTM Software(Bio-Rab Laboratories)软件分析条带的灰度值。
1.3 数据统计与分析
所有数据用Kolmogorov-Smirnov and Levene tests检测数据的齐性和正态分布,然后用SPSS 22.0进行单因素方差分析(One-Way ANOVA),用LSD法进行组间比较分析。结果用平均值±标准差表示,P<0.05表示差异显著。
2 结 果
2.1 DHA对C57BL/6小鼠摄食量、终体重、体脂和TG的影响
由表2可知,各组间小鼠摄食量均没有显著差异。Model组小鼠终体重最重,显著高于其他3组(P<0.05),DHAL和DHAH组的终体重与Con组均无显著差异(P>0.05),且DHAL和DHAH组终体重也无显著差异(P>0.05)。Model组小鼠体脂重量和肝脏TG含量均显著高于其他3组(P<0.05)。DHAL和DHAH组体脂重量和肝脏TG含量均显著低于Modle组(P<0.05);DHAH组体脂重量和肝脏TG均显著低于DHAL组(P>0.05)。
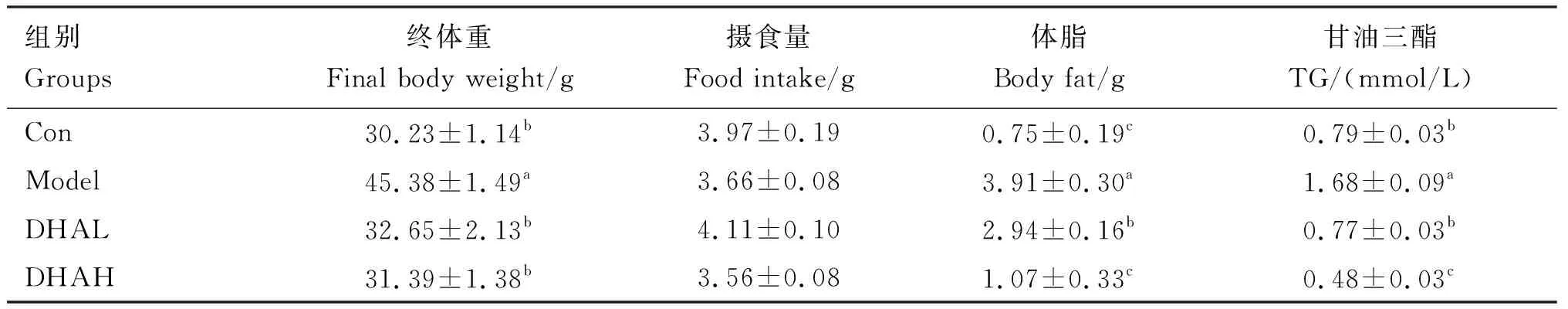
表2 各组小鼠摄食量、体重、体脂重量和TG含量
2.2 DHA对肝脏脂联素含量的影响
由图1可知,Model组肝脏脂联素含量显著低于Con组(P<0.05);DHAL和DHAH 组的脂联素浓度均显著高于Model组(P<0.05)。DHAL组脂联素的含量与Con组差异不显著(P>0.05),DHAH组脂联素的含量显著高于DHAL和Con组(P<0.05)。
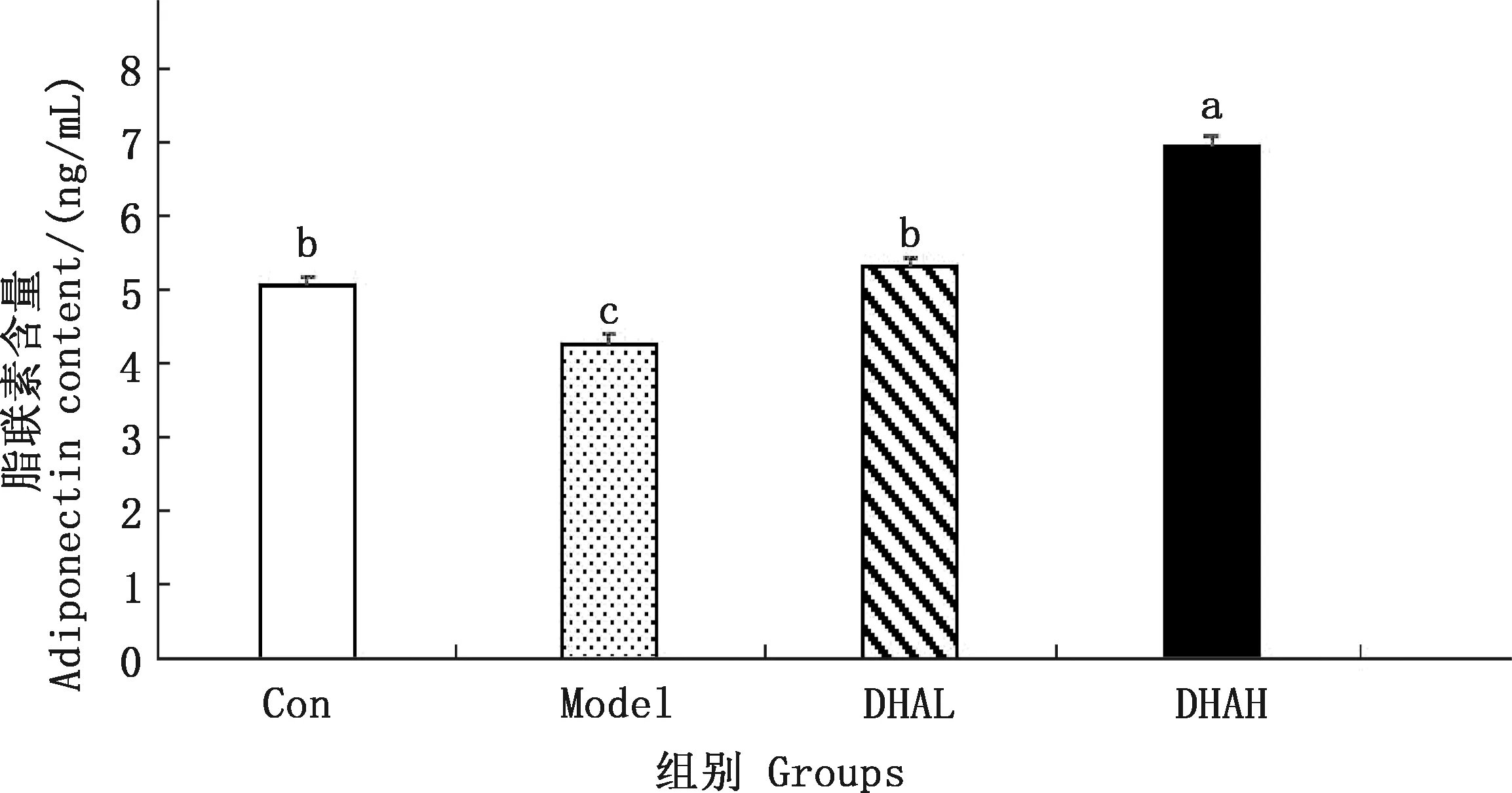
肩标不同字母表示差异显著(P<0.05);肩标相同字母表示差异不显著(P>0.05)。下同Values with different letter superscripts mean significant difference (P<0.05);While with the same letter superscripts mean no significant difference (P>0.05).The same as below图1 各组小鼠肝脏脂联素含量Fig.1 Liver adiponectin content of mice in different groups
2.3 DHA对肝脏脂质代谢相关基因的影响
2.3.1 新生脂肪合成关键酶SREBP-1c、FAS mRNA和p-ACC蛋白的表达 由图2可知,SREBP-1c和FAS mRNA表达与p-ACC蛋白表达变化一致。与Con组相比,Model和DHAL组SREBP-1c和FAS mRNA表达(图2A)及p-ACC蛋白表达(图2B、2C)均显著增加(P<0.05)。DHAH组SREBP-1c、FAS mRNA和p-ACC蛋白表达均低于DHAL组(P<0.05),与Con组无显著差异(P>0.05)(图2A、2B和2C)。
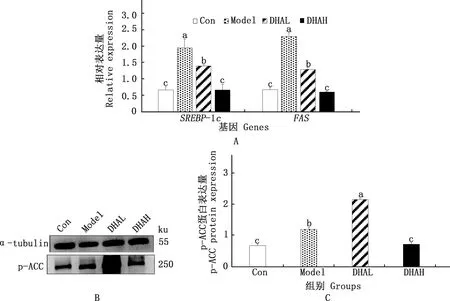
图2 各组小鼠肝脏SREBP-1c和FAS mRNA(A)及p-ACC蛋白(B、C)的表达Fig.2 The expression of liver SREBP-1c and FAS mRNA (A) and p-ACC protein (B and C) of mice in different groups
2.3.2 脂肪酸氧化关键基因PPARα、PPARγ、CPT-1A和ACOX的表达 由图3可知,与Con组相比,Model、DHAL和DHAH组PPARα mRNA表达量均显著降低(P<0.05)。DHAL和DHAH组PPARα mRNA表达量均显著高于Model组(P<0.05),DHAL和DHAH组间PPARα mRNA水平没有显著差异(P>0.05)。各组PPARγ mRNA表达差异不显著(P>0.05)。 CPT-1A和ACOX mRNA表达一致,Model组均显著低于Con组(P<0.05)。DHAL和DHAH组均显著高于Model组(P<0.05),DHAH组显著低于DHAL组(P<0.05)。
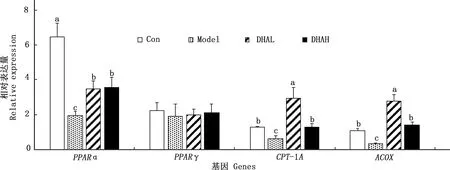
图3 各组小鼠肝脏PPARα、PPARγ、CPT-1A和ACOX mRNA的表达Fig.3 The expression of liver PPARα,PPARγ,CPT-1A and ACOX mRNA of mice in different groups
2.3.3 肝脏线粒体基因PGC-1α及褐色脂肪化基因Prdm16和UCP1 mRNA的表达 由图4可知,Model组PGC-1α mRNA表达量显著低于Con组(P<0.05),DHAL和DHAH组PGC-1α mRNA表达量均显著高于Model和Con组(P<0.05),且DHAH组PGC-1α mRNA表达量显著高于DHAL组(P<0.05)。Model组Prdm16 mRNA表达与Con组没有显著差异(P>0.05),DHAL和DHAH组Prdm16 mRNA表达量显著高于Model和Con组(P<0.05)。Model组UCP1 mRNA表达量显著低于Con组(P<0.05),DHAL和DHAH组UCP1 mRNA表达量均显著高于Model组(P<0.05)。DHAL和DHAH组Prdm16和UCP1 mRNA表达均无显著差异(P>0.05)。
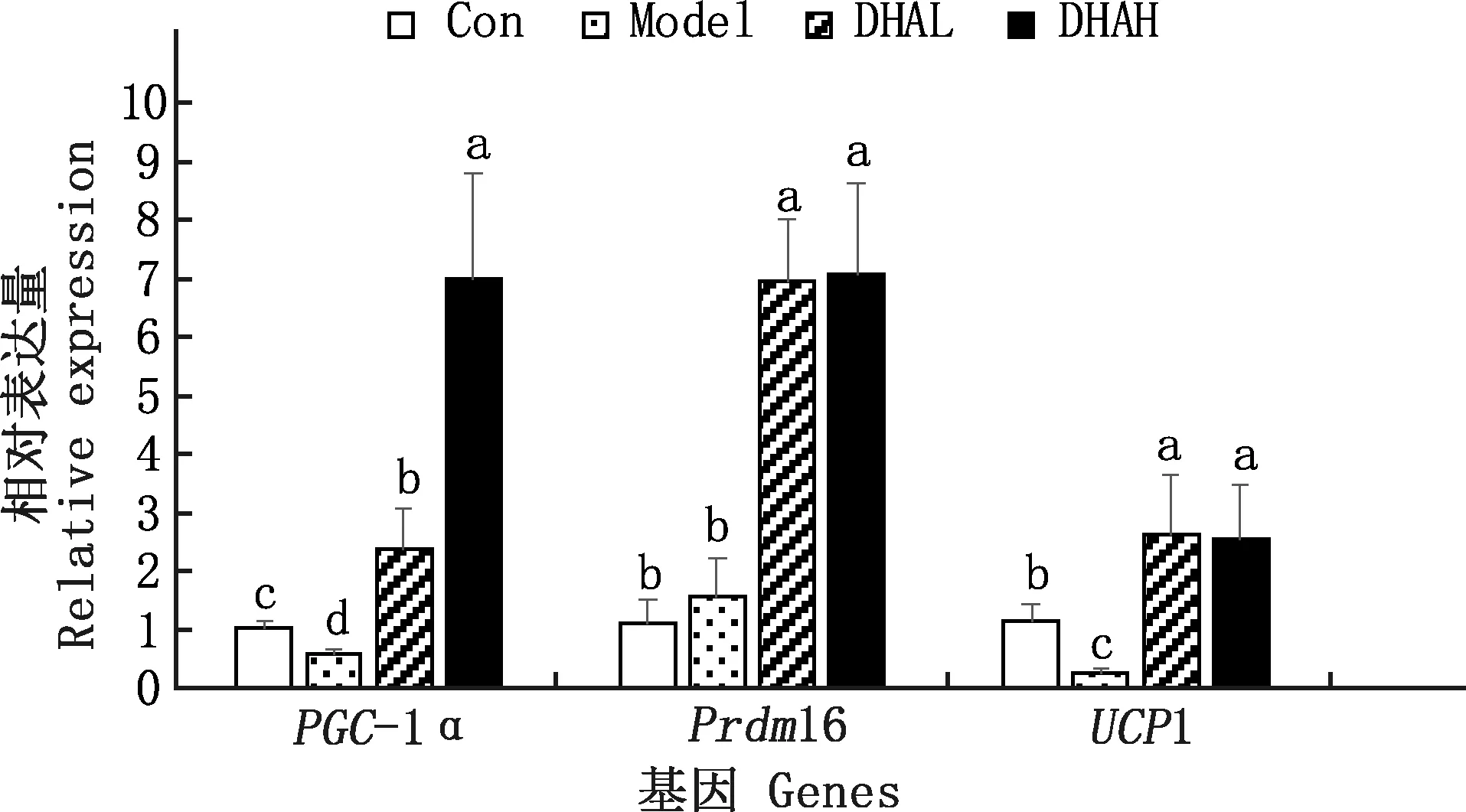
图4 各组小鼠肝脏PGC-1α、Prdm16和UCP1 mRNA的表达Fig.4 The expression of liver PGC-1α,Prdm16 and UCP1 mRNA of mice in different groups
2.3.4 AMPK、p-AMPK、AKT和p-AKT蛋白的表达 由图5可知,Model组p-AMPK/AMPK显著低于Con组(P<0.05),Model和DHAL组的p-AMPK/AMPK差异不显著(P>0.05),DHAH组p-AMPK/AMPK显著高于Model和DHAL组(P<0.05),p-AMPK/AMPK在DHAH与Con组间无显著差异(P>0.05)(图5A、5B)。与Con组相比,Model组p-AKT/AKT显著降低(P<0.05)。与Model组相比,DHAL和DHAH组p-AKT/AKT均显著升高(P<0.05),p-AKT/AKT在DHAL与DHAH组间差异不显著(P>0.05)(图5C、5D)。
3 讨 论
本试验结果表明,DHA逆转了高脂饲粮诱导的终体重、体脂和肝脏TG的增加;增加了肝脏脂联素的浓度,具有剂量依赖性。DHA通过激活AMPK通路,抑制肝脏新生脂肪合成关键酶SREBP-1c、FAS mRNA和p-ACC蛋白表达,上调脂肪酸氧化的关键代谢基因PPARα、CPT-1A和ACOX的mRNA的表达,促进肝脏线粒体基因PGC-1α mRNA和褐色脂肪化基因Prdm16和UCP1 mRNA的表达,从而预防了高脂饲粮诱导的肝脏脂肪的积累。
过量食用高脂饲粮会导致肝脏脂肪积累,引起一系列肝脏的变化,包括单纯的肝脏脂肪变性和炎症等[8-9]。本试验中,高脂饲粮导致C57BL/6小鼠的终体重、体脂重量和肝脏TG含量的增加,表明高脂饲粮可诱导肝脏脂肪的积聚。DHA可预防高脂饲粮诱导的终体重、体脂重量和肝脏TG含量增加,促进肝脏AMPK蛋白磷酸化,增加其下游基因PPARα、CPT-1A和ACOX的mRNA水平,表明AMPK及其下游基因可能是DHA在肝脏中的重要靶点。此外,一些研究发现,脂联素/AMPK信号通路的改变也可能对脂肪的积聚发挥重要的作用[10-11]。小鼠肝脏脂联素/AMPK通路激活能减少高脂饲粮诱导的脂肪肝[12-14]和肾脏脂肪毒性[15]。本研究结果表明,DHAH组C57BL/6小鼠肝脏脂联素的浓度显著增加,DHA导致肝脏AMPK蛋白磷酸化升高,表明DHA预防高脂诱导的肝脏脂肪的积累可能通过脂联素触发AMPK通路实现。另有研究认为,小鼠饲喂补充DHA饲粮后脂联素浓度增加是PPARγ上调所导致的[3]。但是,本研究中DHA对PPARγ的表达没有显著影响,而是上调了AMPK通路下游的PPARα mRNA的表达,且PPARα的下游靶基因CPT-1A和ACOXmRNA的表达也升高了,这进一步证明DHA通过上调肝脏PPARα而不是PPARγ的表达预防肝脏脂肪的积累,该结果与Yang等[6]给患有非酒精性脂肪肝的C57BL/6J小鼠饲喂DHA后,PPARα mRNA表达上升的研究结果一致。DHA是PPARα的天然配体,当DHA与PPARα结合后,可以促进脂肪酸代谢过程基因的表达[8,16-19],可进一步支持DHA通过AMPK通路激活PPARα上调肝脏氧化的关键代谢基因的表达,加速肝脏脂肪酸氧化分解。此外,有证据表明,PPARα激活会抑制大鼠肝脏AKT的磷酸化[20]。但在本研究中,DHA激活了PPARα,也逆转了高脂饲粮导致的肝脏pAKT/AKT表达的降低。因此,DHA是否通过PPARα调节AKT通路从而缓解肝脏脂肪积累还需要进一步研究。
SREBP-1c是激活脂肪酸和TG合成的首要基因[15-16]。 SREBP-1c信号增强与ACC和FAS mRNA表达上调有关[21]。作者发现,DHA降低了高脂饲粮诱导C57BL/6小鼠肝脏新生脂肪合成基因SREBP-1c和FASmRNA表达,且DHA的作用具有剂量依赖性。ACC是脂肪酸合成的限速酶[17],本研究结果表明低剂量DHA促进了ACC蛋白磷酸化,而高剂量DHA降低了ACC蛋白磷酸化,这一结果暗示不同剂量的DHA对ACC蛋白磷酸化的作用不同,还需要进一步验证。
UCP1是唯一只在棕色脂肪组织中表达的解偶联蛋白质,棕色脂肪组织通过大量表达UCP1引起线粒体氧化呼吸的电子传递和ATP产生解偶联作用,降低脂肪酸氧化代谢的产能,使能量以热量形式散失,从而抵御肥胖和相关疾病的发生[22-23]。许多研究都证明,肥胖的人群和小鼠白色脂肪的线粒体功能受损[23-24]。PGC-1α功能的改变可以导致线粒体功能障碍[23,25]。Prdm16是调节棕色脂肪细胞形成的关键转录因子,是控制棕色和白色脂肪细胞特异基因表达程序的分子开关[24]。本研究结果表明,DHA增加了肝脏Prdm16 mRNA的表达,暗示肝脏中的白色脂肪细胞可能转化为棕色脂肪细胞。此外,高脂饲粮导致肝脏UCP1 mRNA的表达下降,而DHA上调了UCP1 mRNA的表达,这也证明了DHA可以诱导肝脏白色脂肪细胞分化成棕色细胞,减少白色脂肪的含量。本研究结果还表明,DHA增加PPARα和PGC-1α mRNA的表达上调。PGC-1α的上调有利于其与PPARα结合,促进脂肪酸氧化酶的转录[8],增强线粒体的呼吸活动,有利于增加能量的消耗。总之,这些数据表明,DHA可能激活肝脏PPARα-AMPK-PGC-1α信号通路,增强线粒体的功能,从而增加能量的消耗。
4 结 论
本研究结果表明,DHA可降低高脂饲粮导致的C57BL/6小鼠终体重、体脂和TG含量的升高,增加肝脏脂联素的水平;DHA可从2个方面预防高脂饲粮诱导的肝脏脂肪积累:首先,通过激活AMPK蛋白,上调PPARα mRNA表达,抑制ACC蛋白的磷酸化,抑制脂肪合成基因SREBP-1c和FASmRNA的表达,并促进脂肪酸氧化基因的表达;其次,通过增加肝脏UCP1、PGC-1α和Prdm16褐色基因的表达,促进肝脏脂肪白色细胞褐色化。
