红嘴鸥TLR7基因克隆与生物信息学分析
2022-02-15罗倩敏余琬玲刘清琦黄翠琴
常 华,段 纲,阮 谦,罗倩敏,余琬玲,刘清琦,黄翠琴,项 勋
(1.云南农业大学,昆明 650201;2.龙岩学院福建省家畜传染病防治与生物技术重点实验室,龙岩 364012)
红嘴鸥是分布于欧亚大陆和北美洲东部沿海的一种候鸟,每年冬天大量的红嘴鸥从北方西伯利亚地区迁徙到中国南方越冬,其越冬地分布广泛。从1985年秋季至今30余年在昆明翠湖从未间断,且种群数量呈增加趋势。野生鸟类的迁徙与多种流行性疾病存在密切联系,受到兽医公共卫生的关注,对于野生鸟类机体的免疫机制研究尤为关键。对红嘴鸥行为模式研究发现,在整个越冬期间其以补充、积累能量为主;日间存在明显的“上午觅食+中午休息+下午觅食”的行为模式,一天中最主要的行为是觅食。 而且它们熟悉昆明翠湖及周边环境,在没有人为伤害的情况下,对游客十分亲近[1]。这些行为均极大地增加红嘴鸥所携带病原体的传播风险。2014年检测发现,红嘴鸥在迁徙过程中感染禽流感[2];2020年检测发现红嘴鸥可持续携带单增李斯特菌[3]。
天然免疫系统是机体防御病原体入侵的首道防线,机体中Toll样受体(Toll-like receptor,TLR)是能调控机体免疫的重要模式识别受体,在机体抗病原体感染中发挥重要的作用,该家族成员有TLR1、TLR2、TLR4、TLR5、TLR6、TLR11、TLR3、TLR7、TLR8和TLR9[4]。当机体感染病毒后,TLR7可识别病毒的单链RNA,激活Ⅰ型干扰素IFN表达来启动不同的信号传导途径发挥抗病毒感染[5-6]。人感染流感病毒后TLR7/8介导的IFN-α蛋白分泌水平有明显的上调作用[7],猪肺泡巨噬细胞感染猪繁殖与呼吸综合征病毒后,TLR7显著诱导β-干扰素(IFN-β)和γ-干扰素(IFN-γ)[8]。相较于人和其他哺乳动物TLR7而言,禽类TLR7研究主要集中在鸭、鹅、鸡、鸽,鸭感染新城疫强毒后TLR7在骨髓和法氏囊内表达上调[9];鹅感染低致病性禽流感H9N2后TLR7在肺组织中相对表达量显著升高[10];在肾型传染性支气管炎病毒(NIBV)诱导的鸡痛风中,NIBV激活TLR4和TLR7信号通路并引起mRNA表达量的变化,促进机体炎症发生,引起肾脏损伤[11]。鸽感染新城疫病毒后TLR7与髓样分化因子MyD88基因结合后激活干扰素调节因子信号通路,促进α-干扰素(IFN-α)和白细胞介素6(IL-6)、白细胞介素12(IL-12)等炎性因子的产生,从而介导免疫应答[12]。相较于家禽TLR7基因功能研究,野生禽类红嘴鸥TLR7基因鲜见报道。 本研究用cDNA末端快速扩增技术(rapid amplification of cDNA ends,RACE)扩增红嘴鸥TLR7基因序列,并对其进行生物信息学分析,以期为后期深入研究TLR7蛋白抗病毒作用机制提供依据。
1 材料与方法
1.1 材料
Tks GflexTMDNA Polymerase(R060A)PCR试剂盒、DL2000 DNA Marker(3427A)、pMD19-T Vector(6013)、RNAiso Plus(9109)RNA提取试剂盒、PrimeScriptTMⅣ 1st Strand cDNA Synthesis Mix(6215A)反转录试剂盒、SMARTer RACE 5′/3′Kit(634858)、大肠杆菌JM109感受态细胞均购自宝日医生物技术(北京)有限公司;胶回收试剂盒(DP209)、小量质粒提取试剂盒(DP103)、SYBR Premix ExTaqTM(FP205)荧光定量试剂盒均购自天根生化科技(北京)有限公司。
全自动凝胶成像系统(5000Proll)购自广州博鹭腾生物科技有限公司;台式离心机(Microfuge 20)和PCR仪(SimpliAmp Thermo Scientific)购自伯乐公司。
1.2 方法
1.2.1 红嘴鸥外周血淋巴细胞RNA提取 2019年10月在云南昆明翠湖采集3只红嘴鸥血样后分离淋巴细胞,在无菌EP管内加入3 mL外周血和3 mL分离液,1 500 r/min离心20 min;吸取云雾状层至无菌EP管并加入1 mL洗液,经离心留沉淀,用2 mL RPMI 1640培养基吹打混匀,放在6孔板中培养,将培养8、12、24 h的淋巴细胞用细胞刮刮下,用RNAiso Plus提取RNA,经1.0%琼脂糖凝胶电泳检测RNA完整性。
1.2.2 引物设计及合成 根据GenBank中鸡(登录号:FJ915562.1)、鸭(登录号:MK986726.1)TLR7基因序列设计第1对引物F1和R1扩增红嘴鸥TLR7基因的部分片段;根据TLR7基因部分片段的测序序列设计第2对引物的上游引物F2,与RACE试剂盒中3′-RACE引物(作为下游引物R2)扩增TLR7基因的3′-RACE片段;根据3′-RACE片段的测序序列和鸭(登录号:MK986726.1)TLR7基因序列设计第3对引物(F3/R3),扩增TLR7基因的全序列,引物序列见表1。引物均由生工生物工程(上海)股份有限公司合成。

表1 引物信息
1.2.3TLR7基因的克隆与测序 用 PrimeScriptTMⅣ 1st Strand cDNA Synthesis Mix 将RNA反转录为cDNA,采用引物F1/R1扩增TLR7基因部分片段;用引物F2/R2扩增TLR7基因3′-RACE片段;用引物F3/R3扩增TLR7全基因。PCR扩增体系25 μL:上、下游引物各1 μL,MgCl21.5 μL,dNTPs 2 μL,10×PCR Buffer 2.5 μL,TaqDNA聚合酶0.25 μL,cDNA模板1 μL,ddH2O补至25 μL。PCR反应程序:95 ℃预变性1 min;94 ℃变性50 s,55 ℃退火45 s,72 ℃延伸1 min,共25个循环;72 ℃延伸10 min。取5 μL PCR产物经1.0%琼脂糖凝胶电泳检测。PCR产物经胶回收纯化后,经过TA克隆至pMD19-T载体,连接体系为Solution Ⅰ 4 μL、pMD19-T载体1 μL,目的片段5 μL,放入16 ℃恒温箱过夜连接,连接产物转化大肠杆菌JM109感受态细胞,并在含有氨苄青霉素的LB固体培养基上37 ℃培养16 h。挑取单克隆后,将其置于含氨苄青霉素的LB液体培养基中继续培养,挑取阳性菌落进行扩大培养,通过菌液PCR验证后,将阳性菌落送至宝日医生物技术(北京)有限公司进行测序。
1.2.4 生物信息学分析 用DNAStar软件中的MegAlign程序分析GenBank中原鸡(登录号:FJ915562.1)、红腹角雉(登录号:MK697329.1)、鹌鹑(登录号:MK697327.1)、绿头鸭(登录号:XM_013108249.4)、黑天鹅(登录号:XM_035542207.1)、山雀(登录号:XM_033512663.1)、白鹭(登录号:XM_009646337.2)、帝企鹅(登录号:XM_009278529.2)、红喉潜鸟(登录号:XM_009813692.1)、巴布亚企鹅(登录号:MN313017.1)与红嘴鸥TLR7基因序列的相似性,并构建系统进化树;采用ProtParam程序分析TLR7蛋白理化性质;分别采用NetNGlyc1.0和NetPhos3.1程序预测蛋白糖基化位点和磷酸化位点;分别采用ProtScale、SignalP v3.0和TMHMM Server 2.0程序分析蛋白的亲/疏水性、信号肽切割位点和跨膜区;用在线软件RARE CODON CALTOR(http:∥people.mbi.ucla.edu/sumchan/caltor.html)预测蛋白的稀有密码子;采用PSORTⅡ Prediction在线软件(https:∥psort.hgc.jp/form2.html)进行亚细胞定位;利用SOPMA程序(https:∥npsa-prabi.ibcp.fr/)预测蛋白二级结构;利用SWISS-MODEL在线软件(https:∥swissmodel.expasy.org/)预测蛋白三级结构。
2 结 果
2.1 TLR7全基因克隆及序列分析
利用F1/R1引物进行PCR扩增,结果表明,PCR产物大小约300 bp(图1A),测序后比对,与预期相符,该片段为TLR7基因的部分片段。3′-RACE PCR扩增条带大小约700 bp(图1B),测序结果显示成功获得3′-RACE序列。F3/R3引物PCR扩增条带为1 720 bp (图1C),与预期一致。PCR产物回收后与pMD19-T载体连接,经转化挑菌鉴定发现,试验成功克隆了红嘴鸥TLR7基因。测序结果表明,红嘴鸥TLR7基因全序列长度为1 720 bp。红嘴鸥TLR7基因存在39个稀有密码子,包括9个AGG、4个CGA、4个CGG、4个GGA、4个CUA、4个CCC、3个AGA、3个AUA、2个GGG、2个ACG,且含有8个连续的稀有密码子CCCCGA、CGACUA、GGGAGG、AGGCUA。序列提交至NCBI数据库,获得GenBank登录号为:MZ668652。
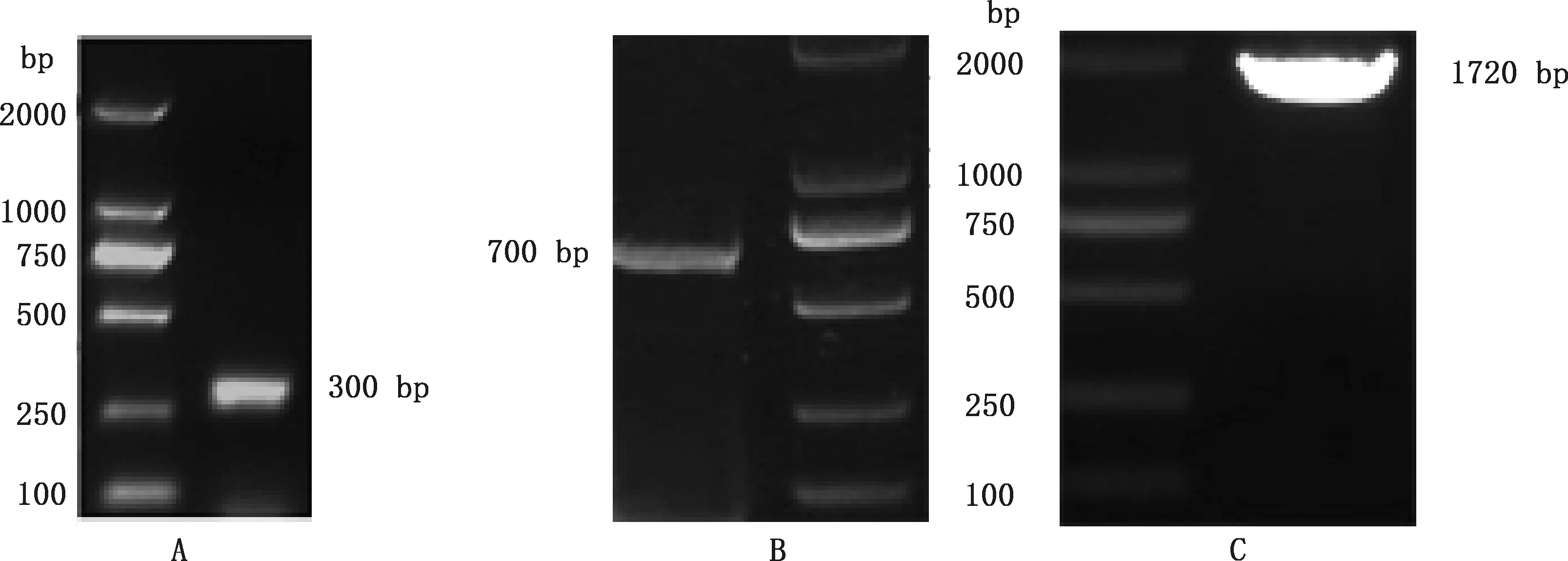
A,TLR7基因部分片段PCR扩增;B,TLR7基因的3′-RACE序列扩增;C,TLR7基因全序列PCR扩增A,PCR amplification of partial sequence of TLR7 gene;B,PCR amplification of TLR7 gene by 3′-RACE;C,PCR amplification of full sequence of TLR7 gene图1 红嘴鸥TLR7基因PCR扩增Fig.1 PCR amplification of TLR7 gene in Larus ridibundus
2.2 生物信息学分析
2.2.1TLR7基因相似性比对及系统进化树构建 红嘴鸥TLR7基因序列与GenBank中已公布的原鸡、红腹角雉、鹌鹑、绿头鸭、黑天鹅、山雀、白鹭、帝企鹅、红喉潜鸟和巴布亚企鹅的TLR7基因相似性分别为85.7%、84.9%、85.4%、87.0%、87.8%、86.8%、91.0%、93.1%、93.1%和93.1%(图2),其中与帝企鹅、红喉潜鸟和巴布亚企鹅TLR7基因相似性都较高。利用DNAStar软件分析并绘制进化树,发现红嘴鸥与鸟纲鹭科白鹭进化关系较近,与家禽(原鸡、鹌鹑、绿头鸭)的亲缘关系较远(图3)。
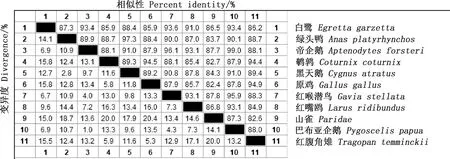
图2 不同物种间TLR7基因核苷酸序列相似性比对Fig.2 Similarity alignment of nucleotide sequences of TLR7 gene in different species
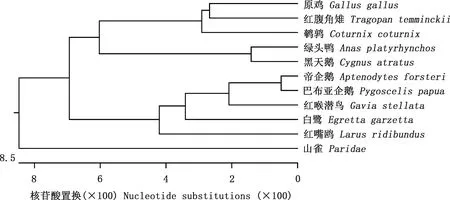
图3 TLR7基因系统进化树Fig.3 Phylogenetic tree of TLR7 gene
2.2.2TLR7基因编码蛋白的基本理化性质 测序获得的TLR7基因全序列长度为1 720 bp,编码区长度为1 182 bp,共编码393个氨基酸,TLR7蛋白分子质量约为63 ku。 分子式 C2080H3256N556O567S19,原子总数为6 478。蛋白质理论等电点为9.25。氨基酸组成中Leu含量(15.0%)最高,其次是Asn(7.4%)和Thr(6.4%),His(2.0%)、Met(2.0%)和Trp(2.5%)含量均较少(表2)。
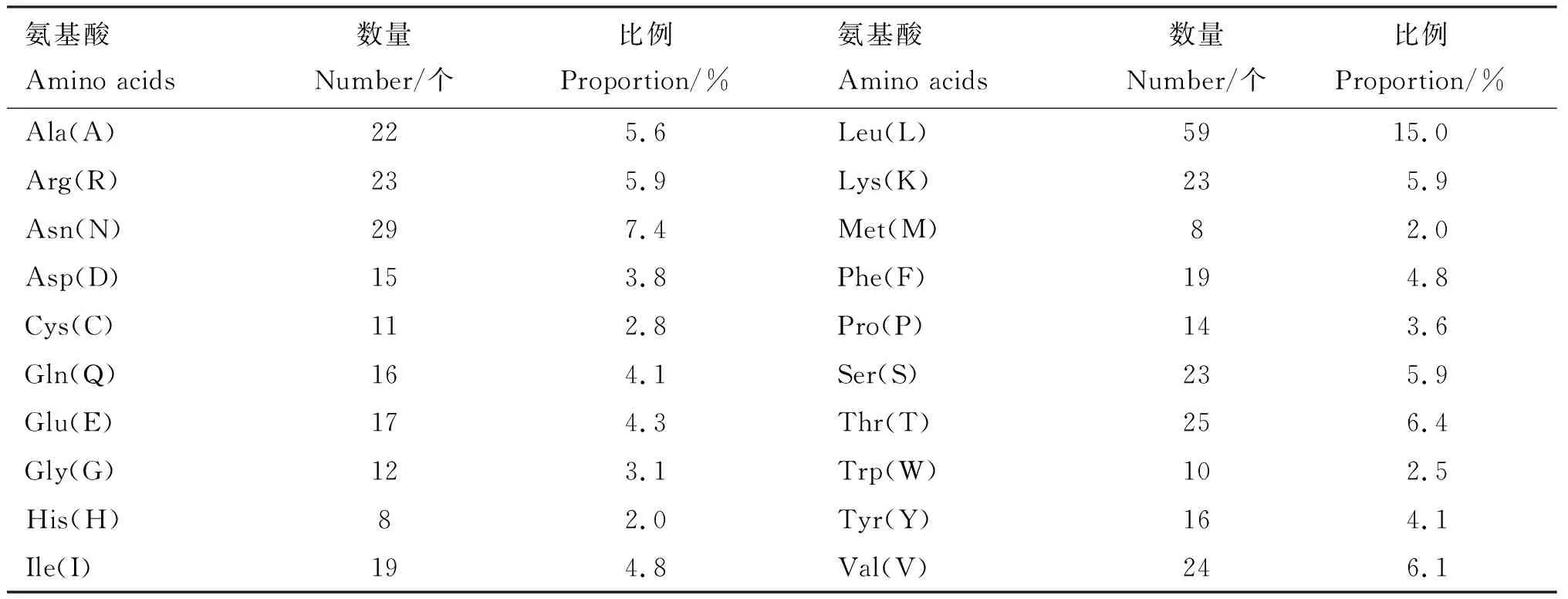
表2 红嘴鸥TLR7氨基酸组成
2.2.3 TLR7蛋白跨膜区和信号肽位点预测 TLR7蛋白多肽链的预测值为0,推测TLR7蛋白没有跨膜区(图4)。SignalP V3.0程序分析结果显示,TLR7蛋白没有信号肽切割位点(图5)。
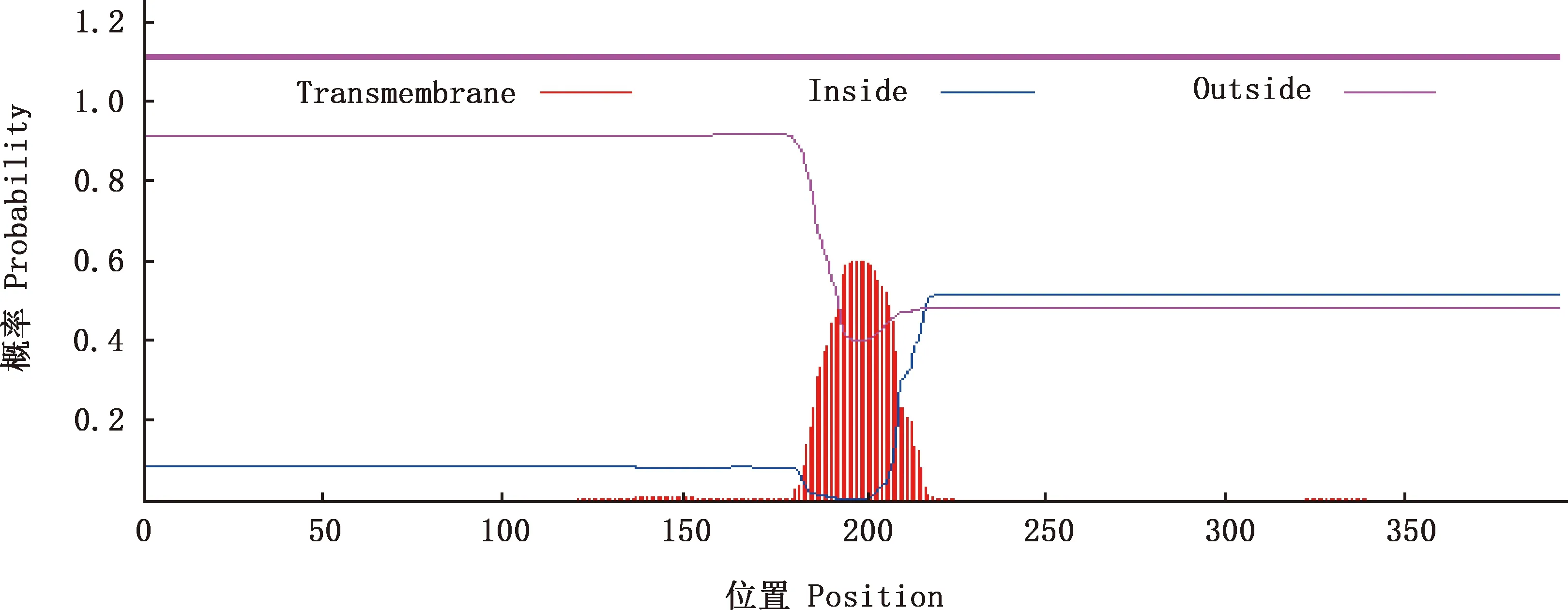
图4 红嘴鸥TLR7蛋白跨膜区预测Fig.4 Transmembrane prediction of TLR7 protein in Larus ridibundus
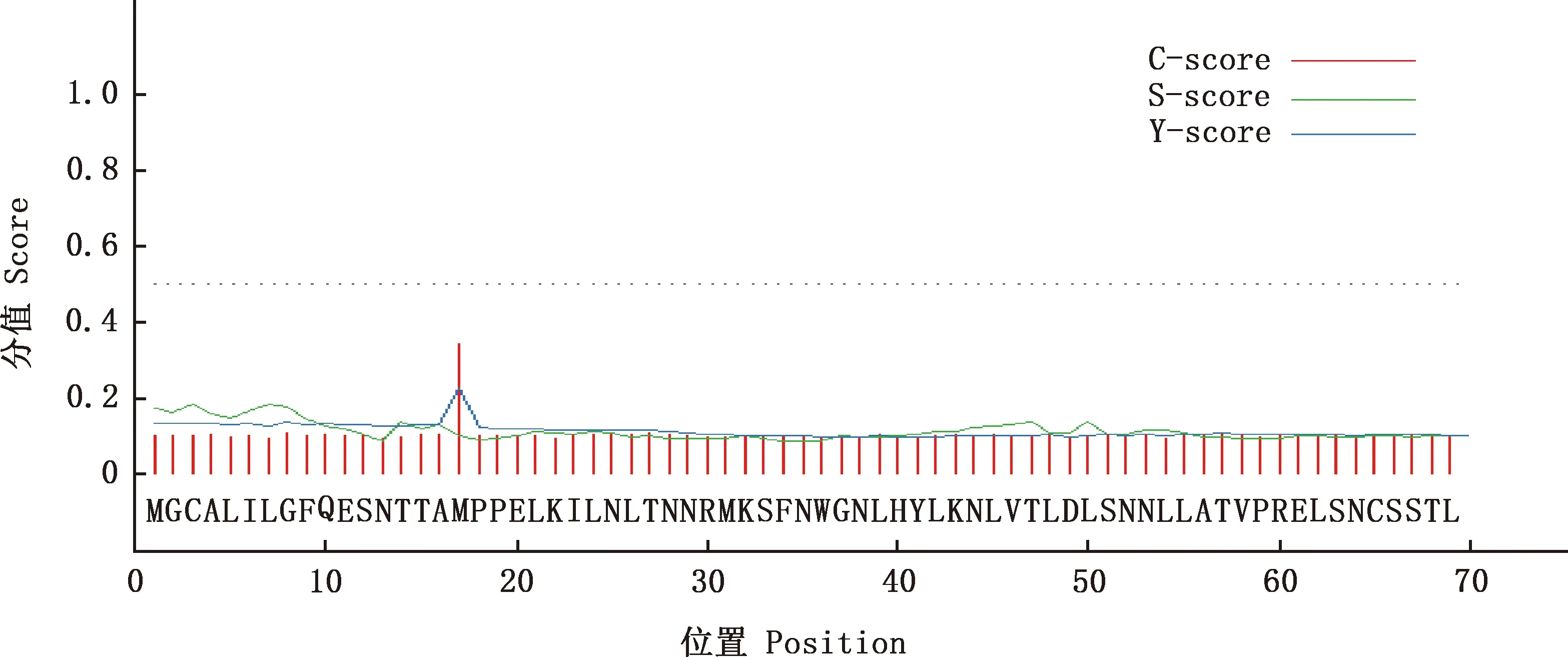
图5 红嘴鸥TLR7蛋白信号肽切割位点预测Fig.5 Signal peptide cleavage site prediction of TLR7 protein in Larus ridibundus
2.2.4 TLR7蛋白N-糖基化位点和磷酸化位点预测 预测结果显示,TLR7蛋白含有6个N-糖基化位点,分别位于第13、25、64、143、286、380位氨基酸处(图6)。TLR7蛋白含有33个磷酸化位点,其中16个丝氨酸磷酸化位点分别位于12、33、63、109、110、168、182、190、192、229、288、294、308、342、354、355位氨基酸处;4个酪氨酸磷酸化位点分别位于95、305、316、344位氨基酸处;13个苏氨酸磷酸化位点分别位于27、57、83、145、176、193、201、203、254、297、302、314、382位氨基酸处(图7)。
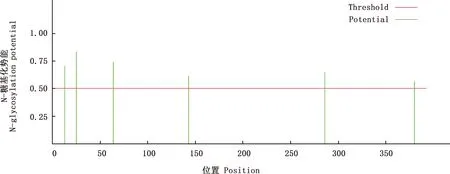
图6 红嘴鸥TLR7蛋白N-糖基化位点预测Fig.6 N-glycosylation site prediction of TLR7 protein in Larus ridibundus
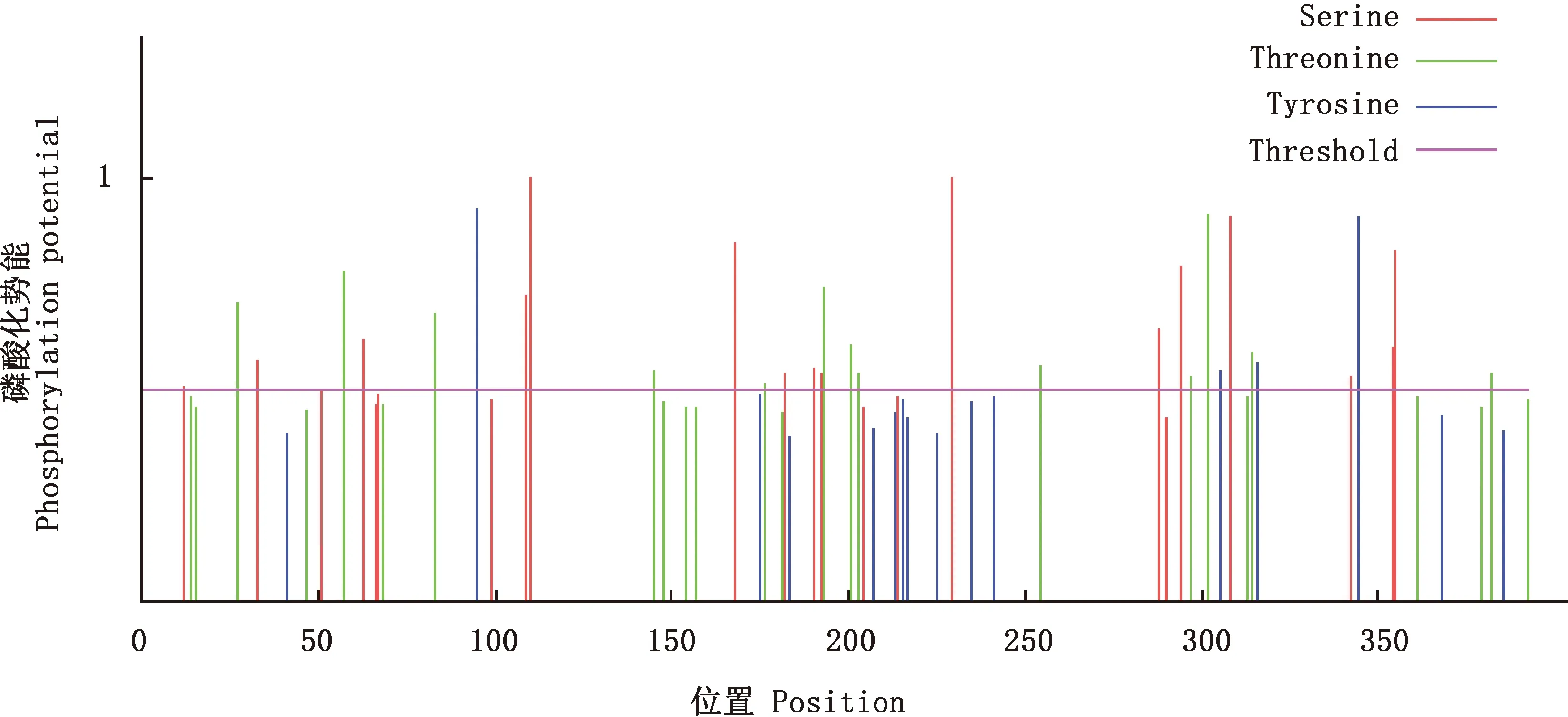
图7 红嘴鸥TLR7蛋白磷酸化位点预测Fig.7 Phosphorylation site prediction of TLR7 protein in Larus ridibundus
2.2.5 TLR7蛋白亲疏水性分析 TLR7蛋白含有9个疏水区域,其最小值为-2.367,最大值为3.044。 疏水区主要集中在5-7、119-120、135-141、149-160、170-173、185-208、236-238、297-303和329-337位氨基酸处;亲水区位于14-18、28-41、74-88、163-168、224-248、243-248、259-278、306-318、340-352、361-368和383-389位氨基酸处,该多肽链中亲水区域多于疏水区域,说明该蛋白为亲水性蛋白(图8)。
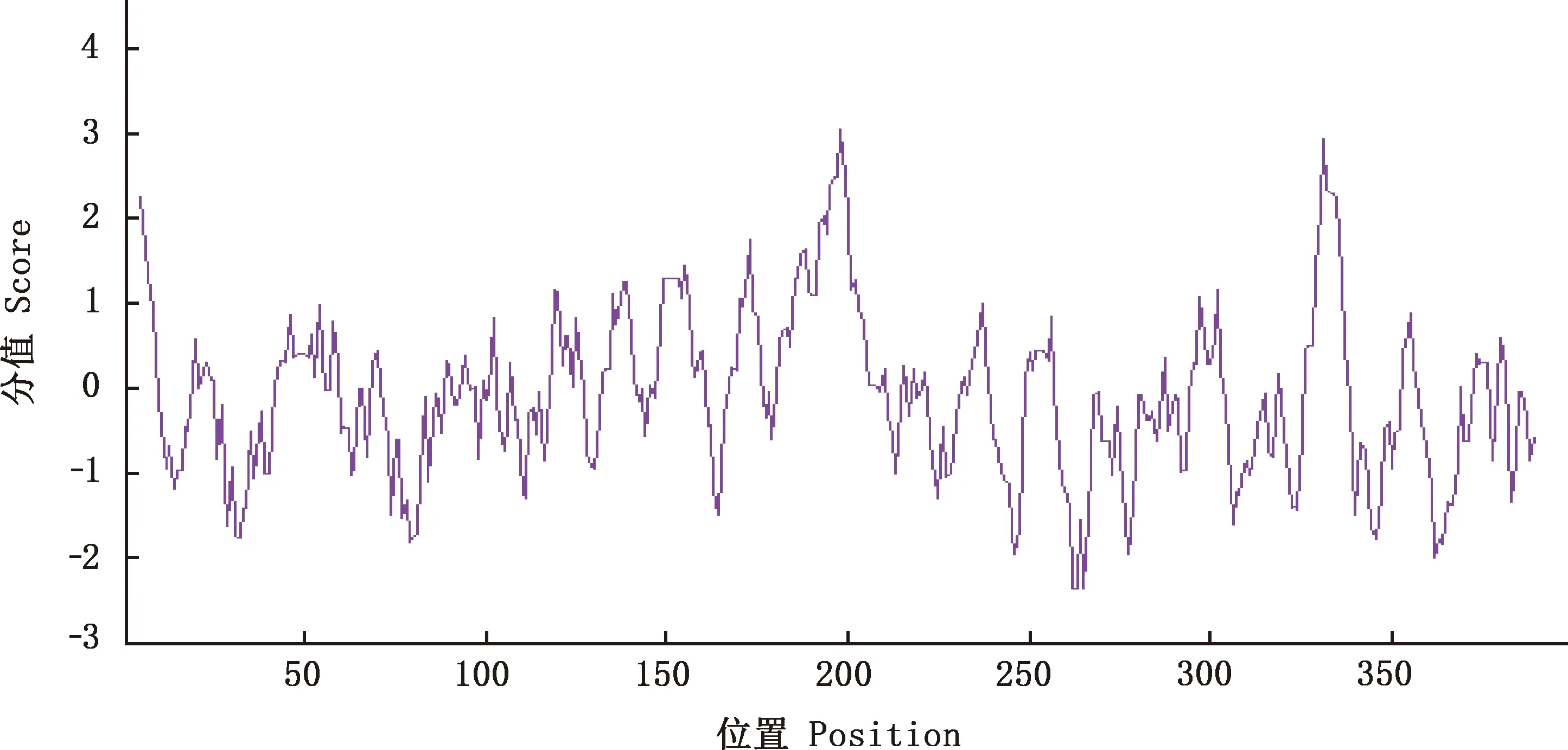
图8 红嘴鸥TLR7蛋白亲/疏水性预测Fig.8 Hydrophilicity and hydrophobicity prediction of TLR7 protein in Larus ridibundus
2.2.6TLR7蛋白亚细胞定位 蛋白亚细胞定位预测结果表明,红嘴鸥TLR7蛋白主要存在于细胞质(39.1%)、线粒体(17.4%)和细胞核(17.4%)中。
2.2.7 二级结构和三级结构预测 利用SOPMA程序预测红嘴鸥TLR7蛋白的二级结构,发现该蛋白中α-螺旋、无规则卷曲、延伸链、β-转角分别占48.09%、32.06%、13.23%、6.62%(图9);使用SWISS-MODEL在线软件预测红嘴鸥TLR7蛋白的三级结构发现,红嘴鸥TLR7蛋白主要以α-螺旋为主,与二级结构预测结果一致,且与模型蛋白人TLR7蛋白相似性为68.78%(图10)。
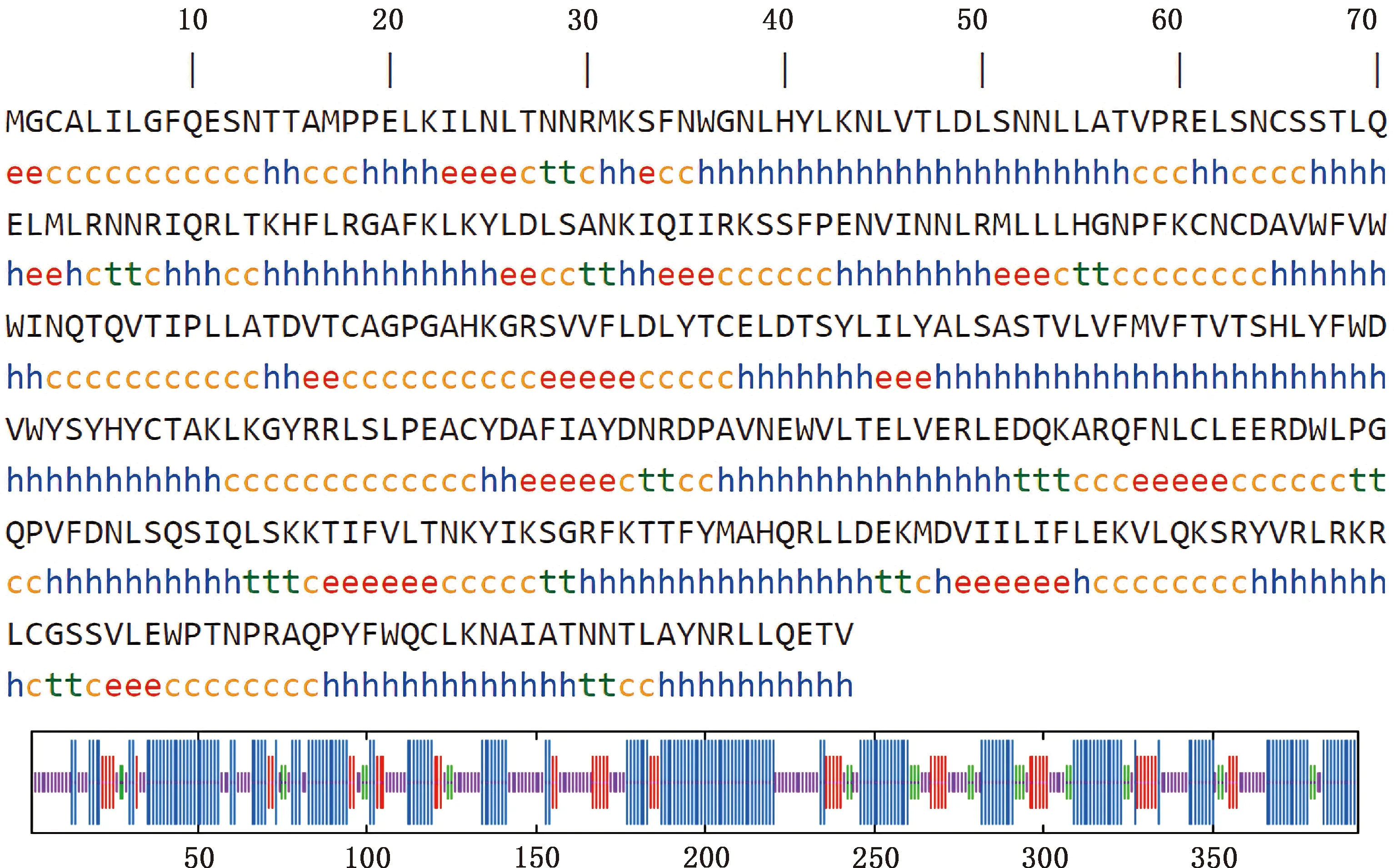
①h,α-螺旋;e,延伸链;t,β-转角;c,无规则卷曲.②线条按照从长到短的依次代表α-螺旋、延伸链、β-转角和无规则卷曲①h,Alpha helix;e,Extended chain;t,Beta turn;c,Random coil.② The lines represent alpha helix,extended chain,beta turn and random coil,by the length,respectively图9 红嘴鸥TLR7蛋白二级结构预测Fig.9 Secondary structure predicition of TLR7 protein in Larus ridibundus
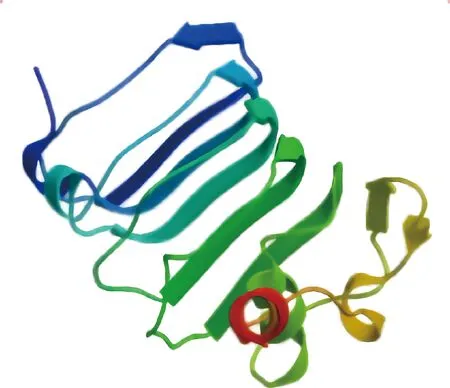
图10 红嘴鸥TLR7蛋白三级结构预测Fig.10 Tertiary structure prediction of TLR7 protein in Larus ridibundus
3 讨 论
红嘴鸥在迁徙过程中会携带大量病原,其中不乏会有能导致人兽共患疾病的病原。为此,深入研究红嘴鸥自身抗病毒的机制尤为关键。野生鸟类基因序列与已报道的家禽基因虽有相似性,但保守区片段都非常短,此外红嘴鸥是野生保护动物,每次采血量不能过多,导致核酸获得难度加大,试验设计引物时,要比对多个物种,寻找相似性非常高的区域进行扩增。 本试验设计同源序列引物,最终获得红嘴鸥TLR7基因的全序列,为后续基因分析奠定基础。
大多数畜禽TLR7基因已有报道,且不同动物TLR7基因长度不同,如大鲵[13]TLR7基因全长3 747 bp,ORF为3 150 bp(编码1 049个氨基酸);猪[8]TLR7基因全长3 160 bp,ORF为3 153 bp(编码1 050个氨基酸);鸽[14]TLR7基因长3 516 bp,ORF为3 175 bp(编码1 047个氨基酸);鸡[15]TLR7基因长6 747 bp,ORF为3 180 bp(编码1 059个氨基酸);鸭[16]TLR7基因全长6 747 bp,ORF为3 270 bp(编码1 089个氨基酸)。红嘴鸥TLR7基因序列全长1 720 bp,比鸡、鸭TLR7基因片段都小。将红嘴鸥TLR7基因与GenBank中已公布的10个物种TLR7基因进行相似性分析,虽其与帝企鹅、红喉潜鸟和巴布亚企鹅TLR7基因相似性都较高(93.1%),但进化树发现红嘴鸥TLR7基因与鸟纲鹭科白鹭属白鹭进化关系较近,与家禽(原鸡、鹌鹑、绿头鸭)的亲缘关系较远,说明该基因在不同物种间保守性存在差异。
家禽病毒感染机制研究中TLR7基因是非常重要的检测基因,在体外感染试验中,感染禽流感病毒[17-18]、禽呼肠孤病毒[19]、禽冠状病毒[20]、传染性支气管炎病毒[21]及传染性法氏囊病毒[22]后均出现TLR7基因表达水平升高;鹅感染新型病毒性肠炎病毒(NGVEV)后,检测发现脾脏中TLR7基因mRNA高水平表达,表明鹅TLR7在抗病毒防御中起重要作用[23]。TLR7基因在鸭先天免疫反应中也起重要作用,poly(I:C)诱导刺激鸭胚成纤维细胞,检测发现鸭TLR7基因过表达会促进β-干扰素(IFN-β)、干扰素调节因子7(IRF7)、信号转导与转录激活子(STAT1、STAT2)的表达[16]。表明TLR7蛋白在病毒感染早期参与免疫反应。本研究获得了红嘴鸥TLR7基因全长,为后期研究TLR7蛋白的抗病毒活性奠定基础。
红嘴鸥TLR7基因存在3个以上相连的稀有密码子,体外表达量低。在一定程度上蛋白表达量降低会影响蛋白纯化效率,所以后期体外表达该蛋白时要考虑选择利于表达的载体或表达宿主菌[24-25]。红嘴鸥TLR7蛋白不是跨膜蛋白或分泌蛋白,后期体外表达该蛋白时要优化诱导表达的温度和表达的时间提高其表达量。红嘴鸥TLR7蛋白主要定位于细胞质,与鹅TLR7蛋白亚细胞定位[10]有相似之处。N-糖基化的位点突变可以加强或降低细胞及体液免疫。磷酸化修饰是可逆的,参与细胞信号传导、神经活动等生理病理过程[25]。红嘴鸥TLR7蛋白存在6个N-糖基化位点和33个磷酸化位点,推测这些修饰可能与该蛋白的生理功能有关。后期TLR7蛋白功能研究可以借助修饰位点的变化来分析其抗病毒作用。这些蛋白质预测结果可为后期体外构建红嘴鸥TLR7基因原核表达载体及蛋白的表达优化提供重要的科学数据。
4 结 论
本试验采用RACE技术扩增获得红嘴鸥TLR7基因全序列,长1 720 bp,ORF大小为1 182 bp,存在39个稀有密码子,共编码393个氨基酸,TLR7蛋白分子质量约为63 ku。TLR7基因系统进化树结果显示,红嘴鸥与白鹭的亲缘关系最近。TLR7蛋白没有跨膜区和信号肽切割位点,含有6个N-糖基化位点和33个磷酸化位点,是疏水性蛋白,主要存在细胞质中。二级结构主要以α-螺旋为主,三级结构预测与二级结构一致。这些数据为后期探索红嘴鸥TLR7蛋白参与抗病毒免疫机制的深入研究提供重要依据。
