北京地区1株鸽圆环病毒全基因组测定及遗传进化分析
2022-02-15亓玉卓梁瑞英贾亚雄
亓玉卓,梁 琳,韩 坤,梁瑞英,贾亚雄,
(1.中国农业科学院北京畜牧兽医学研究所,北京100193;2.农业农村部兽用药物与诊断技术北京科学观测实验站,北京100193)
鸽圆环病毒(Pigeon circovirus,PiCV)是单链环状无囊膜DNA病毒,属于圆环病毒科(Circoviridae)圆环病毒属(Circovirus)成员[1],基因组长度约2 000 bp[2]。PiCV的基因组包含2个主要的开放阅读框(open reading frame,ORF)[3],分别编码复制酶蛋白(replicatedassociated protein,Rep)和核衣壳蛋白(putative capsid protein,Cap)[4]。编码Cap蛋白的起始密码子有ATG/ATA 两种,不同的起始密码子可能与编码蛋白大小及毒株的遗传进化有关。自1993年首次被发现[5]以来,PiCV陆续在世界各地被报道[6-7],2009年中国报道了第1例鸽圆环病毒病[8],随后2011—2017年陆续在福建和东部地区被报道检出,并且该病原被怀疑与幼鸽疾病综合征有关[9],目前该病原多在南方的鸽群中被检出,在报道中缺乏北京地区的PiCV基因组信息,从而缺少对该病原的诊断和认识。与其他动物圆环病毒类似,PiCV主要引起机体免疫抑制[10],影响青年鸽的发育,被感染鸽常出现消瘦、困倦、精神萎靡、腹泻等特征,严重影响赛鸽的竞翔能力。 PiCV与其他病毒、细菌、支原体等病原体混合感染后常加重病情,显示其他致病原的临床症状,混合感染或继发感染的情况下死亡率最高可达100%。PiCV与同属的鸡贫血病毒只感染鸡不同,它还可以感染其他鸟类,如金丝雀等。随着国内养鸽数量的增加,疾病的防控工作尤为重要,作为免疫抑制病原PiCV的检测应该引起重视,由于PiCV还无法培养,无论是鸽养殖者还是研究人员对该病原的认识都较少,关于PiCV病原学、流行病学及防控等多方面亟待研究。
2019年,北京市某鸽场发现有部分青年鸽发生精神萎靡、竞翔能力差的症状,疑似PiCV感染。为了解北京地区PiCV的遗传变异情况,掌握本地区PiCV的流行情况,本研究对该疑似患病鸽进行了检测,成功获得了1株PiCV的全基因组序列,并进行了遗传进化分析,以期了解毒株的遗传进化规律,为该病的防控及疫苗的研制提供思路,也为该病致病机理的研究奠定基础。
1 材料与方法
1.1 主要试剂与仪器
2×Lamp PCR MasterMix购自南京诺维赞生物科技有限公司;病毒基因组DNA提取试剂盒购自北京艾德莱生物科技有限公司;Trans2K DNA Marker、pEASY®Blunt克隆载体及大肠杆菌Trans T1感受态细胞均购自全式金生物科技有限公司;胶回收试剂盒、质粒纯化试剂盒均购自Omega。T100®Thermal Cycler PCR仪购自Bio-Rad公司;Tanon-1600凝胶成像分析系统购自上海天能科技有限公司;PowerPac®电泳仪购自Bio-Rad公司;NanoDrop2000微量核酸测定仪购自赛默飞世尔科技公司。
1.2 样品处理
自北京市某赛鸽场无菌条件下采集3只10日龄发病鸽的肝脏和脾脏组织,用生理盐水冲洗后,用无菌剪刀剪取约1 cm3大小,放入15 mL离心管中,再加入等体积的无菌PBS(pH 7.4),使用手持电动匀浆机匀浆后,迅速置于液氮中。提取组织基因组DNA/RNA前,在-80 ℃反复冻融3次。使用病毒基因组DNA提取试剂盒提取病毒基因组DNA,-20 ℃保存备用。
1.3 病料PCR检测
参考文献设计引物检测禽腺病毒[9](Fowl adenovirus,FAdV)、鸽Ⅰ型疱疹病毒[9](Columbid herpes virus 1,CHV-1)、PiCV[11]、鸽Ⅰ型副黏病毒(PPMV-1)[11],引物信息见表1。引物均由生工生物工程(上海)股份有限公司合成。PCR反应体系25 μL:2×PCR MasterMix 12.5 μL,上、下游引物(10 μmol/L)各1 μL,DNA模板1 μL,加ddH2O至终体积为25 μL。PCR反应条件:95 ℃预变性5 min;94 ℃变性50 s,退火(温度见表1)35 s,72 ℃延伸1 min,共35个循环;72 ℃延伸10 min。PCR产物通过1.0%琼脂糖凝胶电泳检测。
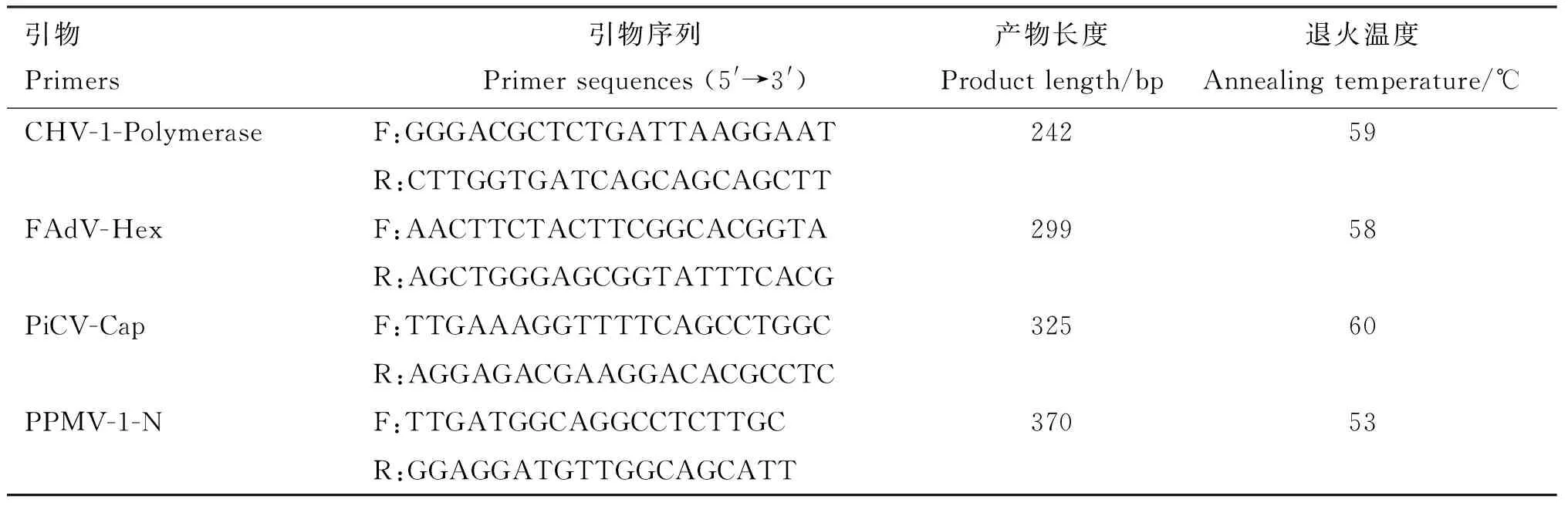
表1 引物信息
1.4 PiCV全基因组克隆及测序
参考GenBank中PiCV基因组序列(登录号:JX901128、AF252610、KX108795)设计引物,用于扩增病毒基因组,引物信息见表2,引物均由生工生物工程(上海)股份有限公司合成。 PCR反应体系25 μL:2×Lamp PCR MasterMix 12.5 μL,上、下游引物(10 μmol/L)各1 μL、DNA模板1 μL,加ddH2O至终体积为25 μL。PCR反应条件为:94 ℃预变性5 min;94 ℃变性50 s,60 ℃退火35 s,72 ℃延伸100 s,共35个循环;72 ℃延伸10 min。PCR产物经1.0%琼脂糖凝胶电泳检测,利用胶回收试剂盒回收纯化后与pEASY®-Blunt克隆载体连接,转化大肠杆菌Trans T1感受态细胞,随机选取3个阳性重组质粒送GENEWIZ生物科技有限公司测序。

表2 PiCV全基因组克隆引物
将测序结果与GenBank中登录的相关序列通过BLAST进行比对分析,用DNAStar软件进行序列整理和校对,然后拼接形成病毒全基因组序列。
1.5 遗传进化分析
将获得的病毒的全基因组序列及Cap和Rep基因分别与表3中参考序列分别进行相似性比对,利用DNAStar中的MegAlign软件进行相似性分析,利用Mega 7.0软件绘制系统进化树,采用Bootstrap工具对进化树的可靠性进行评价,重复1 000次。
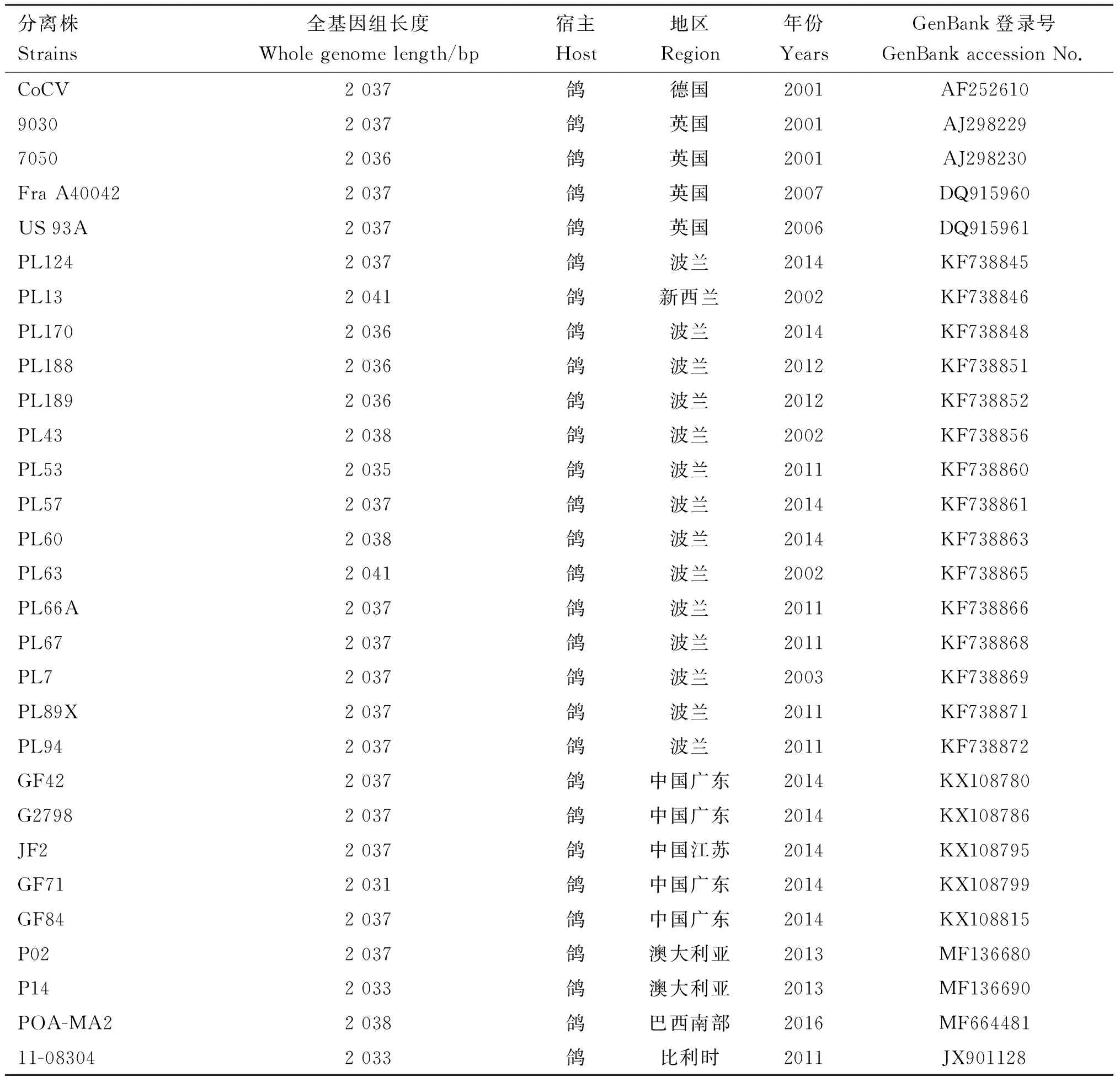
表3 参考毒株信息

续表
2 结 果
2.1 病料PCR检测结果
经PCR检测,3只病鸽中有1只病鸽的肝脏和脾脏中检测到大小为325 bp目的条带(图1),经过测序和BLAST比对,确定为PiCV阳性,并未检出其他病毒。
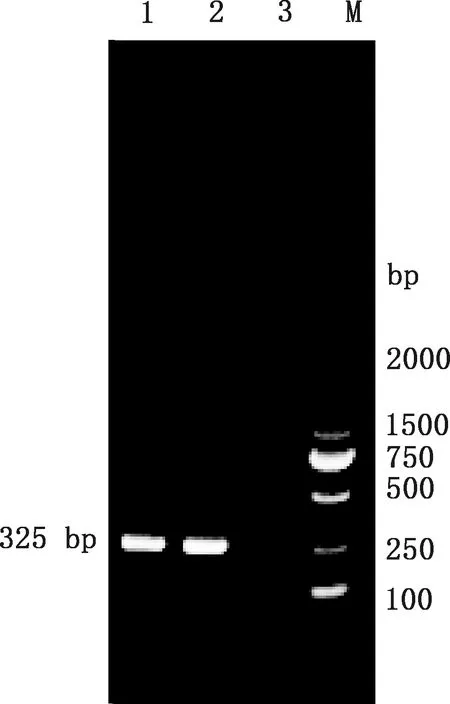
1,1号鸽脾脏组织;2,1号鸽肝脏组织;3,阴性对照;M,Trans2K DNA Marker1,Spleen tissue of No.1 Pigeon;2,Liver tissue of No.1 Pigeon;3,Negative control;M,Trans2K DNA Marker图1 鸽圆环病毒检测Fig.1 Detected of the PiCV
2.2 全基因组克隆及序列分析
利用检测引物对样品进行PCR扩增,得到大小分别为947、822、1 428和441 bp的产物(图2),阳性重组质粒测序结果表明,获得了1株PiCV的病毒全基因序列,病毒基因组全长为2 034 bp,包括5个开放阅读框,有2个主要开放阅读框,GC含量为55%,命名为PiCV BJ。 序列提交GenBank后,获得登录号:MW289588。 PiCV BJ株ORF-V1(48-995 bp)编码复制Rep蛋白,ORF-C1(1 981-1 166 bp)编码Cap蛋白。
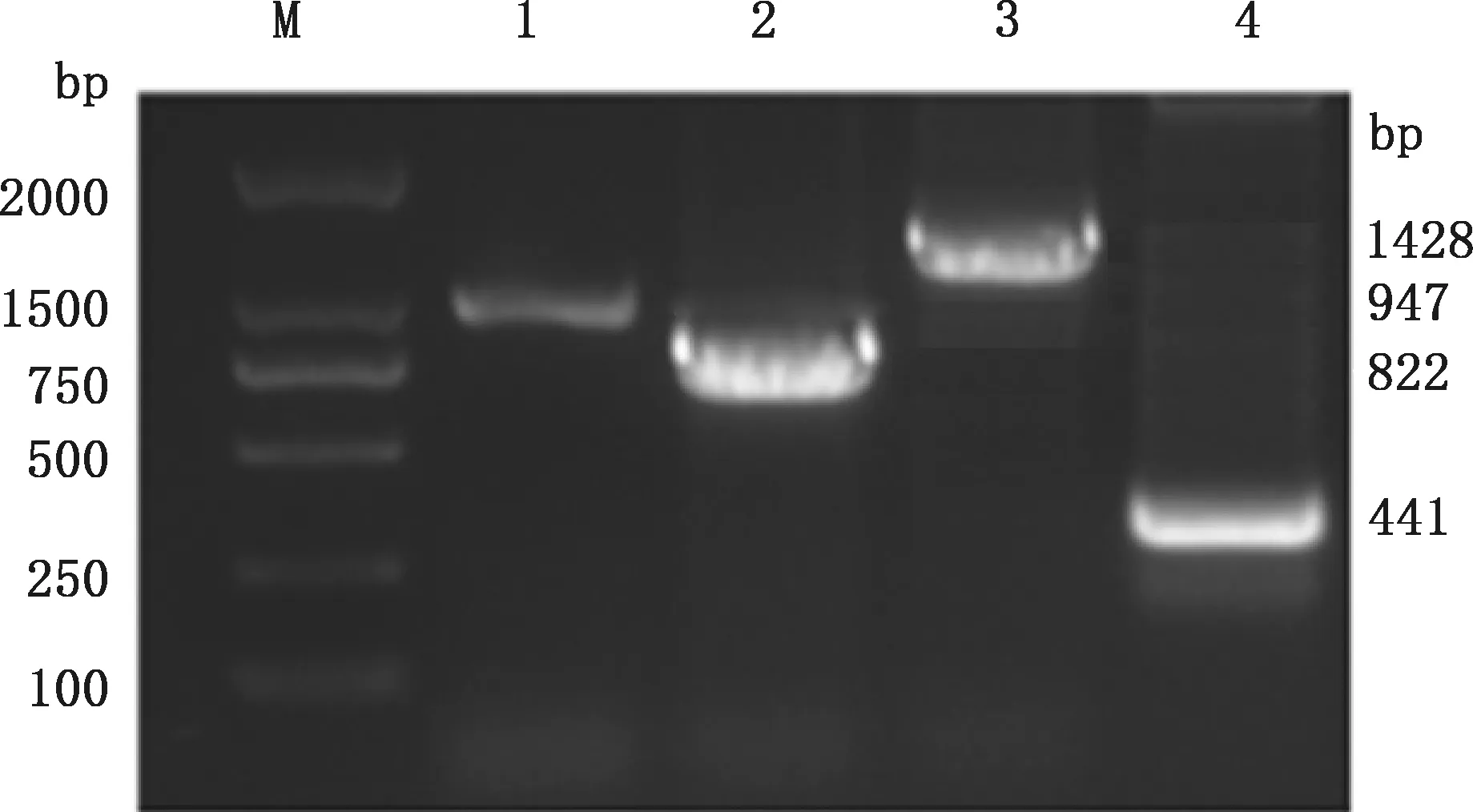
M,Trans2K DNA Marker;1~4,依次为引物3、1、2和4的PCR产物M,Trans2K DNA Marker;;1-4,The PCR products of primers 3,1,2 and 4,respectively图2 病毒全基因组分段扩增产物Fig.2 Segmented amplification product of the virus whole genome
2.3 全基因组序列相似性比对及遗传进化分析
相似性比对结果显示,PiCV BJ与其他PiCV的核苷酸相似性在86.0%~97.0%之间,其中PiCV BJ株与2011年分离自波兰的PL53的相似性最高,为97.0%;与分离自比利时的的鸽源11-08304株相似性最低,为86.0%(图3)。遗传进化树分析可知,PiCV BJ株与其他禽源圆环病毒不在同一分支,亲缘关系较远;与分离自波兰的鸽源PL124株处于同一分支,亲缘关系较近(图4);与国内其他省市发现的毒株遗传距离相对较远,表明PiCV BJ株可能是由国外引种传入中国,并发生了变异。
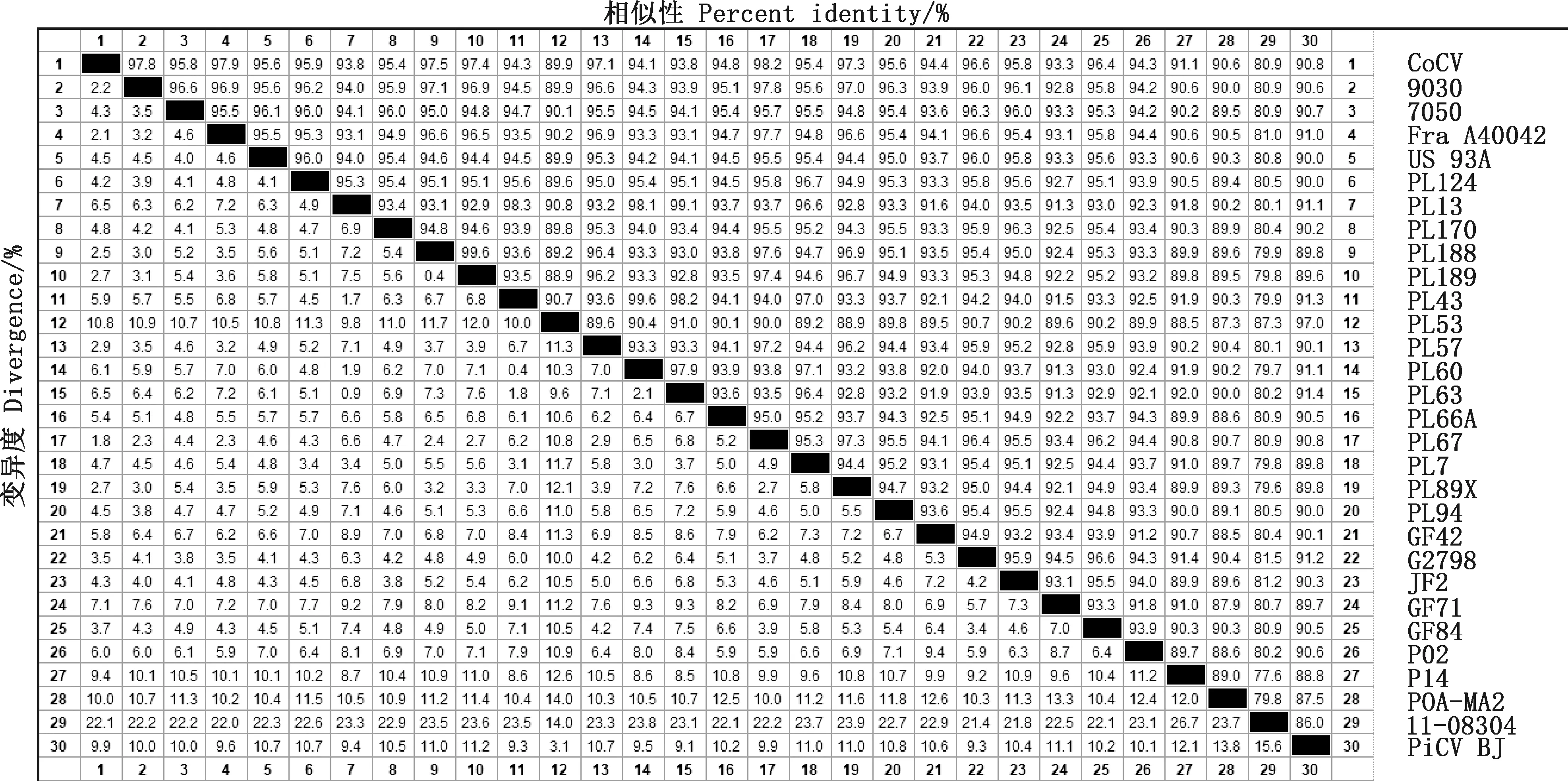
图3 PiCV全基因组核苷酸相似性比对Fig.3 Similarity alignment of genome-wide nucleotide of PiCV
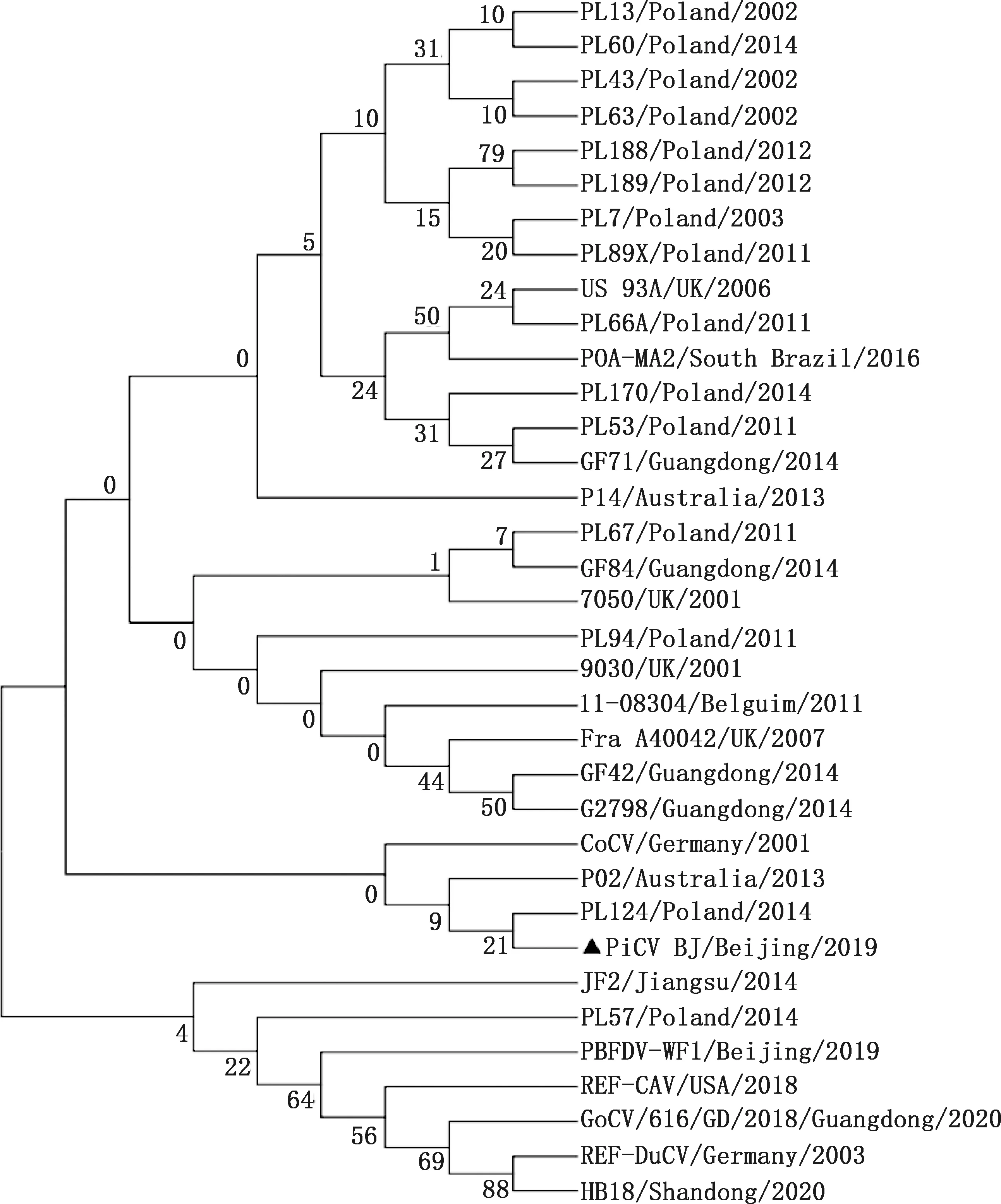
图4 PiCV遗传进化树Fig.4 Phylogenetic tree of PiCV
2.4 Cap及Rep基因的遗传进化分析
将PiCV BJ的Cap和Rep基因的核苷酸和氨基酸序列分别与国内外毒株进行相似性比对,并构建遗传进化树,结果发现,PiCV BJ的Cap基因与分离自比利时的11-80304核苷酸和氨基酸的相似性分别高达95.8%和85.2%(图5A和5B),Rep基因与分离自波兰的PL53核苷酸和氨基酸相似性分别高达94.6%和96.2%(图6A和6B)。通过氨基酸序列比对发现,PiCV BJ与国内外其他毒株相比,Cap蛋白主要在第23位(苏氨酸→丙氨酸)、673位(天冬氨酸→丙氨酸)、674位(脯氨酸→天冬氨酸)、802位(丙氨酸→谷氨酸)发生了氨基酸的变化。Rep蛋白氨基酸序列除因分离自比利时的11-80304株序列不全,仅有17.9%相似度以外,与其他参考毒株相似性均在93.4%以上,仅有3个位点与其他毒株有明显的不同,除起始密码子为ATG编码甲硫氨酸以外,分别在30位(脯氨酸→丝氨酸)、148位(甘氨酸→精氨酸)、225位(谷氨酰胺→天冬氨酸)发生变化。遗传进化树显示,PiCV BJ的Cap和Rep基因均与PL53和11-08304在同一分支,亲缘关系较近(图7),这与相似性分析的结果一致,它们的Cap基因起始密码子均为ATG,与起始密码子为ATA的7050、9030株的亲缘关系较远。
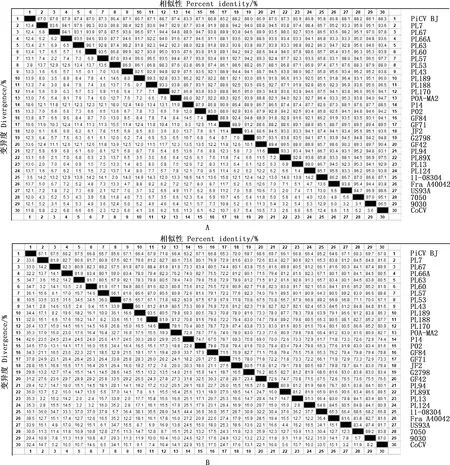
图5 PiCV Cap基因核苷酸(A)和氨基酸(B)序列相似性比对Fig.5 Similarity alignment of nucleotide (A) and amino acid (B) sequences of Cap gene of PiCV

图6 PiCV Rep基因核苷酸(A)和氨基酸(B)序列相似性比对Fig.6 Similarity alignment of nucleotide (A) and amino acid (B) sequences of Rep gene of PiCV
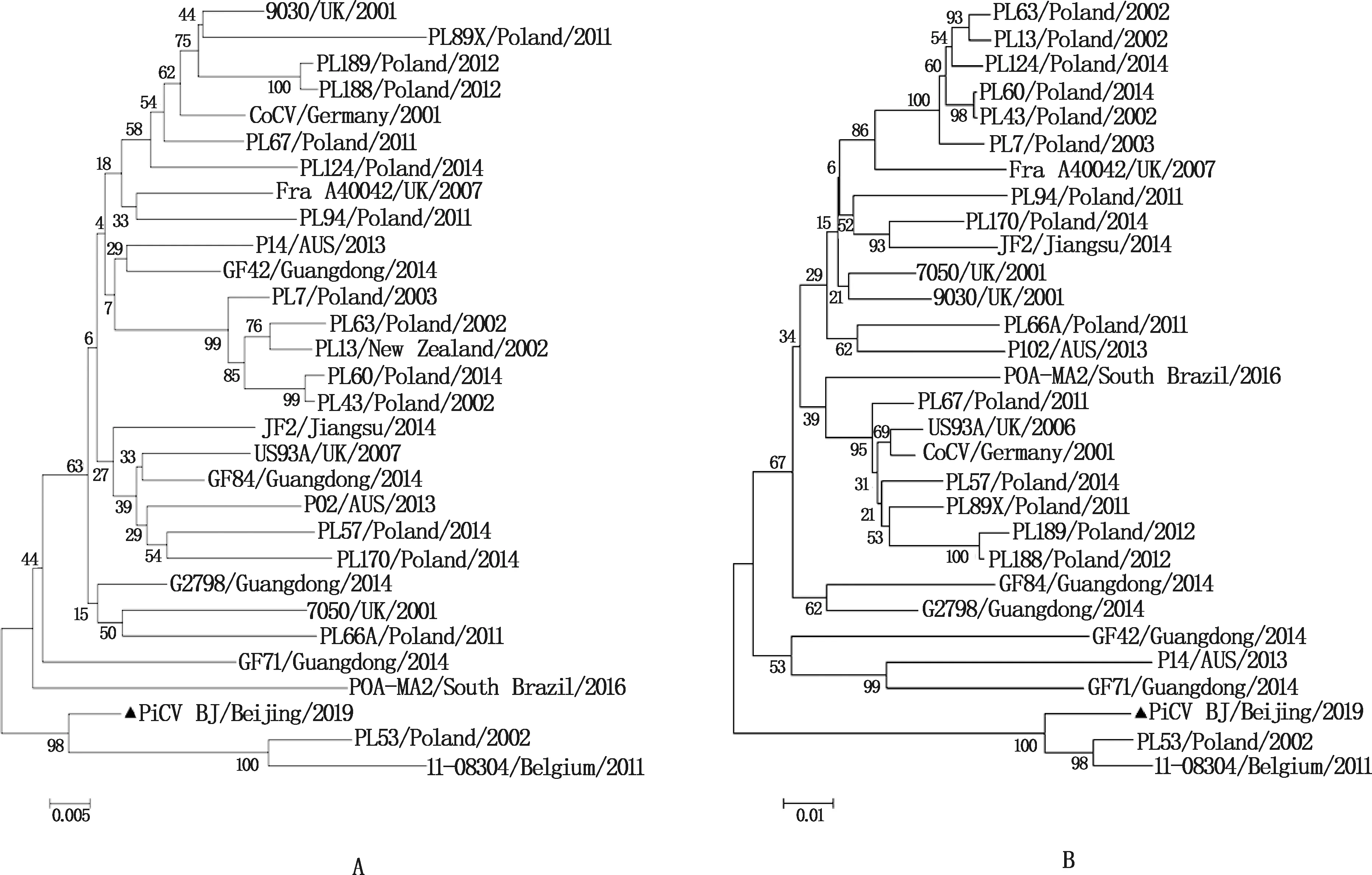
图7 PiCV Rep(A)和Cap(B)基因的遗传进化树Fig.7 Phylogenetic tree of Cap (A) and Rep (B) genes of PiCV
3 讨 论
圆环病毒是目前已知的最小的动物DNA病毒,基因组大小只有2 kb,主要宿主是动物的淋巴细胞[12],主要引起动物机体免疫水平下降[13]。由于目前仍没有适宜PiCV生长的培养条件[14-15],所以针对圆环病毒的致病机理及防控措施的研究较为缺乏。本试验根据已发表的检测方法对疑似PiCV感染的病鸽肝脏和脾脏组织进行了检测,最终检测到了PiCV的存在,与Santos等[16]报道一致,肝脏、脾脏这些免疫器官是最易检出的部位。由于该病毒造成鸽的免疫抑制,故在检测时应多关注淋巴组织在内的免疫器官。随后参考NCBI已发表的国内外PiCV序列,通过比对设计引物,利用PCR技术成功获得了1株PiCV的全序列,命名PiCV BJ。将拼接序列与其他参考序列进行比对发现,PiCV BJ与其他参考序列的相似性在86.0%~97.0%之间,遗传进化树显示该毒株与中国报道的其他PiCV遗传距离较远,与国外报道的PiCV序列亲缘关系较近,尤其是与波兰报道的PL53相似性最高,据此推测该病毒株来自国外,可能由赛鸽引种传入中国,提示在外部引种时要做好病毒监测[17],在PiCV致病机制尚不清楚且没有相应疫苗的现在,对防控PiCV大流行来说至关重要。
PiCV的基因组与其他圆环病毒相似,2个功能较为清晰的ORF分别为V1和C1[16],ORF-V1(48-995 bp)编码复制Rep蛋白(315个氨基酸);ORF-C1(1 981-1 166 bp)编码Cap蛋白(271个氨基酸)。此次得到的PiCV序列编码5个ORFs,除功能较明确的2个主要的ORFs以外,还存在有2个可能与病毒复制有关的的基因间区,均位于ORF-V1和ORF-C1之间:其中,在1 892-196 bp的位置有一段5′→3′的区域,与报道的其他PiCV 5′-端间区长短在90~101 bp[18]之间有较大差异,该区段有339 bp,存在1个茎环结构,编码方向与ORF-C1一致;在293-2 001 bp的位置存在第二段编码区,长度327 bp,编码方向与ORF-C1一致,与ORF-V1相反。除此之外,在ORF-V1和ORF-C1之间各有1个与其编码方向相反的ORF,其功能暂不明晰。对比其他参考序列的Rep基因可发现,目前已发表的PiCV全序列的Rep蛋白起始密码子均为ATG,而编码Cap蛋白的起始密码子有ATA和ATG两种[19-20],本试验中得到的该株PiCV全序列Cap基因的起始密码子为ATG。Cap基因的起始密码子分为2种,分别为ATA与ATG,之前报道中发现起始密码子的不同使得在构建遗传进化树时分为2个明显的分支[18],即起始密码子为ATG的在同一分支,而起始密码子为ATA的在另一分支,在本研究中没有发现因起始密码子不同在进化树中有明显的分群现象,但可以发现不同起始密码子的序列在亲缘关系上较远,目前PiCV只有1种基因型,这提示Cap蛋白起始密码子的种类可能是PiCV的分群标准,但关于该毒株遗传进化与Cap蛋白起始密码子的关系还有待进一步研究。此外,本试验中PiCV Cap和Rep蛋白与其他毒株相比均有不同程度的氨基酸变化,由于目前尚没有对PiCV毒力的界定,故暂不清楚这些位点氨基酸的变化对毒力是否产生影响,以及PiCV在鸽群中的传播是否与该病毒对鸽易感性有关系,这些都值得进一步探索。PiCV在世界各地的高检出率已经引起了养鸽行业的重视[21],为进一步了解PiCV的遗传进化规律,今后需获取更多的基因组信息来明确PiCV的流行情况及地区分布规律。
4 结 论
本研究在北京地区的病鸽肝脏和肾脏组织中检出1株PiCV(PiCV BJ株),并克隆获得了其基因组序列,全长为2 034 bp,共编码5个ORFs。PiCV BJ株与2011年分离自波兰的PL53株和分离自比利时的11-08304株亲缘关系较近,这与相似性分析结果一致,说明该病毒株来自国外,可能由赛鸽引种传入中国,提示在外部引种时要做好病毒监测。
