基于网络药理学和实验验证探讨苦参治疗乙型病毒性肝炎的作用机制
2022-02-15龙飘房盛懿杨雨莹欧阳丹满荣勇曹建中
龙飘 房盛懿 杨雨莹 欧阳丹 满荣勇 曹建中




〔摘要〕 目的 基于網络药理学和分子对接技术,探讨苦参治疗乙型病毒性肝炎的作用机制,为临床防治提供指导。方法 通过GeneCards、OMIM和TTD数据库获取乙型病毒性肝炎靶点,使用TCMSP、BATMAN-TCM、ETCM、HERB数据库及查阅相关文献获取苦参活性成分及靶点,并利用VENNY作图取两者的交集。用Cytoscape、STRING构建“活性成分-潜在靶点”网络图和蛋白互作网络图;应用DAVID数据库进行GO和KEGG通路的富集分析;最后通过分子对接和qPCR对上述结果进行验证。结果 乙型病毒性肝炎靶标1827个,苦参活性成分39个,主要成分为刺芒柄花素、8-isopentenyl-kaempferol、(2R)-7-hydroxy-2-(4-hydroxyphenyl)chroman-4-one、高丽槐素、氧化苦参碱;苦参干预乙型病毒性肝炎共同靶点64个,其核心靶点为IL-6、AKT1、VEGFA、PTGS2、JUN、CASP3、TNF和MAPK1;KEGG富集得到通路111条,包括癌症的通路、乙型肝炎和TNF信号通路;分子对接技术显示氧化苦参碱与TNF、IL-6结合,结合能为-6.1~ -9.8 kcal·mol-1;体外实验证实氧化苦参碱可下调HepG2.2.15细胞中TNF-α、IL-6 mRNA的表达,且随着剂量的增加,下调趋势更显著。结论 苦参具有多成分、多靶点特性,其主要成分氧化苦参碱可通过激活TNF信号通路,下调TNF-α、IL-6 mRNA的表达,控制肝脏炎症,抑制HBV复制。
〔关键词〕 苦参;乙型病毒性肝炎;网络药理学;实验验证;作用机制
〔中图分类号〕R285.5 〔文献标志码〕A 〔文章编号〕doi:10.3969/j.issn.1674-070X.2022.02.017
Mechanism study of Kushen (Sophorae Flavescentis Radix) in treating viral hepatitis type
B based on network pharmacology and experimental test
LONG Piao1, FANG Shengyi1, YANG Yuying1, OUYANG Dan1, MAN Rongyong2, CAO Jianzhong1*
(1. Provincial Key Laboratory of TCM Diagnostics, Hunan University of Chinese Medicine, Changsha, Hunan 410208, China;
2. Department of Neurology & Department of Medical Experimental Center, The First People's Hospital of
Huaihua City, Huaihua, Hunan 418000, China)
〔Abstract〕 Objective To explore the potential mechanisms of action of Kushen (Sophorae Flavescentis Radix) against viral hepatitis type B, and to provide guidance for improvement in clinical prevention and treatment based on network pharmacology and molecular docking technology. Methods GeneCards, OMIM, and TTD databases were searched to obtain viral hepatitis type B targets. The active ingredients and targets of Kushen (Sophorae Flavescentis Radix) were searched through TCMSP, BATMAN-TCM, ETCM, HERB databases and related literature. The VENNY was used to map the intersection of the two search results. Cytoscape and STRING were used to construct the "active ingredient-potential target" network diagram and protein-protein interaction network diagram; then the DAVID database was used for the enrichment analysis of GO and KEGG pathways. Finally, molecular docking and qPCR were used to verify the above results. Results There were 1827 targets of viral hepatitis type B and 39 active components of Kushen (Sophorae Flavescentis Radix), including formononetin, 8-isopentenyl-kaempferol, (2R)-7-hydroxy-2-(4-hydroxyphenyl) chroman-4-one, sophorin, oxymatrine. There were 64 common targets for viral hepatitis type B and Kushen (Sophorae Flavescentis Radix), including core targets IL-6, AKT1, VEGFA, PTGS2, JUN, CASP3, TNF and MAPK1. KEGG analysis enriched 111 pathways, including cancer pathway, hepatitis type B and TNF signaling pathway. The molecular docking revealed that oxymatrine could bind with TNF and IL-6, with binding energy between -6.1~-9.8 kcal·mol-1. Vitro experiments confirmed that oxymatrine can down-regulate the expression of TNF-α and IL-6 mRNA in HepG2.2.15 cells, and with the increase of the dose, the down-regulation trend was more significant. Conclusion Kushen (Sophorae Flavescentis Radix) has multi-component and multi-target characteristics. Its main component oxymatrine can activate TNF signaling pathways, down-regulate the expression of TNF-α and IL-6 mRNA, control liver inflammation, and inhibit viral hepatitis type B replication.
〔Keywords〕 Kushen (Sophorae Flavescentis Radix); viral hepatitis type B; network pharmacology; experimental test; mechanism of action
乙型病毒性肝炎(简称“乙肝”)是由乙型肝炎病毒(hepatitis B virus, HBV)感染引起,主要有乏力、消化道症状、尿黄、肝大及肝功能异常等表现[1]。流行病学调查显示,全球约2.4 亿人为慢性乙肝患者,每年约有65万人死于HBV相关性疾病[2]。患者感染HBV超过6个月,可导致肝脏发生不同程度炎性坏死或纤维化,严重者可发展成肝硬化,最终导致肝癌。目前,治疗乙肝以抗病毒药物(如恩替卡韦、富马酸丙酚替诺福韦片、聚乙二醇干扰素α)为主,但存在免疫耐受、价格昂贵及不良反应大等问题[3-4],因此,越来越多乙肝患者寻求中医治疗。
乙肝根据其临床表现属中医学“黄疸”“胁痛”“鼓胀”等范畴,常因湿热疫毒之邪侵袭机体所致[5]。中医治疗乙肝注重以人为本,采取辨证论治、扶正祛邪、调整阴阳的方法,维持脏腑功能平衡,在改善临床症状、抗HBV方面具有独特优势。苦参主治黄疸,始载于《神农本草经》,《补缺肘后方》中记载苦参治疗黄疸时配伍龙胆、牛胆汁等疗效更显著,《杂病源流犀烛》则明确载有龙胆苦参丸这首方剂,中成药苦参素胶囊、肝炎灵注射液、苦黄注射液、苦胆片等,临床常用于治疗乙肝[6-9]。现代药理研究亦表明,苦参生物碱具有保肝、减轻肝脏纤维化、抑制HBV DNA的复制及乙型肝炎表面抗原(hepatitis B surface antigen, HBsAg)、乙型肝炎e抗原(hepatitis B e antigen, HBeAg)的分泌[10-12]。但苦参治疗乙肝的具体作用机制尚缺乏系统认识,故本研究基于网络药理学方法从整体上探讨苦参治疗乙肝的作用机制,为苦参的进一步研究及临床对乙肝的防治提供指导。
1 材料与方法
1.1 数据库及软件
中药系统药理分析平台(traditional Chinese medi⁃
cine systems pharmacology datebase and analysis platform, TCMSP, https://tcmspw.com/tcmsp.php);中药分子机制生物信息学分析工具(a bioinformatics analysis tool for molecular mechANism of traditional Chinese medicine, BATMAN-TCM, http://bionet.ncpsb. org.cn/bat-man-tcm/index.php/Home/Index/index);中医药百科全书数据库(the encyclopedia of traditional Chinese medicine, ETCM, http://www.tcmip.cn/ETCM/index.php/Home/Index/);本草组鉴数据库(http://herb.ac.cn/);GeneCards數据库(https://www.genecards.org);在线《人类孟德尔遗传》数据库(online mendelian inheritance in man, OMIM, https://www.omim.org);Therapeutic Target Database数据库(http://db.idrblab.net/ttd/);化源网(https://www.chemsrc.com/);韦恩在线作图软件(VENNY 2.1, https://bioinfogp.cnb.csic.es/tools/venny/index.html);Cytoscape软件(Version 3.7.2);STRING数据库(http://string-db.org/);微生信(http://www.bioinformatics.com.cn/login/);DAVID数据库(https://david.ncifcrf.gov/tools.jsp);结构生物信息学研究合作组织(Research Collaboratory for Structural Bioinformatics, RCSB, www.rcsb.org)数据库。
1.2 乙肝相关靶点的收集
以“viral hepatitis type B”为检索词,在TTD、OMIM、GeneCards数据库中进行筛选,并将GeneCards筛选条件设置为score≥20。利用Excel表格将3个数据库所得靶点进行合并、删除重复值。
1.3 苦参活性成分及靶点的收集
以“苦参”为检索词,从TCMSP [以口服生物利用度(oral bioavailability, OB)≥30%、类药性(drug-like, DL)≥0.18和小肠上皮细胞渗透率(Caco-2 permeability, Caco-2)≥0.4为筛选条件]、BATMAN-TCM(以score≥20和P<0.5为筛选条件)、ETCM和HERB数据库中获取活性成分及对应靶点,并通过检索中国知网、万方和Pubmed数据库进行补充,通过VENNY作图得到乙肝与苦参的共同靶点,将苦参活性成分中两者非共同靶标删除。
1.4 “活性成分-潜在靶点”网络构建
将苦参活性成分和乙肝共同靶点导入Cytoscape 3.7.1进行“活性成分-潜在靶点”网络构建、分析以及可视化。
1.5 蛋白相互作用(protein-protein interaction, PPI)网络构建
将共同靶点导入STRING构建PPI网络,把string_interactions.tsv文件导入Cytoscape进行可视化分析。
1.6 GO功能和KEGG通路富集分析
利用DAVID数据库对共同靶点进行GO功能和KEGG通路富集分析,再通过微生信在线作图工具选取P值排名靠前的结果以柱状图和气泡图形式展示。
1.7 分子对接
首先从TCMSP数据库下载苦参成分mol2格式3D结构,蛋白的三维结构从RCSB数据库下载,通过AutodockTools 1.5.6进行配体和受体准备,并保存为pdbqt文件。然后采用Autodock vina 1.1.2进行半柔性对接,将参数exhaustiveness设置为20,其他参数均采用默认值,选取affinity最佳的构象,作为最终的对接构象。最后选取对接打分最低的构象用于对接结合模式分析,并通过Pymol进行作图。
1.8 HepG2.2.15细胞体外实验验证
1.8.1 细胞株、药物、试剂及仪器 HepG2.2.15细胞株(广州吉妮欧生物科技有限公司);氧化苦参碱(索莱宝生物科技有限公司,批号IO0240);DMEM培养基(赛默飞世尔科技公司,批号8121091);胎牛血清(上海双洳生物科技有限公司,批号OW05583);CCK-8溶液、逆转录试剂盒(南京诺唯赞医疗科技有限公司,批号7E352C9、7E482F0);SteadyPure通用型RNA提取试剂盒、SYBR Green Pro Taq HS 预混型qPCR试剂盒(湖南艾科瑞生物工程有限公司,批号A2A0929、A2A1444);PCR引物(生工生物工程股份有限公司);iMark酶标仪、My Cycler 96孔型 PCR仪、Mini-Sub Cell GT电泳系统(美国BIO-RAD公司);NanoDrop One超微量可见分光光度计、二氧化碳培养箱(赛默飞世尔科技公司);Light Cycler 480 Ⅱ型实时荧光定量PCR仪(上海罗氏制药有限公司)。
1.8.2 细胞培养及分组 将HepG2.2.15细胞复苏后,于DMEM培养液中(含10%胎牛血清、1% 100×青鏈霉素溶液)培养,置于37 ℃、5% CO2培养箱中,观察细胞形态,3 d更换1次培养液,当生长密度达到80%左右时,进行传代,取对数生长期的细胞进行实验。分组及给药剂量如下:正常组(氧化苦参碱浓度为0 mmol·L-1);2 mmol·L-1组(氧化苦参碱浓度为2 mmol·L-1);3 mmol·L-1组(氧化苦参碱浓度为3 mmol·L-1);4 mmol·L-1组(氧化苦参碱浓度为4 mmol·L-1);5 mmol·L-1组(氧化苦参碱浓度为5 mmol·L-1);6 mmol·L-1组(氧化苦参碱浓度为6 mmol·L-1)。
1.8.3 CCK-8法检测氧化苦参碱对细胞增殖的影响 取生长状态良好的HepG2.2.15细胞制成浓度为6×104个/mL的单细胞悬液,接种于96孔板中,每孔100 μL,于37 ℃、5% CO2培养箱中培养24 h后,各组进行加药处理,正常组加等体积的DMEM培养液。药物干预24 h后,每孔加入10 μL CCK-8溶液,置于培养箱中培养3 h后取出,用酶标仪检测450 nm的各孔吸光值。按照下列公式计算细胞存活率:
细胞存活率=[(A-C)/(B-C)]×100%
A:实验组吸光值(为含有培养基、细胞、待测药物和CCK-8溶液的吸光值);B:对照组吸光值(为含有培养基、细胞、CCK-8溶液的吸光值);C:空白组吸光值(为含有培养基、CCK-8溶液的吸光值)
1.8.4 qPCR检测TNF-α、IL-6 mRNA的表达 细胞干预24 h 后,用PBS缓冲液冲洗2遍。提取各组细胞总RNA进行反转录,用qPCR技术检测细胞中TNF-α、IL-6蛋白的mRNA水平,反应程序为95 ℃预变性30 s;95 ℃变性5 s,60 ℃退火30 s,共45个循环;溶解曲线95 ℃ 5 s,65 ℃ 60 s;降温40 ℃ 30 s。采用2-ΔΔCt法进行计算,Graphpad进行分析作图。引物设计为TNF-α正向引物:AGCCCTGGTATGAGCCCATCTATC、TNF-α反向引物:TCCCAAAGTAGACCTGCCCAGAC;IL-6正向引物:CACTGGTCTTTTGGAGTTTGAG、IL-6反向引物:GGACTTTTGTACTCATCTGCAC;β-actin正向引物:CCTGGCACCCAGCACAAT、β-actin反向引物:GGGCCGGACTCGTCATAC。
2 结果
2.1 乙肝相关靶点的收集
从TTD、OMIM、GeneCards数据库中分别检索到18、964和854个靶点,合并删除重复值后共1827个。
2.2 苦参活性成分及靶点的获取
通过TCMSP、BATMAN-TCM、ETCM和HERB数据库检索苦参活性成分及靶点,并查阅文献进行补充。通过制作韦恩图获得苦参和乙肝共同靶点64个,将苦参活性成分中两者非共同靶标删除,对获得的39个苦参活性成分(见表1)进行编号,并在化源网查询相应活性成分中文名。
2.3 “活性成分-潜在靶点”网络构建
将筛选获得的39个苦参活性成分及药物-疾病共同靶点导入Cytoscape,得到“活性成分-潜在靶点”图(见图1),共包含103个节点,259条边。选取度值排名靠前的活性成分有刺芒柄花素、8-isopentenyl-kaempferol、(2R)-7-hydroxy-2-(4-hydroxyphenyl)chroman-4-one、高丽槐素、氧化苦参碱、菜豆蛋白、槐果碱、苦参碱等,推测这些活性成分可能是苦参抗乙肝病毒的主要活性成分。
2.4 PPI网络构建
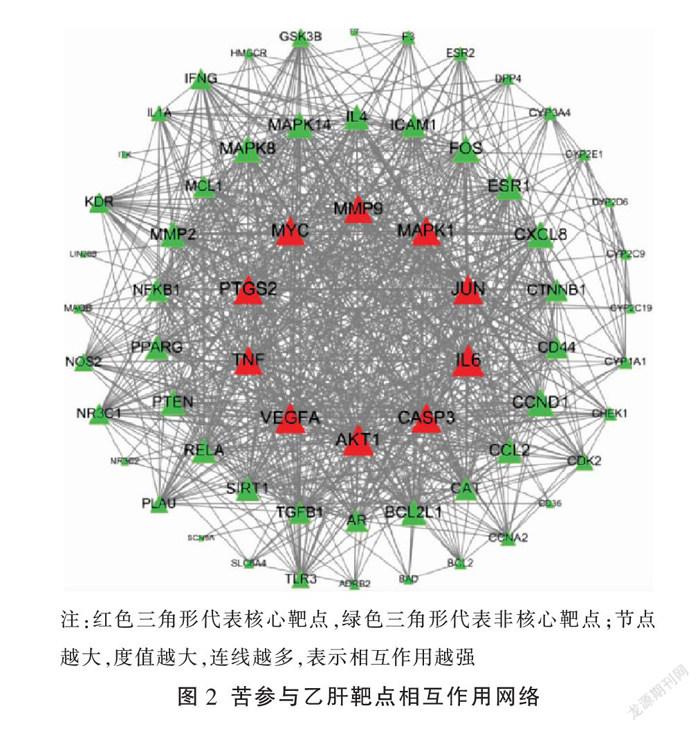
将筛选所得的64个共同靶点导入STRING,并将文件导入Cytoscape,构建PPI图(见图2),可见IL-6、AKT1、VEGFA、PTGS2、JUN、CASP3、TNF和MAPK1为苦参抗乙肝病毒的主要靶点。
2.5 GO功能和KEGG通路富集分析
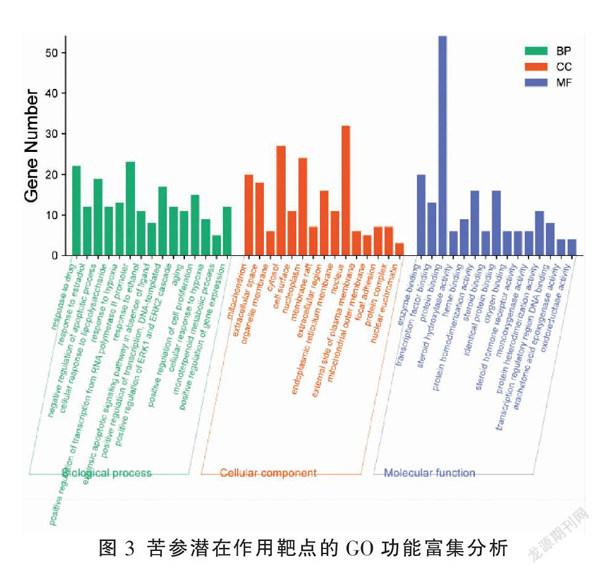
根据P<0.01进行GO功能富集分析,选取P值排名靠前的15个结果进行展示(见图3)。由图可见,生物过程(biological process, BF)富集有394条,涉及对药物的反应、对雌二醇的反应、凋亡过程的负调控、细胞对脂多糖的反应、对缺氧的反应等;分子功能(molecular function, MF)共富集到69条,涉及酶结合、转录因子结合、蛋白质结合、类固醇羟化酶活性、血红素结合等;细胞组分(cellular component, CC)富集到39条,涉及线粒体、细胞外间隙、细胞器膜、胞质溶胶、细胞表面等。以上结果体现了苦参可能通过调控多个GO功能来治疗乙肝。
根据P<0.01进行KEGG通路富集分析,共富集到111条通路,选取P值排名靠前的20条通路做气泡图(见图4)。由图可见苦参抗乙肝病毒通路主要富集在癌症的通路、乙型肝炎、TNF信号通路等。这些生物过程的发生可能与乙肝关系密切。
2.6 分子对接结果
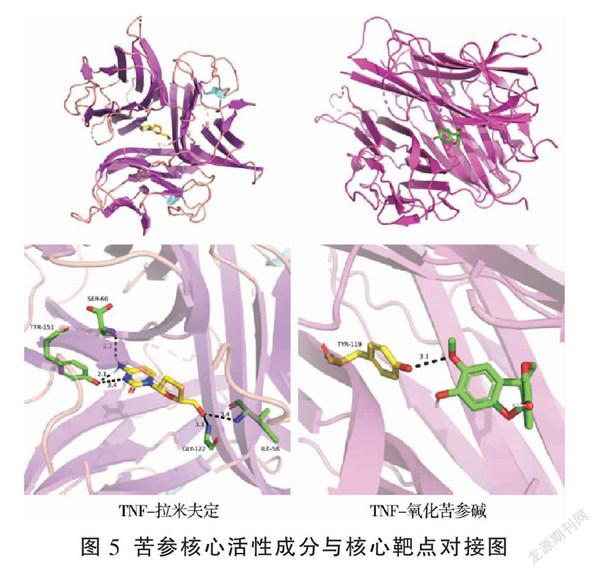
为了从分子水平阐明蛋白与化合物的作用模式,将靶蛋白TNF、IL-6与化合物氧化苦参碱进行对接,以拉米夫定为阳性对照药物。结果(见表2)显示小分子化合物与靶蛋白结合能均小于-4.5 kcal·mol-1,说明均具备良好的结合活性。其中,TNF与拉米夫定、氧化苦参碱的结合能分别为-7.1、-9.8 kcal·mol-1,IL-6与拉米夫定、氧化苦参碱的结合能分别为-4.5、-6.1 kcal·mol-1,选TNF与拉米夫定、氧化苦参碱进行作图展示。
由图5可见蛋白TNF与拉米夫定对接得分为-7.1 kcal·mol-1,化合物和氨基酸残基SER60形成键长为2.2Å的氢键作用,和氨基酸残基TYR151形成键长为2.1、3.4Å的氢键作用,和氨基酸残基GLY122形成键长为3.1Å的氢键作用,和氨基酸残基ILE58形成键长为3.4Å的氢键作用。蛋白TNF与氧化苦参碱对接得分为-9.8 kcal·mol-1,化合物和氨基酸残基TYR119形成键长为3.1Å的氢键作用。这些相互作用使得蛋白与化合物形成稳定的复合物,分子对接研究为化合物和蛋白的相互作用方式给予一定的解释,为进一步研究蛋白小分子药物奠定理论基础。
2.7 实验验证结果
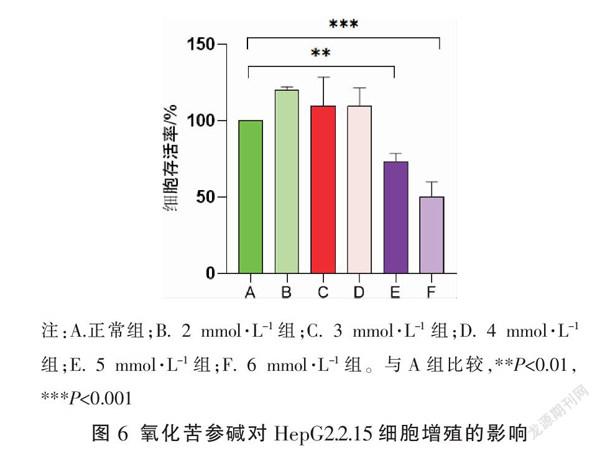
2.7.1 氧化苦参碱对细胞增殖的影响 与A组比较,B、C、D组的细胞增殖能力没有受到抑制,而E、F组细胞增殖受到明显抑制(P<0.01,P<0.001)。故选取2 mmol·L-1和4 mmol·L-1这两个药物浓度进行后续实验。见图6。
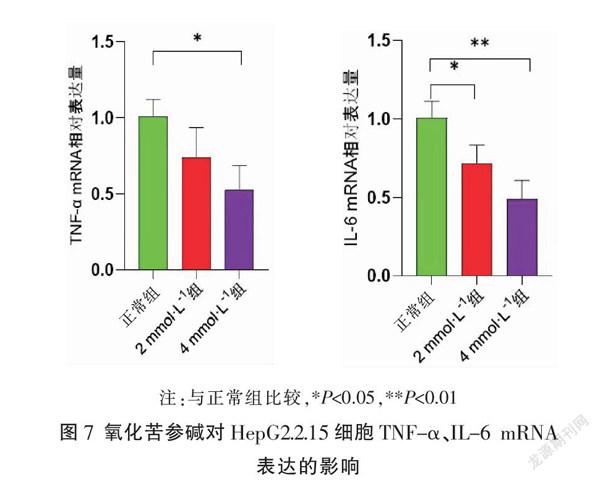
2.7.2 氧化苦参碱对TNF-α、IL-6 mRNA表达的影响 根据预测靶点的KEGG通路结果和疾病相关核心蛋白结果,选择与TNF信号通路相关的TNF-α、IL-6蛋白进行验证,见图7。与正常组比较,2 mmol·L-1组IL-6 mRNA表达下调(P<0.05);4 mmol·L-1组的TNF-α、IL-6 mRNA表达均下调(P<0.05,P<0.01)。
3 讨论
基于“活性成分-潜在靶点”可知,刺芒柄花素、8-isopentenyl-kaempferol、(2R)-7-hydroxy-2-(4-hydroxyphenyl)chroman-4-one、高丽槐素和氧化苦参碱是苦参防治乙肝的主要活性成分,再结合苦参含量测定结果可知,氧化苦参碱为最重要的活性成分[13]。PPI网络显示IL-6、AKT1、VEGFA、PTGS2、JUN、CASP3、TNF和MAPK1为苦参抗乙肝病毒的主要靶点;KEGG分析表明主要富集在癌症的通路、乙型肝炎和TNF信号通路。TNF信号传导通路在乙型肝炎的发病机制中发挥着重要的作用,AKT1、CASP3和MAPK1(亦称ERK2)是下游信号传导通路中3個重要的靶标。
TNF信号通路分为受体信号通路和下游传导信号通路,受体信号通路包括TNFR1和TNFR2,下游信号通路包括激活核因子κB(nuclear factor kappa-B, NF-κB)、丝裂原活化蛋白激酶、半胱氨酸蛋白酶及磷酯酰肌醇-3激酶/蛋白激酶B信号通路[14]。TNF-α活化后组装成同源三聚体并与TNFR1、TNFR2受体结合,导致受体的三聚化。TNFR与配体结合后,介导TRADD或TRAF等衔接蛋白的结合,进而启动下游信号通路的转导,产生炎性因子(IL-6、TNF-α)、转录因子(JUN)、炎症介质(PTGS2)等,导致肝脏炎症、肝纤维化甚至发展为肝癌[15]。
TNF-α、IL-6在防治乙型肝炎中发挥了重要作用,TNF-α与细胞膜上的受体TNF-R结合,可激活NF-κB途径,涉及炎症反应、细胞免疫等多个环节。研究发现TNF-α、IL-6水平的增加与肝细胞的炎症有关,其可能在肝损伤中发挥了重要作用,且TNF-α、IL-6水平与乙型肝炎严重程度相关[16]。此外,TNF-α和IL-6对HBV复制具有双向调控作用。当机体受到TNF-α、IL-6刺激后,IκB被磷酸化,使NF-κB呈游离状态,移入细胞核内,促进HBV的转录[17]。研究表明TNF-α抗HBV的活性,可能与阻碍衣壳的形成与降低宿主对病毒的易感性有关[18-19]。而有实验发现IL-6抑制HBV的复制与核衣壳减少和抑制病毒转录有关,且通过增强淋巴细胞功能发挥抗HBV的作用[20-21]。
基于分子对接技术显示氧化苦参碱与IL-6、TNF-α具有良好的结合活性,初步验证了苦参通过调控TNF信号通路发挥抗乙型肝炎的作用。本研究选取氧化苦参碱进行实验验证,以HepG2.2.15细胞为研究对象,结果显示,氧化苦参碱可下调TNF-α、IL-6 mRNA的表达,且随着剂量的增加,下调趋势更显著。
综上所述,苦参具有多成分、多靶点特性,其主要成分氧化苦参碱可通过激活TNF信号通路,下调TNF-α、IL-6 mRNA的表达,控制肝脏炎症,抑制HBV复制的作用。本研究从细胞水平初步验证了苦参治疗乙肝的基本药理作用和相关机制,后续还需进行动物实验,进一步明确苦参治疗乙型肝炎的机制。
参考文献
[1] 张玲霞,周先志.现代传染病学[M].2版.北京:人民军医出版社, 2010:365.
[2] 严丽波,唐 红.慢性乙型肝炎诊治进展和展望[J].实用医院临床杂志,2016,13(2):5-9.
[3] 中华医学会感染病学分会,中华医学会肝病学分会.慢性乙型肝炎防治指南(2019年版)[J].中华传染病杂志,2019,37(12):711-736.
[4] FANNING G C, ZOULIM F, HOU J L, et al. Therapeutic strategies for hepatitis B virus infection: Towards a cure[J]. Nature Reviews Drug Discovery, 2019, 18(11): 827-844.
[5] 王永炎.中医内科学[M].上海:上海科学技术出版社,1997:209-225.
[6] Hepatobiliary Specialized Committee of China Association of Chinese Medicine, Liver Diseases Specialized Committee of China Medical Association of Minorities. 慢性乙型肝炎中医诊疗指南(2018年版)[J].临床肝胆病杂志,2018,34(12):2520-2525.
[7] 伍 磊,张志鹏,蔡文涛,等.中药抗乙肝病毒活性及作用机制的研究进展[J].中草药,2020,51(24):6367-6376.
[8] 吴少祯.中医十大经典全本诵读版[M].北京:中国医药科技出版社,2017:238.
[9] 田思胜.明清名医全书大成沈金鳌医学全书[M].北京:中国中医药出版社,2015:302.
[10] LIU M F, JIN S, YAN H, et al. Effect of oxymatrine HSPC liposomes on improving bioavailability, liver target distribution and hepatoprotective activity of oxymatrine[J]. European Journal of Pharmaceutical Sciences, 2017, 104: 212-220.
[11] QIAN H, SHI J, FAN T T, et al. Sophocarpine attenuates liver fibrosis by inhibiting the TLR4 signaling pathway in rats[J]. World Journal of Gastroenterology, 2014, 20(7): 1822-1832.
[12] SANG X X, WANG R L, HAN Y Z, et al. T cell: Associated immunoregulation and antiviral effect of oxymatrine in hydrody⁃
namic injection HBV mouse model[J]. Acta Pharmaceutica Sinica B, 2017, 7(3): 311-318.
[13] 陈发奎,刘晓秋.中药有效成分含量测定[M].北京:人民卫生出版社,2008:1193-1199.
[14] VARFOLOMEEV E E, ASHKENAZI A. Tumor necrosis factor: An apoptosis JuNKie?[J]. Cell, 2004, 116(4): 491-497.
[15] 丘创华,侯 敢,黄迪南.TNF-α信号传导通路的分子机理[J].中国生物化学与分子生物学报,2007,23(6):430-435.
[16] WANG J Y, WANG X L, LIU P. Detection of serum TNF-alpha, IFN-beta, IL-6 and IL-8 in patients with hepatitis B[J]. World Journal of Gastroenterology, 1999, 5(1): 38-40.
[17] 唐炳华,郑晓珂.分子生物学[M].3版.北京:中国中医药出版社,2017:196-198.
[18] PURO R, SCHNEIDER R J. Tumor necrosis factor activates a conserved innate antiviral response to hepatitis B virus that desta?
bilizes nucleocapsids and reduces nuclear viral DNA[J]. Journal of Virology, 2007, 81(14): 7351-7362.
[19] WATASHI K, LIANG G X, IWAMOTO M, et al. Interleukin-1 and tumor necrosis factor-α trigger restriction of hepatitis B virus infection via a cytidine deaminase activation-induced cytidine deaminase(AID)[J]. Journal of Biological Chemistry, 2013, 288(44): 31715-31727.
[20] KUO T M, HU C P, CHEN Y L, et al. HBV replication is significantly reduced by IL-6[J]. Journal of Biomedical Science, 2009, 16: 41.
[21] LAN T, CHANG L, WU L, et al. IL-6 plays a crucial role in HBV infection[J]. Journal of Clinical and Translational Hepatology, 2015, 3(4): 271-276.
