电针“委中”穴对腰多裂肌损伤大鼠铁代谢的调节
2022-02-15吕巧巧李霞田圆徐菁陈莉张莉霍则军
吕巧巧 李霞 田圆 徐菁 陈莉 张莉 霍则军


〔摘要〕 目的 觀察多时间点大鼠多裂肌损伤后铁代谢相关蛋白的变化规律,探讨不同干预时间条件下电针“委中”穴对多裂肌损伤性腰痛的治疗作用。方法 SD大鼠按随机数字表法分为正常组、模型组、电针组,每组30只,各组再分为1 d、2 d、3 d、5 d、7 d 5个亚组,每个亚组6只。采用注射0.5%布比卡因(bupivacaine, BPVC)的方法造模,电针组电针双侧“委中”穴(1次/d),正常组、模型组不进行电针干预。分别于治疗的1 d、2 d、3 d、5 d、7 d取材。采用HE染色观察造模前后多裂肌形态变化;采用生化法检测多裂肌组织总铁含量变化;采用Western blot法检测铁蛋白重链(ferritin heavy chain1, FTH1)含量;采用Real-time PCR法检测多裂肌膜蛋白转铁蛋白受体1(transferrin receptor 1, Tfr1)、二价金属转运蛋白1(divalent metal transporter 1, DMT1)mRNA的表达。结果 HE染色结果显示,模型组相较于正常组可见肌纤维断裂、坏死并伴有炎性细胞浸润;与同时间点模型组相比,电针组受损肌纤维可见明显改善。生化法检测结果显示,与同时间点正常组相比,模型组、电针组总铁含量升高(P<0.01);Western blot、Real-time PCR检测结果提示模型组FTH1蛋白表达低于正常组(P<0.05或P<0.01),而Tfr1与DMT1 mRNA表达均高于正常组(P<0.05或P<0.01);与同时间点模型组相比,电针1 d、2 d、3 d、5 d组FTH1蛋白表达升高(P<0.05或P<0.01),而电针2 d、3 d、5 d、7 d 组Tfr1 mRNA和电针1 d、2 d、3 d、5 d 组DMT1 mRNA表达均降低(P<0.05或P<0.01);各模型组间比较发现,模型2 d组FTH1蛋白表达最低(P<0.05),而模型2 d、3 d组Tfr1 mRNA表达较高(P<0.05),模型3 d组DMT1 mRNA表达最高(P<0.05);各电针组比较结果显示,FTH1蛋白在电针2 d组最高(P<0.05),电针3 d、5 d、7 d组Tfr1 mRNA表达较低(P<0.05),电针3 d组DMT1 mRNA表达较高(P<0.05)。结论 在BPVC致多裂肌损伤模型中,局部受损多裂肌发生铁代谢紊乱,且在急性损伤期较典型。电针“委中”穴能促进损伤多裂肌的修复,其机制可能与调节多裂肌铁代谢、减轻组织过氧化损伤相关,并且在电针持续干预3 d后显著促进对铁代谢紊乱水平的调节。
〔关键词〕 多裂肌损伤;电针;铁代谢;铁蛋白;转铁蛋白受体1;二价金属转运蛋白1
〔中图分类号〕R245 〔文献标志码〕A 〔文章编号〕doi:10.3969/j.issn.1674-070X.2022.02.014
Regulation of electroacupuncture at "Weizhong" (BL40) on iron metabolism in
rats with lumbar multifidus muscle injury
LU Qiaoqiao1, LI Xia1, TIAN Yuan1, XU Jing2, CHEN Li3, ZHANG Li1*, HUO Zejun4*
(1. School of Acupuncture and Massage, Beijing University of Chinese Medicine, Beijing 100029, China;
2. Department of Rehabilitation Medicine, People's Hospital of Zhejiang Province, Hangzhou, Zhejiang 310014, China;
3. Beijing Byte Beat Network Technology Co., Ltd., Beijing 100086, China; 4. Department of Traditional Chinese
Medicine, The Third Hospital of Peking University, Beijing 100191, China)
〔Abstract〕 Objective To observe the changes of iron metabolism related proteins after lumbar multifidus muscle injury (LMMI), and to explore the therapeutic effect of electroacupuncture (EA) at "Weizhong" (BL40) on back pain caused by LMMI under different intervention time. Methods SD rats were randomly divided into normal group (n=30), model group (n=30) and EA group (n=30). Each group was further divided into five subgroups (1 d, 2 d, 3 d, 5 d, 7 d), with 6 rats in each group. The LMMI model was made by injecting 0.5% bupivacaine (BPVC). EA group was treated EA at both sides of "Weizhong" (BL40) points once a day, the normal group and model group were not intervened by EA. The samples were collected at 1, 2, 3, 5 and 7 days after treatment. HE staining was used to observe the morphological changes of multifidus muscle before and after modeling; biochemical method was used to detect the content of total iron in multifidus tissue; Western blot method was used to detect the content of ferritin heavy chain 1 (FTH1); and Real-time PCR method was used to detect the expression of multifidus membrane protein transferrin receptor 1 (Tfr1) and divalent metal transporter 1 (DMT1) mRNA. Results The results of HE staining showed that the muscle fibers in the model group were broken, necrotic and accompanied with inflammatory cell infiltration compared with the normal group, and the damaged muscle fibers were significantly improved in the EA group compared with the model group at the same time. The results of biochemical method showed that the content of total iron in the model group and EA group was higher than that in the normal group at the same time (P<0.01). Western blot and Real-time PCR showed, the expression of FTH1 protein in the model group was lower than that in the normal group (P<0.05 or P<0.01), while the expression of Tfr1 and DMT1 mRNA in the model group was higher than that in the normal group (P<0.05 or P<0.01). Compared with the model group at the same time, the expression of FTH1 protein increased in the EA 1 d, 2 d, 3 d and 5 d groups (P<0.05 or P<0.01), while the Tfr1 mRNA expression decreased in the EA 2 d, 3 d, 5 d and 7 d groups and the DMT1 mRNA expression decreased in the EA 1 d, 2 d, 3 d and 5 d groups (P<0.05 or P<0.01). Compared with each model group, it is found that the expression of FTH1 protein in model 2 d group was the lowest (P<0.05), while the expression of Tfr1 mRNA in model 2 d and 3 d groups was higher (P<0.05), the expression of DMT1 mRNA in model 3 d group was the highest (P<0.05). Compared with each EA group, the results showed that the expression of FTH1 protein was the highest in the EA 2 d group (P<0.05), the expression of Tfr1 mRNA was lower in the EA 3 d, 5 d and 7 d groups (P<0.05), and the expression of DMT1 mRNA was higher in the EA 3 d group (P<0.05). Conclusion In the model of LMMI induced by BPVC, the iron metabolism of local injured multifidus muscle is disordered, and it is typical in the time of acute injury. EA at "Weizhong" (BL40) can promote the repair of injured multifidus muscle, and its mechanism may be related to regulating iron metabolism of multifidus muscle and reducing tissue peroxidation injury, and significantly promote the regulation of iron metabolism disorder level after continuous EA intervention for 3 d.
〔Keywords〕 lumbar multifidus muscle injury; electroacupuncture; iron metabolism; ferritin; transferrin receptor 1; divalent metal transporter 1
“腰背委中求”是历代医者长期治疗腰背部疾患临床经验的凝缩,既符合了针灸取穴中“经脉所过,主治所及”的原则,又体现了远部取穴理论的具象应用[1]。慢性下腰痛(chronic low back pain, CLBP)是非常普遍的疼痛性肌肉骨骼疾病,是现在全球导致残疾的主要原因[2-3],在世界范围内造成了重大的流行病学负担,其患病率呈现不断上升的趋势[4],并且长期的病痛与治疗,既降低了个人生活质量,又给家庭、社会带来了沉重负担。临床上电针治疗腰痛由来已久且疗效稳定。腰多裂肌是腰椎旁肌的一部分,其形态、功能的正常与CLBP的发生密切相关[5]。所以,探索电针“委中”穴对损伤腰多裂肌的修复机制对临床上治疗CLBP有积极意义。铁是机体重要的微量金属元素,参与氧利用、酶促反应、能量代谢等多种生理活动,但体内Fe2+可以通过Fenton反应产生多种活性氧物质,造成组织细胞氧化损伤,因此铁的转运、储存、利用过程要受到严格的调控[6]。本课题组前期[7-10]制备了成熟的布比卡因(bupivacaine, BPVC)致腰多裂肌损伤大鼠模型,从炎症反应、自噬、氧化应激、细胞微环境变化等多角度探讨了电针“委中”穴促进腰多裂肌损伤后修复的相关机制,但目前还没有对铁代谢调节这一层面的观察。因此,本实验着眼于骨骼肌铁代谢,设置多个时间点来动态观察多裂肌损伤后铁代谢相关蛋白的变化规律,探讨不同电针干预时间对多裂肌损伤性腰痛治疗的可能机制。
1 材料与方法
1.1 实验动物及分组
健康雄性SD大鼠90只,体质量270~320 g,由北京斯贝福实验动物中心提供[清洁级,许可证号:SCXK(京)2019-0010],在北京中医药大学良乡校区动物房分笼喂养,自由摄食、饮水,适应性喂养7 d,明暗周期各12 h,环境温度24 ℃,湿度40%~50%。整个实验过程中对动物的各种处理均遵循科技部2006年颁布的《关于善待实验动物的指导性意见》的相关规定。
将动物按随机数字表法分为正常组、模型组、电针组,每组再分为1 d、2 d、3 d、5 d、7 d共5个亚组,每个亚组6只。
1.2 主要仪器和试剂
韩氏电针仪(北京冀诺泰科技发展有限公司,型号:HANS-200A);华佗牌针灸针(北京中研太和医疗器械有限公司,型号:0.18 mm×13 mm);半自动化石蜡切片机(德国Leica,型号:RM2235);生物显微镜及成像系统(日本OLYMPUS,型号:BX43);酶标仪(芬兰Labsystems Multiskan,型号:M2型);Eppendorf离心机(德国Eppendorf ,型号:5430R);AriaMX 实时qPCR仪器与系统(美国Agilent,型号:G8830A);电泳槽及其附件(型号:Mini-PROTEAN Tetra)、电泳仪电源(型号:PowerPac基础)、全能型成像系统(型号:ChemiDoc MP)、T100TMPCR仪(型号:T100)均来自美国Bio-Rad公司。
布比卡因盐酸盐(美国Sigma,批号:80-477-DK);10%水合氯醛(北京百诺威生物科技有限公司吗,批号:rh32027-250g);苏木素伊红(HE)染色试剂盒(批号:G1120)、组织铁测定试剂盒(批号:A039-2-1)、BCA蛋白浓度测定试剂盒(批号:PC0020)、SDS-PAGE凝胶制备试剂盒(批号:P1200)、5×Tris-甘氨酸电泳缓冲液(批号:T1070)均来自北京Solarbio公司;高效RIPA裂解液(南京建成生物工程研究所有限公司,批号:A039-2-1);快速转膜液20X(批号:WB4600)、超敏ECL化学发光试剂盒(批号:P10100)均来自苏州新赛美生物科技有限公司;PVDF转移膜(0.45 um,美国Millipore, 批号:IPVH00010);GAPDH抗体(北京Bioss, 批号:bs-10900R);山羊抗兔二抗(批号:ZB-2301)、山羊抗鼠二抗(批号:ZB-2305)均来自北京中杉金桥生物科技有限公司;FTH抗体(美国Affinity, 批号:DF6278);组织细胞RNA提取试剂盒(广州美基生物科技有限公司,批号:R4115);RevertAid First Strand cDNA Synthes(批号:K1622)、SYBR Green PCR Master Mix(批号:4367659)均来自美国Thermo公司;引物(均购自上海生工生物科技有限公司)。
1.3 造模方法
模型的复制参照课题组前期研究,采用一次性注射BPVC建立大鼠多裂肌损伤模型[11]:除正常组外,每组以10%水合氯醛(350 mg/kg)腹腔注射麻醉后,剔除大鼠背部毛发,操作过程保持无菌。选择双侧腰椎L4、L5(首先找到双侧髂棘最高点,定位为L6棘突)水平棘突为进针点,使用一次性4号针头注射器抽取0.5% BPVC溶液,针头紧贴棘突旁进入肌肉,直到接触关节突和乳突所在的骨面回抽套管1 mm无血,注射BPVC溶液400 μL(100 μL×4),单次时间不得小于3 s,以利于药物的吸收。以HE染色结果显示肌纤维大面积断裂、肌间隙增大、炎性细胞浸润为模型成功标志。
1.4 干预方法
正常组不进行任何处理。电针组在造模后进行电针干预,将大鼠俯卧固定在操作臺上,暴露双侧后肢腘窝部位,参照《实验针灸学》[12]常用实验动物穴位图谱,分别选取大鼠双侧“委中”穴(膝关节背面正中),用一次性针灸针直刺3 mm,不做任何手法,接电针仪,采用2 Hz/100 Hz的疏密波,电流强度1 mA,治疗20 min,1次/d,直至取材。模型组在造模后与电针组同步束缚与固定,不做任何干预,在相应时间点取材。
1.5 观察指标及检测方法
每组大鼠分别在电针1 d、2 d、3 d、5 d、7 d后进行取材,用10%水合氯醛(350 mg/kg)腹腔注射麻醉后,剔除大鼠背部毛发,操作过程保持无菌。待大鼠完全麻醉后,将其俯卧固定在解剖板上,充分暴露背部,剪开皮肤,剥离开筋膜、肌肉,锐性切取L4-L5水平的多裂肌。取左侧多裂肌固定于4%多聚甲醛溶液中,用于观察多裂肌形态变化,再将右侧多裂肌分为3份放置于冻存管后迅速投入液氮中,之后转移至-80 ℃冰箱冻存,用于分子生物学检测。
1.5.1 HE染色观察多裂肌形态学变化 左侧多裂肌于4%多聚甲醛溶液固定48 h以上,常规梯度乙醇脱水后,进行石蜡包埋、切片,切片厚度为5 μm。然后将石蜡切片常规脱蜡水化后,再进行苏木素染色、自来水冲洗、分化液分化、自来水浸泡、伊红染色、自来水冲洗浸泡,最后进行脱水、透明、中性树胶封固。显微镜下观察切片组织形态。
1.5.2 生化法检测多裂肌铁含量 根据说明书要求配置相应试剂。按重量(g)∶体积(mL)=1∶9的比例,每1 mg肌肉加入9倍体积的生理盐水,冰水浴条件机械匀浆,2500 r/min,离心10 min(离心半径为9.5 cm),取上清液待测。空白管、标准管、测定管先分别各加入500 μL双蒸水、2 mg/L铁标准应用液、待测样本,再均加入1500 μL的铁显色剂,混匀后,沸水浴5 min,流水冷却,3500 r/min,离心10 min(离心半径为9.5 cm)后,取上清液300 μL于96孔板,设置酶标仪波长为520 nm,双蒸水调零,测定各样本吸光度OD值。计算出样本铁含量,观察造模后多裂肌组织铁含量相对正常组的变化。
1.5.3 Western blot法检测多裂肌FTH1蛋白的表达 从-80 ℃冰箱中取出冻存的样本,称取适量的组织,按样本∶裂解液为1∶20的比例在EP管内加入样本、裂解液和钢珠,置于快速匀浆机中碾磨5 min后,4 ℃,12 000 r/min,离心5 min(离心半径为9.5 cm),取上清。采用BCA试剂盒测定蛋白浓度,根据实际情况计算样本最终上样量,加入一定量的样本、loading buffer、PBS缓冲液,放入95 ℃恒温金属浴内变性5 min后用于上样。制备10%分离胶和5%浓缩胶,上样,以每块胶浓缩胶60 V、分离胶80 V、恒压电源进行电泳,快速转膜液400 mA,恒流电源进行电转。用TPBS配制的10%的牛奶对PVDF膜封闭2 h,用TPBS配制的5%的牛奶稀释抗体(FTH按1∶750稀释,GAPDH按1﹕5000稀释,二抗按1∶2000稀释),一抗4 ℃孵育过夜,二抗摇床室温孵育1 h,根据说明书将ECL试剂中A液、B液按1∶1比例混匀,滴加适量显影液于PVDF膜上,采用化学发光凝胶成像系统进行曝光,曝光结果使用Image Lab软件分析灰度值,并定量分析FTH1吸光度与GAPDH吸光度的比值,进行统计分析。
1.5.4 Real-time PCR法检测多裂肌Tfr1、DMT1
mRNA的表达 从-80 ℃冰箱取出冻存的样本,取适量的组织,按组织细胞RNA提取试剂盒说明书,双柱法提取组织中总RNA,反转录为cDNA后,按20 μL的扩增体系,加入一定量的引物、模板、SYBR Green荧光染料进行扩增,PCR反应条件为95 ℃ 30 s、60 ℃ 30 s、72 ℃ 30 s,45个循环,检测基因相对表达水平,结果用2-△△Ct表示。引物由上海生工生物科技有限公司合成,序列见表1。
1.6 统计学分析
采用SPSS 20.0统计软件对所得数据进行分析,数据用“x±s”表示,服从正态分布的数据组间差异用单因素方差分析,两两比较用LSD-t检验。以P<0.05为差异有统计学意义。
2 结果
2.1 各组大鼠多裂肌组织形态学结果
通过HE染色结果可见,正常组大鼠肌纤维排列整齐,肌间隙大小一致,肌细胞核位于细胞边缘;和正常组比较,模型组大鼠可见多裂肌肌纤维有断裂、肌纤维排列不规整、肌细胞坏死、细胞间隙增宽并伴有炎性细胞浸润,表明造模成功,且在第3天损伤更为严重,模型5 d组炎性浸润相对减轻;电针组和模型组比较,受损肌纤维可见一定程度改善,电针3 d组炎性浸润仍比较严重,电针5 d组肌纤维间隙较为均匀,炎性浸润相对减少。见图1。
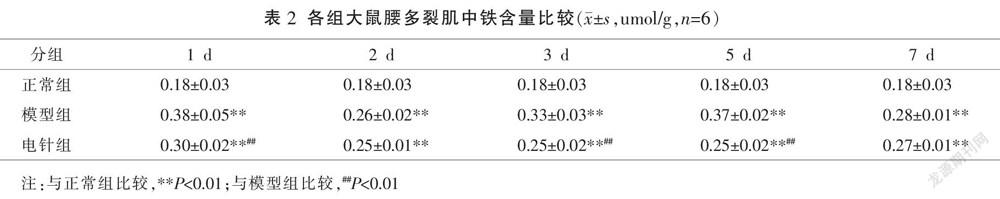
2.2 各组大鼠不同时间点多裂肌组织点总铁含量比较
与同时间点正常组相比较,各时间点模型组和电针组铁含量水平均升高(P<0.01);与同时间点模型组相比较,电针1 d、3 d、5 d组铁含量水平降低(P<0.01)电针2 d、7 d组与模型组比较差异无统计学意义(P>0.05)。见表2。
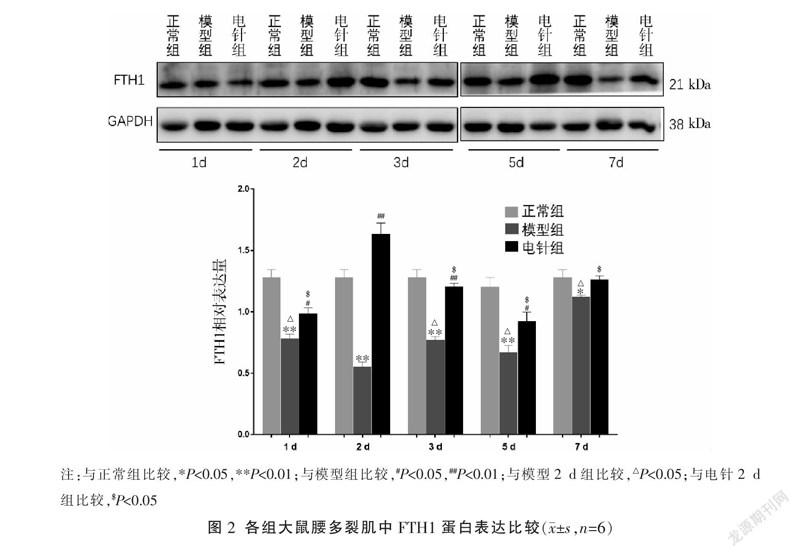
2.3 各组大鼠不同时间点多裂肌组织FTH1蛋白表达水平比較
与同时间点正常组相比较,模型组大鼠多裂肌FTH1表达水平总体降低(P<0.05或P<0.01);与同时间点模型相比较,电针组1、2、3、5 d FTH1表达水平有所升高(P<0.05或P<0.01),电针7 d组与模型7 d组比较差异无统计学意义(P>0.05)。模型各组比较,2 d组最低(P<0.05);电针各组比较,2 d组最高(P<0.05)。见图2。
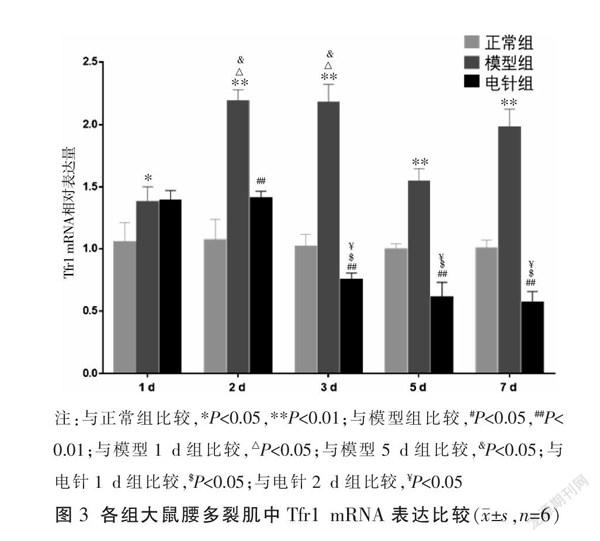
2.4 各组大鼠不同时间点多裂肌组织铁代谢相关基因Tfr1 mRNA水平比较
与同时间点正常组相比较,模型组大鼠多裂肌Tfr1 mRNA水平总体升高(P<0.05或P<0.01);与同时间点模型相比较,电针2 d、3 d、5 d、7 d组Tfr1 mRNA水平有所降低(P<0.01),电针1 d组与模型1 d组比较差异无统计学意义(P>0.05)。各模型组间比较结果显示,与模型1 d、5 d组比较,模型2 d、3 d组较高(P<0.05);模型2 d组与模型3 d、7 d组比较,模型3 d组与模型2 d、7 d组比较,差异无统计学意义(P>0.05)。各电针组比较结果显示,与电针1 d、2 d组相比较,电针3 d、5 d、7 d组较低(P<0.05);电针1 d组与电针2 d组比较,电针3 d、5 d、7 d组之间比较,差异无统计学意义(P>0.05)。见图3。
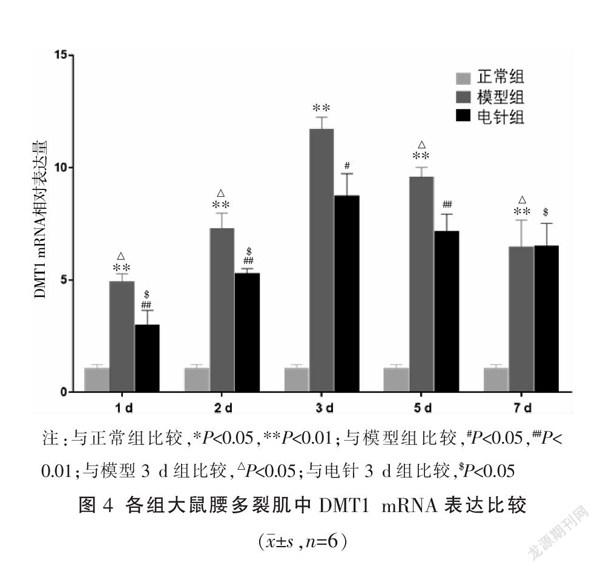
2.5 各组大鼠不同时间点多裂肌组织铁代谢相关基因DMT1mRNA水平比较
与同时间点正常组相比较,模型组大鼠多裂肌DMT1 mRNA水平升高(P<0.01);与同时间点模型相比较,电针1、2、3、5 d组DMT1 mRNA水平降低(P<0.05或P<0.01),电针7 d组与模型7 d组比较无统计学意义(P>0.05)。与其它时间点模型组相比,模型3 d组最高(P<0.05);各电针组比较结果显示,电针3 d组与电针1 d、2 d、7 d组相比较表达量最高(P<0.05),与电针5 d组比较差异无统计学意义(P>0.05)。见图4。
3 讨论
铁作为一种人體必须的微量元素,广泛参与细胞的生理生化过程,但是过量的铁对机体是有害的[13]。过量Fe2+可以通过Fenton反应产生过量的ROS,打破细胞中的氧化平衡,导致DNA、蛋白质和脂质等损伤,因此,机体内的铁需要受到严格调控以维持铁代谢稳态[6],便于铁发挥其核心的生物功能,同时防止其细胞毒性作用。研究表明,由铁过载介导的氧化应激会导致线粒体功能障碍[14],会直接影响ATP产生,进而影响骨骼肌的功能[15]。铁代谢失衡可能破坏骨骼肌微环境,抑制肌卫星细胞(satellite cells, SCs)的增殖潜能,打破SCs的分化平衡,影响骨骼肌的再生[16-17]。所以,铁代谢与骨骼肌损伤修复过程中的氧化应激、肌卫星细胞增殖分化密切相关,并且课题组前期研究发现,电针“委中”穴对多裂肌损伤早期有较好的修复作用[18],因此,本实验基于腰多裂肌损伤大鼠模型,设置多个时间点动态观察铁代谢变化与多裂肌损伤后时间的相关性,探讨在不同时间电针干预条件下,电针“委中”穴促进损伤多裂肌修复的可能机制。本实验HE染色结果显示造模后多裂肌肌纤维损伤严重,说明造模成功,电针干预后缓解了多裂肌的损伤,促进了修复进程。
骨骼肌是体内铁的主要储存库,其含量占非血液成分的60%[19]。铁是构成血红素必不可少的成分,参与了细胞的增殖和分化,通过催化氧化-还原反应,参与电子传递、细胞呼吸、能量代谢等机体许多重要的生理过程,同时它也能调节与细胞生长和功能有关的基因表达[20]。因此,铁在肌细胞分化、肌纤维生长以及维持骨骼肌正常生理功能方面必不可少。研究表明,骨骼肌再生的铁是循环的[21]。而当骨骼肌内游离的铁增多,又会诱导发生氧化应激,抑制骨骼肌再生[22]或者导致骨骼肌萎缩[23]。研究发现,在铁过载的小鼠中,骨骼肌表现出氧化应激增加和肌卫星细胞标志物表达减少的现象,并在肌肉损伤后,还表现出肌肉再生延迟、再生肌纤维减少、成肌细胞分化标志物表达减少[22]。所以骨骼肌铁代谢的调节异常,尤其是不稳定的铁积累,可能会抑制骨骼肌的再生[21]。本实验通过对不同时间点各组大鼠多裂肌组织铁含量的测定,发现模型组和电针组铁含量总体比正常组铁含量高,表明损伤后局部组织总铁含量升高。铁主要以离子的形式存在于机体内,Fe2+超标会诱导产生大量具有代谢毒性的ROS,进而氧化细胞膜脂质等导致细胞死亡[24]。铁蛋白是机体内铁储藏蛋白,主要在释放和储存上对铁代谢进行调控,也可以清除亚铁离子介导的自由基反应,保护细胞免受氧化性损伤[25]。铁蛋白由铁蛋白轻链(ferritin light chain, FTL)和铁蛋白重链(ferritin heavy chain, FTH1)两个亚基构成,其中FTH1可将Fe2+氧化成Fe3+[26-27]。本实验发现,多裂肌损伤后FTH1表达水平总体上是降低的,且通过对比不同时间点变化趋势发现,模型2 d组FTH1水平与正常组和其它各时间点模型组相比最少,说明在多裂肌损伤后,铁蛋白结构破坏,释放Fe2+,在2 d后FTH1表达水平开始升高。电针治疗后,FTH1表达水平总体上高于模型组,说明电针是促进FTH1的表达的,通过促进FTH1的表达来抵御多裂肌损伤后过量Fe2+造成的氧化损伤,促进损伤多裂肌修复,且对干预的不同时间点比较发现,电针2 d后FTH1表达升至最高,说明在持续干预2 d后,在时间上加速了铁蛋白大量表达,从而抵抗Fe2+对肌细胞的伤害性作用。而在干预7 d后,电针组与模型组无明显差异,可能与机体的自我修复能力有关。
铁在细胞内的浓度需要受到严格调控。Tfr1可转运Fe3+进入细胞,在DMT1作用下将Fe3+转为Fe2+,多余的铁储存在铁蛋白中[28-29]。DMT1在完成细胞铁摄取的全过程中不可缺少[30]。细胞一方面可以通过释放铁蛋白储存的铁,另一方面可以通过增加转铁蛋白从胞外摄取铁来满足细胞对铁的需求[15]。研究表明,肌卫星细胞中Tfr1的特异性缺失会抑制骨骼肌再生,并会诱导氧化损伤[17],成人Tfr1的缺失会导致骨骼肌萎缩和功能障碍[16]。本实验结果发现,多裂肌损伤后,Tfr1 mRNA水平升高,并且不同时间点比较显示Tfr1 mRNA损伤后2~3 d表达量相比较于其它时间点更高。在电针治疗后,电针1 d组与对应时间点模型组无显著差异,随着治疗周期的继续,电针组Tfr1 mRNA表达量相对模型组有所降低,不同时间点干预结果发现,Tfr1 mRNA表达水平在电针治疗3 d后显著降低,并且随着治疗时间的增加,电针组Tfr1 mRNA的表达均维持在较低水平。与此同时,造模后DMT1 mRNA的表达水平升高,并且在第3天表达量升至最高,在3 d后表达趋势逐渐降低,电针干预治疗后,不同时间点结果分析发现,DMT1 mRNA也是在第3天的表达水平最高,但是总体上电针干预会降低DMT1 mRNA表达水平,在干预7 d后,电针组与模型组无明显差异,可能与机体的自我恢复水平有关。上述结果提示在多裂肌损伤后,Tfr1、DMT1水平升高,摄取过多的Fe2+进入细胞内,且在损伤后2~3 d这种铁代谢紊乱情况更为明显,电针治疗后通过抑制Tfr1、DMT1的表达,减少骨骼肌游离的Fe2+,减轻过度氧化造成的损伤,从而促进骨骼肌再生,并发现在电针持续干预3 d后,显著促进多裂肌损伤后铁代谢紊乱情况的改善。
综上所述,在BPVC引起的腰多裂肌损伤模型中,多裂肌总铁含量升高,FTH1表达降低,Tfr1、DMT1表达升高,初步提示多裂肌局部铁代谢失稳,并且,通过对铁代谢和多裂肌损伤时间的相关性分析发现,铁代谢的紊乱在急性损伤期比较典型。在电针治疗一段时间后,FTH1表达相对升高,Tfr1、DMT1表达相对降低,并且电针治疗3 d后显著促进铁代谢紊乱的调节,说明电针“委中”穴可以促进大鼠受损腰多裂肌修复,其机制可能与电针干预调节了铁代谢的平衡、减轻组织过氧化损伤有关,为电针“委中”穴治疗腰痛提供了一定的实验依据。
参考文献
[1] 李志道.腧穴远治作用的规律是“经脉所过,主治所在”[J].针灸临床杂志,1995(9):1-4.
[2] WOOLF A D, PFLEGER B. Burden of major musculoskeletal conditions[J]. Bulletin of the World Health Organization, 2003, 81(9): 646-656.
[3] GBD DISEASE AND INJURY INCIDENCE AND PREVALENCE COLLABORATORS. Global, regional, and national incidence, prevalence, and years lived with disability for 328 diseases and injuries for 195 countries, 1990-2016: A systematic analysis for the Global Burden of Disease Study 2016[J]. Lancet (London, England), 2017, 390(10100): 1211-1259.
[4] MATTIUZZI C, LIPPI G, BOVO C. Current epidemiology of low back pain[J]. Journal of Hospital Management and Health Policy, 2020, 4: 15.
[5] RUSSO M, DECKERS K, ELDABE S, et al. Muscle control and non-specific chronic low back pain[J]. Neuromodulation: Technology at the Neural Interface, 2018, 21(1): 1-9.
[6] THIRUPATHI A, CHANG Y Z. Brain iron metabolism and CNS diseases[J]. Advances in Experimental Medicine and Biology, 2019, 1173: 1-19.
[7] 陳 莉,徐 菁,李 霞,等.电针“委中”穴对腰多裂肌损伤大鼠血小板衍生生长因子CC及受体α表达的影响[J].针刺研究,2021, 46(5):397-403.
[8] 鲁 曼,徐 菁,李欣怡,等.电针“委中”穴对大鼠腰多裂肌损伤后TGF-β1、CTGF、Vimentin表达的影响[J].中国中医急症,2020,29(3):386-390.
[9] 陈玉佩,许 玥,陈 洁,等.基于大鼠腰多裂肌损伤模型探讨电针“委中”穴对多裂肌超微结构及结蛋白表达的影响[J].辽宁中医杂志,2020,47(3):30-34,218.
[10] 陈玉佩,刘 通,许 玥,等.电针“委中”穴对大鼠腰多裂肌损伤后细胞外基质中相关蛋白表达的影响[J].针刺研究,2019,44(5):341-346.
[11] 陈玉佩,刘 通,邹德辉,等.局部注射布比卡因建立大鼠骨骼肌损伤模型的组织形态学评价[J].中国组织工程研究,2016,20(18): 2615-2621.
[12] 李忠仁.实验针灸学[M].北京:中国中医药出版社,2003:316.
[13] 钱忠明.铁代谢:基础与临床[M].北京:科学出版社,2000:165-277.
[14] PICCA A, MANKOWSKI R T, KAMENOV G, et al. Advanced age is associated with iron dyshomeostasis and mitochondrial DNA damage in human skeletal muscle[J]. Cells, 2019, 8(12): E1525.
[15] 王海涛,刘玉倩,刘建国,等.骨骼肌细胞铁代谢的研究进展[J].体育学刊,2009,16(3):96-100.
[16] LI Y, CHENG J X, YANG H H, et al. Transferrin receptor 1 plays an important role in muscle development and denervation-induced muscular atrophy[J]. Neural Regeneration Research, 2021, 16(7): 1308-1316.
[17] DING H R, CHEN S J, PAN X H, et al. Transferrin receptor 1 ablation in satellite cells impedes skeletal muscle regeneration through activation of ferroptosis[J]. Journal of Cachexia, Sarcopenia and Muscle, 2021, 12(3): 746-768.
[18] 彭园园,刘 通,陈玉佩,等.电针“委中”对布比卡因致大鼠腰多裂肌损伤后再生及组织形态的影响[J].中国针灸,2016,36(3):287-294.
[19] CHEN L H, THACKER R. Effects of dietary vitamin E and high level of ascorbic acid on iron distribution in rat tissues[J]. International journal for vitamin and nutrition research. Internationale Zeitschrift für Vitamin-und Ernährun, 1986, 56(3): 253-258.
[20] BOLDT D H. New perspectives on iron: An introduction[J]. The American Journal of the Medical Sciences, 1999, 318(4): 207-212.
[21] ALTUN M, EDSTRÖM E, SPOONER E, et al. Iron load and redox stress in skeletal muscle of aged rats[J]. Muscle & Nerve, 2007, 36(2): 223-233.
[22] IKEDA Y, SATOH A, HORINOUCHI Y, et al. Iron accumulation causes impaired myogenesis correlated with MAPK signaling pathway inhibition by oxidative stress[J]. The FASEB Journal, 2019, 33(8): 9551-9564.
[23] XU J Z, HWANG J C Y, LEES H A, et al. Long-term perturbation of muscle iron homeostasis following hindlimb suspension in old rats is associated with high levels of oxidative stress and impaired recovery from atrophy[J]. Experimental Gerontology, 2012, 47(1): 100-108.
[24] XIE Y, HOU W, SONG X, et al. Ferroptosis: process and function[J]. Cell Death Differ, 2016, 23(3): 369-379.
[25] 陳 静,赵永亮,王 丹.铁蛋白研究现状[J].河南师范大学学报(自然科学版),2010,38(1):152-155.
[26] CHASTEEN N D, HARRISON P M. Mineralization in ferritin: An efficient means of iron storage[J]. Journal of Structural Biology, 1999, 126(3): 182-194.
[27] CRICHTON R R, DECLERCQ J P. X-ray structures of ferritins and related proteins[J]. Biochimica et Biophysica Acta-General Subjects, 2010, 1800(8): 706-718.
[28] PANTOPOULOS K, PORWAL S K, TARTAKOFF A, et al. Mechanisms of mammalian iron homeostasis[J]. Biochemistry, 2012, 51(29): 5705-5724.
[29] ANDERSON G J, FRAZER D M. Current understanding of iron homeostasis[J]. The American Journal of Clinical Nutrition, 2017, 106(suppl_6): 1559-1566.
[30] 唐家明,邹亚学,王秋悦,等.DMT1:多种二价金属离子的转运载体[J].河北科技师范学院学报,2016,30(4):78-84.
