1例食管癌术后并发胸廓内吻合口瘘患者的药学实践
2022-02-14刘培培冯赵慧子郭少鸣
刘培培,冯赵慧子,郭少鸣
(1.赣南医学院第一附属医院;2.赣州市人民医院,赣州 341000)
食管癌是世界上最常见的癌症之一,是癌症相关死亡的第六大原因[1-2]。据2018年统计,我国有36.4%的患有胃癌、肝癌、食管癌预后极差,5年总体生存率较低(2013-2015年低于35%)[3]。截至2018年,我国食管癌死亡人数为283433人,占癌症总发病率的9%[4]。尽管近年来食管癌发病率和死亡率有所下降,但我国仍是世界食管癌高发地区之一。目前,手术治疗是食管癌患者的首选治疗方法。然而,手术治疗易诱发相关并发症(如功能性胃排空障碍、严重腹泻及反流性食管炎、肺部感染、乳糜胸、吻合口瘘等)。食管切除术是最复杂的胃肠道手术之一,并发症发生率在20%~80%[5]。吻合口瘘是最可怕和危及生命的并发症之一,据报道食管切除术术后出现吻合口瘘的发生率为8.2~15%[6-8]。2019年我国的一项多中心调查研究表明[9],食管胃/肠吻合口瘘的发生率为2.4%,死亡率高达23.1%(为所有肠外瘘中死亡率最高)。本文1例食管癌术后并发胸廓内吻合口瘘患者,药师经过参与临床治疗方案制定,最终患者痊愈出院,现予以报道,以期为药师临床实践带来启发。
1 病例资料
1.1 现病史 患者男,69岁,体重64 kg,身高170 cm,BMI 22.1 kg/m2,2月前无明显诱因出现吞咽梗阻感,伴呃逆、反酸,伴进食后剑突下疼痛,偶有黑便,无恶心、呕吐,无腹泻,便秘,无腹痛等。未予重视,症状较前逐渐加重。遂就诊我院,门诊行电子胃镜检查提示:食管距门齿30 cm见一巨大新生物。颈部、胸部、全腹平扫加增强示:(1)食管胸下段占位,考虑食管Ca,胃底周围小弯侧肿大淋巴结,腹膜后多发淋巴结显示;(2)左肺下叶小结节;(3)肝内多发囊肿;胆囊结石并胆囊炎;(4)左肾囊肿,双侧肾上腺稍增粗;(5)肠系膜脂膜炎;(6)甲状腺右叶小结节,考虑良性病变,建议随诊;(7)双侧颈部多发淋巴结显示。上消化道低张双重造影示:食管下段占位,考虑食管癌。现为进一步诊治入住我院心胸外科。本次起病以来,近两个月体重减少约5 kg。入院后完善相关检查,于入院第4 d在全麻下行“全腔镜下食管部分切除+经胸骨后食管-胃左颈部吻合+胸膜粘连烙断术+空肠造瘘术”,术后给予禁食补液、镇痛、抑酸、抗感染、化痰、营养支持等治疗。术后第3 d起患者出现咳嗽、咳白痰。术后第12 d复查上消化道低张双重造影提示吻合口瘘,右侧胸腔引流管通畅,引出约250 mL淡红色液体;术后第14 d痰细菌培养+鉴定+药敏示:阴沟肠杆菌、铜绿假单胞菌;予以禁食、抗感染、营养支持治疗。既往有吸烟、饮酒史,有2型糖尿病病史,口服降糖药物,血糖控制可。否认食物药物、过敏史。
1.2 实验室检查 血生化、血分析:总蛋白54.10 g/L,白蛋白33.20 g/L,前白蛋白172.60 mg/L,钠134.50 mmol/L,钙2.02 mmol/L,镁0.60 mmol/L,白细胞11.61×109/L,中性细胞比率82.0%,其余相关指标均无明显异常。
入院诊断:(1)食管恶性肿瘤;(2)2型糖尿病;(3)营养不良;(4)窦性心动过缓伴不齐;(5)左肺下叶结节;(6)肝内多发囊肿;(7)胆囊结石伴胆囊炎;(8)甲状腺右叶小结节;(9)左肾囊肿;(10)上颌窦炎。
1.3 参与主要治疗过程
1.3.1 营养支持治疗过程 入院第4 d在全麻下行“全腔镜下食管部分切除+经胸骨后食管-胃左颈部吻合+胸膜粘连烙断术+空肠造瘘术”,术后给予禁食补液、镇痛、抑酸、抗感染、化痰、营养支持等治疗。术后第1 d至第3 d,给予全肠外营养支持治疗,术后第4 d至第15 d,给予肠外联合肠内营养支持治疗。临床药师通过会诊参与调整营养支持治疗方案(具体见表1),由肠外营养、肠内营养,逐渐过渡到经口进食后,患者的胸腔引流液明显减少(引流量变化见图1),吻合口瘘明显改善,予以胸腔引流管夹管。术后第40 d(入院第44 d),患者病情稳定好转,最终痊愈出院。

表1 营养支持治疗方案调整
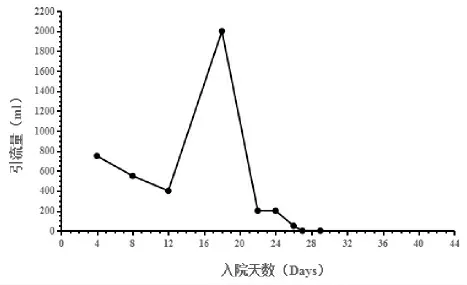
图1 胸内吻合口瘘引流量变化图
1.3.2 抗感染治疗过程 术后第3 d起患者出现咳嗽、咳痰、咳白痰、不易咳出。WBC 10.47×109/L,NE%92.56%,PCT 0.34 ng/mL,抗感染方案为哌拉西林钠他唑巴坦钠(4.5g、ivgtt、q8h)。术后第14 d痰细菌培养+鉴定+药敏示:阴沟肠杆菌(对头孢哌酮舒巴坦钠、哌拉西林钠他唑巴坦钠、头孢他啶、头孢曲松耐药)、铜绿假单胞菌(仅对阿米卡星、氨曲南敏感),PCT 0.15 ng/mL,抗感染方案调整为左氧氟沙星注射液(0.5g、ivgtt、qd)。入院第31 d(术后第27 d)出现发热,最高体温39.0℃,PCT 0.09 ng/mL,抗感染方案调整为左氧氟沙星注射液(0.5g、ivgtt、qd)+哌拉西林钠他唑巴坦钠 (4.5 g、ivgtt、q8 h)。入院第39 d,PCT 0.11 ng/mL,痰细菌培养+鉴定+药敏示:鲍曼不动杆菌,仅对多粘菌素E耐药。抗感染方案调整为美罗培南(1.0g、ivgtt、q12 h)。入院第44 d,PCT 0.08 ng/m,患者无发热,一般情况可,无明显咳嗽、咳痰,予以停用抗菌药物。
2 讨论
食管癌因术后并发症直接影响患者的疗效和生活质量,甚至导致死亡。术后并发症主要包括:乳糜胸、肺部并发症(Postoperative Pulmonary Complications,PPC)、吻合口瘘、吻合口狭窄和反流性食管炎,部分患者可能存在功能性胃排空障碍。食管癌手术后发生乳糜胸是罕见的,但乳糜胸一旦发生,其后果是非常严重的,导致乳糜液渗漏,大量体液流失,在预防食管癌术后乳糜胸方面,采用低位膈上整块结扎周围组织与胸导管是安全可靠的。食管癌术后肺部并发症发生率高,危害严重,患者年龄、肥胖、吸烟及肺部疾病均可导致PPC的发生。术前呼吸功能训练、术中减少肺损伤、术后药物治疗可减少肺部并发症的发生。胸廓内吻合口瘘是最严重的手术并发症之一,可导致其他术后并发症(10%~20%)和死亡率(4%~50%),通过胸部CT扫描和胃肠血管造影检查,尽早发现隐匿性瘘,并进行规范的保守治疗,可显著降低食管癌术后胸瘘的发生率[4]。
目前对于吻合口瘘没有明确的治疗指南推荐,临床多采用保守、手术、内窥镜等治疗手段。而保守治疗主要包括:“三管法”(胸腔闭式引流管、胃肠减压管、肠内营养管)、内镜下放置全覆膜支架、内镜下金属架修补[10]。
2.1 吻合口瘘的营养支持治疗方案 发生吻合口瘘的原因主要有吻合方式、张力、继发性感染、术前营养状况等。颈部吻合口瘘不易危及患者生命,可通过引流治疗。胸腔内吻合口瘘常发生于术后5~10 d。即使有些吻合口瘘是无症状的,病情恶化时仍可导致胸膜污染和胃坏死,对患者的威胁极大,死亡率也很高。术后低蛋白血症和肾功能不全的女性患者更容易发生吻合口瘘[11]。同时有研究表明[12],血糖升高易导致患者术后出现吻合口瘘,影响恢复。
食管癌切除术成功的关键在于患者的营养状况[13]。食管癌患者普遍存在营养不良和恶病质表现,因此围手术期营养评估与支持治疗对于改善预后尤为重要。营养支持治疗方案主要包括全肠外营养(TPN)、鼻十二指肠/鼻空肠管喂养、空肠造口管喂养和口服喂养。而在食管癌切除术时术中放置空肠造口管成为肠内营养输注通路的首选方法。一项早期前瞻性随机试验显示,与肠内营养(EN)相比,接受TPN的患者严重并发症的发生率更高,需要干预的败血症发生率更高,静脉血栓形成、电解质失衡和肝衰竭[14]。TPN是当患者存在EN禁忌时才予以考虑。一项meta分析表明[15],与TPN相比,在术后前7 d经鼻十二指肠或鼻空肠途径喂养肠内营养可降低肺部并发症与吻合口瘘的发生率,同时可保持较高的白蛋白水平、改善术后营养状况。在一项中国食管癌患者的大型回顾性队列研究中发现,与TPN[16]相比,早期EN减少了术后住院时间和随后的住院费用,但在吻合口瘘或临床结果方面没有显著差异。因此,肠内喂养绝对是食管切除术后大多数喂养方案。Lorimer等人[17]发现,在接受食管切除术的患者中,通过空肠营养造瘘管管饲肠内营养的患者,总体住院时间更短,死亡率更低。经空肠造口术的肠内喂养似乎与改善患者预后有关,并允许早期建立肠内营养,最终过渡到口服饮食。Dalton等人[18]认为,在接受新辅助治疗前进行喂养空肠造口的患者在食管癌切除术后30 d内的肺炎发生率显著降低。
2020年《食管癌患者营养治疗指南》[19]推荐,采用NRS 2002进行营养风险筛查、PG-SGA进行营养评估,对于术前存在营养风险或营养不良的患者需进行7~14 d的营养支持治疗后再行手术,营养治疗途径首选肠内营养,一般能量需求量推荐为25~30 kcal/kg·d-1,蛋白质目标摄入量为1.5~2.0 g/kg·d-1。
本例患者在营养药师会诊后及时调整营养支持治疗方案,停用肠外营养,改用适合糖尿病患者使用的肠内营养剂型(肠内营养混悬液TPF-DM)后,患者血糖控制平稳,提供热卡为1500 kcal/d。经过个体化营养支持治疗,患者的胸腔引流液明显减少,吻合口瘘明显改善,胸腔引流管夹管。肠内营养混悬液(TPF-DM)为糖尿病患专用型肠内营养制剂,适用于有肠道功能且不能正常进食的糖尿病患者、一过性血糖升高或应激性高血糖患者。肠内营养混悬液(TPF-DM)利于血糖控制的原由[20]:(1)碳水化合物含量低(44.6%),有利于减少患者血糖波动;(2)单不饱和脂肪酸含量高达26%,可降低患者餐后血糖及胰岛素水平;(3)增加了膳食纤维的含量以及ω6:ω3的比例,改善胰岛素抵抗,降低炎症和氧化应激水平。
同时由于食管癌手术还可能引起胃肠道功能障碍,导致严重的腹泻,应积极给予止泻药物,同时补充水分、电解质,防止脱水、电解质紊乱。本例患者术后早期出现了腹泻,通过积极处理,恢复改善胃肠道功能、止泻补液等对症处理后,腹泻症状消失。
2.2 抗感染治疗方案 食管癌手术中虽然没有切除肺组织,但胸壁和肋间肌的完整性受到了破坏,尤其是膈肌的完整性,由于受累肺的通气泵受到严重破坏,容易发生呼吸道感染。当颈部、胸部或上腹部切口疼痛时,如果将胃拉入胸腔压迫肺部,患者术后可能会经历不同程度的呼吸困难和呼吸短促。导致肺部感染的病理生理机制包括肺泡塌陷、肺水肿、肺防御机制减弱和通气不良[21]。与术后肺部感染相关的围手术期危险因素包括慢性支气管炎、慢性心功能不全和年龄超80岁[22]。近期研究表明,2704例患者中28%发生严重呼吸并发症,15%发生肺炎,7%发生呼吸衰竭[23]。食管癌肺部感染患者术后大多出现肺水肿,导致痰量增加,咳嗽无效,痰咳嗽。胸壁切开引流管引起的疼痛可使患者担心疼痛,降低呼吸深度,导致排斥咳嗽或弱咳嗽,损害同侧肺通气功能,阻碍痰咳的有效释放和缓解[24]。
阴沟肠杆菌广泛分布于水、污水、土壤和蔬菜自然环境中,也可存在于人和动物的肠道,属正常菌。阴沟肠杆菌率属于肠杆菌科肠杆菌属,是引起医院感染的重要病原菌之一[25]。铜绿假单胞菌是一种革兰氏阴性菌,存在于正常人的皮肤、自然界、呼吸道、肠道中,是一种常见致病菌,在临床治疗中发现,感染该病菌的患者耐药性非常强,耐药机制极其复杂,为临床治愈增加了难度。本例患者术前诊断患有窦性心动过缓伴不齐,既往有2型糖尿病病史,术后出现发热,咳嗽、咳痰,感染相关生化结果提示升高。药师结合药敏结果,及时调整抗感染方案,患者最终感染症状明显改善,最终痊愈出院。
2.3 营养支持治疗药学监护 管饲肠内营养时,应密切观察患者耐受性(胃肠道不适、防止误吸);注意防范导管相关并发症发生,空肠造口相关并发症的发生率约为30%,轻微的并发症:渗漏、脱位、浅表感染、堵管等。严重的并发症可危及生命,包括小肠坏死、肠扭转和肠套叠等。同时应注意开封使用的肠内营养液不应超过24 h;TPN中葡萄糖功能占比应以50%~60%为宜,输注速率应控制在4 mg/(kg·min)以下,同时建议葡萄糖与短效胰岛素的比例约为3~4 g:1U,密切监测血糖,围手术期血糖控制范围为7.8~10.0 mmol/L[26]。
3 总结
吻合口瘘仍然是食管癌切除术后最严重的并发症之一,术前营养状况评估与治疗、术中应尽量减少导管直接损伤、术后早期肠内营养、肺物理治疗等是降低吻合口瘘发生率的重要手段。大多数食管癌患者术前均存在营养风险或营养不良,由于本例患者术前未进行营养风险筛查与评估,围手术期也未进行规范的营养支持治疗,这可能是造成术后发生吻合口瘘的主要因素之一。因此,药师在今后的临床实践中,对于食管癌切除术术后应密切监测患者状态,对发热或白细胞增多的患者应保持警惕,必要时予以抗感染治疗。同时房颤、血液中高水平的炎症标志物(白细胞、C-反应蛋白)也可能是发生渗漏的强有力指标。吻合口瘘一旦发生,应尽早诊断(胸腔内瘘容易被漏诊),无论临床采取哪种治疗手段,都应及时尽早给予肠内营养支持治疗,同时通过全程配合临床医师调整治疗方案,提供药学监护与用药指导,保证患者用药安全,改善临床结局。
