淋巴细胞比值联合降钙素原对早期诊断直肠癌术后吻合口瘘的临床意义
2019-08-24王金光黄峰平李志宇朱锦辉
王金光 黄峰平 陶 辉 李志宇 朱锦辉
直肠癌是一种常见的恶性肿瘤,吻合口瘘是直肠癌术后常见且严重的并发症[1-2]。临床调查显示,吻合口瘘通常发生在术后5~7 天,常伴弥漫性感染,增加患者痛苦、延长住院时间,甚至可导致患者死亡,因此早期及时发现及处理吻合口瘘具有重要意义[3-4]。目前,除影像学及造影检查外,缺乏有效诊断术后吻合口瘘的方法。近年发现淋巴细胞比值(NLR)与降钙素原(PCT)对早期诊断术后吻合口瘘具有重要价值[5-6]。因此,本研究探讨NLR 联合PCT 早期诊断直肠癌术后吻合口瘘患者的临床意义。现报道如下。
1 临床资料
1.1 一般资料 选择2017 年6 月—2018 年6 月于浙江省义乌市义乌復元私立医院普外科收治直肠癌术后患者147 例。男89 例,女58 例,年龄27~75 岁,平均(57.83±5.41)岁,手术方式:开腹术57 例,腹腔镜术90 例。本研究经单位伦理委员会审核通过。
1.2 诊断标准 符合以下1 项即可诊断为术后吻合口瘘[7]:(1)从骶前引流管甚至腹部切口处引流出肠内容物,或者肛门指诊触及瘘口;(2)通过辅助检查以下中任何1 项:CT 检查示吻合口周围积气及肠壁不连续;消化道造影检查可见造影剂从引流管流出或者从瘘口流出;(3)再手术确诊为吻合口裂开。
1.3 纳入标准 (1)所有患者均行直肠癌根治术;(2)均经病理学证实为直肠癌,且术前未发生远处转移;(3)与患者及其家属签订知情同意书者。
1.4 排除标准 (1)术前合并急慢性感染者;(2)凝血功能障碍或免疫疾病者;(3)精神疾病者;(4)近期接受抗菌药物治疗者。
2 方 法
2.1 PCT 和NLR 检测 血清标本采集:所有患者于术前、术后3 天和术后5 天清晨空腹抽取患者静脉血3mL,以离心半径15cm、转速3000r/min,离心10min,分离血清,放置于-20℃下保存待测。采用电化学发光法测定PCT 含量,试剂盒购自基蛋生物科技股份有限公司(批号1602131),严格按试剂盒说明书标准测定。并于术前、术后3 天和术后5 天清晨空腹抽取患者静脉血3mL,计算NLR。
2.2 观察指标 (1)观察术后吻合口瘘发生情况[7],根据是否出现吻合口瘘分为吻合口瘘组和无吻合口瘘组;(2)观察吻合口瘘组与无吻合口瘘组血清PCT含量变化;(3)观察吻合口瘘组与无吻合口瘘组NLR变化;(4)观察PCT 联合NLR 诊断效能,包括灵敏度和特异度,其中以真阳性患者/(真阳性患者+假阴性患者)×100%为灵敏度;以真阴性患者/(真阴性患者+假阳性患者)×100%为特异度。
2.3 统计学方法 应用SPSS19.0 统计软件处理数据。计量资料采用均数±标准差) 表示,两组间采用t 检验。以P<0.05 表示差异有统计学意义。
3 结 果
3.1 术后吻合口瘘发生情况 直肠癌术后患者147例,发生吻合口瘘23 例,占15.65%,未发生吻合口瘘124 例,占84.35%。吻合口瘘组23 例患者中,男14例,女9 例,平均年龄(58.19±4.87)岁,手术方式:开腹术10 例,腹腔镜术13 例。无吻合口瘘组124 例患者中,男75 例,女49 例;平均年龄(57.49±4.21)岁;手术方式:开腹术47 例,腹腔镜术77 例。两组性别、年龄和手术方式比较,差异无统计学意义(P>0.05)。
3.2 两组手术前后血清PCT 含量比较 两组术前血清PCT 含量比较,差异无统计学意义(P>0.05);无吻合口瘘组术前、术后3 天和术后5 天血清PCT 含量比较,差异无统计学意义(P>0.05);吻合口瘘组术后3 天和术后5 天血清PCT 含量高于术前(P<0.01);吻合口瘘组术后3 天和术后5 天血清PCT 含量高于无吻合口瘘组(P<0.05)。见表1。
表1 两组直肠癌术后患者血清PCT 含量比较(ng/mL
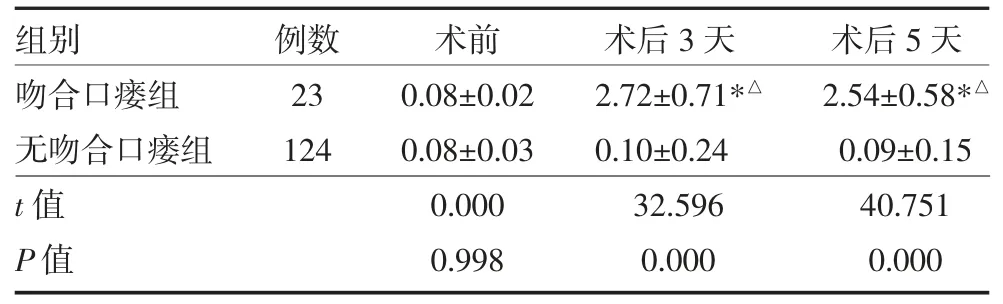
表1 两组直肠癌术后患者血清PCT 含量比较(ng/mL
注:与同组术前比较,*P<0.05;与无吻合口瘘组同期比较,△P<0.01;PCT:降钙素原
组别吻合口瘘组无吻合口瘘组t 值P 值例数23 124术前0.08±0.02 0.08±0.03 0.000 0.998术后3 天2.72±0.71*△0.10±0.24 32.596 0.000术后5 天2.54±0.58*△0.09±0.15 40.751 0.000
3.3 两组手术前后NLR 比较 两组术前NLR 比较,差异无统计学意义(P>0.05);无吻合口瘘组术前、术后3 天和术后5 天NLR 值比较,差异无统计学意义(P>0.05);吻合口瘘组术后3 天和术后5 天NLR 值高于术前,而术后5 天 NLR 值低于术后3天(P<0.01);吻合口瘘组术后3 天和术后5 天NLR值高于无吻合口瘘组(P<0.01)。见表2。
表2 两组直肠癌术后患者NLR 变化比较(
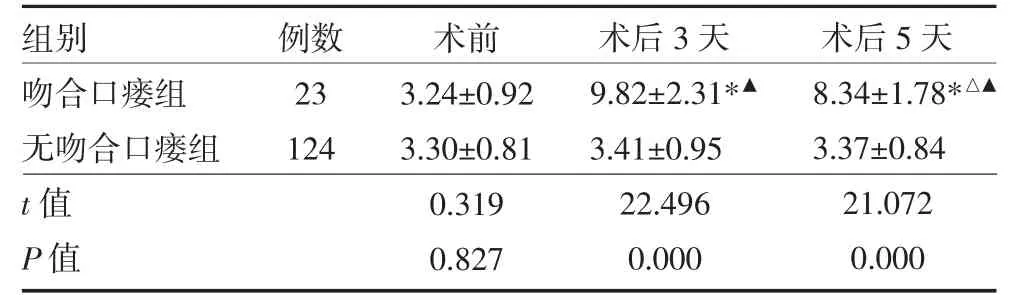
表2 两组直肠癌术后患者NLR 变化比较(
注:与同组术前比较,*P<0.05;与同组术后3 天比较,△P<0.01;与无吻合口瘘组比较,▲P<0.01;NLR:淋巴细胞比值
组别吻合口瘘组无吻合口瘘组t 值P 值例数23 124术前3.24±0.92 3.30±0.81 0.319 0.827术后3 天9.82±2.31*▲3.41±0.95 22.496 0.000术后5 天8.34±1.78*△▲3.37±0.84 21.072 0.000
3.4 NLR 与PCT 联合诊断效能 NLR 联合PCT 诊断灵敏度和特异度高于NLR 与PCT 单项诊断。见表3。
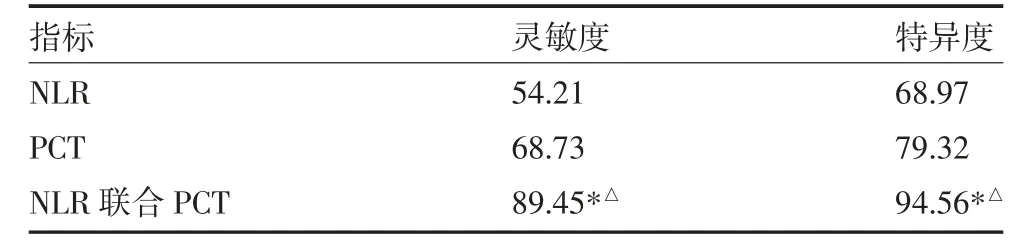
表3 NLR 与PCT 联合诊断效能
4 讨 论
目前,手术是直肠癌的主要治疗手段,但直肠癌术后容易并发吻合口瘘,且部分需进行二次手术,从而大大降低了患者对手术效果满意度[7-8]。临床调查显示,直肠癌术后吻合口瘘发生率为1%~19%[9]。直肠癌术后吻合口瘘严重影响直肠癌预后。因此,早期诊断和干预术后吻合口瘘具有重要意义。临床研究报道发现,NLR 与多种恶性肿瘤预后相关,并且随着NLR 水平升高提示预后不良[10-11]。且相关研究证实,NLR 是吻合口瘘独立危险因素[12]。认为其机制可能是中性粒细胞一方面能够产生某些细胞因子刺激肿瘤细胞的生长,从而促进肿瘤进展,以及某些趋化因子增加了肿瘤的浸润性和转移性;此外,认为中性粒细胞作为炎症细胞通过抑制淋巴细胞,激活自然杀伤细胞、T 细胞等免疫细胞对免疫系统起到抑制作用,从而降低了免疫防御功能,由此可知淋巴细胞在抗肿瘤免疫过程中具有重要作用。本研究表明,吻合口瘘组术后3 天和术后5 天NLR 高于术前,且吻合口瘘组NLR 高于无吻合口瘘组,故而说明术后吻合口瘘患者NLR 值明显升高,提示NLR 用于结直肠癌患者预后的评估,尤其在围术期并发症术后吻合口瘘预测提供参考,但其具体机制尚不十分明确。
PCT 主要是由甲状腺C 细胞在内毒素刺激以及细菌感染下产生的蛋白质,真菌感染、自身免疫反应及过敏不会造成其在血清中表达升高[13-15]。PCT 在重症感染如感染性休克和脓毒血症的病理生理状态下感染2~3h 后明显升高,最高值能够达700ng/mL[16-17]。由于吻合口瘘特征最重要的是肠道菌群进入腹腔,且以革兰阴性菌为主,故而分析PCT 水平,可能达导致早期诊断直肠癌术后吻合口瘘的发生[18-19]。本研究表明,吻合口瘘组术后3d 和术后5d 血清PCT 含量高于术前,且吻合口瘘组血清PCT 含量高于无吻合口瘘组,故而说明术后吻合口瘘患者血清PCT 水平明显升高,提示术后通过动态检测PCT 水平,对于持续增高患者应注意有无吻合口瘘发生,可通过PCT评估吻合口瘘风险,但其具体机制尚不十分明确,还需后续研究中增加样本量进一步深入研究。
综上所述,直肠癌术后吻合口瘘患者NLR 与PCT水平明显升高,且联合诊断可提高灵敏度和特异度,作为辅助性诊断术后吻合口瘘指标,值得临床借鉴。
