MiR-32对非小细胞肺癌细胞增殖、迁移和侵袭的影响及机制
2022-02-14向丹王文涛张益
向丹 王文涛 张益
(1荆门市中医医院呼吸内科,湖北 荆门 448000;2湖北民族大学附属民大医院手术室)
非小细胞肺癌(NSCLC)具有发病率高、死亡率高和预后差的特点,其发生发展过程复杂;深入研究NSCLC发病机制可有助于筛选NSCLC诊疗的新靶点〔1〕。CCNE2作为调控细胞周期的因子,一直是肿瘤相关研究的热点,有报道称CCNE2信号通路的紊乱会导致肿瘤的发生,如miR-664b-5p〔2〕、miR-26a和miR-30b〔3〕可调控CCNE2的表达从而促进乳腺癌细胞的凋亡,并抑制细胞迁移和侵袭。且CCNE2在NSCLC组织和细胞中高表达,可促进NSCLC细胞增殖、侵袭和迁移,在NSCLC治疗和研究中发挥着重要作用〔4〕。关于miR-32在肿瘤中的研究早有报道,如miR-32靶向FBXW7促进乳腺癌细的增殖和迁移,抑制细胞凋亡〔5〕和靶向KLF4调控胃癌细胞的增殖和迁移〔6〕。而miR-32在NSCLC细胞的功能也已有研究,其在NSCLC组织和细胞中表达显著降低〔7〕。也有研究发现MiR-32可通过靶向调控TWIST1〔8〕和SOX9〔9〕抑制NSCLC细胞增殖、上皮间质转化和转移。本实验通过生物信息学分析预测发现CCNE2可能是miR-32的靶基因,但miR-32是否可靶向调控CCNE2表达而影响NSCLC细胞增殖、迁移和侵袭过程仍不清楚。因此,本研究旨在研究miR-32对NSCLC细胞的增殖、迁移和侵袭的影响及其分子调控机制是否与CCNE2有关。
1 材料与方法
1.1材料 胎牛血清、 DMEM培养基购自北京华迈科生物技术有限责任公司;CCK-8试剂购自上海益启生物科技有限公司;胰蛋白酶购自上海恒渡生物科技有限公司;miRNeasy Mini试剂盒购自上海科敏生物科技有限公司;Totol RNA提取试剂盒和miRNA实时荧光定量-聚合酶链反应(qRT-PCR)SYBR®试剂盒购自北京索莱宝科技有限公司;miR-NC、miR-32 mimics、miR-32 inhibitor购自上海吉玛生物。CCNE2干扰RNA(si-CCNE2)和对照干扰RNA(si-NC)均由上海生物工程有限公司合成构建。电化学(ECL)发光试剂盒购自上海经科化学科技有限公司;GAPDH抗体、CCNE2抗体、辣根过氧化酶(HRP)标记的二抗均购自上海恒斐生物科技有限公司;pcDNA3.1空载体、CCNE2过表达载体pcDNA3.1-CCNE2均购自赛默飞公司;荧光素酶报告基因检测试剂盒购自北京博迈斯科技发展有限公司。Transwell小室购于Millipore。清洁级雄性BALB/c小鼠(体重18~23 g,8~10周龄),由上海斯莱克实验动物中心提供,许可证号为SCXK(沪)2012-0002。所有动物至少适应相应的饲养环境1 w。所有的动物实验按照有关法律法规指导方法进行,并获得医学实验动物伦理委员会批准。
1.2方法
1.2.1肺癌组织标本 收集荆门市中医医院2016年1月至2019年1月手术切除并经病理切片确诊为NSCLC的石蜡标本30例。30例患者术后病理切片确诊为NSCLC,患者经手术切除癌组织,距离癌组织边缘2~5 cm处切除的为癌旁组织。所有患者术前未接受过放化疗。所有患者签署知情同意书。本研究经医院医学伦理委员会批准。
1.2.2细胞培养 正常支气管上皮细胞株16-HBE和NSCLC细胞株H460、A549和H1299购自美国ATCC。将以上细胞接种于DMEM培养液(含10%胎牛血清)中,然后将其放在含5%CO2的37℃培养箱中培养。
1.2.3qRT-PCR检测miR-32和CCNE2表达 提取16-HBE、H460、A549和H1299细胞的总RNA和miRNA,合成cDNA,按qPCR试剂盒进行操作。MiR-32和U6引物来源于MicroRNA Real-time PCR试剂盒。miR-32引物正义链:5′-GCGGCGTATTGCACATTACT-3′,反义链:5′-TCGTATCCAGTGCAGGGTC-3′;U6引物正义链:5′-CTCGCTTCGGCAGCACA-3′,反义链:5′-AACGCTTCACGAATTTGCGT-3′;CCNE2引物正义链:5′-ATTTGGCTATGCTGGAGGAA-3′,反义链:5′-GTGCTCTTCG GTGGTGTCAT-3′。GAPDH引物正义链:5′-CCACTCCTCCACCTTTGAC-3′,反义链:5′-ACCCTGTTGCTGTAGCCA-3′。
1.2.4细胞转染 取对数生长期A549和H1299细胞,以1×105个/孔密度接种于6孔板中,随机分为8组:NC组(转染miR-NC)、miR-32组(转染miR-32 mimics)、NC inhibitor组(转染miR-32-NC)、miR-32 inhibitor组(转染miR-32 inhibitor)、si-NC组(转染对照干扰RNA)、si-CCNE2组(转染CCNE2干扰RNA)、miR-32+vector组(共转染miR-32 mimics和pcDNA3.1)、miR-32+CCNE2组(共转染miR-32 mimics和pcDNA3.1-CCNE2),具体步骤按照LipofectamineTM2000使用说明进行。 48 h后,qRT-PCR检测转染效果,qRT-PCR和Western印迹分别检测CCNE2 mRNA和蛋白表达水平;采用CCK-8法和Transwell法检测细胞增殖、迁移、侵袭能力。
1.2.5CCK-8法检测细胞增殖 将1.2.4中各组细胞,分别于培养12、24、48和72 h时,每孔加入20 μl的CCK-8溶液,然后于酶标仪上检测490 nm波长下的吸光度值。实验重复3次。
1.2.6Transwell小室检测细胞迁移与侵袭能力 取1.2.4中各组细胞,迁移实验:Transwell上室接种3×104个/孔细胞,侵袭实验:有基质胶的Transwell上室接种105个/孔细胞,两者下室中均加入600 μl含10%胎牛血清的培养液,培养24 h后,用PBS漂洗,再分别用甲醇和0.5%结晶紫固定、染色。倒置显微镜观察并随机选5个视野的迁移和侵袭细胞数的平均值。
1.2.7双荧光素酶报告基因检测miR-32与CCNE2基因的靶向关系 生物信息学分析库预测显示miR-32与CCNE2 3′-UTR有结合位点。将构建好的野生型CCNE2-WT和突变型CCNE2-MUT的荧光素酶报告质粒分别与miR-NC、miR-32 mimics转染至A549和H1299细胞中,转染6 h后换新鲜培养液并继续培养24 h,按照双荧光素酶报告基因检测试剂盒说明检测各组细胞荧光素酶活性,实验重复3次。
1.2.8Western印迹检测 提取A549和H1299细胞总蛋白,二喹啉甲酸(BCA)进行蛋白定量度。变性后取20 μg蛋白样品进行12%十二烷基硫酸钠-聚丙烯酰胺凝胶电泳(SDS-PAGE),转至聚偏氟乙烯(PVDF)膜,封闭液封闭后加入1∶2 000倍稀释的一抗4℃孵育过夜。TBST洗膜,加入1∶10 000稀释的二抗,37℃下孵育1 h。加化学发光剂显影成像,Image J分析条带的灰度值,以目的条带与GAPDH的比值表示目的蛋白的表达情况。
1.2.9异种移植瘤实验 将2.5×106的对照细胞(H1299)或稳定表达miR-32的细胞悬浮于200 μl无血清DMEM中,皮下注射到每只小鼠的1只(每组10只雄性BALB/C 小鼠,且经病理切片确诊为NSCLC)30 d。30 d后处死小鼠,测定各项参数。
1.3统计学方法 采用SPSS20.0软件进行t检验、单因素方差分析。
2 结 果
2.1miR-32在NSCLC组织和细胞中低表达 癌组织中miR-32表达水平(0.35±0.04)显著低于癌旁组织(1.14±0.13,P=0.000);A549组(0.36±0.04)、H1299组(0.26±0.03)和H460(0.49±0.05)中miR-32表达水平显著低于16-HBE组(1.12±0.13,均P<0.05)。
2.2过表达 miR-32抑制NSCLC细胞的增殖、迁移和侵袭能力 与NC组相比,miR-32组在A549和H1299细胞中miR-32表达显著升高(均P=0.000);与NC组相比,miR-32组细胞活力、迁移细胞数、侵袭细胞数均显著降低(P=0.000)。表明miR-32可显著降低A549和H1299细胞的迁移和侵袭能力。见图1,表1,表2。
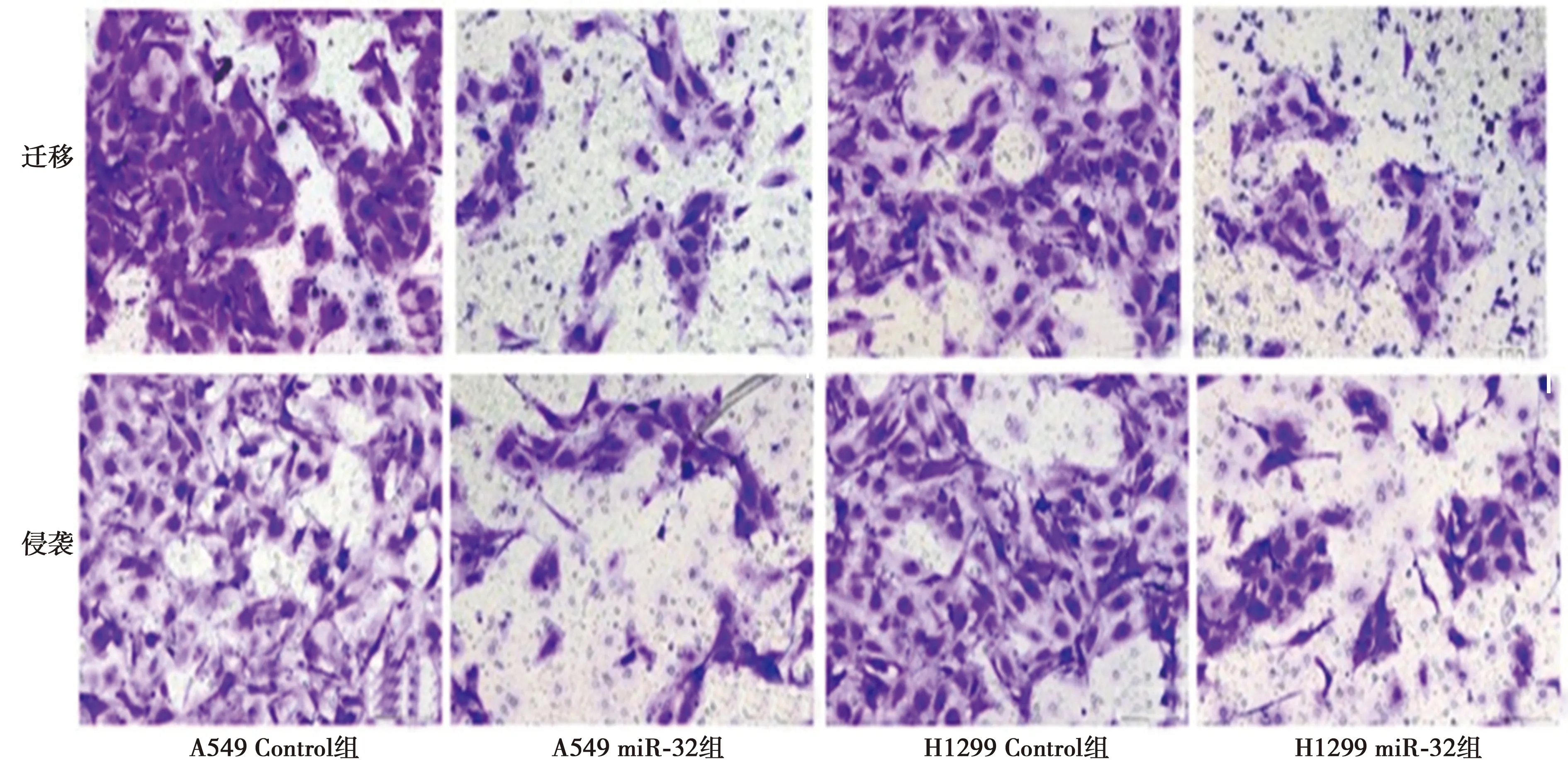
图1 过表达miR-32对细胞A549迁移、侵袭能力的影响(结晶紫染色,×100)


2.3沉默CCNE2抑制NSCLC细胞的增殖、迁移和侵袭能力 与si-NC组相比,si-CCNE2组A549和H1299细胞CCNE2、miR-32、迁移和侵袭细胞数及细胞活性均显著下调(均P=0.000)。见表3、表4。表明沉默CCNE2可显著降低A549和H1299细胞的迁移和侵袭能力。


2.4CCNE2是miR-32的靶基因 生物信息学预测发现miR-32与CCNE2 3′UTR存在结合位点见图2;双荧光素酶报告基因实验结果显示,miR-32能显著降低CCNE2-3′UTR-WT的荧光素酶活性(P<0.01),而不影响CCNE2-3′UTR-MUT的荧光素酶活性(P>0.05),见表5;miR-32组A549和H1299细胞CCNE2蛋白表达显著低于miR-NC组(P<0.01);miR-32 inhibitor组A549和H1299细胞CC-NE2蛋白表达显著高于NC inhibitor组(P<0.01),见表6、图3。

图2 miR-32与CCNE2 3′UTR综合位点

表5 双荧光素酶报告实验

表6 miR-32调控CCNE2的表达

图3 miR-32靶向、调控CCNE2
2.5miR-32负调控CCNE2抑制NSCLC细胞的增殖、迁移和侵袭能力 与miR-32+vector组相比,miR-32+CCNE2组CCNE2蛋白水平、细胞活力、迁移细胞数、侵袭细胞数均显著升高(均P<0.05)。见图4,表7,表8。

图4 CCNE2蛋白的表达


2.6miR-32在体内抑制异种移植瘤生长 与NC组相比,miR-32组10 d肿瘤体积显著变小(均P<0.01);30 d后,对处死小鼠的肿瘤重量进行测量,miR-32组肿瘤重量显著降低(P<0.01),miR-32组肿瘤细胞中miR-32表达上调,CCNE2蛋白表达水平显著降低(P<0.01),见表9,图5。


图5 CCNE2蛋白的表达
3 讨 论
研究表明miR-32在多种肿瘤中能够发挥抗肿瘤作用,它在结肠癌、神经胶质瘤、肾癌、前列腺癌Wilm瘤中的表达水平显著下调〔10〕。如 Zhao等〔6〕发现miR-32通过KLF4蛋白调控胃癌细胞增殖和迁移;Wu等〔11〕发现,miR-32通过调控PTEN蛋白调控肠癌细胞的增殖、迁移和侵袭。但miR-32在乳腺癌中的表达显著上调,如Wei等〔5〕发现miR-32能靶向调控FBXW7的表达促进乳腺癌细胞的增殖、迁移、侵袭和抑制细胞凋亡。miR-32在NSCLC细胞的功能也已有研究,它在NSCLC组织和细胞中表达显著下调〔7〕。有研究发现miR-32可通过负调控TWIST1〔8〕和SOX9〔9〕抑制NSCLC细胞增殖、上皮间质转化和转移。miR-32可靶向AURKA基因从而抑制NSCLC细胞活力〔12〕。本研究发现miR-32在NSCLC组织、A549、H460和H1299细胞中显著下调,表明,过表达miR-32可显著抑制细胞增殖、迁移和侵袭;miR-32在体内可明显抑制异种移植瘤的生长,提示miR-32在NSCLC中能够发挥抑癌作用。
肿瘤的一个重要生物学特征是有无限生长的潜能,癌基因的活化及抑癌基因通路的改变是肿瘤发生的重要因素〔13〕。细胞增殖受到细胞周期素、细胞周期依赖性激酶〔14〕及细胞周期蛋白依赖性激酶抑制剂的严格调控。CCNE2与CCNE1〔15〕同属于细胞周期素E家族〔16〕,有研究报道CCNE2在非转化的细胞中难以检测到,但是在肿瘤性细胞中却显著升高〔17〕。目前国内外学者已经证明CCNE2在多种肿瘤组织中高表达,如肺癌、胃癌〔13〕、乳腺癌、宫颈癌、卵巢癌〔19〕、脑癌等。如miR-664b-5p〔2〕、miR-26a和miR-30b〔3〕可调控CCNE2的表达从而促进乳腺癌细胞的凋亡,并抑制细胞迁移和侵袭。研究显示CCNE2在NSCLC组织和细胞中高表达,可促进NSCLC细胞增殖、侵袭和迁移,提示CCNE2在NSCLC治疗和研究中可能发挥重要作用〔4〕。本研究推测CCNE2可能是miR-32的潜在靶基因,进一步的双荧光素报告基因实验证实了CCNE2是miR-32的靶基因,且miR-32过表达可负调控CCNE2表达,沉默miR-32可使细胞中CCNE2的表达上调,与过表达miR-32结果一致。本实验结果表明miR-32可显著下调肿瘤细胞中CCNE2蛋白表达,提示CCNE2在NSCLC细胞A549和H1299的增殖、迁移和侵袭过程中有重要作用,miR-32可负调控CCNE2表达参与其中。
miR-32在NSCLC中的作用已有报道〔7〕,miR-32调控NSCLC的机制十分复杂,本研究发现miR-32下调CCNE2抑制NSCLC细胞A549和H1299的增殖、迁移和侵袭,这一结果为NSCLC的治疗和诊断提供了新的理论依据。
