基于王三虎“燥湿相混致癌说”探究半边莲治疗癌症的作用及物质基础
2022-02-14王雪梅吴凡伟李彦荣
王雪梅,吴凡伟,李彦荣
[1.广州中医药大学,广东广州510405;2.深圳市宝安中医院(集团),广东深圳518100]
半边莲为桔梗科植物半边莲Lobelia chinensisLour.的干燥全草,具有清热解毒、利尿消肿之功效,用于痈肿疔疮、蛇虫咬伤、臌胀水肿、湿热黄疽、湿疹湿疮等症[1],临床常用于支气管炎、支气管肺炎、呼吸道感染和婴儿腹泻等的治疗[2-4]。半边莲喜欢潮湿的环境,分布于我国长江中下游及以南各省区,别名细米草、急解索、半边花、蛇脷草、长虫草。近年来,有学者通过各种药理实验证实半边莲在抗肿瘤、调节内皮细胞、镇痛消炎、抑制α-葡萄糖苷酶、抗心肌缺血再灌注等方面具有显著作用,其应用于各种临床实践中取得了良好的治疗效果[5]。有研究[6-7]报道,半边莲的活性成分具有一定的抗癌作用,如何珊等[8]通过观察半边莲生物碱对U266细胞的体外增殖及细胞凋亡的影响,发现半边莲可能通过提高癌细胞胞内游离钙离子浓度而诱导癌细胞凋亡。
陕西省名中医、广西省名中医王三虎教授认为抗癌治疗症状的消除就是人体的阴阳趋于和谐的表现。王三虎教授认为“风为百病之长”,肿瘤的形成与六气息息相关,尤其是燥、湿,即燥湿相混是贯穿于某些癌症始终的矛盾[9],由此提出了“燥湿相混致癌论”,并以此理论指导使用利水药牵牛子治疗盆腔癌、前列腺癌及结肠癌、直肠癌,均取得良好疗效。因此,本研究基于“燥湿相混致癌说”,探讨利水消肿中药半边莲治疗癌症的作用。为了进一步探究中医学利用半边莲抗癌的物质基础并寻找可能的抑制肿瘤细胞生长的活性成分,本研究又对半边莲干燥全草进行了系统化学成分分离以及活性研究。现将研究结果报道如下。
1 材料与方法
1.1 试药半边莲(采于四川省雅安市),由广州中医药大学附属深圳市宝安中医院吴凡伟教授鉴定为桔梗科植物半边莲(Lobelia chinensisLour.)全草。
1.2 试剂与仪器反相材料RP-C18(美国Merck公司);MCI-GEL CHP-20P(三菱化学公司);柱层析硅胶、薄层层析硅胶(青岛海洋化工厂);凝胶材料Sephadex LH-20(GE保健生物科学);显色剂(5%硫酸乙醇溶液、5%香草醛浓硫酸溶液);半制备C18柱(Agilent SB-C18column 250 mm×9.4 mm,5 mm);有机溶剂(天津致远化学试剂有限公司)。RPIM-1640(上海立菲生物技术有限公司);10%胎牛血清(HyClone);四甲基偶氮唑盐(MTT)、顺铂(美国Sigma公司)。全自动旋光仪(Anton-Paar MCP 200);核磁共振仪(Bruker AV-400-Ⅲ和Bruker AV-500-Ⅲ);低分辨质谱仪(Agilent 1200 series LC-MS/MS system);高 分 辨 质 谱 仪(Shimadzu LCMS-IT-TOF);酶标仪(Thermo)。
1.3 提取与分离将干燥的半边莲全草(3 kg)粉碎后,过60目筛,用95%的乙醇(3×60 L)室温下浸提3次。所得浸提液合并减压浓缩后得其浸膏,浸膏混悬于1 L水中,再用乙酸乙酯(4×1 L)萃取,浓缩后得到乙酸乙酯部分浸膏(100 g)。乙酸乙酯部分浸膏用石油醚/乙酸乙酯(1∶0,10∶1,3∶1,1∶1,1∶4,0∶1)经由硅胶柱梯度洗脱,洗脱液经薄层板分析后,将表现相近的组分合并,共分离得到4个组分(A~D)。B组分(16 g)用二氯甲烷/甲醇(300∶1~30∶1)经由硅胶柱梯度洗脱得到3个部分(B1~B3)。B2部分(2 g)经由MCI柱,用甲醇/水(30%~100%)洗脱得到4个部分(B2a~B2d)。B2b部分(800 mg)再经过硅胶柱层析得到3个部分(B2b1~B2b3)。其中,B2b2通过高效液相色谱(HPLC)分离得到2个化合物——化合物1(15 mg)、化合物2(10 mg)。B1组分经由RP-C18柱(甲醇/水,40%~90%,v/v)得到3个亚组分(B1a1~B1a3)。B1a3部分通过硅胶柱(石油醚/乙酸乙酯,20∶1~1∶1)分离得到化合物6(12 mg)。B1a2部分通过HPLC分离得到化合物3(8.5 mg)。C组分(1.6 g)用二氯甲烷/乙酸乙酯(200∶1~1∶1)经硅胶柱梯度洗脱得到3个组分(C1~C3)。C1部分经RPC18柱(甲醇/水,50%~100%,v/v)得到4个部分(C1a~C1d)。C1b部分在二氯甲烷/甲醇(1∶1)体系中重结晶得到化合物4(100 mg),剩余部分经硅胶柱(环己烷/乙酸乙酯,4∶1~1∶1)纯化得到化合物5(15 mg)。
1.4 化合物抑制癌细胞增殖活性的筛选人乳腺癌细胞MCF-7由中山大学微生物与生化制药研究室提供;人胃癌细胞MGC-803购自美国保藏中心ATCC。以顺铂作为阳性对照,采用MTT法[10-11]对半边莲中分离得到的6个化合物,应用MCF-7和MGC-803细胞模型进行抗癌活性评价。用RPMI-1640、10%胎牛血清、1%的双抗所配的培养基于37℃、5%CO2的恒温培养箱中孵育。96孔板种板前,对细胞计数,每孔2 000~4 000个细胞,每孔100 μL培养基,孵育1 d后,加药。其中,空白对照组为培养基,阴性对照组为不加药处理的细胞,加顺铂处理作为阳性对照组。48 h后,加入用磷酸盐缓冲液(PBS)配制好的5 mg/mL的MTT 20 μL处理4 h,再弃去培养基,每孔加入120 μL DMSO,振荡10 min,最后用酶标仪测定其在492 nm波长处的吸光度(OD)值。根据OD值计算出各药物浓度对细胞的抑制率,通过GraphPad Prism软件,采用非线性回归计算出各化合物的半数抑制浓度(IC50)值[12]。
2 结果
2.1 提取物结构鉴定化合物1为白色固体,C20H22O6,ESI-MS:m/z359[M+H]+;1H NMR(400 MHz,CDCl3)δH7.53(1H,d,J=8.4 Hz),7.21(1H,d,J=7.8 Hz),7.01(1H,d,J=1.8 Hz),6.95(1H,dd,J=7.8,1.8 Hz),6.78(1H,d,J=1.8 Hz),6.69(1H,dd,J=8.4,1.8 Hz),4.11(1H,t,J=8.4 Hz),3.87(1H,t,J=9.0 Hz),3.81(3H,s),3.77(3H,s),3.16(1H,dd,J=13.8,5.4 Hz),3.09(1H,dd,J=13.8,6.6 Hz),2.79(1H,ddd,J=9.0,6.6,5.4 Hz),2.73(1H,dd,J=13.8,5.4 Hz),2.62(1H,m),2.51(1H,dd,J=13.6,9.0 Hz);13C NMR(100 MHz,CDCl3)δC178.9(s,C-9),146.8(s,C-3),146.7(s,C-3’),144.7(s,C-4’),144.5(s,C-4),129.9(s,C-1),129.7(s,C-1’),122.2(d,C-6’),121.5(d,C-6),114.5(d,C-5’),114.2(d,C-5),111.6(d,C-2’),111.1(d,C-2),71.5(t,C-9’),56.0(q,OCH3),55.9(q,OCH3),46.7(d,C-8),41.1(d,C-8’),38.5(t,C-7’),34.7(t,C-7)。与文献研究[13]报道的Matairesinol一致,故结构鉴定为Matairesinol。见图1。
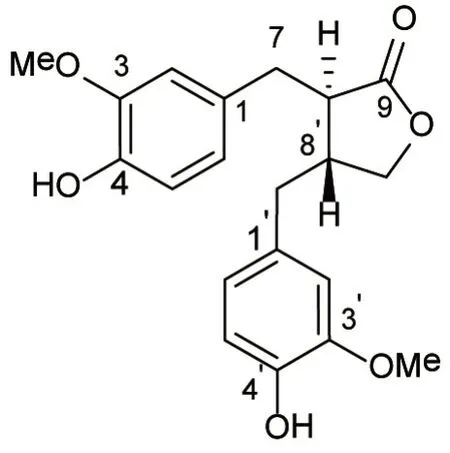
图1 化合物1的化学结构Figure 1 Chemical structure of compound 1
化合物2为白色固体,C21H26O6,ESI-MS:m/z375[M+H]+;1H NMR(400 MHz,CDCl3)δH6.79(1H,d,J=8.5 Hz,H-5),6.77(1H,d,J=8.5 Hz,H-5’),6.59(1H,dd,J=8.0,1.9 Hz,H-6),6.54(1H,dd,J=8.0,1.9 Hz,H-6’),6.50(1H,d,J=1.9 Hz,H-2),6.42(1H,d,J=1.9 Hz,H-2’),4.72(1H,d,J=1.5 Hz,H-9),4.02(1H,dd,J=8.6,7.1 Hz,H-9’a),3.80(3H,s,OMe),3.79(3H,s,OMe),3.65(1H,t,J=8.1 Hz,H-9’b),3.31(3H,s,H-9OMe),2.69(1H,dd,J=13.8,7.4 Hz,H-7a),2.54(2H,d,J=7.3 Hz),2.39(1H,dd,J=13.8,7.4 Hz,H-7’a),2.14(2H,m,H-8),2.14(2H,m);13C NMR(100 MHz,CDCl3)δC146.6(s,C-4’),146.5(s,C-4),144.1(s,C-3),143.9(s,C-3’),132.6(s,C-1’),131.7(s,C-1),121.7(d,C-6),121.3(d,C-6’),114.2(d,C-2’),114.1(d,C-5),111.2(d,C-2),111.1(d,C-5’),110.2(d,C-9),72.3(t,C-9’),55.8(q,OMe),54.9(q,C-9OMe),52.5(d,C-8’),45.9(d,C-8),39.4(t,C-7’),38.9(t,C-7)。与文献研究[14]报道的(8S,9S,8’S)-4,4’-Dihydroxy-3,3’,9-trimetoxy-9,9’-epoxylignan一致,故结构鉴定为(8S,9S,8’S)-4,4’-Dihydroxy-3,3’,9-trimetoxy-9,9’-epoxylignan。见图2。
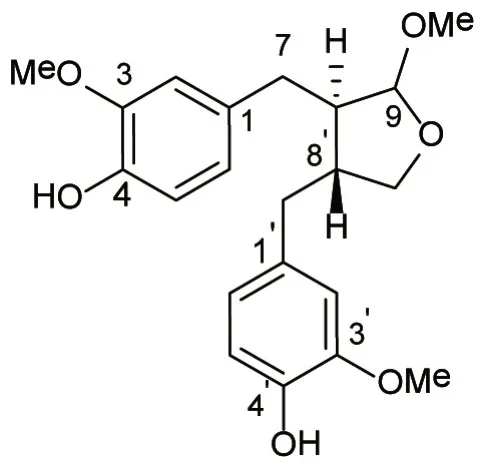
图2 化合物2的化学结构Figure 2 Chemical structure of compound 2
化合物3为白色固体粉末,C30H50O,ESI-MS:m/z427[M+H]+;1H NMR(400 MHz,CDCl3)δH4.68(2H,s,H-30),3.13(1H,dd,J=5.3,11.5 Hz,H-3),2.56(1H,m,H-21),1.85(1H,m,H-7a),1.73(1H,m,H-20a),1.65(3H,s,H-29),1.60(1H,m,H-2a),1.50(4H,m,H-2b,16a,19a,20b),1.42(1H,m,H-6a),1.36(2H,m,H-11a,16b),1.30(5H,m,H-1,12,17),1.24(2H,m,H-5,13),1.21(2H,m,H-15),1.20(5H,m,H-6b,7b,26),0.92(2H,m,H-11b,19b),0.88(3H,s,H-23),0.79(3H,s,H-25),0.77(3H,s,H-27),0.68(3H,s,H-28),0.60(3H,s,H-24);13C NMR(100 MHz,CDCl3)δC33.3(t,C-1),29.3(t,C-2),79.4(d,C-3),39.3(s,C-4),48.1(d,C-5),19.2(t,C-6),35.0(t,C-7),43.2(s,C-8),46.1(d,C-9),37.1(s,C-10),22.6(t,C-11),24.5(t,C-12),49.9(d,C-13),41.8(s,C-14),33.8(t,C-15),21.6(t,C-16),55.3(d,C-17),45.0(s,C-18),41.9(t,C-19),27.5(t,C-20),46.6(d,C-21),148.9(s,C-22),29.2(q,C-23),16.1(q,C-24),22.8(q,C-25),22.8(q,C-26),17.3(q,C-27),16.3(q,C-28),25.2(q,C-29),110.2(t,C-30)。以上波谱数据与相关文献研究[15]报道的3β-hydroxyhop-22(29)-ene基本一致,故鉴定化合物3为3β-hydroxyhop-22(29)-ene。见图3。
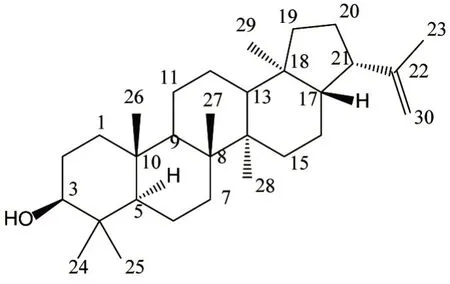
图3 化合物3的化学结构Figure 3 Chemical structure of compound 3
化合物4为黄色粉末,C16H12O5,ESI-MS:m/z285[M+H]+;1H NMR(400 MHz,CDCl3)δH12.29(1H,s,OH-1),12.19(1H,s,OH-11),7.61(1H,s,H-4),7.35(1H,d,J=2.5 Hz,H-8),7.06(1H,s,H-2),6.67(1H,d,J=2.5 Hz,H-10),3.92(3H,s,CH3O-9),2.43(3H,s,H-15);13C NMR(100 MHz,CDCl3)δC162.7(s,C-1),124.7(d,C-2),148.7(s,C-3),121.5(d,C-4),135.5(s,C-5),182.3(s,C-6),133.4(s,C-7),108.5(d,C-8),166.8(s,C-9),107.0(d,C-10),165.4(s,C-11),110.5(s,C-12),191.0(s,C-13),113.9(s,C-14),22.4(q,C-15),56.3(q,CH3O-9)。与文献研究[16]报道的化合物parietin一致,故结构鉴定为parietin。见图4。
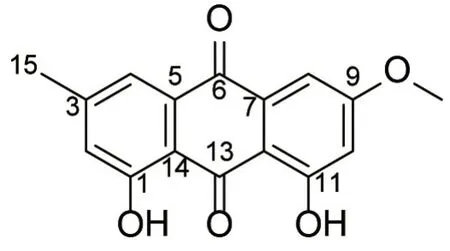
图4 化合物4的化学结构Figure 4 Chemical structure of compound 4
化合物5为黄色粉末,C15H10O4,ESI-MS:m/z255[M+H]+;1H NMR(400 MHz,CDCl3)δH 12.09(1H,s,OH-1),11.98(1H,s,OH-11),7.80(1H,dd,J=8.3,1.1 Hz,H-8),7.65(1H,br d,J=8.3 Hz,H-9),7.63(1H,br s,H-4),7.27(1H,d,J=8.3,1.1 Hz,H-10),7.06(1H,s,H-2),2.44(3H,s,H-15);13C NMR(100 MHz,CDCl3)δC162.9(s,C-1),124.8(d,C-2),149.6(s,C-3),121.6(d,C-4),133.9(s,C-5),182.2(s,C-6),133.5(s,C-7),120.2(d,C-8),137.2(d,C-9),124.6(d,C-10),162.6(s,C-11),114.0(s,C-12),192.08(s,C-13),116.1(s,C-14),22.5(q,C-15)。与文献研究[17]报道的化合物chrysophanol一致,故结构鉴定为chrysophanol。见图5。
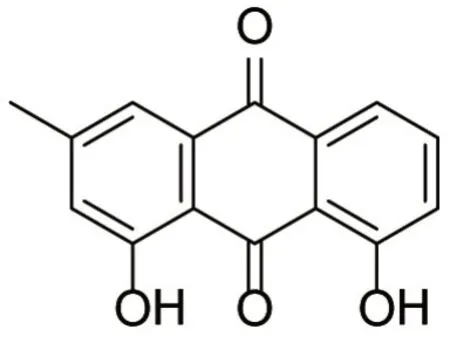
图5 化合物5的化学结构Figure 5 Chemical structure of compound 5
化合物6白色固体,C16H18O4,ESI-MS:m/z275[M+H]+;1H NMR(400 MHz,CDCl3)δH5.01(1H,d,J=17.5 Hz),4.85(1H,d,J=17.5 Hz),3.85(1H,d,J=11.5 Hz),3.47(1H,d,J=11.5 Hz),2.73(1H,m),2.47(1H,m),2.28(1H,m),1.90(1H,m),1.84(1H,m),1.70(1H,m),1.38(1H,m),1.30(1H,m),1.22(3H,s),0.82(3H,s);13C NMR(100 MHz,CDCl3)δC181.0(s,C-14),163.8(s,C-12),158.9(s,C-8),132.4(s,C-7),121.9(d,C-11),111.9(d,C-9),71.4(d,C-6),69.7(t,C-13),47.9(d,C-5),42.9(s,C-4),35.2(s,C-10),29.7(t,C-1),27.8(t,C-3),24.9(q,C-16),24.2(q,C-15),17.5(t,C-2)。与文献研究[18]报道的gaultheriadiolide一致,故结构鉴定为gaultheriadiolide。见图6。
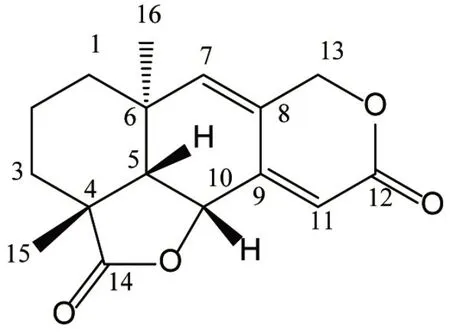
图6 化合物6的化学结构Figure 6 Chemical structure of compound 6
2.2 化合物抑制癌细胞增殖活性筛选结果结果如图7所示,在20 μmol/L浓度下,化合物1和2抑制MCF-7和MGC-803细胞增殖率大于50%。因此,继续对这2个化合物抑制细胞增殖的IC50进行测试。
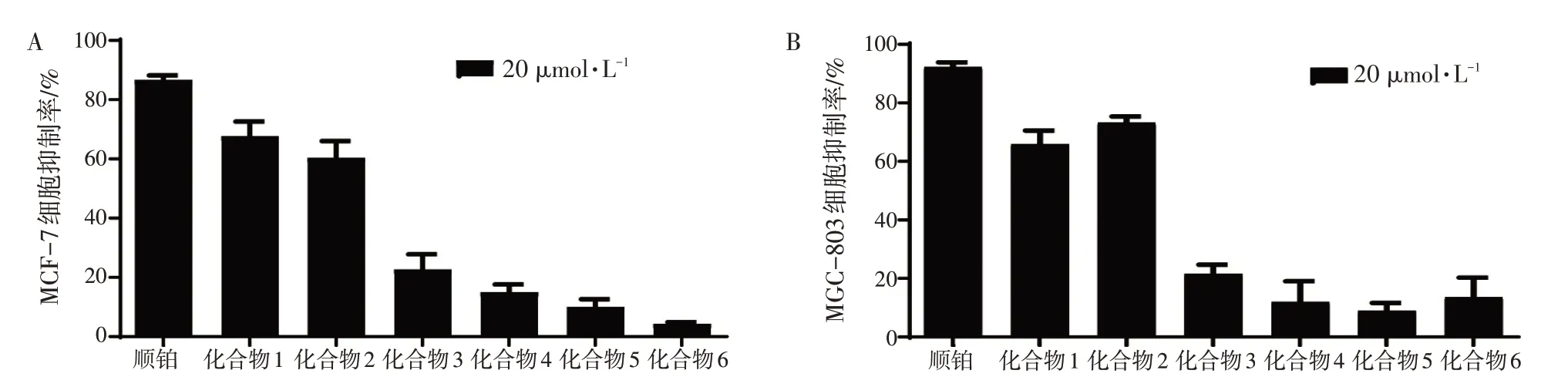
图7 半边莲中分离化合物(1~6)对MCF-7(A)和MGC-803(B)细胞的抑制活性Figure 7 The inhibitory activity of compounds(1-6)isolated from Lobelia on MCF-7 and MGC-803 cells
活性测试结果发现,化合物1、2具有显著的抑制乳腺癌细胞和胃癌细胞增殖活性,其IC50值如表1所示。
表1 半边莲中分离化合物1和化合物2对MCF-7和MGC-803细胞增殖活性的IC50值Table 1 The IC50 value of compound 1 and compound 2 isolated from Lobelia chinensis Lour.on the viability of MCF-7 and MGC-803 cells (±s)
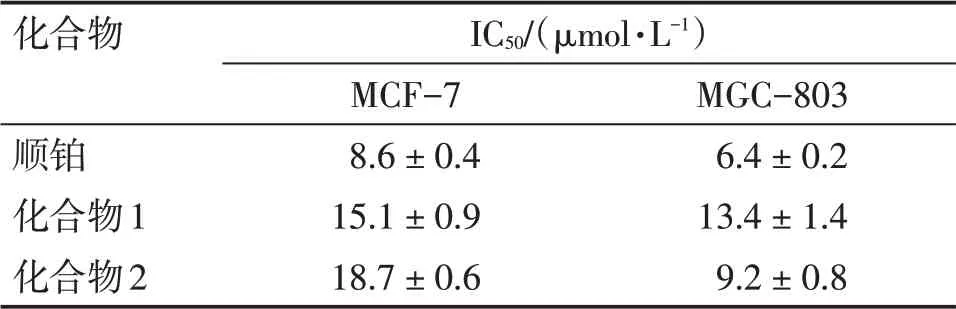
表1 半边莲中分离化合物1和化合物2对MCF-7和MGC-803细胞增殖活性的IC50值Table 1 The IC50 value of compound 1 and compound 2 isolated from Lobelia chinensis Lour.on the viability of MCF-7 and MGC-803 cells (±s)
化合物顺铂化合物1化合物2 IC50/(μmol·L-1)MCF-7 8.6±0.4 15.1±0.9 18.7±0.6 MGC-803 6.4±0.2 13.4±1.4 9.2±0.8
3 讨论
癌病是多种恶性肿瘤的总称,以脏腑组织发生异常增生为特征。中医学上称癌症为“癥瘕”“积聚”等,如《诸病源候论·卷之十九》曰:“积聚者,乃由阴阳不和,脏腑虚弱,受于风邪,搏于脏腑之气所为也。”肿瘤是严重威胁人类健康的重大疑难疾病之一,根据最新的全球肿瘤数据统计,2018年全球新增肿瘤病例1 810万,970万肿瘤患者死亡,2020年肿瘤成为人类健康的“头号杀手”[19]。中医药治疗肿瘤的历史悠久,据相关统计,服用中药治疗恶性肿瘤的患者有三分之二以上[20],因此,对抗肿瘤中药的再研究与开发具有重要的理论和现实意义。
本研究结果显示,从中药半边莲的乙醇提取物中分离鉴定了6个化合物,其中化合物1、2、6为木脂素类,化合物3为三萜类,化合物4、5为黄酮类。对分离得到的所有化合物进行癌细胞毒活性测试以评价其抗癌活性,发现化合物1、2具有潜在的抗胃癌和乳腺癌活性(浓度为20 μmol/L时,其抑制率大于50%),其中化合物2对MGC-803细胞增殖活性的IC50为9.2 μmol/L。
另外,本研究发现,中药半边莲发挥抗癌活性作用的可能为木脂素类化合物,初步阐明了半边莲抗癌活性的物质基础,为基于“燥湿相混致癌说”探究中药半边莲在治疗癌症的作用及物质基础提供了依据。
综上所述,通过对半边莲抗癌活性成分的深入研究,可以为低毒高效的抗癌新药研发提供实验依据。有关半边莲抗癌作用物质基础的研究仍有待进一步深入开展。
