基于内膜-肌层交界区细胞探讨少腹逐瘀汤对子宫腺肌病的镇痛作用
2022-02-14吴思宁谭雅文叶润英
吴思宁,谭雅文,叶润英
(1.广州中医药大学第二临床医学院,广东广州510006;2.广州中医药大学第二附属医院,广东广州510120)
子宫腺肌病(adenomyosis)是一种良性子宫疾病,病理表现为在距离子宫内膜和肌层之间的交界区2 mm以上的肌层内出现子宫内膜腺体[1],临床症状主要表现为子宫增大、痛经、异常子宫出血以及不孕不育。近年来,该病的发病率不断上升,且有年轻化的趋势,已逐渐成为妇科领域的研究热点。本课题组前期大量临床研究发现,中医药治疗在改善子宫腺肌病临床症状、调经助孕、控制病灶发展及降低复发率等方面具有显著优势,通过不断总结前辈经验[2-3],采用少腹逐瘀汤治疗子宫腺肌病引起的女性下腹痛获得了较好的临床疗效。本研究采用体外分离培养人子宫内膜-肌层交界区(EMI)平滑肌细胞,应用少腹逐瘀汤水提液进行干预,进一步探讨少腹逐瘀汤治疗子宫腺肌病的作用机制,以期为其临床应用治疗子宫腺肌病提供实验基础,现将研究结果报道如下。
1 材料与方法
1.1 标本选取收集2019年至2021年在广东省中医院妇科住院且拟行全宫切除的30~50岁非绝经期子宫腺肌病疼痛患者3例,疼痛视觉模拟量表(VAS)评分均大于7分,近半年未行激素类药物治疗。手术室无菌操作获取标本,切开子宫并刮除宫内膜,取内膜下厚约0.5 cm平滑肌层组织1块,约2 cm×2 cm,置于磷酸盐缓冲液(PBS)冰浴,0.5 h内送至实验室进行细胞原代培养。
1.2 药物及制备少腹逐瘀汤组成配比为当归∶川芎∶赤芍∶肉桂∶小茴香∶五灵脂∶没药∶蒲黄∶延胡索∶干姜=3∶1∶2∶1∶0.5∶2∶1∶3∶1∶1。以上中药材均购自康美药业。取同一批次药材并精准称量,煎煮2次:第1次加10倍量去离子水煎药2 h,第2次再加入8倍量去离子水煎药2 h。混合2次水提液,配制成100 mg/mL的母液,用0.22 μm滤过器过滤2次,分装成3 mL小样,-20℃保存。
1.3 主要试剂与仪器高糖DMEM培养基、胎牛血清、胰酶均购自美国Gibco公司;二甲基亚砜(DMSO)、四甲基偶氮唑盐(MTT)(美国Sigma公司);细胞鉴定试剂盒购自北京中杉金桥生物技术有限公司,其中包括细胞角蛋白(CK)抗体和波形蛋白(Vimentin)抗体;人平滑肌肌动蛋白抗体购自美国Abcam公司;血管内皮生长因子(VEGF)兔抗、白细胞介素6(IL-6)兔抗、神经生长因子(NGF)兔抗(北京Bioss公司);甘油醛-3-磷酸脱氢酶(GAPDH)小鼠单抗(上海康成公司);辣根过氧化物酶(HRP)标记的羊抗小鼠免疫球蛋白(IgG)抗体、HRP标记的羊抗兔IgG抗体、3,3’-二氨基联苯胺(DAB)显色试剂盒(武汉博士德公司);末端脱氧核苷酸转移酶介导的d UTP缺口末端标记(TUNEL)法试剂盒(瑞士Roche公司);雌二醇(E2)、前列腺素E2(PG-E2)、雌激素受体(ER)酶联免疫吸附分析(ELISA)试剂盒(武汉华美公司);二喹啉甲酸(BCA)蛋白定量分析试剂盒(上海博彩公司);Marker(美国Thermo Scientific Pierce公司)。DV300-1型显微镜、TS2光学显微镜(日本尼康公司);170-200P CO2培养箱(英国RS Biotech公司);JSY-SC-021H全自动细胞计数器(深圳博大博聚公司);Multiskan MK3型酶标仪(美国赛默飞世尔公司)。
1.4 EMI细胞原代培养、鉴定以及生长曲线绘制无菌操作下将获取的标本剪碎,消化、终止反应后离心取沉淀细胞,用含1%双抗、10%胎牛血清的DMEM培养基制成5×105个/mL的细胞悬液,分装于T-25培养瓶中。置于CO2培养箱培养24 h,换液,再次置于培养箱继续培养,2~3 d换液1次。待细胞融合率达到80%~90%,吸出培养液并用PBS洗净,用2.5 g/L胰蛋白酶消化、离心、取细胞沉淀。细胞沉淀分2批:一批冻存留种;另一批重新用T-25瓶培养,2~3 d换液1次,按照1∶3~1∶4比例传代。培养至达到实验要求,即可进行铺板和加药操作。其中,第1代细胞行细胞鉴定和生长曲线观察,第2~5代细胞用于实验操作。
取第1代细胞于24孔板爬片。细胞成功爬片后,PBS漂洗,用95%乙醇固定;PBS漂洗,0.5%TritonX-100室温处理;PBS漂洗,滴加一抗α-平滑肌蛋白(α-SMA)、CK(均稀释100倍),波形蛋白Vimentin(稀释200倍),空白对照组加PBS,4℃孵育过夜;PBS漂洗后再用3% H2O2室温封闭;PBS漂洗,滴加DAKO REALTMEnVisionTM/HRP(兔/小鼠)抗体,室温(25~27℃)孵育30 min;PBS洗3次,DAB底物工作液显色,镜下掌握显色程度;蒸馏水洗,苏木素轻度复染、饱和磷酸氢二钠分化;脱水、透明、封片、镜检,进行细胞鉴定。
取第1代和第3代细胞,用24孔板进行细胞铺板,于培养箱培养,每3 d换液1次。每天分别从第1代和第3代细胞铺板中分别抽取3个孔,应用细胞计数仪进行细胞计数,共10 d。绘制细胞生长曲线。
1.5 观察指标与方法
1.5.1 MTT法测定少腹逐瘀汤对EMI细胞的增殖抑制率待细胞培养达到实验的要求制备成悬液,以7 000个/孔、100 μL/孔的密度接种于96孔板,分4组(对照组,中药低、中、高浓度组),培养24 h后加入不含血清的高糖DMEM(基础培养液),置于培养箱中饥饿处理24 h;中药低、中、高浓度组分别加入10、20、40 g/L少腹逐瘀汤水提液(母液用无血清的DMEM配制),对照组加入基础培养液,继续培养24 h;轻缓吸走培养液,加入100 μL的MTT培养液(90 μL基础培养基+10 μL MTT母液5 mg/mL),放入培养箱中孵育4 h;再吸去培养基,加入150 μL DMSO,震荡10 min至结晶完全溶解,酶标仪测量各孔570 nm波长处吸光度(OD)值,并计算细胞增殖抑制率(%)。细胞增殖抑制率(%)=(对照组OD值-实验组OD值)/对照组OD值×100%。确定少腹逐瘀汤抑制EMI细胞增殖的最佳浓度,作为实验组,用于后续研究。
1.5.2 TUNEL法测定EMI细胞凋亡率取6孔板细胞爬片达70%~80%时,进行干预诱导(实验组加入含20 g/L浓度少腹逐瘀汤中药的基础培养液;对照组仅加入基础培养液)24 h后,用40 g/L多聚甲醛溶液固定30 min,PBS漂洗3次,制作细胞样本。用3%H2O2-甲醇溶液室温封闭,蒸馏水洗3次;滴加5%牛血清白蛋白(BSA)封闭液,室温静置20 min;用含0.1%TritonX-100的柠檬酸钠溶液冰上孵育爬片2 min;加TUNEL反应混合液(每45 μL标志液,加5 μL酶液)37℃染色1 h,PBS室温浸洗3次;加Converter-POD反应液室温孵育30 min后充分浸洗;镜下控制DAB显色程度;用去离子水冲洗终止反应,复染,脱水,封片,光学显微镜拍照并计数。
1.5.3 ELISA法检测E2、PG-E2和ER水平药物处理细胞24 h后,按照上述指标ELISA试剂盒说明书进行操作,分别测定OD值。其中,E2指标采用细胞上清液,PG-E2和ER指标采用细胞沉淀进行检测。
1.5.4 蛋白免疫印迹(Western Blot)法检测EMI细胞VEGF、IL-6、NGF蛋白表达各组细胞处理后,弃培养液,用冷PBS清洗3遍后,采用放射免疫沉淀分析(RIPA)冰上裂解30 min,4℃离心收集上清液,BCA法测定蛋白浓度;在配胶、灌胶后,上样、电泳、转膜,用TBST液洗膜2次,5%BSA封闭,摇床震动,4℃过夜;封闭后加入一抗(兔单克隆抗IL-6抗体以1∶1 000稀释,兔单克隆抗VEGF抗体以1∶1 000稀释,兔单克隆抗NGF抗体以1∶800稀释,小鼠单克隆抗GAPDH抗体以1∶1 000稀释),4℃静置过夜;洗涤后加入二抗(HRP羊抗兔IgG、HRP羊抗小鼠IgG,1∶10 000稀释)孵育1 h;洗膜,加入电化学发光(ECL)液显色、曝光、定影、拍照。采用SensiAnsys软件进行图像数据分析,测定目的条带灰度值。
1.6 统计方法采用SPSS 22.0统计软件分析数据。实验数据以均数±标准差(±s)表示。检验正态性及组间方差齐性:若满足正态性与方差齐性,比较同一样本多组间数据采用单因素方差分析,比较2组数据采用t检验;若不满足,则采用非参数秩和检验。以P<0.05为差异有统计学意义。
2 结果
2.1 人EMI病灶原代细胞培养与鉴定收集并成功培育人EMI病灶原代细胞,经免疫细胞化学法鉴定,结果见图1,可见CK、β-SMA、Vimentin蛋白呈阳性表达(示棕褐色染色)。肌成纤维细胞在子宫腺肌病的发展中起重要作用,主要表达CK和α-SMA;Vimentin蛋白主要存在于中胚层起源的细胞中,是间质细胞中重要的中间纤维。因此,图1中3种蛋白的阳性表达可证实体外培养的原代细胞为子宫腺肌病细胞。

图1 体外人内膜-肌层交界区(EMI)病灶原代细胞培养与鉴定结果Figure 1 Culture and identification results of primary cells in human EMI lesions in vitro
2.2 EMI细胞的生长曲线图2结果表明,第1代和第3代的细胞生长曲线基本相同,且第3代子EMI细胞的倍增速度比第1代快。两者经过1 d滞留期后开始繁殖,第2~7天均为生长期,其中第5~7天呈对数生长,第8天开始进入平台期,第9天达至相同细胞数。根据既往文献研究[4]及本研究实验观察,EMI细胞可原代培养并传代,10代内活力稳定,选择3~6代细胞作为实验模型最佳。细胞接种后4 h开始贴壁,培养24 h后可完全贴壁。
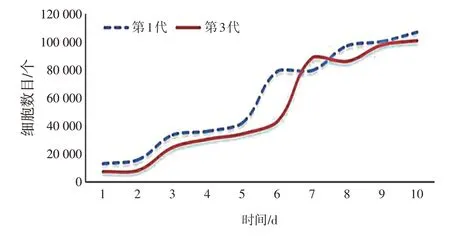
图2 体外人内膜-肌层交界区(EMI)细胞的生长曲线Figure 2 Growth curve of EMI cells
2.3 不同浓度少腹逐瘀汤对EMI细胞增殖的抑制情况与对照组比较,中药高、中、低浓度组EMI细胞增殖抑制率降低(P<0.05),其中,高、中浓度组效果更显著(P<0.05);中浓度组与高浓度组的抑制作用比较,差异无统计学意义(P>0.05)。具体结果见表1。
表1 各组体外人内膜-肌层交界区(EMI)细胞增殖抑制率比较Table 1 Comparison of the inhibition rate in human EMI cell proliferation in vitro among various groups(±s)
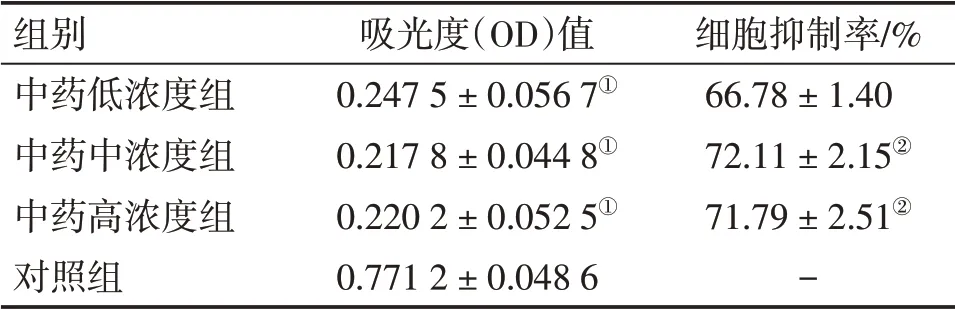
表1 各组体外人内膜-肌层交界区(EMI)细胞增殖抑制率比较Table 1 Comparison of the inhibition rate in human EMI cell proliferation in vitro among various groups(±s)
秩和检验:①P<0.05,与对照组比较;单因素检验:②P<0.05,与中药低浓度组比较
组别中药低浓度组中药中浓度组中药高浓度组对照组吸光度(OD)值0.247 5±0.056 7①0.217 8±0.044 8①0.220 2±0.052 5①0.771 2±0.048 6细胞抑制率/%66.78±1.40 72.11±2.15②71.79±2.51②-
2.4 少腹逐瘀汤对EMI细胞凋亡的影响对照组的EMI细胞核完整,细胞核未被明显褐染;少腹逐瘀汤中药干预的实验组EMI出现较多棕黄色染色的凋亡细胞,贴壁细胞数量减少,细胞凋亡率显著升高(P<0.01)。具体结果见表2、图3。
表2 2组体外人内膜-肌层交界区(EMI)细胞凋亡率比较Table 2 Comparison of the apoptosis rate of human EMI cells in vitro between the two groups(±s,n=3)

表2 2组体外人内膜-肌层交界区(EMI)细胞凋亡率比较Table 2 Comparison of the apoptosis rate of human EMI cells in vitro between the two groups(±s,n=3)
单样本t检验:①P<0.01,与对照组比较
组别实验组对照组细胞凋亡率/%13.58±0.91①5.13±0.58
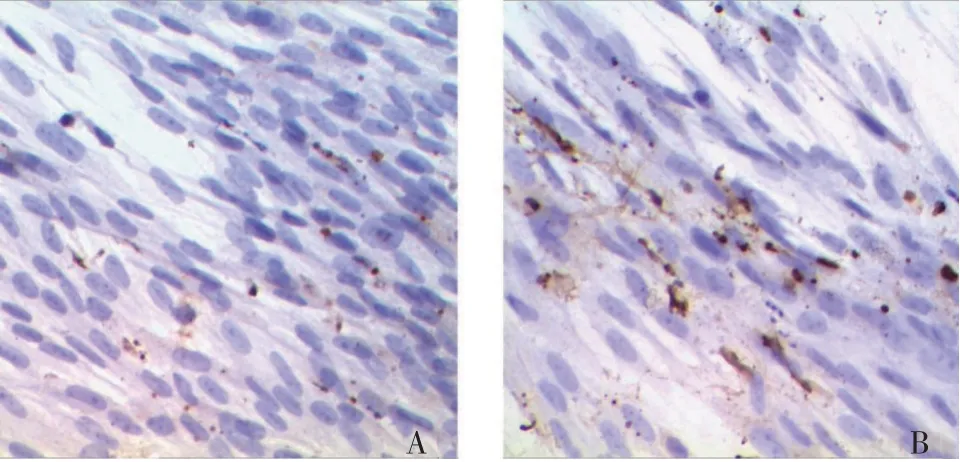
图3 2组体外人凋亡内膜-肌层交界区(EMI)细胞分布比较(TUNEL染色,×200)Figure 3 Comparison of the distribution of apoptotic humar EMI cells in vitro between the two groups(by TUNEL staining,×200)
2.5少腹逐瘀汤对EMI细胞中E2、PG-E2和ER表达的影响少腹逐瘀汤实验组的E2、PG-E2、ER含量均低于对照组(P<0.05或P<0.01)。结果见表3。
表3 2组体外人内膜-肌层交界区(EMI)细胞中E2、PG-E2、ER含量比较Table 3 Comparison of contents of E2,PG-E2 and ER in human EMI cells in vitro of the two groups(±s,pg·mL-1;n=3)

表3 2组体外人内膜-肌层交界区(EMI)细胞中E2、PG-E2、ER含量比较Table 3 Comparison of contents of E2,PG-E2 and ER in human EMI cells in vitro of the two groups(±s,pg·mL-1;n=3)
单因素检验:①P<0.05,②P<0.01,与对照组比较
组别实验组对照组E2 73.59±1.22②249.38±58.63 PG-E2 2.40±1.09②16.04±3.39 ER 6.29±2.06①11.01±1.39
2.6 少腹逐瘀汤对EMI细胞中IL-6、VEGF、NGF蛋白表达的影响图4结果显示,与对照组比较,实验组中少腹逐瘀汤处理后的EMI细胞中IL-6、VEGF蛋白表达均下降(P<0.01),而神经生长因子NGF虽亦表达减弱,但差异无统计学意义(P>0.05)。
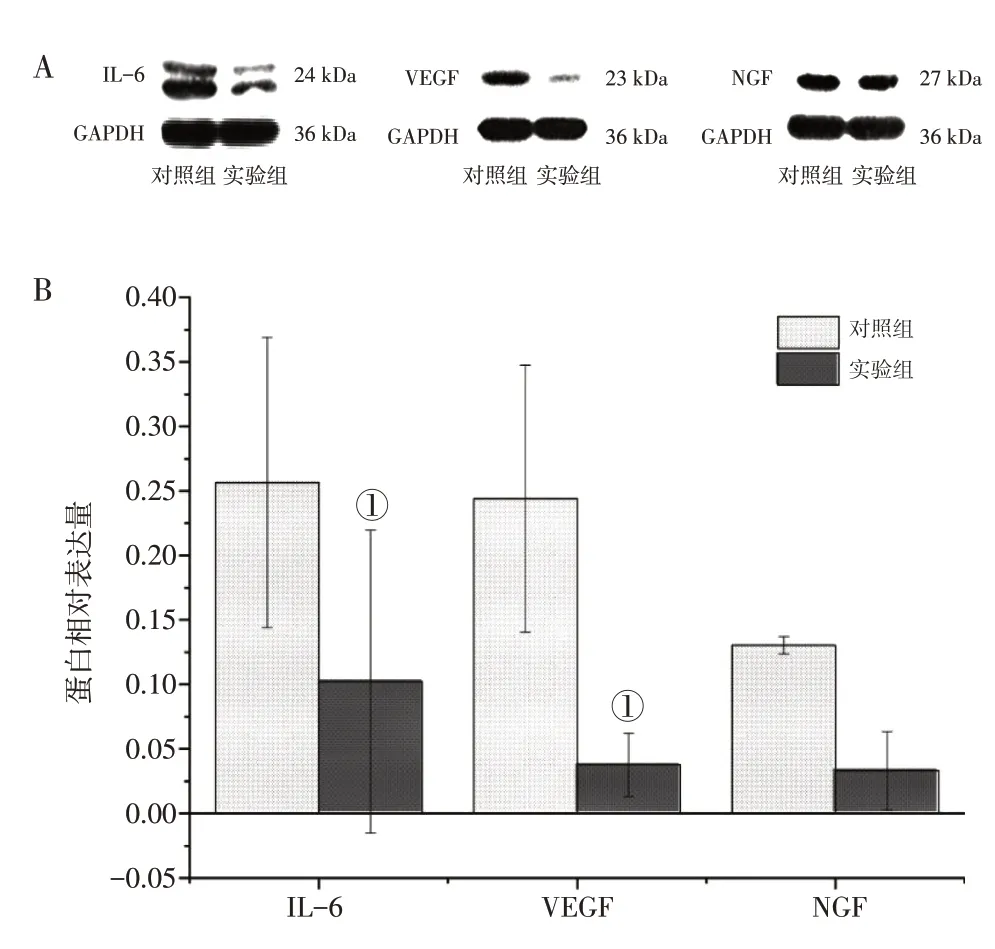
图4 2组体外人内膜-肌层交界区(EMI)细胞IL-6、VEGF、NGF蛋白表达比较Figure 4 Comparison of protein expression of IL-6,VEGF and NGF in human EMI cells in vitro between the two groups
3 讨论
子宫腺肌病根据其临床症状可归属于中医学“痛经”“癥瘕”等范畴,多是由于瘀血蓄积于胞宫、阻滞气血冲任所致。临床上,少腹逐瘀汤治疗子宫腺肌病引起的女性下腹痛疗效较佳[2-3],其在对症止痛之余还能从根本上弱化腺肌病,改善月经和生育。少腹逐瘀汤出自清代《医林改错》,由10味中药组成,方中当归、赤芍、川芎为君药,具有行气活血、养血调经之功效;五灵脂、蒲黄、延胡索、没药为臣药,具通利血脉、祛瘀止痛之功;小茴香、干姜、肉桂为佐药,温经散寒病引诸药直达少腹。全方共奏活血化瘀、温里散寒、散结止痛之效。现代研究也表明其有改善血液黏度、镇痛、消炎等作用[5-6]。本研究通过观察少腹逐瘀汤干预后EMI细胞的E2、PG-E2、ER、IL-6、VEGF、NGF水平的变化以及凋亡程度,初步探讨该药治疗子宫腺肌病的作用机制。
本研究采用体外原代培养人子宫腺肌病EMI平滑肌细胞,成功率为100%,为进一步开展分子学机制研究提供了重要基础。总结EMI细胞的培养经验如下:培养基2~3 d换1次液;细胞按1∶3~1∶4比例传代;10代内生存活力稳定,3~6代细胞活力最佳。
本研究结果显示,少腹逐瘀汤能够抑制EMI细胞的增殖,最佳作用浓度为20 g/L,少腹逐瘀汤干预后的EMI细胞凋亡率显著升高(P<0.01)。子宫腺肌病的异位内膜侵袭黏附能力强,导致子宫内膜与子宫肌层结合带异常,被认为是一种增殖性疾病,具备类肿瘤的生物特性。子宫腺肌病的发生发展,与细胞凋亡和增殖失衡有关[7]。本研究结果表明,少腹逐瘀汤可促进EMI细胞凋亡,同时促进EMI细胞增殖。
本研究结果还显示,少腹逐瘀汤能明显降低EMI细胞上清E2,EMI细胞PG-E2、ER的水平。子宫腺肌病是一种雌激素依赖性疾病,异位病灶上皮细胞内ER过表达促使异位组织在肌层内种植、生长、发展。基于正反馈机制,E2、PG-E2持续存在于病灶并不断增加,子宫合成前列腺素(PG)增加,是痛经的重要原因,且痛经的程度与EMI细胞的侵袭深度、血管增生有关[8]。说明子宫腺肌病通过E2与其受体结合激活基因效应及相关通路,同时在血管、炎症、神经等不同层面产生相应的生物效应,诱导疼痛发生。因此,推断少腹逐瘀汤通过抑制ER受体表达,同时下调E2、PG-E2水平,进而弱化子宫腺肌病并有效改善痛经。
为了进一步探讨少腹逐瘀汤镇痛的分子机制,本研究检测了EMI细胞相关致痛因子、炎症因子、血管生成因子的蛋白表达情况,结果显示,少腹逐瘀汤干预的EMI细胞IL-6、VEGF、NGF蛋白表达均显著下降,但NGF指标差异无统计学意义(P>0.05)。子宫腺肌病是一种慢性免疫炎性疾病,IL-6是子宫腺肌病炎症病理状态的主要细胞因子[9],子宫腺肌病疼痛程度与IL-6有关[10]。VEGF在子宫腺肌病异位、在位内膜中的高表达,提示局部血供丰富和新生血管形成与子宫腺肌病的发病及月经过多有关[11]。另外,有研究表明,子宫腺肌病在位内膜功能层和病灶中NGF的高表达与其痛经程度呈正相关[12]。还有临床研究表明,子宫腺肌病患者血清NGF水平明显升高,与痛经强度密切相关[13]。考虑本研究NGF的检测结果可能与样本量少、由于经费受限致购买的抗体不稳定等因素有关;也表明少腹逐瘀汤可以下调EMI细胞的NGF蛋白表达,但并不是其作用的关键途径之一。由于子宫腺肌病的发生发展与E2、ER、PG-E2及IL-6、VEGF关系密切,加之VEGF和PG-E2均有促血管生成,IL-6有促炎反应作用,故推断少腹逐瘀汤抑制子宫腺肌病EMI细胞主要与抑制雌激素分泌、血管生成、减轻炎症反应相关。
综上所述,少腹逐瘀汤可有效促进人EMI细胞凋亡,抑制EMI细胞的增殖,其可能是通过减少雌激素、血管生成因子、炎症因子的表达,最终改善子宫腺肌病的痛经程度,体现了其中医“活血化瘀止痛”功效的特点。
