异常凝血酶原对肝癌合并门静脉癌栓的预测价值
2022-02-13童敬澍马浙平毛书奇卢长江陆才德
童敬澍,马浙平,毛书奇,卢长江,陆才德
(宁波大学附属李惠利医院 肝胆胰外科,浙江 宁波 315040)
肝细胞癌(hepatocellular carcinoma,HCC)是目前世界上第五大常见的恶性肿瘤,全球每年新增HCC近70 万人,其中50%发生在我国,其病死率在我国恶性肿瘤中位列第二[1]。门静脉癌栓(portal vein tumor thrombosis,PVTT)作为HCC最常见的并发症之一,是引起HCC患者肝功能减退、门静脉高压、肿瘤转移复发的重要原因,伴有PVTT的HCC患者自然病程仅为3个月,预后较差[2]。异常凝血酶原(protein induced by vitamin K absence or antagonist-II,PIVKA-II)是在肝癌细胞中,因凝血酶原前体羧化不足产生的蛋白质。研究发现PIVKA-II在HCC的增殖、血管浸润和转移过程中发挥作用,并与微血管侵犯(MVI)独立相关[3]。然而PIVKA-II与PVTT大血管的关系尚不明确,本研究旨在探究PIVKA-II与PVTT的关系,及其在HCC患者发生PVTT的预测价值。
1 资料和方法
1.1 一般资料
回顾性收集自2019年9月至2020年12月宁波大学附属李惠利医院肝胆胰外科收治的206例HCC患者临床资料,按照纳入排除标准,最终有191例患者纳入本研究,如图1。纳入标准:(1)依据《原发性肝癌诊疗规范(2019年版)》[4]确诊为HCC;(2)于我院行一次及以上腹部增强CT或MRI平扫,并且行一次及以上血清PIVKA-II、D-二聚体、AFP、AFP-L3、血常规、生化全套检测。排除标准:(1)合并其他恶性肿瘤;(2)行HCC根治术后肿瘤复发;(3)伴其他全身严重疾病;(4)长期服用华法林、维生素K及其拮抗剂。本研究通过医院伦理委员会审批(审批号:KY2020PJ125)。
1.2 PVTT诊断和分型评估
本组HCC患者的PVTT通过腹部增强CT或MRI诊断,所有影像资料均由两位及以上具有副高以上年资的影像科医师判读。PVTT的分型按照程氏分型标准:I型,癌栓侵及肝叶或肝段的门静脉分支;II型,癌栓侵及门静脉左或右支;III型,癌栓侵及门静脉主干;IV型,癌栓侵犯及肠系膜上静脉[5]。
1.3 分组和内部验证方法
为研究PIVKA-II对HCC患者发生PVTT的预测价值并确定其最佳截断值,本研究采用队列内部验证方法,即所有HCC患者按照3∶2的比例随机分为试验组和验证组,在试验组中计算PIVKA-II和D-二聚体的最佳截断值,并在验证组中验证其预测PVTT的价值,见图1。

图1 分组方法及设计思路示意图
1.4 检验仪器与标本处理
使用μTASWako i30全自动电泳荧光免疫分析仪(日本)及配套检测试剂盒(富士胶片和光纯药株式会社)检测所有HCC患者的血清PIVKA-II、甲胎蛋白(AFP)、甲胎蛋白异质体(AFP-L3);其余相关血液指标包括白蛋白(ALB)、谷丙转氨酶(ALT)、谷草转氨酶(AST)、碱性磷酸酶(ALP)、谷氨酰转肽酶(GGT)、总胆红素(TBIL)、凝血酶原时间(PT)、凝血功能国际标准化比值(INR)。所需的血液标本均在HCC患者进行手术、介入或化疗前空腹时采集,并经过3 500 r/min离心10 min分离血清,且在2 h内完成各指标检验。
1.5 统计学分析
采用SPSS 23.0软件进行分析:各数据正态性采用Kolmogorov-Smirnov法检验,符合正态分布的计量资料采用()表示,组间比较采用t检验;非正态分布的计量资料采用M(P25,P75)表示,组间比较采用Mann-WhitneyU检验;计数资料组间比较采用χ2检验。采用受试者工作特征曲线(receiver operation curve,ROC)评估PIVKA-II和D-二聚体对HCC患者发生PVTT的预测价值并计算其最佳截断值。采用Logistic回归分析HCC患者发生PVTT的危险因素。采用Spearman等级相关检验分析PIVKA-II与PVTT程氏分型等级的相关性。P<0.05表示差异有统计学意义。
2 结果
2.1 试验组和验证组的基线资料
试验组和验证组之间基线特征差异无统计学意义(P<0.05),见表1。

表1 试验组和验证组的基线资料及比较
2.2 试验组和验证组内有PVTT与无PVTT之间比较分析
分别比较两组临床资料,伴有PVTT 的患者PIVKA-II、AFP、AFP-L3、D-二聚体水平高于无PVTT的患者,差异有统计学意义(表2,图2)。

图2 试验组和验证组有PVTT与无PVTT之间PIVKA-II的差异比较
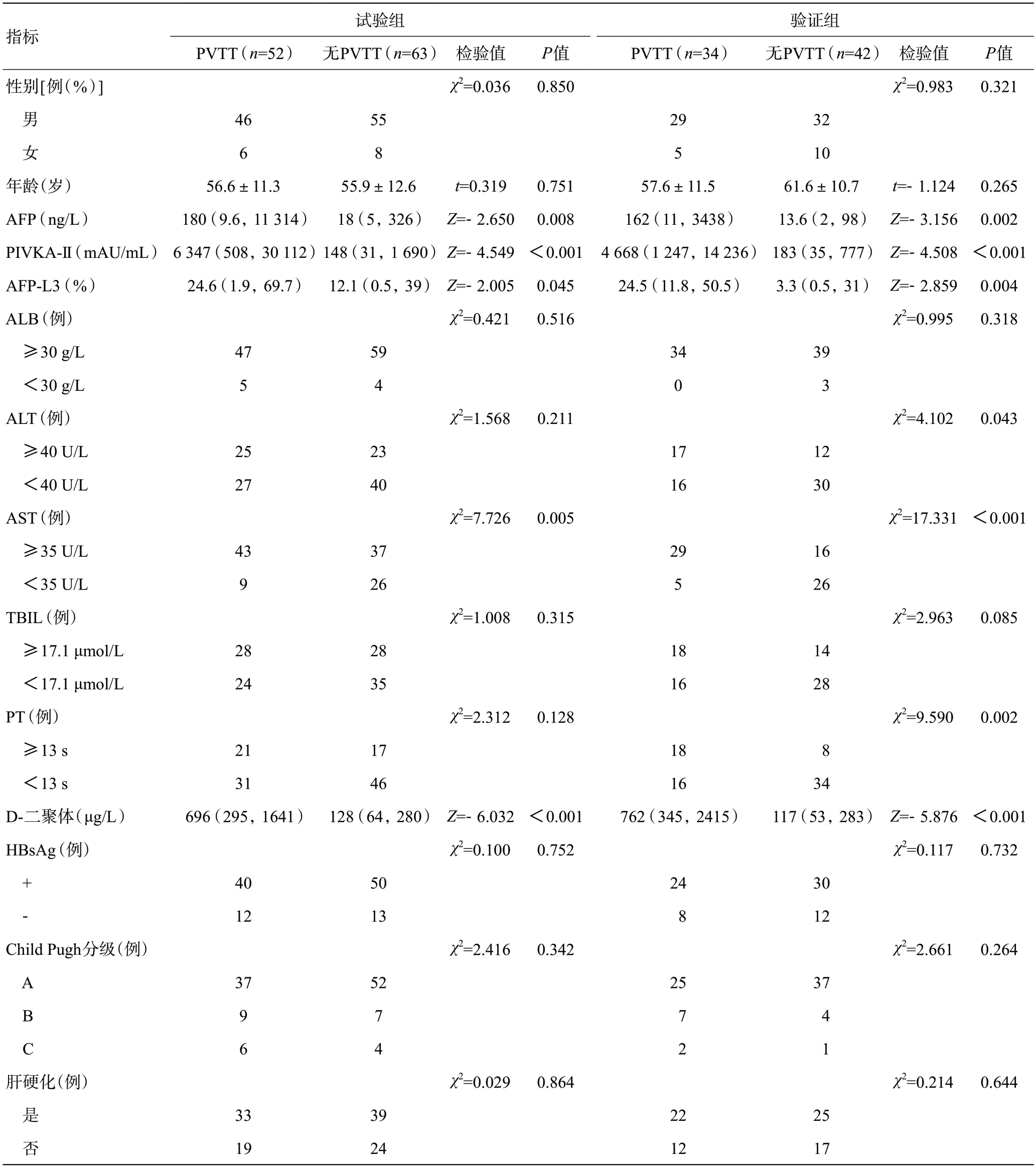
表2 试验组和验证组内伴有PVTT与无PVTT之间临床资料比较
2.3 试验组中研究PIVKA-II和D-二聚体对HCC患者发生PVTT的预测价值并确定其最佳截断值
在试验组HCC 患者中,绘制ROC 曲线研究PIVKA-II和D-二聚体对合并PVTT的预测价值(图3)。PIVKA-II的ROC曲线下面积为0.747(95%CI0.652~0.842,P<0.001),PIVKA-II预测HCC患者发生PVTT的最佳截断值为426.5 mAU/mL,敏感度为78.8%,特异度为69.8%;D-二聚体ROC曲线下面积为0.828(95%CI0.751~0.904,P<0.001),D-二聚体预测HCC患者发生PVTT的最佳截断值为286 μg/L,敏感度为78.8%,特异度为77.8%;PIVKA-II与D-二聚体两者联合检测的ROC曲线下面积为0.861(95%CI0.791~0.932,P<0.001),在PIVKA-II与D-二聚体各自最佳截断值下,两者联合预测HCC患者发生PVTT的敏感度为90.4%,特异度为57.1%。两者联合预测发生PVTT的敏感度较单一指标均有所提高,但特异度下降。

图3 试验组中PIVKA-II和D-二聚体对HCC患者发生PVTT的预测价值
2.4 验证组中验证PIVKA-II和D-二聚体对HCC患者发生PVTT的预测价值并验证其最佳截断值
为验证PIVKA-II和D-二聚体对HCC患者发生PVTT的预测价值并验证其上述最佳截断值,在验证组中通过绘制ROC曲线验证。PIVKA-II的验证组ROC曲线下面积为0.802(95%CI0.693~0.911,P<0.001),将PIVKA-II以试验组中确定的426.5 mAU/mL为界,其预测HCC 患者发生PVTT 的敏感度为79.4%,特异度为69.0%;D-二聚体的验证组ROC曲线下面积为0.894(95%CI0.825~0.963,P<0.001),将D-二聚体以试验组中确定的286 μg/L为界,其预测HCC患者发生PVTT的敏感度为88.2%,特异度为76.2%;在各自最佳截断值下,两者联合预测发生PVTT的敏感度为94.5%,特异度为57.1%,两者联合检测来预测PVTT的敏感度较单独检测有所提高。
2.5 HCC患者发生合并PVTT的危险因素分析
将本研究中伴有PVTT的HCC患者与无PVTT的HCC患者对比,单因素分析显示:PIVKA-II≥426.5 mAU/mL、AFP≥20 ng/L、AFP-L3 ≥10%、ALB≥30 g/L、ALT≥40 U/L、D-二聚体≥286 μg/L是发生PVTT的独立危险因素;多因素分析显示,PIVKA-II≥426.5 mAU/mL、D-二聚体≥286 μg/L是HCC患者发生PVTT的独立危险因素,见表3。

表3 HCC患者发生PVTT的单因素、多因素分析
2.6 合并PVTT的HCC患者血清PIVKA-II水平与PVTT的程氏分型等级呈线性相关
本研究共86 例伴有PVTT的HCC患者中,患者PVTT分型等级越高,其血清PIVKA-II水平也相应增高,两者呈线性相关(相关系数=0.400,P<0.001),见图4。

图4 PIVKA-II水平与PVTT的程氏分型等级关系
3 讨论
由于肝脏解剖特点和HCC生物学特性,HCC极易侵犯肝血管系统,包括门静脉主干分支的大血管和肝段以上的小血管系统。PVTT是HCC常见的大血管侵犯形式,其发生率在HCC患者中占40%以上,发生PVTT的HCC患者预后极差[6],及时诊断或预测PVTT是改善HCC患者预后的重点。本研究重点探究PIVKA-II与HCC患者发生PVTT的关系,研究发现,即使是在PIVKA-II水平普遍升高的HCC患者中,PVTT患者与无PVTT患者之间的PIVKA-II水平差异仍有统计学差异,虽然这种差异也体现在AFP和AFP-L3 上,但多因素分析显示仅PIVKA-II的差异有意义,这表明不仅是肿瘤本身,而且是PVTT与PIVKA-II的内在关联引起的PVTT患者PIVKA-II升高。目前关于PIVKA-II与血管侵犯的研究表明,PIVKA-II通过与生长因子受体c-Met结合并激活蛋白酪氨酸激酶1(JAK1)、VEGF、表皮生长因子受体(EGFR)等一系列下游信号通路,诱导HCC增殖和血管浸润,并导致MVI[7-8]。因此,用PIVKA-II预测PVTT具备理论基础,但其深入的内在相关肿瘤生物学机制仍待进一步研究。
PIVKA-II作为HCC的新一代肿瘤标志物,其优势正在逐步体现。临床上将PIVKA-II≥40 mAU/mL作为诊断HCC的标准,但尚无诊断或预测PVTT的标准。本研究发现PIVKA-II≥426.5 mAU/mL是HCC患者发生PVTT的独立危险因素,并且用该标准预测PVTT的灵敏度达78.8%。目前PVTT的诊断主要依靠CT、MRI等影像学检查,但由于影像学检查只能检测到肝叶门静脉分支以下的大血管PVTT,对于肝段及以上更细小的门静脉分支PVTT只能根据显微镜下的病理学检查,此外影像学检查普遍具有费用昂贵、易漏诊误诊等自身局限性,其诊断PVTT的敏感度仅在70%左右[9],因此用PIVKA-II来协助诊断或预测PVTT具有临床价值。早在2007年,我国的程树群教授首次提出了PVTT的程氏分型,并为之后PVTT的相关研究奠定基础,目前临床上根据HCC患者的肿瘤和PVTT的大小、位置情况,采取对应的个性化治疗,如根治性手术、经肝动脉化疗栓塞(TACE)、射频消融、放疗、免疫靶向治疗等[10],因此精准、有效、及时地评估HCC患者的PVTT情况十分重要。本研究发现,PIVKA-II的升高程度与PVTT程氏分型等级存在线性相关,提示PIVKA-II越显著升高的HCC患者,更需谨慎评估治疗PVTT,以减少相关并发症,改善患者预后。
国外的一项大样本回顾性研究表明,AFP≥20 000 ng/mL是诊断HCC合并PVTT的截断值,但其敏感度仅为24%,诊断效能并不理想[11]。HCC新型标志物miRNA的图谱研究表明,虽然miRNA可以提示HCC的静脉侵犯,但miRNA并不能诊断或预测PVTT的发生[12]。目前尚无诊断PVTT的特定肿瘤标记物,本研究从PIVKA-II的理论基础出发,研究PIVKA-II对PVTT的预测价值,旨在填补这一空缺。此外本研究发现作为反应血液高凝状态指标的D-二聚体也是PVTT形成的独立危险因素,可以与PIVKA-II联合预测PVTT。对于这一现象研究者认为,在PVTT形成过程中,门静脉局部血液呈高凝状态,从而引起D-二聚体的反应性升高。PIVKAII联合D-二聚体可以将预测PVTT的敏感度提高至90.4%,但特异度降至57.1%,考虑到延误诊治PVTT将导致不良后果,敏感度比特异度更为重要,应尽量提高预测PVTT的敏感度。因此,即便目前尚缺乏支持D-二聚体预测PVTT的理论依据,仍可将D-二聚体作为联合预测PVTT的补充指标,国外一项回顾性研究表明PIVKA-II、D-二聚体与PVTT相关联(以PIVKA-II≥221.3 mAU/mL为界,灵敏度为83.7%),其结果也支持本研究的结论[13]。
为确定PIVKA-II预测PVTT的最佳截断值并减少统计偏倚,本研究采取随机分组的内部验证思路方法,即先在试验组中计算得PIVKA-II ≥426.5 mAU/mL是预测PVTT的最佳截断值,并在验证组中验证其灵敏度为79.4%,证明该截断值的可靠性。该方法在类似研究中主要采取外部验证,但外部验证在本研究中并不适用,一是由于样本量的限制,二是由于本研究主要探讨PIVKA-II而非多种变量。研究者在表1 中将试验组和验证组的基线资料进行对比,以增加本研究随机分组内部验证的科学性。本研究为单中心回顾性研究,存在局限性,相关结果仍需多中心、大样本随机对照、外部验证进一步研究。
综上所述,HCC患者PIVKA-II≥426.5 mAU/mL是发生PVTT的独立危险因素,PIVKA-II具有良好的预测PVTT的价值。
