脂氧素A4对脑缺血-再灌注损伤模型大鼠Caspase-1活性的抑制作用*
2022-02-13吴乐武强陈勇
吴乐,武强,陈勇
[泰康同济(武汉)医院1.神经内科;2.急诊医学科,武汉 430050]
缺血性脑卒中是导致人类死亡的第二大疾病,也是导致终身残疾的首要原因[1]。早期恢复脑血流再灌注是治疗缺血性脑卒中的重要方法,但可能导致缺血-再灌注(ischemia/ reperfusion,I/R)损伤,进一步加重脑损伤。炎症反应是导致脑I/R损伤的重要因素,而神经炎症与继发性神经元死亡密切相关。细胞质炎性体复合物激活被认为是神经炎症的必要步骤,也是神经元焦亡的一个重要触发因素[2]。笔者以往的研究表明,脂氧素A4(lipoxin A4,LXA4)抑制核苷酸结合寡聚化结构域样受体3(NOD like receptor protein 3,NLRP3)炎性体可能是其抗I/R损伤的机制之一[3]。NLRP3炎性体是激活天冬氨酸蛋白水解酶1(cysteinyl aspartate-specific proteases 1,Caspase-1)的分子平台,当内源性或外源性因素激活NLRP3炎性体后,细胞内招募无活性的半胱天冬氨酸蛋白酶-1前体(protease cysteine aspartate-specific protease-1,pro-caspase-1),无活性的pro-caspase-1酶原水解,产生p20和p10两个亚基,组合成四聚体,最终形成有活性的Caspase-1[4]。因此,笔者在本研究拟观察LXA4对大鼠大脑中动脉闭塞再灌注(middle cerebral artery occlusion/reperfusion,MCAO/R)模型缺血脑皮层周边区Caspase-1活性的影响,进一步探讨LXA4抗脑I/R损伤的机制。
1 材料与方法
1.1实验动物 清洁级健康SD雄性大鼠24只,体质量250~280 g,购自华中科技大学同济医学院实验动物学部,实验动物生产许可证号:SCXK(鄂)2010-0007。适应性喂养 7 d,饲养温度(20±2)℃,相对湿度(50±10)%,实验前动物禁食 12 h,自由饮水。
1.2试剂及试剂盒 LXA4(美国Cayman Chemical公司,批号:90410),2,3,5-氯化三苯基四氮唑(TTC,美国Sigma公司,批号:T8877),兔抗Caspase-1 p20(德国Merck Millipore公司,批号:ZRB1233),二抗(羊抗兔和羊抗鼠)(武汉Boster公司,批号:BA1056),Caspase-1活性检测试剂盒(上海碧云天生物技术有限公司,批号:C1102),大鼠白细胞介素1β(IL-1β)和大鼠IL-18酶联免疫吸附测定(ELISA)试剂盒(伊莱瑞特生物科技有限公司,批号分别为E-EL-R0012c,E-EL-R0567c)。
1.3实验分组、造模及给药 雄性大鼠24只,按数字随机分为假手术组、模型对照组、LXA4组,每组8只。假手术组:假手术大鼠侧脑室注射0.9%氯化钠溶液5 μL;模型对照组:大鼠接受2 h的MCAO和24 h再灌注,并侧脑室注射0.9%氯化钠溶液5 μL;LXA4组,大鼠接受2 h的MCAO和24 h再灌注,并侧脑室注射LXA4(0.2 mmol·L-1)5 μL,剂量参照SOBRADO等[5]研究。MCAO手术操作依据LONGA等[6]方法,缺血2 h后小心拔出栓线约10 mm,即形成再灌注,保持再灌注24 h。手术过程、缺血期及再灌注后2 h体温保持在(37.0±0.5) ℃。大鼠麻醉清醒后出现左侧肢体肌力下降并屈曲,站立不稳,提尾时向一侧转圈或行走时向左侧转圈为模型成功的判断标准。假手术组大鼠只是不插入鱼线,其余步骤同模型组。MCAO操作完成后立即进行侧脑室注射,采用江湾Ⅱ型立体定位仪,以前囱为基点,按照坐标调整位置(前后0.8 mm,侧方1.5 mm,背腹3.8 mm)。并用牙钻钻开颅骨,进行侧脑室注射,深4.5 mm,注射速度2 μL·min-1,注射完毕后留针1~2 min。
1.4观察指标
1.4.1检测大鼠脑梗死体积 采用TTC染色法检测各组大鼠脑梗死体积,大鼠缺血再灌注24 h后,给予10%水合氯醛腹腔注射麻醉大鼠,处死并取脑,将新鲜脑组织置于-20 ℃冰箱中冷冻15 min。大脑以额极与视交叉连线中点处为起点,切5片脑组织,厚度为2 mm。将脑组织切片置于2%TTC溶液避光,放入37 ℃温箱30 min。然后将脑组织切片置入10%甲醛溶液浸泡过夜。剩余脑组织继续切片,取梗死侧缺血脑组织,-70 ℃冰箱中冷冻,生化实验备用。数码相机摄像,图像分析软件(Image J software,NIH Image,Version 1.61,Bethesda,USA)计算脑梗死灶面积,依据公式计算脑梗死灶体积。为了排除脑水肿的干扰作用,校正的脑梗死灶面积计算公式如下:校正的脑梗死灶面积=测量梗死面积×{1-[(同侧半球面积-对侧半球面积)/对侧半球]}。根据公式V=t(A1+…An)-t(A1+…An)/2计算梗死体积,t为切片厚度,A为梗死面积[7]。
1.4.2检测大鼠神经行为学评分 大鼠神经功能评分以HUNTER等[8]5分制法进行评分。具体标准如下,0分:无神经损伤症状;1分:不能完全伸展对侧前爪;2分:提起尾巴时,对侧前爪握力下降;3分:自发性旋转及向对侧倾倒;4分:没有自发运动活动;5分:对刺激无反应。神经功能评分越高,表明大鼠神经损伤越严重。
1.4.3检测大鼠缺血脑皮层Caspase-1 p20的蛋白水平 采用Western blotting免疫印迹法检测各组Caspase-1 p20的蛋白水平,取少量缺血脑皮层,称定质量,置于匀浆器中,并加入1:100的体积比PMSF,按1 mg脑组织/9 μL匀浆液的比例加入匀浆器开始匀浆,匀浆完毕后将其移入1.5 mL EP管中,冰上静置30 min裂解。于4 ℃下20 000×g离心20 min,收集上清液,按照体积比为1:5加入上样缓冲液,置于100 ℃沸水煮10 min,使蛋白变性,并用BCA蛋白定量法测定各组蛋白浓度,计算上样量,保持各组上样蛋白质量的一致。进行10%十二烷基硫酸钠-聚丙烯酰胺凝胶电泳(sodium dodecyl sulfate polyacrylamide gel electrophoresis,SDS-PAGE)凝胶电泳,100V恒压转膜1.5 h,转膜后的NC膜用50 g·L-1脱脂奶粉缓冲封闭液封闭1 h,加一抗4 ℃孵育过夜,一抗为兔抗Caspase-1 p20(1:200),鼠抗β-actin(1:400)。之后洗膜15 min×3,二抗37 ℃孵育1 h,二抗为辣根过氧化酶标记的羊抗兔,羊抗鼠(1:10 000)。然后洗膜15 min×3,洗去未结合的二抗,用增强化学发光试剂(ECL)洗片,暗室曝光胶片。测定条带反应灰度值,以β-actin为内参计算相对值,每组实验重复6次进行统计学分析。
1.4.4检测大鼠缺血脑皮层Caspase-1活性 脑组织匀浆同“1.4.3”项,然后把匀浆液转移到1.5 mL EP管中,冰浴再裂解5 min。于4 ℃下20 000×g离心10~15 min,把上清液转移到冰浴预冷的离心管中,立即测定Caspase-1的酶活性。按照试剂盒步骤操作,一个酶活力单位定义为当底物饱和时,在37 ℃可以剪切1nmol Ac-YVAD-pNA产生1 nmol pNA的caspase-1的酶量。按公式计算Caspase-1活力:
Caspase-1活力=pNA浓度×反应体系稀释倍数÷待测样本蛋白浓度。
1.4.5检测大鼠缺血脑皮层IL-1β和IL-18 采用ELISA法检测各组大鼠缺血脑皮层IL-1β和IL-18。脑组织匀浆同“1.4.3”项,取上清液,按照试剂盒步骤操作,用酶标仪在450 nm波长测量各孔吸光度(A值),由标准物的浓度与A值计算出直线回归方程式,将样品的A值代入方程式,计算出样品浓度。
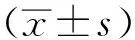
2 结果
2.1各组大鼠脑梗死体积及神经功能评分的比较 大鼠梗死面积见图1。 图1中白色脑组织为缺血病灶,红色脑组织为正常脑组织。模型对照组大鼠脑缺血非常明显,LXA4组脑梗死灶体积显著缩小,与模型对照组相比大鼠脑缺血脑组织体积显著缩小(P<0.01)(图1)。假手术组大鼠没有任何神经功能障碍,模型对照组神经功能评分为(2.83±0.41),表示神经功能缺损严重。LXA4组大鼠神经功能评分显著降低,为(1.33±0.21),明显低于模型对照组(t=9.753,P<0.01),表明LXA4组大鼠神经功能缺损较轻。
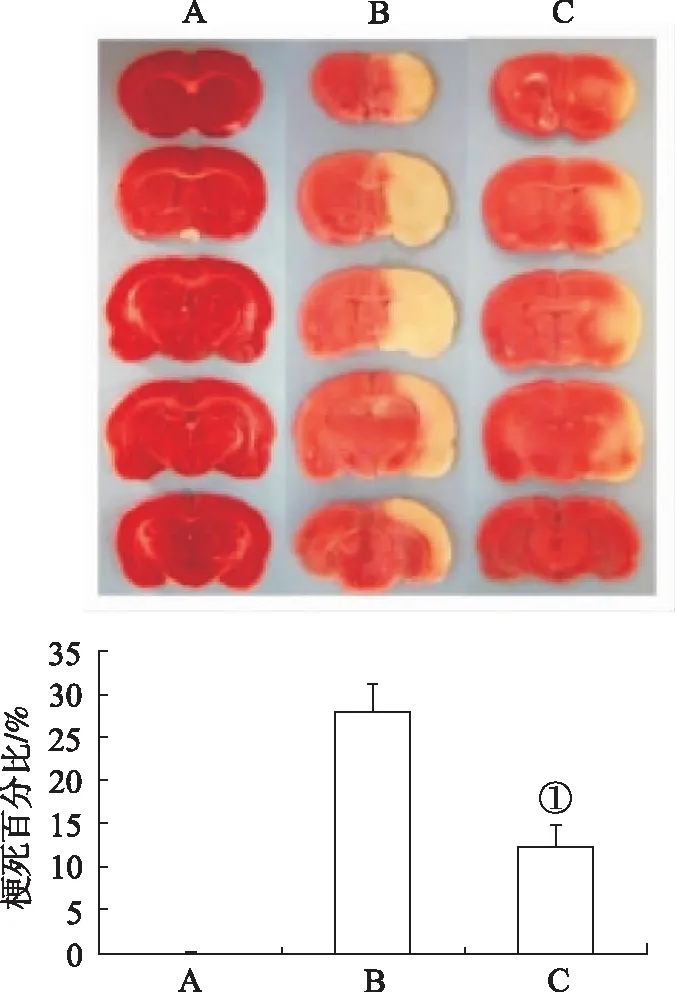
A.假手术组;B.模型对照组;C.LXA4组;①与模型对照组比较,t=5.411,P<0.01。图1 3组大鼠脑梗死体积比较A.sham operation group;B.model control group;C.LXA4 group;①Compared with model control group,t=5.411,P<0.01.Fig.1 Comparison of cerebral infarction volume among three groups of
2.2各组大鼠缺血脑皮层Caspase-1(p20)的蛋白表达变化 Western blotting分析结果见图2,模型对照组和LXA4组大鼠缺血脑皮层Caspase-1(p20)蛋白表达分别较假手术组明显增高,差异有统计学意义(P<0.01)。但LXA4组与模型对照组相比,LXA4组Caspase-1(p20)表达明显降低,与模型对照组比较差异有统计学意义(P<0.01)。
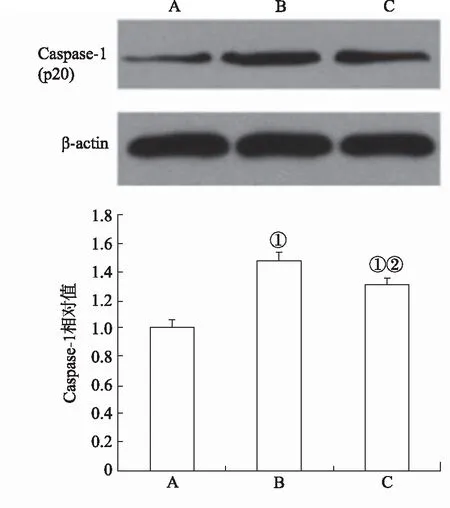
A.假手术组;B.模型对照组;C.LXA4组;①与假手术组比较,t=11.498,16.228,P<0.01;②与模型对照组比较,t=33.362,P<0.01。图2 3组大鼠缺血脑皮层Caspase-1(p20)蛋白表达比较A.sham operation group;B.model control group;C.LXA4 group;①Compared with sham operation group,t=11.498,16.228,P<0.01;②Compared with model control group, t=33.362,P<0.01.Fig.2 Comparison of Caspase-1 (p20) protein expression in ischemic cerebral cortex among three groups of rats
2.3各组大鼠缺血脑皮层Caspase-1活性变化 各组Caspase-1活性结果见图3。与假手术组比较,模型对照组和LXA4组大鼠缺血脑皮层Caspase-1活性明显增高,差异有统计学意义(P<0.01)。但与模型对照组相比,LXA4组Caspase-1活性明显降低,差异有统计学意义(P<0.01)。
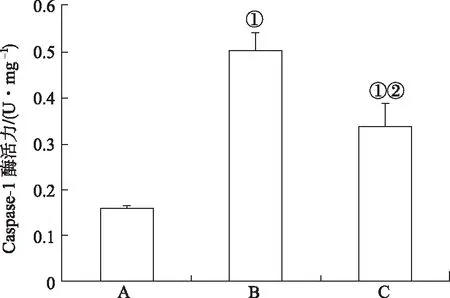
A.假手术组;B.模型对照组;C.LXA4组;①与假手术组比较,t=4.276,5.945,P<0.01;②与模型对照组比较,t=10.291,P<0.01。图3 3组大鼠缺血脑皮层Caspase-1活性比较A.sham operation group;B.model control group;C.LXA4 group;①Compared with sham operation group,t=4.276,5.945,P<0.01;②Compared with model control group, t=10.291,P<0.01.Fig.3 Comparison of Caspase-1 activity in ischemic cerebral cortex among three groups of
2.4各组大鼠缺血脑皮层IL-1β和IL-18浓度变化 各组大鼠缺血脑皮层IL-1β浓度结果见图4,模型对照组和LXA4组大鼠缺血脑皮层IL-1β浓度分别较假手术组明显增高,差异有统计学意义(P<0.05)。但与模型对照组比较,LXA4组IL-1β浓度明显降低,差异有统计学意义(P<0.01)。各组大鼠缺血脑皮层IL-18浓度结果见图4,模型对照组和LXA4组大鼠缺血脑皮层IL-18浓度分别较假手术组明显增高,差异有统计学意义(P<0.05)。与模型对照组比较,LXA4组IL-18浓度降低,差异有统计学意义(P<0.05)。
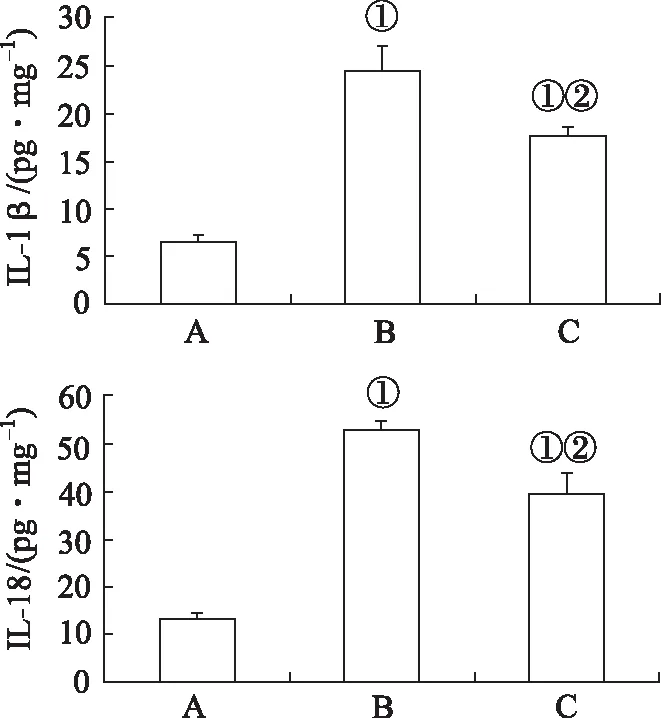
A.假手术组;B.模型对照组;C.LXA4组;①与假手术组比较,t=3.707~4.708,P<0.05;②与模型对照组比较,t=12.272,14.151,P<0.05。图4 3组大鼠缺血脑皮层IL-1β和IL-18浓度比较A.sham operation group;B.model control group;C.LXA4 group;①Compared with sham operation group,t=3.707-4.708,P<0.05;②Compared with model control group, t=12.272,14.151,P<0.05.Fig.4 Comparison of concentration of IL-1β and IL-18 in ischemic cerebral cortex among three groups of rats
3 讨论
目前,细胞死亡的方式主要有凋亡、焦亡和坏死。焦亡是一种新近发现的程序化、炎症性细胞死亡方式,具有Caspase-1依赖性的特点[9]。细胞焦亡机制可能是Caspase-1介导细胞膜上形成小孔(直径1.1~2.4 nm),进而破化细胞内外的离子梯度[特别是钠离子(Na+)和钾离子(K+)],使得细胞内外渗透压发生改变,水分子通过水通道蛋白渗透进入细胞内,导致细胞肿胀、裂解及死亡细胞。焦亡作为一种新型的炎性相关的细胞死亡方式,在缺血性脑卒中等中枢神经系统损伤模型中也得到了证实[10]。核苷酸结合区和亮氨酸富集区蛋白(nucleotide-binding domain leucine-rich repeat containing proteins,NLRs)与凋亡相关的斑点样蛋白 (apoptosis-associated speck-like protein containing caspase recruitment domain,ASC)以及无活性的pro-caspase-1构成炎性体复合体[4]。炎性体复合体激活后产生具有活性的Caspase-1,诱发细胞焦亡,并释放IL-1β和IL-18等炎性因子[11]。
NLRs也称NOD样受体,包括NLRP1、NLRP3、NLRP6、NLRP7及 NLRP12。研究表明,敲除NLRP3基因能明显减轻小鼠脑I/R损伤,NLRP3炎性体信号通路与脑I/R损伤密切相关[12]。NLRP3炎性体主要作用是将pro-caspase-1转化为有活性的Caspase-1。激活后Caspase-1将pro-IL-1β和pro-IL-18裂解成为有活性的炎症因子IL-1β和IL-18,释放到细胞外,触发神经元、星型胶质细胞及小胶质细胞的炎性损伤,导致神经及胶质细胞死亡。同时,激活后的Caspase-1,直接诱导Caspase-1依赖的细胞焦亡,同时也能促进细胞凋亡。
脂氧素(lipoxins,LXs)是SERHAN等[13]于1984年发现的花生四烯酸代谢产物,已被证实为体内重要的抗炎及促炎症消退递质,对多种炎症细胞和炎症相关因子有着显著的负性调节效应[14-17]。2009年SOBRADO等[5]首次在大鼠MCAO模型上观察到LXA4能减轻脑缺血损伤。也有研究表明LXA4能减轻老龄大鼠海马神经炎症[18]。笔者以往的研究在大鼠MCAO/R模型上观察到LXA4能缩小脑梗死体积,减轻神经功能缺损、脑水肿及星型胶质细胞损伤,初步机制包括减少炎性递质白三烯的产生[19]。笔者也在大鼠MCAO/R模型上观察到LXA4能显著减少NLRP3阳性神经元以及显著下调NLRP3蛋白表达[3]。
笔者在以往研究基础上,进一步探讨LXA4对NLRP3炎性体的下游分子Caspase-1的作用,进一步揭示LXA4抗脑I/R损伤的机制。所观察到侧脑室注射LXA4显著降低MCAO/R模型大鼠脑梗死灶体积和神经功能缺失评分,与以往的研究结果一致[19]。缺血脑皮层周边区Caspase-1蛋白表达和活力明显增加,炎症因子IL-1β和IL-18浓度升高,而LXA4能显著抑制Caspase-1蛋白表达和活力,降低IL-1β和IL-18浓度。本研究表明LXA4抑制Caspase-1活性是其抗脑缺血-再灌注损伤的机制之一。
