2021ESC共识文件《急性深静脉血栓的诊断和管理》解读*
2022-02-13尹琪楠韩丽珠边原黄雪飞雷洋宋玉洁童荣生
尹琪楠,韩丽珠,边原,黄雪飞,雷洋,宋玉洁,童荣生
(四川省医学科学院·四川省人民医院/电子科技大学附属医院药学部·个体化药物治疗四川省重点实验室,成都 610072)
自2017年欧洲心脏病学会(European Society of Cardiology,ESC)《急性深静脉血栓的诊断和管理》[1]共识文件发布以来,涌现了大量关于急性深静脉血栓诊断和治疗的新证据。此外,非维生素K拮抗剂口服抗凝剂(non-vitamin K antagonists oral anticoagulants,NOACs)的问世,其益处和安全性受到进一步重视。2021年7月,ESC主动脉和外周血管疾病工作组以及肺循环与右心功能工作组整合数据,指导临床医生对延长抗凝、癌症患者的治疗、血栓后综合征(post-thrombotic syndrome,PTS)的预防和治疗、抗凝期间出血的管理以及妊娠期深静脉血栓(包括激素相关的深静脉血栓和血栓形成倾向)管理,对《急性深静脉血栓的诊断和管理》共识文件进行更新[2]。笔者在本文对更新内容进行解读,以期为我国临床急性深静脉血栓的诊断和治疗提供参考。
1 深静脉血栓的危险因素
一项社区静脉血栓栓塞性疾病(venous thromboembolic disease,VTE)流行病学研究显示,在高达50%的深静脉血栓患者中,没有预先发现可识别的危险因素。深静脉血栓的危险因素主要分为3种,高危风险因素:近期重大手术[(骨科和神经系统)/重大创伤;<3个月内因急性心脏病而住院治疗;既往静脉血栓栓塞;抗磷脂综合征;活动性癌症(取决于癌症类型和阶段)/化疗]。中危风险因素:膝关节关节镜下手术;静脉导管;口服避孕/激素替代疗法/体外受精(取决于激素的剂量和类型);妊娠或围产期;炎症和自身免疫性疾病;感染;活动性癌症(取决于癌症类型和阶段)/化疗;充血性心力衰竭或呼吸衰竭;遗传性血栓形成倾向;浅表静脉血栓[距离隐股交界处(SFJ)或深静脉交界处(PJ)>3 cm,且长度>5 cm];卒中伴遗留偏瘫/偏瘫。轻危风险因素:卧床休息(>3 d)/制动(长时间坐位,如旅行);年龄;肥胖;浅表静脉血栓;静脉曲张/慢性静脉功能不全;腹腔镜手术[2]。目前发现,新型冠状病毒肺炎(corona virus disease 2019,COVID-19)是一个新的血栓中-高危风险因素,COVID-19感染可导致血液高凝状态,尽管进行抗凝预防,但静脉和动脉血栓栓塞事件的发生率仍较高。近期的一项荟萃分析报告COVID-19住院患者的VTE发病率,18 093例总体VTE发病率为17.0%,其中病房患者为7.1%,重症监护病房为27.9%[3]。
2 深静脉血栓的诊断和管理
2.1深静脉血栓的诊断 与2017年的共识文件相比,诊断上没有明显的差异,图1总结深静脉血栓的评估和管理流程[2]。如果怀疑肺栓塞(pulmonary embolism,PE),可参考2019年ESC[4]关于PE诊断和管理的指南。

图1 深静脉血栓的评估和管理Fig.1 Assessment and management of DVT
2.2深静脉血栓的管理 深静脉血栓的管理分为初始阶段(最初的5~21 d,3周内),长期阶段(最初3个月),延长阶段(在最初3个月之后)。不同药物管理方法不同。①阿哌沙班,初始阶段剂量为10 mg,bid,7 d;长期阶段为5 mg,bid;延长阶段为5 mg,bid或2.5 mg,bid(超过6个月)。②达比加群,先给予低分子量肝素(low-molecular-weight heparin,LMWH)5~10 d,然后给予达比加群150 mg,bid或110 mg,bid[对于年龄>80岁或肌酐清除率(CLcr)30~50 mL·min-1者]。③艾多沙班,先给予LMWH5~10 d, 再给予艾多沙班60 mg,qd或30 mg,qd(对于CLcr 30~50 mL·min-1,联合P-糖蛋白(P-gp)抑制剂或体质量<60 kg者);④利伐沙班,初始阶段剂量为15 mg,bid,21 d;长期阶段为20 mg,qd,延长阶段为20 mg,qd或10 mg,qd(超过6个月)。⑤维生素K拮抗剂(VKA),先给予LMWH5~10 d, 再给予VKA,目标国际标准化比值(INR)2~3[2]。
2.2.1癌症与非癌症患者的抗凝策略 与其他慢性病种患者比较,癌症患者抗凝策略有所不同。对于非癌症患者,与2017年共识文件一致[1],共识建议在没有禁忌证的情况下,NOACs应首选作为一线抗凝治疗。然而,对于COVID-19患者,特别是住院患者感染的急性期,由于感染可能导致多器官衰竭,发生快速临床恶化的高风险,共识建议首选普通肝素(unfractionate heparin,UFH)或LMWH。此外,抗病毒药物、免疫调节剂或通过CYP3A4和P-gp途径的药物,与NOACs有潜在的药物相互作用,共识建议NOAC避免使用。相反,在急性期后或出院后,在没有药物相互作用的情况下,NOACs仍然是首选。
对于癌症患者,VTE治疗的最初阶段(前5~10 d)中,LMWH可能优于UFH。对于长期的治疗,CLOT试验[5]首次证明LMWH比VKA更有效地降低癌症患者VTE复发的风险,主要出血风险差异无统计学意义。四项随机临床试验比较NOACs与LMWH对癌症患者的疗效和安全性[6-9],包含艾多沙班、利伐沙班、阿哌沙班分别与达肝素在癌症患者中的比较,在这些研究中,NOACs在VTE复发方面至少不劣于LMWH(利伐沙班显示出优越性),出血事件显著增加(阿哌沙班与达肝素比较除外,两组出血发生率相似,并且提示,若胃肠道癌症不切除,胃肠道出血也会增加,包括LWMH组),但仅局限于胃肠道癌症患者。尽管癌症患者进行抗凝治疗,但VTE复发率仍很高。使用VKA治疗观察到年复发率为20%,通过长期使用LMWH可使其降低一半。根据现有的艾多沙班或利伐沙班证据,使用NOACs可能会进一步减少VTE复发,但发生大出血的风险增加,尤其是在胃肠道癌症患者中。阿哌沙班至少有和LMWH一样的安全性和有效性,但不推荐在原发性或转移性脑癌或急性白血病患者中使用,因为这些患者不包括在Caravaggio研究[10]中。在具有NOACs药物相互作用及上消化道手术影响NOACs吸收的患者中,更多推荐LMWH。此外,严重血小板减少以及恶心、呕吐患者也应使用LMWH。总之,抗凝药物应根据患者的特点和偏好以及癌症的特点和治疗方法进行个性化治疗,见图2。
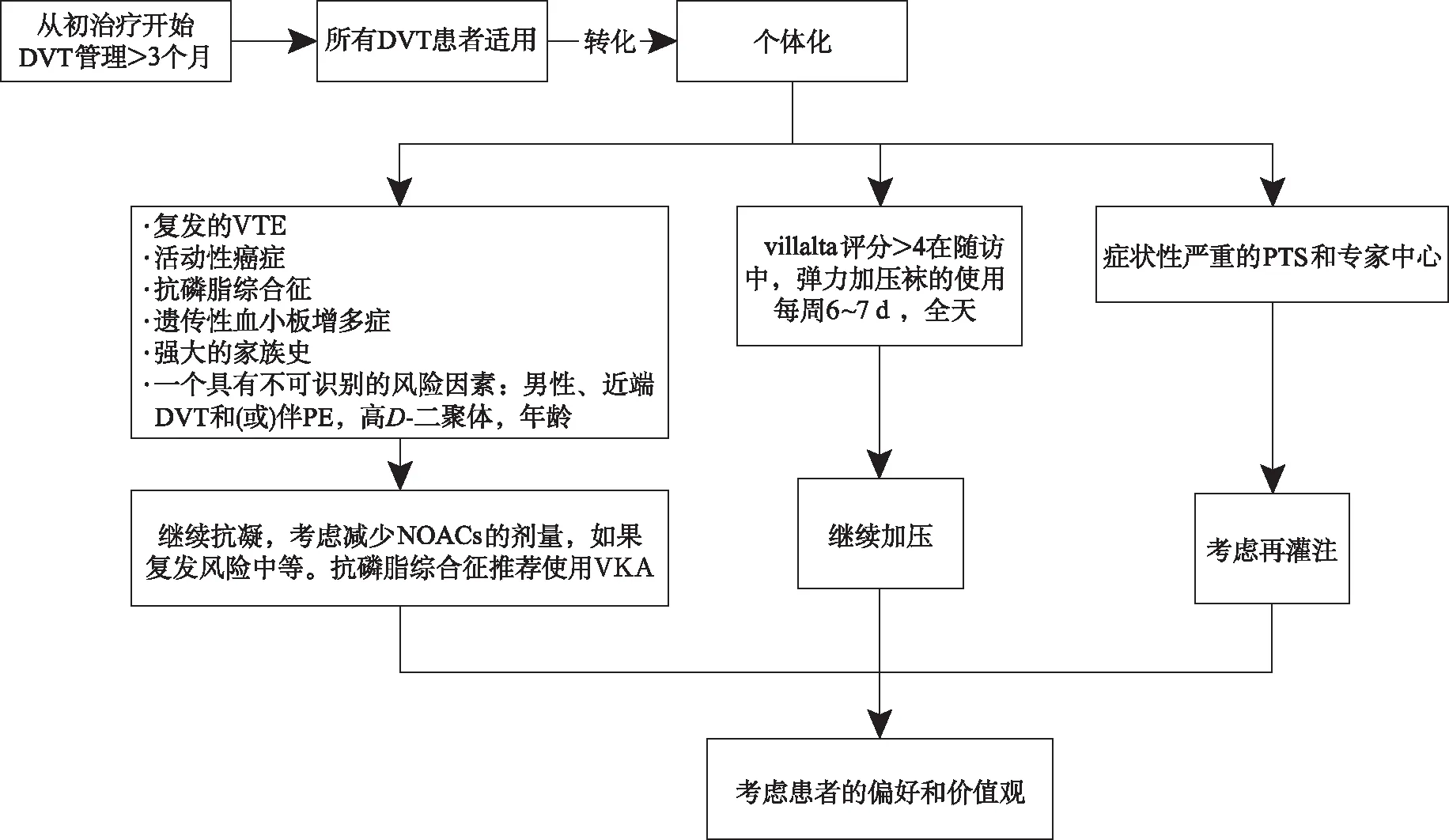
图2 深静脉血栓管理的转变Fig.2 Changes in the management of DVT
2.2.2孤立性远端DVT(isolated distal DVT,IDDVT)患者的抗凝策略 IDDVT是否应接受抗凝治疗仍存在争议。与近端深静脉血栓相比,低风险患者对IDDVT的VTE复发风险较低,而对高危患者则相似。IDDVT患者VTE复发的危险因素分类如下,低风险因素:石膏、固定、创伤、长途旅行等,在避孕或替代激素治疗期间(如果治疗已中断)。高风险因素:既往VTE、男性、年龄>50岁、活跃的癌症、无诱因的IDDVT、持续制动。IDDVT涉及:腘静脉三支和(或)>1根小腿静脉,双侧的,存在诱发性疾病(如炎症性肠病),遗传性血栓形成倾向,轴向与肌肉的IDDVT。CACTUS试验[11]表明,在低风险IDDVT患者中,LMWH和安慰药的症状VTE发生率比较差异无统计学意义(3.3%和5.4%,P=0.54);LMWH组出血发生率更高(4%和0%,P=0.03)。IDDVT的管理应该是个性化,VTE高危患者可用全剂量抗凝剂治疗至少3个月,与近心端DVT治疗相似,近端DVT停止抗凝剂后VTE复发的风险见表1。LMWH治疗短疗程(4~6周)、小剂量或静脉彩色超声监测可能对低风险患者是有效和安全的。在没有临床试验的情况下,最近两个前瞻性研究表明,NOACs对IDDVT患者具有证据意义的有效性和安全性[12-13]。
2.3延长阶段的管理 在仔细评估个体复发风险、出血、患者依从性和偏好以及长期深静脉验证检查并发症的影响后,应确定最初3个月阶段后的抗凝治疗。治疗停止后第1年复发较高,随着时间的推移而减少,但不会完全无风险。有60% DVT和40% PE患者出现复发性VTE。一旦停止抗凝治疗,VTE复发风险因指标事件特征不同而不同,无可识别危险因素的患者VTE复发风险比有可识别危险因素的患者高出1倍以上,见表1。传统上,如果复发风险1年<5%,5年<15%,则停止抗凝治疗是合适的。延长抗凝治疗可减少80%~90%的复发,但面临不可预测的出血并发症的风险。尤其是在低出血风险患者和低剂量使用的患者中,延长NOACs治疗相关的大出血风险低于VKA。已有临床预测模型来检测低复发风险的患者,然而,它们在低出血风险的NOACs时代的作用存在争议。与高出血风险相关的因素包括:老年、癌症、肾功能或肝功能不全,抗血栓性药物以及既往大出血史。
2.4非癌症和癌症患者的抗凝治疗持续时间 对于近端深静脉血栓(伴有或不伴有PE),如果复发风险较低,3个月的抗凝治疗是最佳选择。如果出血风险较低,无限期抗凝治疗是高风险复发患者的最佳选择,未确定风险因素和低出血风险的深静脉血栓患者可在最初3个月后延长抗凝时间。将VTE分为有诱因和无诱因来进行指导治疗似乎很简单,但研究表明,有诱因的VTE患者比无VTE病史患者复发风险更高,延长抗凝也没有显示获益,因此,需要个性化进行治疗管理。在没有禁忌证的情况下,在非癌症患者中应首选NOACs作为一线延长抗凝治疗,但对于抗磷脂综合征患者只推荐VKA。在中等复发风险的患者中,两个随机对照组比较“全剂量和减少剂量阿哌沙班与安慰剂”[14]以及“全剂量和减少剂量的利伐沙班与阿司匹林”[15]表明,减少剂量的阿哌沙班与全剂量有效性相当,与安慰剂或阿司匹林的出血风险相当。对于癌症患者,由于复发风险较高,应根据抗凝持续时间进行单独评估,包括癌症类型、分期、活动、化疗、预期寿命等,以及癌症的活跃或缓解状态。需要定期对持续抗凝治疗的风险效益比进行重新评估,因为复发和出血的风险可能随时间而异。长程的抗凝剂可能包括口服抗凝剂。服用VKA的癌症患者(INR达标)的VTE复发需要更改为LMWH。使用LMWH的患者VTE复发可增加剂量,特定患者可选择腔静脉过滤器。关于深静脉血栓癌症患者长期治疗NOACs的数据非常有限。
2.5PTS的预防与处理 PTS是最常见的慢性DVT并发症,30%~50%患者在近端DVT后2年内发生。5%~10%患者PTS症状很严重[16]。PTS的病理生理学尚未完全阐明。既往同侧深静脉血栓检查、髂静脉位置和残余静脉阻塞是PTS最重要的危险因素,因此强调个性化的治疗管理方式。几十年来,弹性压缩袜一直是PTS管理的支柱,基于两个开放标签随机对照试验[17-18],均显示PTS发展的相对风险降低50%。最近的两项临床试验表明,良好的依从性(每周至少6 d)和高依从率(>80%)与显著降低PTS发生率相关,并且建议弹性压缩袜的使用时间可以是个性化的[19-20]。
2.6随访 对患者进行随访,避免复发风险以及深静脉血栓相关和抗凝相关并发症,回顾治疗、实验室检查和患者信息。在抗凝期间,每年进行评估,监测调节抗凝治疗的因素(肾功能不全、怀孕、体质量减轻、严重的高血压)。应评估治疗的依从性以及效益/风险平衡。应对PTS的发展情况进行评估。在停止抗凝治疗之前,静脉彩超评估有助于确定基线残余静脉血栓,不是推动抗凝治疗的持续时间,而是在出现新症状时区分新旧血栓。抗凝停药后,应提供有关未来高血栓风险的信息。
3 特殊情况
3.1妊娠期深静脉血栓 怀孕使VTE的风险增加4~5倍[21]。股动脉和(或)(孤立的)髂静脉血栓通常发生于妊娠患者,主要是由于解剖学原因出现在左侧。42%女性妊娠相关DVT有发生PTS的风险,7%发生严重的PTS风险[22],妊娠期深静脉血栓的危险因素包括:既往因素(既往的VTE,严重的血栓形成倾向,静脉曲张,吸烟,体质量指数>30 kg·(m2)-1,系统性红斑狼疮);产科特定的危险因素(剧吐、剖宫产尤其是紧急情况、早产、子痫前期、辅助生育);其他危险因素(产后感染或大出血、输液、制动)。治疗包括治疗剂量肝素(不穿过胎盘,母乳中不明显),优先选择LMWH而不是UFH,推荐每日一次,不建议常规进行抗Xa监测和剂量调整(极端体质量或肾功能不全者可考虑)。是否可以在妊娠期间的将抗凝剂减量作为二级预防尚缺乏证据。围产期需要多学科团队进行,抗凝治疗应持续产后至少6周,并且直到至少3个月的抗凝治疗。在母乳喂养的妇女中,可以继续给予LMWH或切改用VKA[给母乳喂养的新生儿服用少量维生素K(每周1 mg)]。在无安全数据的情况下,在妊娠/哺乳期禁止使用NOACs。
3.2口服避孕药 使用复方口服避孕药增加VTE的风险,在最初几个月风险最高,持续使用期间比非使用者增加3~8倍[23]。血栓形成倾向的存在进一步增加激素相关VTE的风险,激素相关VTE女性的VTE复发风险低于无诱因VTE女性的风险[HR=0.5,95%CI(0.3,0.8)][24]。因此,大多数女性接受3个月的治疗是足够的。如果同时使用治疗性抗凝剂,可以在不增加复发风险的情况下使用口服避孕药。然而,在口服避孕药停药后,DVT的风险增加仍持续3个月,因此有必要使用低VTE风险的避孕方法作为替代。
3.3上肢DVT(UEDVT) UEDVT占所有DVT的10%,每年发生率为(0.4~1.0)/10 000人[25-26]。由于中央静脉导管、心脏起搏器和除颤器的使用不断增加,发病率增加。20%~30%的UEDVT是由解剖异常或持续的体力劳动引起[27]。继发性静脉血栓包括静脉导管和器械相关并发症、癌症、怀孕以及近期臂/肩手术或创伤。静脉彩超是首选的诊断检查。除特定严重病例外,不建议使用溶栓。
3.4脑静脉血栓(cerebral vein thrombosis,CVT)患者 一项随机临床试验[28]评估NOACs对120例CVT患者的疗效和安全性,患者在使用LMWH或UFH治疗5~15 d后,接受达比加群(150 mg,bid)或调整剂量的VKA 24周。研究发现,两组在复发VTE和出血方面差异无统计学意义,表明两种药物在CVT患者中可能安全有效。
3.5电生理相关手术过程中的静脉血栓栓塞 股静脉为电生理相关手术中心导管插入的选择性途径。然而,此类手术VTE风险的数据有限。在最近的一篇系统综述[29]中,非房颤和房颤手术后DVT的合并发生率分别为0.24%[95%CI(0.08%,0.39%)]和0%[95%CI(0,0.0003%)],后者的较低发生率与术中系统使用抗凝治疗有关,房颤(1%)比非房颤(0.3%)消融更频繁。此外,包括欧洲心律学会(EHRA)[30]在内的共识文件支持在干预期间维持口服抗凝剂(如果已经不足),按程序使用肝素和术后抗凝。在其他手术中,特别是在不需要抗凝的右侧腔室,在手术过程中使用肝素是可选的,需要进行进一步研究以平衡血栓与出血风险。
4 抗凝期间出血的管理
接受严重大出血治疗的患者应静脉注射维生素K和凝血酶原复合物浓缩物(PCCs),以快速逆转抗凝血。在接受NOACs治疗的患者中,依达塞珠单抗是目前在欧洲可用于直接因子Ⅱa抑制剂达比加群的特异性逆转剂。直接因子Ⅹa抑制剂的逆转剂是andexanet alfa,这是一种人类凝血因子Xa的重组改构产物,目前被美国食品药品管理局(FDA)和欧洲药物管理局(EMA)批准用于急性大出血患者,如果没有逆转剂,使用直接因子Ⅹa抑制剂和危及生命的出血治疗的患者应接受PCCs,目前还没有关于氨甲环酸在直接因子Ⅹa抑制剂和危及生命的出血患者治疗的有效性和安全性的数据。
5 结束语
本文分别从深静脉血栓的风险评估,癌症与非癌症患者的管理,特殊情况的处理,抗凝出血的管理等4个方面,详细解读该共识文件,以期为临床提供参考。本共识文件强调个体化的治疗管理模式,并对抗凝药物的选择予以相应的推荐,虽然纳入较多新的文献,提供更多新的数据,也提出一些新的观点与理念,但是仍然存在一些无法解决的具体问题,需要相关的医务人员进行更多的试验与相关的研究,来提供更强力的临床指导推荐。
