哺乳动物滑翔和飞行性状适应性演化研究进展
2022-02-12高珊珊李金良杨佳妮周通刘瑞王晓萍于黎
高珊珊,李金良,杨佳妮,周通,刘瑞,王晓萍,于黎
哺乳动物滑翔和飞行性状适应性演化研究进展
高珊珊,李金良,杨佳妮,周通,刘瑞,王晓萍,于黎
云南大学省部共建云南生物资源保护与利用国家重点实验室,生命科学学院,昆明 650091
运动形式的适应性演化与生物的捕食、防御、繁殖和通讯等生存行为紧密相关。哺乳动物演化出的多种多样的运动方式对占领新栖息地和获取新生存资源有着举足轻重的作用,其中滑翔和飞行能力是哺乳动物为适应环境而演化出的特殊运动形式,该类群动物已成为适应性演化研究的热点模型之一。为了适应生存,滑翔和飞行哺乳动物在形态、生理和行为方面都发生了一系列的适应性改变。近年来,随着基因组和转录组等高通量测序技术的日益发展,适应性演化研究进入了组学时代,能够更系统更全面地揭示适应性演化背后的分子基础。本文对哺乳动物滑翔和飞行能力的起源、适应性形态特征,包括翼膜和肢体演化,以及能量代谢等生理特征及其分子机制方面的研究进展进行了综述,以期为今后开展哺乳动物运动方式适应性演化的分子机制研究提供理论基础,同时对该类群研究所面临的挑战和未来的研究方向进行了展望。
哺乳动物;飞行;滑翔;适应性演化;分子机制
适应性演化(adaptive evolution)是指自然界中的生物为了在不同环境条件下生存繁衍,在演化过程中,经历长期的自然选择,结构和功能发生了变化以适应各种各样的生存环境,从而占据更多的生态位[1]。适应性演化在自然界中广泛存在,其中哺乳动物多种多样的运动形式的适应性演化备受关注。运动形式的适应性演化与生物的捕食、防御、繁殖和通讯等生存行为紧密相关[2]。在以陆生行走为主要运动形式的哺乳动物中,滑翔或飞行能力的获得无疑是哺乳动物占领新栖息地和获取新的生存资源而适应环境的关键。飞行和滑翔的运动方式增加了动物捕食猎物的机会和更有效的防御和躲避天敌,对动物的自身生存和繁衍有着十分重要的意义。
在现生哺乳动物中,滑翔运动方式总共经历了6次独立演化,包括啮齿目(Rodentia)的鳞尾松鼠科(Anomaluridae)和鼯鼠科(Pteromyidae)、皮翼目(Dermoptera)的鼯猴科(Cynocephalidae)以及有袋目(Marsupialia)的环尾袋貂科(Pseudocheiridae)、袋鼯科(Petauridae)和树袋貂科(Acrobatidae)[3]。翼手目(Chiroptera)是哺乳动物中唯一具有飞行能力的类群(图1)。
为了适应生存,滑翔和飞行哺乳动物在形态、生理和行为方面都发生了一系列的适应性改变。例如,它们都具有翼膜(patagium)和支撑翼膜展开的附肢软骨(appendage cartilage),有益于滑翔或飞行时翼膜更大限度的展开[7,8];具有更长的前肢和后肢,有利于其翼膜表面积的扩大,更好的行使滑翔或飞行运动;具有扁平的尾巴,以控制滑翔或飞行时的方向和平衡[5];具有高效的能量供应系统,提供滑翔或飞行时快速的能量代谢消耗[9]。此外,唯一具有飞行能力的蝙蝠中的小蝙蝠亚目(Microchiroptera)蝙蝠和大蝙蝠亚目(Machiroptera)的果蝠属(如美洲果蝠属)蝙蝠为了适应夜间生活而进化出复杂的回声定位系统,使其在夜间或者昏暗环境下能够精确定位猎物位置和调整飞行方向[10]。

图1 滑翔和飞行哺乳类动物及其近缘物种的系统发育树
在系统发育树中,鳞尾松鼠科和鼯鼠科所在的枝系为蓝色枝,鼯猴科所在的枝系为紫色枝,环尾袋貂科、树袋貂科和袋鼯科所在的枝系为绿色枝,翼手目所在的枝为红色枝。图根据文献[4~6]修改绘制。
最初对滑翔和飞行哺乳动物的研究,主要是对形态学、空气动力学和解剖学等方面的描述[11~15]。随着分子生物学的快速发展,对哺乳动物运动形式,尤其是蝙蝠的飞行能力的适应性演化分子机制的研究不断涌现,成为进化生物学的研究热点。近年来,随着基因组和转录组等高通量测序技术的日益发展,适应性演化研究进入了组学时代,能够更系统更全面地揭示适应性演化背后的分子基础[16,17]。本文对哺乳动物滑翔和飞行能力的起源、适应性形态特征,包括翼膜和肢体演化,以及能量代谢等生理特征及其分子机制方面的研究进展进行综述,以期为今后开展哺乳动物运动方式适应性演化的分子机制研究提供理论基础。目前,关于蝙蝠在飞行过程中回声定位能力的适应性进化研究已经有大量综述报道[17~23],本文将不再赘述。
2.精心设计微课,提供有趣的学习资料。教师根据内容重难点制作微课,用精彩的微课激发学习兴趣,促使学生主动获取知识。
1 哺乳动物滑翔和飞行能力的起源及假说
哺乳动物滑翔和飞行运动形式具有趋同和趋异的形态适应性特征,如两者都演化出独特的体侧翼膜和尾翼膜(蝙蝠为股间膜),在滑翔或飞行中行使控制方向和保持平衡的功能,并利用空气动力进行长距离移动[37];同时,两者的翼膜和前肢骨骼结构表现出差异,例如蝙蝠宽阔的指翼膜和强劲的前肢都为远距离飞行提供了所需的持续动力,这与滑翔哺乳动物利用张开翼膜滑翔有着显著不同。
作为现存哺乳动物中唯一具有飞行能力的物种,翼手目蝙蝠的化石证据可以追溯到距今约5000万年和5250万年之前的古新世早期至白垩纪晚期的食指伊神蝠()和爪蝠(),它们均在美国怀俄明州绿河组发现[27,28]。食指伊神蝠具备现生蝙蝠所有的特征,如前肢的拇指短小而有力量,后肢的力量则较弱且相对短小[27,29]。而爪蝠的体型比食指伊神蝠大,拥有强健的锁骨、椎骨和肩胛骨,与食指伊神蝠相似,但是具有更原始的前肢形态结构:每个翼指都有三节指骨,在所有的翼指上都有发育良好的爪子以及翅膀形态[28,30,31]。目前,关于蝙蝠飞行起源的假说有两种[28,32,33]:一是“树栖起源”假说(“trees-down” hypothesis),即飞行是通过树栖和滑翔阶段获得的;二是“奔跑起源”(“ground-up” hypothesis)假说,即飞行从地面运动起飞。但大多数研究者认为,“树栖起源”假说更有可能[34],因为假设蝙蝠飞行祖先起源于“地面”,那么需要蝙蝠能够达到足够高的地面运动速度,使它能够从地面起飞。尽管缺乏化石证据,但蝙蝠的形态特征使得人们很难想象树栖和滑翔起源之外的任何其他起源,因为蝙蝠的后肢以及所有现存的滑翔哺乳动物的后肢都被翼膜覆盖,所以滑翔和飞行哺乳动物的祖先不可能独立使用前肢和后肢来同时高速奔跑和扑动。
以上研究均支持滑翔和飞行哺乳动物的祖先可能为树栖物种,该结论也得到了化石证据和形态数据的支持[24,25,28],飞行源自于从树上降落,同时也暗示滑翔可能是树栖和飞行之间重要的过渡运动形式[35,36]。
2 哺乳动物滑翔和飞行的形态适应性特征及分子机制
对哺乳动物滑翔能力起源的研究,主要来自于北京自然博物馆孟庆金研究团队。2017年孟庆金等[24,25]分别在中国辽宁省建昌县和河北省青龙县距今约1.6亿年前的晚侏罗纪地层中,发现了迄今为止最原始的具有翼膜的滑翔哺乳动物化石,分别被命名为似叉骨祖翼兽()和双钵翔齿兽(),它们均位于哺乳动物的祖先支系,是现代哺乳动物有袋目和胎盘类以及其他中生代哺乳动物的祖先类群。研究发现它们的身体结构与现存的滑翔哺乳动物相似,其锁骨与间锁骨的构造与鸟的叉骨形状近似趋同。该研究成果揭示了早在1.6亿年前哺乳动物就演化出滑翔功能,明显早于2006年Meng等[26]在中国东北发现的7000万年前的中生代滑翔哺乳动物化石,揭开了早期哺乳动物由树栖向空中滑翔演化的面纱。
2.1 翼膜的适应性特征
工业生产服务机器人是一种半自主式或全自主式工作的可以自由编程的移动设备.它从事的服务是使参与工业生产的设备能够更好地工作.主要从事仓库环境的动态监测与预警,工厂设备的远程监视、维护检查和故障诊断.作为家庭智能设备的网络控制终端,进行日常事务的助理、安防工作[3].
滑翔哺乳动物的翼膜包括4个部分,即脖颈和前肢之间的前翼膜(propatagium, prp)、前肢指间或后肢脚趾间的指翼膜(digipatagium, dp)、前肢和后肢之间的体侧膜(plagiopatagium, plp)以及后肢与尾巴之间的尾翼膜(uropatagium, up)[7]。在现存的滑翔类哺乳动物中,鳞尾松鼠科和鼯鼠科类群的翼膜仅包含翼膜系统中的前翼膜、体侧膜和尾翼膜三部分,而不存在指翼膜[5](图2:A,B)。其中,它们的体侧膜都是从前肢(手腕或肘部之间)和脚踝之间延伸出来,鳞尾松鼠()体侧膜是由肘部的钩状软骨支撑,鼯鼠科类群体侧膜则是由手腕的针状软骨支撑[5]。除此之外,鼯鼠科类群的前翼膜处,还附着有独特的肌肉复合体结构枕-拇肌(occipito-pollicalis, OP),其沿着前翼膜延伸,由外侧翼膜的喙-皮神经(coraco-cutaneus, CC)、肱骨干肌(humeropatagialis, HP)和斜肌(plagiopatagialis, PP)以及内侧翼膜内的尾肌 (uropatagialis, UP)组成,滑翔时该肌肉群能伸张前翼膜保证滑翔平稳,其中枕–拇肌是细而微有弹性的带状肌肉,有助于滑翔时展开前翼膜[38](图2B)。鼯猴()的翼膜则是从耳后的颈部两侧开始,由皮肤延伸形成,翼膜从前、后肢一直延伸到指(趾)端和尾部,包含了前翼膜、指翼膜、体侧膜和尾翼膜4部分[39],是唯一拥有完整翼膜结构的滑翔哺乳动物[5](图2C)。其中,鼯猴前掌光滑,可以减小滑翔的空气摩擦力,而指与指之间附着特有的指翼膜,可以更好的完成滑翔过程[40]。有袋目的环尾袋貂科、树袋貂科和袋鼯科物种包含体侧膜和尾翼膜两部分,不包含前翼膜和指翼膜,其体侧膜在前后肢之间,从第五趾的第二和第三关节延伸到脚踝,脚伸直时体侧翼膜张开,浓密的尾巴上还附有尾翼膜,增加了滑翔和降落时的稳定性[5](图2D);袋鼯科的蜜袋鼯()在其翼膜最外侧区域还具有发育良好的胫腕肌(tibiocarpalis muscle),有助于控制滑翔的方向和平稳性[37]。
翼膜是滑翔和飞行哺乳动物区别于其他哺乳动物运动形式最显著的身体特征,是滑翔和飞行哺乳动物借助空气阻力完成滑翔和飞行运动过程最重要的身体结构。翼膜连接在身体两侧前后肢间且具有被毛,哺乳动物可以通过这一特殊形态结构从一个地方滑翔或飞行到另一个地方,也可以通过翼膜扭转身体躲避障碍物,安全降落于树木而不需要着陆[36]。

图2 滑翔和飞行哺乳类动物代表物种的翼膜结构
A:啮齿目鳞尾松鼠;B:啮齿目鼯鼠;C:皮翼目鼯猴;D:有袋类(袋鼯科、环尾袋貂科和树袋貂科);E:蝙蝠。prp:前翼膜(propatagium);dp:指翼膜(digipatagium);plp:体侧膜(plagiopatagium);up:尾翼膜(蝙蝠为股间膜)(uropatagium);OP:枕-拇肌(occipito-pollicalis)。图根据文献[5,10]修改绘制,翼膜结构根据文献[44,45]标注。
与滑翔哺乳动物相比,具有飞行能力蝙蝠的翼膜包含脖颈与前肢之间形成前翼膜,从前肢第DII指(蝙蝠前肢第二肢)至第DV指(蝙蝠前肢第五肢)之间延伸,指间组织在胚胎发育阶段并没有凋亡和消融,而是发育成富有弹性的指翼膜[41],第V指连接至后肢形成体侧膜,后肢与尾部之前形成股间膜。因此,除了DI指(蝙蝠前肢第一指)和后肢趾外,在前肢指之间具有指翼膜,前后肢与体侧、后肢与尾之间分别具有前翼膜、体侧膜和尾翼膜 (图2E),蝙蝠前肢的DII-V指相较于后肢的II-V趾明显延长,延长的前肢指骨有助于前肢指翼膜的延伸和扩张[42]。此外,蝙蝠前翼膜还具有与鼯鼠科类群相似的肌肉复合体结构枕–拇肌,该肌肉组织除了在飞行时有助于展开前翼膜的作用,同时是蝙蝠动力飞行中能量代谢所必需的场所,促使蝙蝠实现持续的动力飞行[36,43](图2E)。
35例观察组:年龄[上限67岁、下限42岁、平均值(53.50±2.93)岁],男女之比为18:17,病程(3.43±0.71)年。
2.2 骨骼结构适应性特征
专业综合实训实验室是高校实验室的一个重要组成部分,通过专业综合实训环节,将学生的创新能力的培养具体规范地纳入实训教学计划之中。建立各种系统的、操作性强、特色鲜明的大学生创新能力培养的实训体系,可以把创新能力培养贯穿于实训教学全过程。在实训过程中,培养学生的设计能力、创新能力、动手能力和跨专业的综合应用能力。系统从设计到实现需要多学科的结合及团队各成员的分工协作、共同努力,培养了学生的团队协作精神。另外构筑开放式实训教学新体系,还可以为大学生各类科技竞赛及创新创业训练,营造良好的科研环境、创新环境和创新氛围。
与仅分布在非洲中西部森林地区的鳞尾松鼠科相比,鼯鼠科类群分布广泛,数量众多,故对其针状软骨的形态学、解剖学特征开展了大量的研究,并根据针状软骨的所处位置以及与腕关节骨骼的连接方式对其同源性提出了多种假说[29~34,48]。1966年Gupta[47]根据 SC与尺骨部籽骨的空间位置和其肌肉、韧带的连接方式等结果提出SC与尺骨部籽骨同源的假说。1998年,Stafford等[49]认为,SC不可能与尺骨部籽骨同源,因为它是一种不同于腕部籽骨的骨骼,似乎是与松鼠手掌中的小鱼际软骨同源,因为二者与豌豆骨和第五掌骨有着同样的连接方式。2000年,Oshida等[50]则根据尺侧腕屈肌(flexor carpi ulnaris)在前肢中的存在方式提出鼯鼠的SC与豌豆骨同源。2001年,Thorington等[51]认为鼯鼠随着年纪的增大其SC逐渐骨化来支持SC与豌豆骨的同源性这一假设并不成立,推测在胚胎发育过程中SC可能是尺骨边界软骨发育而来,SC与尺骨骨骺具有同源性。直到2017年,Kawashima等[52]总结前人的研究结果,基于更多不同种类鼯鼠的形态学和解剖学方法进行研究,提出SC同源性的两大主要假说:(1)与腕部的豌豆骨同源;(2)与尺骨骨骺或者与其他腕部骨骼同源。但是,到目前为止,还没有其他的证据进一步解决SC的同源性。
2006年,Weatherbee等[60]通过原位杂交技术(hybridization, ISH)探究已知在哺乳动物小鼠肢体发育方面有重要作用的成纤维细胞生长因子8(fibroblast growth factor 8,)基因和(DAN family BMP antagonist,)基因在蝙蝠翼膜发育中是否有作用。研究发现蝙蝠指翼膜组织的维持依赖于高水平的Fgf信号以及低水平的Bmp信号,从而抑制了指翼膜的细胞凋亡,有助于翼膜的发育形成;同年,Sears等[43]利用免疫荧光(immunofluorescence)和实时荧光半定量PCR (semiquantitative RT-PCR)方法研究短尾叶鼻蝠()不同胚胎发育阶段(carnegie stages:CS18、CS19、CS20、CS21和CS22),结果发现骨形态发生蛋白2(bone morphogenetic protein 2,)基因可以刺激蝙蝠胚胎前肢中软骨的增殖和分化,并增加前肢指长度。此外,相对于小鼠或蝙蝠后肢指,蝙蝠前肢指中基因的表达显著增加,Bmp信号显著上调。Bmp信号上调是蝙蝠前肢指发育伸长的主要因素之一,也可能是蝙蝠前肢指伸长的关键分子机制。
滑翔和飞行哺乳动物除了具有翼膜结构外,前肢骨骼结构为了适应滑翔或飞行也发生了改变。滑翔哺乳动物多数都具有从前肢腕部或肘部延伸的附肢软骨,以增大翼膜面积和加固支撑翼膜而增强物种滑翔的稳定性和高效性[38]。比如:啮齿目鳞尾松鼠的肘部鹰嘴突(olecranon)处的钩状软骨(unciform cartilage, UC)用来支撑翼膜的前缘,有效地增加了翼膜的面积[5]。而鼯鼠科相较于其近缘物种,腕部具有独特的针状软骨(styliform cartilage, SC)支撑翼膜,针状软骨带动前翼膜张开实现滑翔[5,46]。除此之外,鼯鼠科与鳞尾松鼠科物种的不同之处在于鼯鼠科物种的尺骨退化显著,其远端贴附于桡骨且不能活动,有与桡骨融合的趋势。鼯鼠()的腕关节豌豆骨不仅与第五掌骨连接,且与SC连接,SC在运动过程中便以豌豆骨为轴心进行旋转运动[47],而鳞尾松鼠科物种肘部延伸的钩状软骨不具备旋转功能[40]。
与以陆生行走为主要运动形式的哺乳动物相比,除了翼膜及骨骼形态特征的变化,滑翔和飞行的哺乳动物还需要高效率的能量供应系统,以满足滑翔和飞行运动方式带来的能量剧烈变化。Byrnes等[73]采用三维加速度(three-dimensional acceleration)数据系统记录了皮翼目鼯猴的爬升和滑翔的连续数据,结果显示,在运动相同的水平距离中,攀爬滑翔所需的能量约是陆栖奔跑所需能量的1.5 倍,这是由于垂直攀爬的代谢成本约是陆栖的10倍。Flaherty等[74]通过开放式呼吸测量法(open-flow respirometry)和变速跑步机(variable-speed treadmill )计算鼯鼠运动成本、运动时耗氧量和运动后耗氧量,结果显示在滑翔运动全过程中的耗氧量比基础代谢高1.25~2.65倍,并随着速度呈指数增长,滑翔比自身代谢更耗能。而持续拍打飞行的蝙蝠比滑翔的物种有更高需求的能量代谢[75]。蝙蝠是唯一能够保持动力飞行的哺乳动物,飞行是最耗能的运动形式之一,因此能量供应在蝙蝠飞行演化过程中占重要地位。已有研究显示,蝙蝠飞行所需的能量代谢是其身体大小相仿的陆地哺乳动物运动中的最大代谢率的3~5倍,是其自身基础代谢的15倍[76,77]。以上研究结果表明,滑翔和飞行是一项耗能的运动,需要高效的能量供应系统来维持生命活动所需的能量代谢,以适应滑翔和飞行过程中的能量需求。
与滑翔类哺乳动物相比,蝙蝠是唯一具有飞行能力的哺乳动物,对飞行的关键适应是一对显著延长的前肢指以及极其宽阔的翼膜。蝙蝠的指翼膜主要由细长的DI-DV和附着其上的肌肉组成,它们的前肢指极度延伸以支撑指翼膜,形成翼膜的主体支架结构[44]。通常蝙蝠的DIII (前肢的第三指)是其头部至身体长度的1.54倍,相当于人类手指延长至原长的9倍,但并不是每个指都是延伸拉长。蝙蝠前肢的DII-V指相较于后肢的II-V趾是明显延长的,DI保持着与后肢趾相似的短小形态,用来抓取或者在地面上移动[56]。
与滑翔动物相比,蝙蝠的前肢具备4根极度延长的指用来支撑宽大的指翼膜,这是滑翔哺乳动物所没有的,宽大的指翼膜结构在飞行过程中配合着翼膜上20多个关节可灵活的行使振“膜”拍打行为,指翼膜的变形极大,包含了骨骼控制的主动大变形和指翼膜控制的被动变形,从而获得主动飞行的动力[57~59]。这些不同于滑翔哺乳动物独特的身体结构,使蝙蝠成为唯一能够飞行的哺乳动物,更有利于占据天空生态位获取生存资源。
2.3 翼膜和前肢骨骼适应性演化的分子机制
生物运动形式的适应性演化是自然选择、基因和基因相互作用的综合性结果[1]。通过解析关键发育基因是如何调控滑翔和飞行哺乳动物的翼膜产生和前肢骨骼独特发育的分子机制,是深入理解和认识哺乳动物滑翔和飞行能力适应性演化的重要途径和主要方法[7,43,44]。目前,相关研究主要集于具有飞行能力的翼手目蝙蝠的研究。
鼯猴科不具备前肢外侧延伸的附肢骨骼结构,但是具有能够支撑指翼膜的指骨结构。鼯猴的中间指骨和近端指骨间很难连成一条直线,一直处于弯曲状态以适应攀爬和抓握[53]。2020年,Geng等[54]通过对包括鼯鼠科和鼯猴科在内的灵长类总目共4个目122个不同运动形式物种,包括陆栖、树栖、滑翔哺乳动物类群,根据前掌第三指骨的3个指标数据,包括掌骨(MC3)、近端指骨(MPP3)和中端指骨(MIP3)的比例进行比较分析,发现滑翔类哺乳动物中端指骨(MIP3)比例与近缘物种相比都显著拉长,具有较长的指骨特征,且指骨比例将滑翔类哺乳动物,即啮齿目的鼯鼠和皮翼目的鼯猴聚在一起,它们并没有和各自的近缘物种聚在一起,说明不同的哺乳动物为了适应滑翔运动方式,在指骨的形态特征上发生了趋同进化[54,55]。
2008年,Hockman等[61]通过对纳塔尔长翼蝠 ()和短尾叶鼻蝠不同胚胎发育阶段(CS15、CS16、CS17)的前后肢进行原位杂交,并与对应的小鼠胚胎发育阶段(E12.0、E13.0和E13.5)进行比较分析,发现文献[62,63]报道的在蝙蝠前肢中常见表达的Hedgehog信号通路(sonic hedgeho,)基因和人蛋白质修补同系物1 (Patched 1,)基因激活了Shh-Fgf8反馈环路,而Shh-Fgf8反馈环路提供了细胞生存和增殖的信号,促进细胞增殖和存活,进而可能促进了翼膜的生长和前肢的发育[61,64]。2012年,Tokita等[17]通过基因克隆和基因表达分析等方法,发现在Fgf信号通路中,成纤维生长因子10 ( fibroblast growth factor 10,)基因在亚洲长翼蝠()的指翼膜的结缔组织中是唯一被激活并持续表达的基因,推测基因可能是参与指翼膜肌肉发育的关键因子。此外,Cretekos等[65]将硫氧还原蛋白过氧化物酶1 (paired related homeobox 1,)基因替换为蝙蝠的同源增强子序列,会导致小鼠前肢延长,在蝙蝠中调控肢体发育的基因的转录增强子会导致前肢骨骼转录水平升高,说明基因的增强子参与蝙蝠前肢的延长[65]。
2010年,Wang等[44]首次利用高通量测序技术标签测序法(Tag-seq),通过比较蝙蝠胚胎期前肢伸长指和短指(趾)的表达序列标签(DGE-tag),筛选出前后肢之间显著性差异表达基因,并对其中14个与前肢指发育相关的基因,包括基因(和)、通路基因(、和)、同源盒基因(和)以及与指畸形或细胞增殖有关的基因(和),进行实时荧光定量PCR表达模式的验证,发现这些基因的表达模式与DGE标记结果一致。因此,该研究从高通量数据中鉴定出可能与指的形成及发育相关的关键基因集,也开启了使用高通量测序技术进行蝙蝠骨骼发育适应性演化分子机制的新时代[66]。
式中 A为道路双向每日实际交通量 (辆/d);D为方向系数,无实测数据时取值范围为0.5~0.6;F为车道系数;V为车辆类型分布系数;E为车辆当量轴载换算系数;i,j为车辆类型编号。
2014年,Wang等[56]以折翼蝠()为研究对象,通过高通量转录组测序技术(mRNA-seq),对蝙蝠胚胎早期(CS14、CS15)、中期(CS16、CS17)和晚期(CS18、CS19)的6个发育阶段前后肢进行转录组测序和原位杂交验证,并与小鼠相同发育阶段的前后肢进行比较,发现与肢体和指发育有关的6个关键转录因子Hoxd9-13 (homeobox d9-13)和T-box转录因子3(T-box transcription factor 3,Tbx3)在蝙蝠胚胎指翼膜中的表达周期较为持久,而且在前后肢中的表达量都非常高。肿瘤抑制因子(BMP/retinoic acid inducible neural specific 3,Fam5c/ Brinp3)仅在蝙蝠的四肢表达而不在小鼠的四肢表达,并且在蝙蝠所有短指区域即DI和趾显著高表达。
以上结果表明,蝙蝠翼膜的发育过程是依赖于多重基因调控网络和复杂的生物学过程,这些基因之间的调控表达促进指翼膜的生长,延长前肢指和保持其他指(趾)较短。
除了转录因子的表达差异,2016年Eckalbar等[67]在高通量多组学水平上以纳塔尔长翼蝠为研究对象,对其胚胎翼膜发育的3个关键时段(CS15、CS16和CS17)及前后肢进行RNA-seq、ChIP-seq(H3K27ac、H3K27me3)测序和整体原位杂交(whole mounthybridization,WISH)验证,以进一步解析蝙蝠翼膜的发育分子机制。研究结果发现,T-box转录因子5(T-box transcription factor 5,)基因附近的Tbx5-as1和基因附近的Hottip,均在前肢、后肢和不同阶段之间差异表达,参与调控蝙蝠翼膜和肢体骨骼的发育。除此之外,还鉴定出调控前肢和前肢指DIII、DV发育的关键表达上调基因:超伸长复合亚基(MLLT3 super elongation complex subunit,和同源盒8基因(LIM homeobox 8,[68,69]。ChIP-seq分析鉴定出在前肢显著差异富集区域附近的基因显著富集在与肢体发育相关的功能通路中。该研究还通过比较基因组学的方法鉴定出蝙蝠中2796个加速区域BAR(bat accelerated regions),这些区域的基因富集到参与调控四肢形态和骨骼发育的信号通路(Bmp、FGF和Wnt/β-catenin信号通路)。该研究从多组学水平全面揭示了蝙蝠翼膜形成的分子机制和通路。同年,Booker等[70]通过对62个脊椎动物基因组(58个非蝙蝠物种和4个蝙蝠)与小鼠不同发育时期的前后肢(E10.5和E11.5) ChIP-seq数据进行比较分析,筛选出BAR116 (bat accelerated regions 116)在蝙蝠胚胎前肢显著表达,而在小鼠前后肢无表达。进一步分析发现BAR116位于肢体发育基因簇5'端附近,说明蝙蝠BAR116序列可能参与了前肢的发育;通过转基因小鼠实验导入蝙蝠BAR116全序列和两翼序列分别替换小鼠相应区域序列,结果表明只有导入BAR116全序列的转基因小鼠,才在前肢高表达BAR116增强子,更加说明了BAR116可能调控基因簇的和成员的表达,从而促进前肢发育。该发现也说明对飞行哺乳动物适应性演化机制的研究,将在基因序列分析的基础上,进入基因间调控模式解析和功能实验验证阶段。针对具有飞行能力蝙蝠独特的翼膜和骨骼适应性演化的分子机制进行的系统总结见表1。
与蝙蝠翼膜和骨骼等形态特征适应性演化的分子机制研究相比,对滑翔类哺乳动物的研究则非常有限。到目前为止,只有Mason等[45]测定了皮翼目鼯猴的基因组数据,通过与其他非滑翔哺乳动物相比,发现鼯猴骨骼肌疾病(如远端肌肉萎缩、手指和足部畸形等)相关基因,包括脊髓小脑共济失调10基因(ataxia type 10 protein)以及参与肌肉收缩的相关基因,包括溶质载体家族18成员A2基因(solute carrier family 18 member A2)、肌钙蛋白1基因(troponin I1)和肌钙蛋白3基因(troponin I3)等受到了正选择作用[71]。这些基因在人类疾病研究中与多种关节或指畸形相关,推测这些基因可能有助于滑翔哺乳动物演化出滑翔能力所需的独特肌肉和骨骼[71,72]。
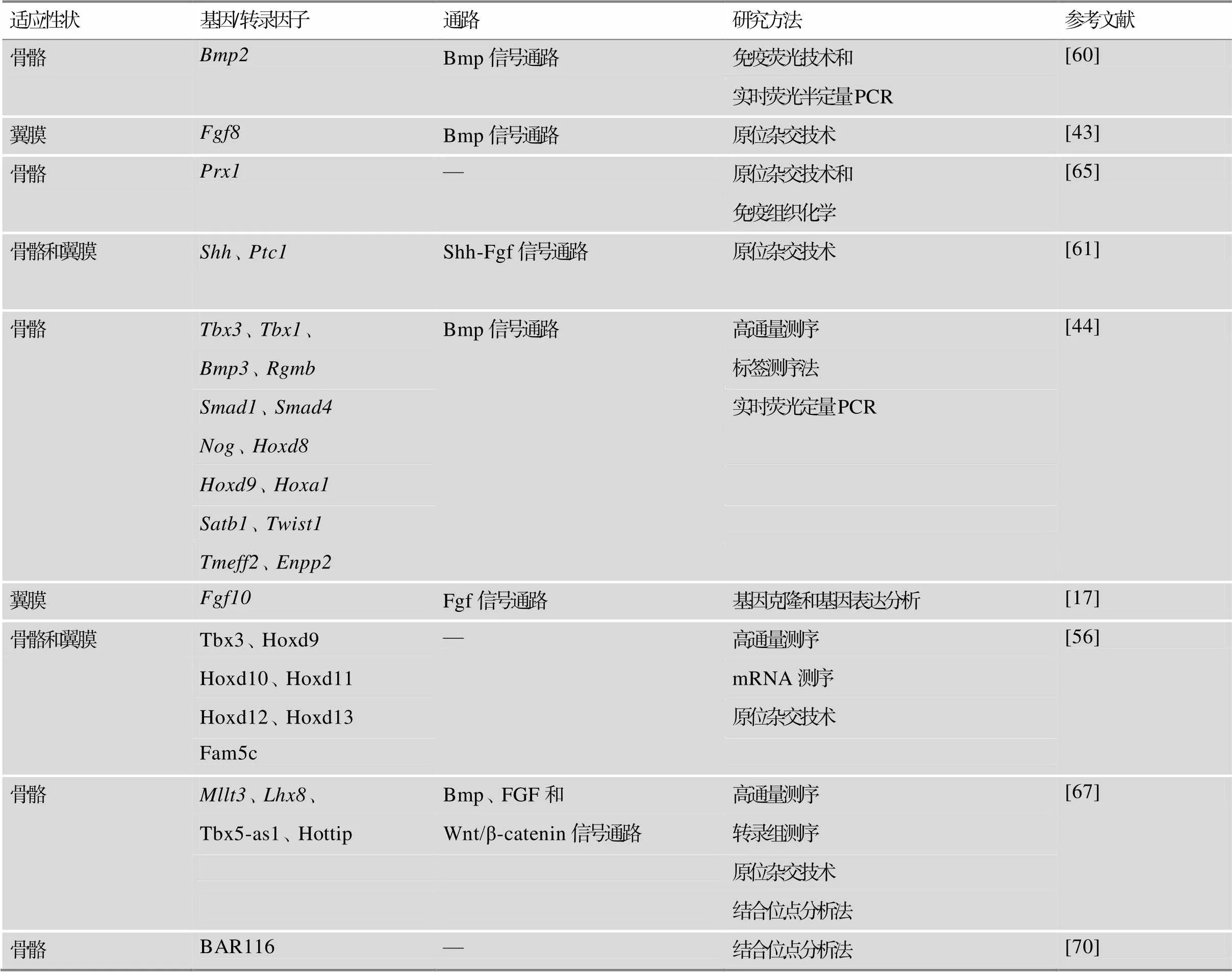
表1 蝙蝠翼膜和骨骼适应性演化的分子机制总结
3 哺乳动物滑翔和飞行的能量代谢适应性特征及分子机制
3.1 能量代谢适应性特征
与胎盘类哺乳动物中的啮齿目和皮翼目滑翔动物相比,有袋目环尾袋貂科的大袋鼯()的尺骨鹰嘴突处延长出一个较短的小软骨刺 (accessory cartilaginous, AC),这也是有袋目袋鼯科和树袋貂科和其他滑翔物种所不具备的[5]。大袋鼯通过把爪子放在下巴下面来滑翔,这样其肘部软骨刺就可以向两侧与身体其他部位成直角的角度伸展,从而在不延长前肢结构的情况下扩大翼膜面积[5]。
2017年,必和必拓公司在厄瓜多尔设立了办公室,并在9月份购买了索尔黄金公司(SolGold)部分股份,一个月后将所持股份扩大了一倍,与新峰矿业公司(Newcrest Mining)展开股权争夺。
3.2 能量代谢适应性演化的分子机制
线粒体呼吸链具有双重遗传基础,由线粒体基因组和核基因组编码而成,供应生物个体生命活动所需的95%能量。来自核基因组和线粒体基因组的基因协同工作、共同进化,产生氧化磷酸化(oxidative phosphorylation, OXPHOS)功能系统,以满足生物体不断增加的能量需求[36,78]。
学校利用“我们的节日”和各种纪念日开展教育活动,特别是利用春节、元宵节、清明节、端午节、中秋节、重阳节等传统节日,大力开展传统文化教育。通过组织阅读活动、知识竞赛、演讲活动、少先队主题实践活动等,挖掘传统节日的文化内涵,使广大师生感受到中华优秀传统文化的魅力,增强师生的文化自信心和传承中华优秀传统文化的感情。“学雷锋活动日”、植树节、世界读书日、世界环境日等纪念日开展相关主题教育和主题实践活动,让学生在实践活动中增长知识,提升素养,强化道德修养,促进学生了解国情、认识社会、坚定信念、磨砺意志,在实践中将社会主义核心价值观内化于心、外化于行,达到知行合一、以知促行、以行促知的目的。
试验在赫章县六曲河镇大田村堰沟组陈进华的承包土地上实施。试验地海拔1 710米,土质为紫砂泥,土壤肥力中上等,前作为玉米。
为了探讨蝙蝠飞行过程中能量代谢的分子基础,Shen等[76]通过对包含10个蝙蝠物种在内的60种哺乳动物的线粒体基因组以及其中包含2个蝙蝠物种共10个哺乳动物的核基因组进行比较分析,发现莹鼠耳蝠(和马来大狐蝠()与氧化磷酸化相关的23.08%线粒体基因和4.90%核基因受到了正选择压力,高于之前预测的正选择基因不会超过2%的比例[79];而对4种蝙蝠的77个基因进行了重测序和正选择分析,结果显示参与能量代谢的基因比例明显更高(27.27%),提供了蝙蝠能量代谢的适应性演化证据。除此之外,Shen等[79]进一步选取了不参与氧化呼吸过程的7146 个编码线粒体基因或者其他与氧化呼吸无关的核基因作为背景对照基因进行分析,结果显示只有72个基因(1.005%)受到了正选择压力,远低于之前检测到的与氧化呼吸链相关的核基因所受正选择压力的比例(4.9%)。这些研究都表明参与能量代谢的基因受到了自然选择的作用,能量代谢是影响蝙蝠飞行的主要因素之一,基因的适应性演化对于实现蝙蝠的飞行是必要的。
高效的能量代谢给蝙蝠动力飞行提供充足的能量,但是代谢所产生的大量副产物,例如活性氧会产生有害的副作用,包括DNA损伤等[80]。2013年,Zhang等[81]对黑狐蝠()和大卫鼠耳蝠()全基因组进行测序和分析,结果显示与其他非飞行的哺乳动物相比,在两个蝙蝠中,多个正选择基因富集在DNA损伤修复机制的通路中。进一步对13个哺乳动物,包括4只蝙蝠(黑狐蝠、大卫鼠耳蝠、莹鼠耳蝠和马来大狐蝠)的原癌基因(MDM2 proto-oncogene,)和肿瘤蛋白基因(tumor protein P53,)进行了分析。之前研究揭示和协同作用可以控制DNA损伤修复中的亚细胞定位[80,81]。该研究结果显示:与核输出信号相关的两个蛋白Mdm2和Tp53蛋白序列分别在黑狐蝠和大卫鼠耳蝠中发生了191位氨基酸位点从亮氨酸(L)到苯丙氨酸(F)替换(Mdm2),319位氨基酸位点从赖氨酸(K)到脯氨酸(P)替换(Tp53)。除此之外,黑狐蝠中还发生了Tp53蛋白序列322位氨基酸位点的赖氨酸(K)到甲硫氨酸(M)替换。以上结果均表明,飞行诱导的适应性演化可能对蝙蝠免疫功能产生有利影响,蝙蝠在飞行演化过程中可能发生了以减小代谢副产物所造成的损害,尤其是减弱对自身遗传物质所造成伤害的适应性演化。
4 结语与展望
适应性演化作为生命科学研究领域中重要的基础性问题,长期以来被广泛关注。哺乳动物在自然选择作用下,演化出适应滑翔和飞行的翼膜和独特的前肢骨骼结构以及高效的能量代谢从而占据天空生态位获取更多的生存资源[82]。当适应性演化研究进入组学时代后,对飞行和滑翔性状的分子机制研究取得了广泛和深入的研究成果,较之前单一的研究手段有了显著地变化。尤其是蝙蝠飞行分子机制的探究经历了从传统的单个基因研究发展到如今高效的高通量基因组研究,包括全基因组测序、转录组测序、表观遗传组测序等,新的技术手段可以更加多维度、高效率、全方面地筛选出与目的性状相关的差异表达基因和调控元件,从多层次、多角度展现了令人惊艳的结果[83]。而滑翔作为飞行的过渡形式,对其研究还主要停留在对适应性特征的描述上,对其分子机制的研究鲜有报道。因此在今后的研究中,可以以蝙蝠飞行适应的研究思路和成果作为范例,应用于滑翔哺乳动物的适应性演化研究,更加全面的揭示哺乳动物滑翔和飞行运动方式的分子机制,促进对飞行演化的理解。此外,目前诸多的研究结果仅仅展示候选基因在遗传序列上的差异变化,但是这些变化是否会对生物的适应性产生影响,还有待功能实验验证[84]来全面系统地揭示哺乳动物多样的运动形式演化过程中的适应性分子机制。
[1] Stern DL. The genetic causes of convergent evolution., 2013, 14(11): 751–764.
[2] Berens AJ, Hunt JH, Toth AL. Comparative transcriptomics of convergent evolution: different genes but conserved pathways underlie caste phenotypes across lineages of eusocial insects., 2015, 32(3): 690–703.
[3] Wilson DE, Reeder DM. Mammal species of the world: a taxonomic and geographic reference., 2007, 88(3): 824–830.
[4] Grossnickle DM, Chen M, Wauer JGA, Pevsner SK, Weaver LN, Meng QJ, Liu D, Zhang YG, Luo ZX. Incomplete convergence of gliding mammal skeletons., 2020, 74(12): 2662–2680.
[5] Stephen J. Gliding mammals of the world. Collingwood, Australia: CSIRO Publishing, 2012.
[6] Futuyma DJ. The evolution of evolutionary ecology., 2013, 59(4): 172–180.
[7] Jackson SM. Glide angle in the genusand a review of gliding in mammals., 2002, 30(1): 9–30.
[8] Asari Y, Yanagawa H, Oshida T. Gliding ability of the siberian flying squirrel., 2012, 32: 151–154.
[9] Bayona-Bafaluy MP, Müller S, Moraes CT. Fast adaptive coevolution of nuclear and mitochondrial subunits of ATP synthetase in orangutan., 2005, 22(3): 716–724.
[10] Teeling EC, Springer MS, Madsen O, Bates P, O'brien SJ, Murphy WJ. A molecular phylogeny for bats illuminates biogeography and the fossil record., 2005, 307(5709): 580–584.
[11] Paskins KE, Bowyer A, Megill WM, Scheibe JS. Take-off and landing forces and the evolution of controlled gliding in northern flying squirrels., 2007, 210(Pt 8): 1413–1423.
[12] Bishop KL. The relationship between 3-D kinematics and gliding performance in the southern flying squirrel,., 2006, 209(Pt 4): 689–701.
[13] Thorington RW, Karolyn D, Gregory AC. Wing tip anatomy and aerodynamics in flying squirrels., 1998, 79(1): 245–250.
[14] Waldman RM, Breuer KS. Shape, lift, and vibrations of highly compliant membrane wings. In: Aiaa Fluid Dynamics Conference, 2013.
[15] Schunk C, Swartz SM, Breuer KS. The effect of wing stroke and aspect ratio on the force generation a compliant membrane flapping wing. In: 68th Annual Meeting of the APS Division of Fluid Dynamics, 2015.
[16] Wei S, Chen SY, Shi SK, Li X, Zhang X, Hu WL, Wang HP. Adsorption of Cu(II) and Pb(II) onto diethylenetriamine-bacterial cellulose., 2009, 75(1): 110–114.
[17] Tokita M, Abe T, Suzuki K. The developmental basis of bat wing muscle., 2012, 3: 1302
[18] Zheng J, Madison LD, Oliver D, Fakler B, Dallos P. Prestin, the motor protein of outer hair cells., 2002, 7(1): 9–12.
[19] Liberman MC, Gao JG, He DZZ, Wu XD, Jia SP, Zuo J. Prestin is required for electromotility of the outer hair cell and for the cochlear amplifier., 2002, 419(6904): 300–304.
[20] Rand DM. The units of selection on mitochondrial DNA., 2001, 32(1): 415–448.
[21] Franchini LF, Elgoyhen AB. Adaptive evolution in mammalian proteins involved in cochlear outer hair cell electromotility., 2006, 41(3): 622–635.
[22] Jones G, Teeling EC, Rossiter SJ. From the ultrasonic to the infrared: molecular evolution and the sensory biology of bats., 2013, 4: 117–121.
[23] Li G, Wang JH, Rossiter SJ, Jones G, Cotton JA, Zhang SY. The hearing gene Prestin reunites echolocating bats., 2008, 105(37): 13959–13964.
[24] Meng QJ, Grossnickle DM, Di L, Zhang YG, Neander AI, Ji Q, Luo ZX. New gliding mammaliaforms from the Jurassic., 2017, 548(7667): 291–296.
[25] Luo ZX, Meng QJ, Grossnickle DM, Liu D, Neander AI, Zhang YG, Ji Q. New evidence for mammaliaform ear evolution and feeding adaptation in a Jurassic ecosystem., 2017, 548(7667): 326–329.
[26] Meng J, Hu YM, Wang YQ, Wang XL, Li CK. A mesozoic gliding mammal from northeastern China., 2006, 444(7121): 889–893.
[27] Jepsen GL. Early eocene bat from wyoming., 1966, 154(3754): 1333–1339.
[28] Simmons NB, Seymour KL, Habersetzer J, Gunnell GF. Primitive early eocene bat from Wyoming and the evolution of flight and echolocation., 2008, 451(7180): 818–821.
[29] Clyde WC, Sheldon ND, Koch PL, Gunnell GF, Bartels WS. Linking the Wasatchian/Bridgerian boundary to the cenozoic global climate optimum: new magnetostratigraphic and isotopic results from south pass, Wyoming., 2001, 167(1): 175–199.
[30] Simmons NB, Geisler JH. Phylogenetic relationships of Icaronycteris, Archaeonycteris, Hassianycteris, and Palaeochiropteryx to extant bat lineages, with comments on the evolution of echolocation and foraging strategies in Microchiroptera., 1998, 235(235): 4–169.
[31] Paul AR, Susan MS. Ecology, evolution, and behaviour of bats. In: Symposia of the Zoological Society of London, 1995.
[32] Smith JD. Comments on flight and the evolution of bats. In: Major Patterns in Vertebrate Evolution. New York: Plenum Press, 1977, 427–437.
[33] Darwin C. On the origin of species by means of natural selection, or the preservation of favoured races in the struggle for life., 1860, 25(50): 367–404.
[34] Norberg UM. Vertebrate flight: mechanics, physiology, morphology, ecology and evolution. New York: Springer- Verlag Berlin Heidelberg, 1990.
[35] Socha JJ, Jafari F, Munk Y, Byrnes G. How animals glide: from trajectory to morphology., 2015, 93(24): 901–924.
[36] Robert D, Greg B, Stephen PY, Brendan B, Rafe MB, Jimmy AM. Gliding and the functional origins of flight: biomechanical novelty or necessity?, 2007, 38(1): 179–201.
[37] Endo H, Yokokawa K, Kurohmaru M, Hayashi Y. Functional anatomy of gliding membrane muscles in the sugar glider ()., 1998, 180(1): 93–96.
[38] Zhu J. Adaptation of the forelimbs of the flying squirrel (L. ) to gliding.,1959, (2): 139–145.
朱靖. 鼯鼠(L. )前肢对滑翔运动的适应. 动物学报, 1959, (2): 139–145.
[39] Janecka JE, Miller W, Pringle TH, Wiens F, Zitzmann A, Helgen KM, Springer MS, Murphy WJ. Molecular and genomic data identify the closest living relative of primates., 2007, 318(5851): 792–794.
[40] Taylor BD, Goldingay RL. Squirrel gliders use roadside glide poles to cross a road gap., 2013, 35(1): 119.
[41] Von BR, Swartz SM, Voigt CC. Flight metabolism in relation to speed in Chiroptera: testing the U-shape paradigm in the short-tailed fruit bat., 2013, 216(11): 2073–2080.
[42] Hockman D, Mason MK, Jacobs DS, Illing N. The role of early development in mammalian limb diversification: A descriptive comparison of early limb development between the natal long-fingered bat () and the mouse ()., 2010, 238(4): 965–979.
[43] Sears KE, Behringer RR, Rasweiler JJ, Niswander LA. Development of bat flight: morphologic and molecular evolution of bat wing digits., 2006, 103(17): 6581–6586.
[44] Wang Z, Dong D, Ru BH, Young RL, Han NJ, Guo TT, Zhang SY. Digital gene expression tag profiling of bat digits provides robust candidates contributing to wing formation., 2010, 11(1): 619.
[45] Mason VC, Li G, Minx P, Schmitz J, Churakov G, Doronina L, Melin AD, Dominy NJ, Lim NTL, Springer MS, Wilson RK, Warren WC, Helgen KM, Murphy WJ. Genomic analysis reveals hidden biodiversity within colugos, the sister group to primates., 2016, 2(8): e1600633.
[46] Rong NN. A skillful glider among rocks and forests flying squirrel.,2013, (6): 130–139.
荣楠楠. 飞鼠为什么会飞?山林间的滑翔高手. 环球人文地理, 2013, (6): 130–139.
[47] Gupta BB. Notes on the gliding mechanism in the flying squirrel. American: University of Michigan Museum of Zoology, 1966.
[48] Speakman JR. The evolution of flight and echolocation in bats: another leap in the dark., 2001, 31(2): 111–130.
[49] Stafford BJ, Jr TRW. Carpal development and morphology in archontan mammals., 1998, 235(2): 135–155.
[50] Oshida T, Hachiya N, Yoshida MC, Ohtaishi N. Comparative anatomical note on the origin of the long accessory styliform cartilage of the Japanese giant flying squirrel,., 2000, 25(1): 35–39.
[51] Thorington RW, Stafford BJ. Homologies of the carpal bones in flying squirrels (): a review., 2001, 26(1): 61–68.
[52] Kawashima T, Thorington Jr RW, Bohaska PW, Sato F. Evolutionary transformation of the palmaris Longus muscle in flying squirrels (Pteromyini: Sciuridae): an anatomical consideration of the origin of the uniquely specialized styliform cartilage., 2017, 300(2): 340–352.
[53] MacPhee RDE. Primates and their relatives in phylogenetic perspective. New York: Plenum Press, 1993, 63-90.
[54] Geng WH, Wang XP, Che LF, Wang X, liu R, Zhou T, Roos C, Irwin D, Yu L. Convergent evolution of locomotory modes in Euarchontoglires., 2020, 8: 615862.
[55] Morris PJR, Cobb SNF, Cox PG. Convergent evolution in the Euarchontoglires., 2018, 14(8): 20180366.
[56] Wang Z, Dai MY, Wang Y, Cooper KL, Zhu TT, Dong D, Zhang JP, Zhang YS. Unique expression patterns of multiple key genes associated with the evolution of mammalian flight., 2014, 281(1783): 20133133.
[57] Norberg UM. Bat wing structures important for aerodynamics and rigidity (Mammalia, Chiroptera)., 1972, 73(1): 45–61.
[58] Konow N, Swartz SM. Advances in the study of bat flight: the wing and the wind1., 2015, 93(12): 977–990.
[59] Phamduy P, Vazquez M. Design and characterization of a miniature free-swimming robotic fish based on multi-material 3D printing., 2017, 1(2): 209–223.
[60] Weatherbee SD, Behringer RR, Rasweiler JJ, Niswander LA. Interdigital webbing retention in bat wings illustrates genetic changes underlying amniote limb diversification., 2006, 103(41): 15103–15107.
[61] Hockman D, Cretekos CJ, Mason MK, Behringer RR, Jacobs DS, Illing N. A second wave of sonic hedgehog expression during the development of the bat limb., 2008, 105(44): 16982–16987.
[62] Hutcheon JM, Kirsch J. Camping in a different tree: results of molecular systematic studies of bats using DNA–DNA Hybridization., 2004, 11(1): 17–47.
[63] Eick GN, Jacobs DS, Matthee CA. A Nuclear DNA phylogenetic perspective on the evolution of echolocation and historical biogeography of extant bats (Chiroptera)., 2005, 22(9): 1869–1886.
[64] Cooper LN, Cretekos CJ, Sears KE. The evolution and development of mammalian flight., 2012, 1(5): 773–779.
[65] Cretekos CJ, Wang Y, Green ED, Martin JF, Rasweiler JJ, Behringer RR. Regulatory divergence modifies limb length between mammals., 2008, 22(2): 141–151.
[66] Wang Z, Zhang SY. Recent studies on the evolution of mammalian flight using high-throughput sequencing technology.2017(7): 631–634.
王喆, 张树义. 高通量测序解析哺乳动物飞行进化的分子机制. 科学通报, 2017(7): 631–634.
[67] Eckalbar WL, Schlebusch SA, Mason MK, Gill Z, Parker AV, Booker BM, Nishizaki S, Muswamba-Nday C, Terhune E, Nevonen KA, Makki N, Friedrich T, VanderMeer JE, Pollard KS, Carbone L, Wall JD, Illing N, Ahituv N. Transcriptomic and epigenomic characterization of the developing bat wing., 2016, 48(5): 528–536.
[68] Collins EC, Appert A, Ariza ML, Pannell R, Yamada Y, Rabbitts TH. Mouse Af9 Is a controller of embryo patterning, like mlll, whose human homologue fuses with AF9 after chromosomal translocation in leukemia., 2002, 22(20): 7313–7324.
[69] Zhao Y, Marin O, Hermesz E, Powell A, Flames N, Palkovits M, Rubenstein J, Westphal H. The LIM-homeobox gene Lhx8 is required for the development of many cholinergic neurons in the mouse forebrain., 2003, 100(15): 9005–9010.
[70] Booker BM, Friedrich T, Mason MK, VanderMeer JE, Zhao J, Eckalbar WL, Logan M, Illing N, Pollard KS, Ahituv N. Bat accelerated regions Identify a bat forelimb specific enhancer in the hoxd locus., 2016, 12(3): e1005738.
[71] Storey E. Genetic cerebellar ataxias., 2014, 34(3): 280–292.
[72] Sussman RW, Rasmussen DT, Raven PH. Rethinking primate origins again., 2013, 75(2): 95–106.
[73] Byrnes G, Libby T, Lim NTL, Spence AJ. Gliding saves time but not energy in malayan colugos., 2011, 214(16): 2690–2696.
[74] Flaherty EA, Ben DM, Smith WP. Quadrupedal locomotor performance in two species of arboreal squirrels: predicting energy savings of gliding., 2010, 180(7): 1067–1078.
[75] Guigueno MF, Shoji A, Elliott KH, Aris BS. Flight costs in volant vertebrates: a phylogenetically-controlled meta- analysis of birds and bats., 2019, 235: 193–201.
[76] Shen YY, Liang L, Zhu ZH, Zhou WP, Irwin DM, Zhang YP. Adaptive evolution of energy metabolism genes and the origin of flight in bats., 2010, 107(19): 8666–8671.
[77] Whiteman JP, Greller KA, Harlow HJ, Felicetti LA, Rode K, Merav BD. Carbon isotopes in exhaled breath track metabolic substrates in brown bears (Ursus arctos)., 2012, 93(2): 413–421.
[78] Tang ZX, Yang ZF, Hu ZQ, Zhang D, Lu X, Jia B, Deng DX, Xu CW. Cytonuclear epistatic quantitative trait locus mapping for plant height and ear height in maize., 2013, 31(1): 1–14.
[79] Carolin K, Vina T, Da FRR, Hubisz MJ, Bustamante CD, Rasmus N, Adam S. Patterns of positive selection in six mammalian genomes., 2008, 4(8): e1000144.
[80] Kevin O, Li HP, Zhang ZP. Nucleocytoplasmic shuttling of p53 is essential for MDM2-mediated cytoplasmic degradation but not ubiquitination., 2003, 23(18): 6396–6405.
[81] Roth J, Dobbelstein M, Freedman DA, Shenk T, Levine AJ. Nucleo-cytoplasmic shuttling of the hdm2 oncoprotein regulates the levels of the p53 protein via a pathway used by the human immunodeficiency virus rev protein., 1998, 17(2): 554–564.
[82] Neuweiler G. The biology of bats. New York: Oxford University Press, 2000.
[83] Cheng SC, Wang XP, Yu L. Recent progress in convergent molecular evolution of animals based on multi-omics studies.2019(7): 874–887.
程绍臣, 王晓萍, 于黎. 基于多组学水平的动物分子趋同演化研究新进展. 中国科学: 生命科学, 2019(7): 874–887.
[84] Jiang M, Li HL, Pang PP, Han JS, Li Y, Zhang XN. Development and prospect of high-throughput single-cell transcriptome sequencing.,2020, 32(12): 1280–1287.
蒋敏, 李慧莉, 庞盼盼, 韩峻松, 李跃, 张晓娜. 高通量单细胞转录组测序发展与展望. 生命科学, 2020, 32(12): 1280–1287.
Progresses on adaptive evolution of gliding and flying ability in mammals
Shanshan Gao, Jinliang Li, Jiani Yang, Tong Zhou, Rui Liu, Xiaoping Wang, Li Yu
The adaptive evolution of locomotion forms is closely related to living behaviors such as predation, defense, reproduction and communication. Diverse forms of mammalian locomotion play an important role in the occupation of new habitats and the acquisition of new resources. The gliding and flying ability of mammals are special locomotion forms to adapt to the environment, which is a classical model of adaptive evolution study. In order to adapt to survival, the gliding and flying mammals have undergone a series of adaptive changes in morphology, physiology and behavior. In recent years, with the increasing development of high-throughput sequencing technologies such as genome and transcriptome, adaptive evolution research has entered the era of omics, which can more systematically and comprehensively reveal the molecular basis behind adaptive evolution
