二甲双胍对斑马鱼骨骼发育及损伤修复的机制研究
2022-02-12贾婷婷雷蕾吴歆媛蔡顺有陈艺璇薛钰
贾婷婷,雷蕾,吴歆媛,蔡顺有,陈艺璇,薛钰
二甲双胍对斑马鱼骨骼发育及损伤修复的机制研究
贾婷婷1,雷蕾1,吴歆媛1,蔡顺有2,陈艺璇1,薛钰1
1. 闽南师范大学,福建省菌类活性物质工程技术研究中心,漳州 363000 2. 闽南师范大学,化学化工与环境学院,福建省现代分离分析重点实验室,漳州 363000
二甲双胍(metformin, MET)是治疗糖尿病的一线药物,对骨骼疾病也有一定的治疗效果,但具体作用机制尚不明确。本研究利用斑马鱼()构建骨质疏松模型,通过荧光观察、骨骼染色、半定量PCR、原位杂交及ELISA等技术方法,探究MET对斑马鱼骨骼发育及损伤修复的作用机制。首先通过胚胎致死率、骨骼矿化及钙化程度确定了MET的工作浓度是0.1%,该浓度MET对斑马鱼胚胎和幼鱼的骨骼发育均有显著的促进作用,可通过增强骨骼调控基因的mRNA水平和蛋白质水平实现。进一步利用枸橼酸铁铵(ferric ammonium citrate, FAC)和硝基还原酶/甲硝唑(nitroreductase/metronidazole, NTR/MTZ)系统构建斑马鱼体外和体内骨质疏松模型,并利用MET进行恢复实验,结果表明MET能显著修复FAC或MTZ诱导引起的骨骼矿化面积减小、脊椎钙化减少、成骨分化减弱等骨质疏松表型,通过促进成骨细胞再生、增强成骨细胞标记物(ALP)表达和抑制破骨细胞标记物(、TRAP)的活性发挥修复作用。最后,通过检测Bmp信号成员的表达水平变化,初步证明MET不仅可以增强Bmp的mRNA和蛋白表达,还可通过激活Bmp下游信号通路促进斑马鱼骨骼发育和损伤修复。综合本研究的实验结果表明,MET作为治疗糖尿病专用药的同时,对斑马鱼骨骼发育也有促进作用,且对骨质疏松症具有显著的修复功效,为老药新用提供了新的研究方向和实验支撑。
二甲双胍;斑马鱼;骨质疏松;损伤修复;Bmp
最近的研究已经证实MET可以减少巨噬细胞促炎症细胞因子的产生,在多发性硬化症(multiple sclerosis, MS)治疗中表现出理想的免疫调节活性[12]。此外,最近的一项蛋白组学研究表明,由于MET的抗病毒活性以及在动物模型中具有减轻急性肺损伤的效果,因此认为MET可以通过增强人体蛋白ACE2磷酸化水平,从而改变其构象来破坏病毒蛋白与ACE2受体之间的相互作用直接抑制SARS-CoV-2感染,可被用作SARS-CoV-2感染和其他病毒感染的潜在治疗药物[13]。研究表明,MET可以促进体外骨细胞的增殖、分化及细胞外基质矿化,逆转高浓度葡萄糖对成骨细胞功能的损伤,抑制破骨细胞的形成,保护2型糖尿病(adult-onset diabetes mellitus, DM)患者的骨质[14]。
骨质疏松症(osteoporosis)是由于骨组织中完成骨吸收功能的破骨细胞,与主导骨形成功能的成骨细胞,二者之间的平衡被打破从而引起的骨代谢性疾病[15],主要表现为骨折风险增加,严重威胁患者生命安全。目前全球已超过2亿人患有骨质疏松病,我国约有1.4亿骨质疏松症患者,其中40岁以上人群的患病率为24.6%,位列全球慢性病第3位。随着人口老龄化的加剧,骨质疏松症已成为全球性健康问题[16]。
骨组织的发育、重建是一个完整的动态过程。目前已在小鼠()、兔()、猴()等动物中成功构建了骨质疏松模型[17],但存在造模用药周期长、工作量大且成本高等限制因素,上述模型本身无法动态追踪骨骼损伤及重建过程。斑马鱼()由于躯体透明度高、便于观察,在20
世纪80~90年代初就被确立为一种新的模式动物。由于其基因与人类基因的相似度较高,尤其是骨骼发育过程的分子调控机制与哺乳动物具有高度的同源性。目前已经发展出多种成熟的研究骨骼发育的技术手段,包括不同的骨骼染色技术及对特异标记骨骼的转基因品系的荧光追踪,为建立骨疾病模型的构建以及药物筛选提供了有力支撑[18]。本实验室在前期工作中,利用高铁胁迫成功构建了斑马鱼骨质疏松疾病模型,该模型可用于抗骨质疏松药物的筛选及机理研究,且对临床知名抗骨质疏松药物阿伦磷酸钠具有同样适用性[19]。本研究进一步利用斑马鱼骨质疏松模型探究了MET促进成骨再生的活性及损伤修复的作用机制,为其用于骨疾病临床治疗提供思路和依据。
1 材料和方法
1.1 材料
MET缓释片为中美上海施贵宝制药有限公司生产。
本研究所使用的斑马鱼品系包括:TU、成骨细胞特异表达的()表征Bmp信号活性的()。()品系由清华大学孟安明课题组构建和筛选;()品系由中国科学院动物研究所王强课题组赠予。所有斑马鱼品系均饲养于28±0.5℃淡水循环系统中,光照周期14 h光照/10 h黑暗,水循环系统pH恒定为7.0~7.4,每日定时定量喂食丰年虾3次[20]。
实验前一晚,挑选达到性成熟、交配成功率高的斑马鱼于配鱼缸中,隔板将雌雄鱼隔开,于次日上午8:00换水后抽出中间隔板,30 min后收集受精卵于含有Holfreter水(3.5 g/L NaCl、0.1 g/L CaCl2、0.05 g/L KCl、0.025 g/L NaHCO3)的培养皿中,28℃恒温培养。
2018年8月6日起北京一轮雨势来临的几天里,我们当年黑龙江建设兵团老九连的一帮“老职工”又出远门了,去距京六七百公里的内蒙古东蒙克什克腾旗一带旅行。
1.2 给药浓度的确定
用Holfreter水配制不同浓度MET溶液(浓度分别为0 mg/mL、0.5 mg/mL、1 mg/mL、2 mg/mL、5 mg/mL、10 mg/mL),以6孔板为实验容器,每孔加入30枚胚胎,同一浓度设两组平行,于28℃恒温培养箱培养,每12 h换药;同时记录挑走的死亡胚胎数和存活胚胎的发育状况,72 h后统计并计算致死率,选择致死率较低的为给药浓度。
1.3 MET对骨骼发育的影响
TU品系自交,收集受精后0.75 h的胚胎,分于6孔板中,每孔30枚;Holfreter水设为空白对照组,给药组为实验组,每12 h换药,保持药物浓度不变,28℃恒温培养至8 d。用双蒸水清洗幼鱼,收集样品用于后续实验。
1.4 MET对体外骨质疏松斑马鱼模型的修复
本实验室在前期的研究工作中通过摸索确定500 g/mL枸橼酸铁铵(ferric ammonium citrate, FAC)可成功构建斑马鱼骨质疏松模型。本研究中,将受精后的胚胎于Holfreter水培养4 d后分为:空白对照即CTR组(Holfreter水继续培养至第8 d)、FAC持续造模组(500 g/mL FAC培养至第8 d)、Holfreter水阴性对照组(FAC培养2 d后,换为Holfreter水培养2 d)、依替膦酸二钠(etidronate, ED)阳性对照组(FAC培养2 d后,换为1 mg/mL ED培养2 d)和MET实验组(FAC培养2 d后,换为1 mg/mL MET培养2 d),共5组,对培养至8 d的幼鱼进行染色或其他实验。
1.5 MET对体内骨质疏松模型的损伤修复
NTR/MTZ细胞消融体系中,当加入硝基还原酶(nitroreductase, NTR)底物甲硝唑(metronidazole, MTZ)时,MTZ与NTR反应,可特异性杀死被荧光标记的细胞,荧光表达消失。本研究利用成骨细胞特异表达的转基因品系(),在该品系中通过MTZ诱导可特异破坏杀死成骨细胞,从体内模拟骨质疏松症。对发育至48 hpf的胚胎,将其分为:空白对照即CTR组(Holfreter水继续培养至第5 d)、MTZ持续造模组(8 mmol/L MTZ培养至第5 d)、ED组(MTZ培养1 d后,换为1 mg/mL ED培养2 d)和MET实验组(MTZ培养1 d后,换为1 mg/mL MET培养2 d),共4组,收集5 d的幼鱼进行后续实验。
1.6 茜素红和钙黄绿素染色
茜素红(alizarin red)染色骨钙化基质,与骨骼中的钙离子螯合发生显色反应,产生深红色的有色化合物,以此来判断干细胞向骨细胞转化的程度,可用于检测斑马鱼成骨的发育程度[21,22]。钙黄绿素(calcein)在进入斑马鱼体内后可与骨骼中钙化的骨基质结合,产生强烈的绿色荧光。因此钙黄绿素可用于标记斑马鱼成骨骨结构,是活体斑马鱼骨染色最好的染色剂[23]。茜素红和钙黄绿素染色方法参考文献[24]。染色完成后,拍照记录染色情况。
1.7 整胚原位杂交及半定量PCR
利用整胚原位杂交及半定量PCR技术在mRNA水平上检测骨骼相关基因和的表达。Runx2家族作为调控成骨特异性转录因子,是间充质细胞向成骨细胞分化的重要标志。研究表明,成骨细胞分化初期,、起始骨基质蛋白的生成,从而使成骨细胞向骨细胞转化[25]。是一种重要的早期胚胎发育相关因子,在软骨形成中起着极其重要的作用[26]。锌指转录因子s(也称)是成骨细胞分化和骨骼形成的标记基因,是成骨细胞特异表达的转录因子[27]。组织蛋白酶K ()和基质金属蛋白酶-9 ()是破骨细胞标志基因,破骨细胞吸附到旧骨质上分泌Ctsk和Mmp9等蛋白酶消化骨基质,形成吸收窝陷,导致骨吸收[27]。Bmp(bone morphogenetic proteins)是TGF-β超家族中的一个亚家族,该蛋白家族在不同的组织中具有广泛的生物活性,参与骨组织、血液、心脏、肾脏、肝脏以及肺等的发育。Bmp通过胞内信号转导,调控骨骼发育,包括软骨和硬骨形成、颅面骨和肢体骨骼发育,并且这种调控作用在不同脊椎动物模型中是高度保守的[28]。
总RNA提取、反转录和原位杂交实验步骤参考文献[24]。
1.8 ELISA检测蛋白表达量
本研究采用特异检测斑马鱼骨骼发育调控因子的ELISA试剂盒(中国台湾Zgenebio公司)检测碱性磷酸酶(alkaline phosphatase, ALP)、抗酒石酸酸性磷酸酶(anti-tartrase acid phosphatase, TRAP)、Sox9、Bmp2b及Bmp4的蛋白表达量,实验步骤根据试剂盒说明书进行。
2 结果与分析
2.1 二甲双胍能显著促进斑马鱼硬骨矿化和钙化
本研究通过不同浓度梯度的MET溶液培养斑马鱼胚胎,对胚胎发育毒性进行测试,通过致死率、发育延缓程度确定合适的MET工作浓度。如图1所示,与对照组(0 mg/mL)相比,0.5 mg/mL、1 mg/mL、2 mg/mL浓度处理组的致死率均小于15%,这几个浓度下的胚胎发育速度均正常;5 mg/mL浓度组死亡率超过23.33%,MET浓度为10 mg/mL时致死率最高,高达90%,存活的胚胎发育迟缓严重(图1:A,B)。选择0.5 mg/mL、1 mg/mL、2 mg/mL浓度MET处理受精后0.75 h的胚胎,收集8 dpf幼鱼进行不同的硬骨染色观察MET对幼鱼骨骼发育的影响。茜素红染色能观察到对照组在孔盖(operculum, op)、脊索(notochord, nc)、匙骨(cleithrum, cl)、副蝶骨(parasphenoid, ps)等部位有清晰的染色信号,当不同浓度的MET处理后,能引起斑马鱼在nc、cl部位的染色信号出现不同程度加深,在op、nc、cl、ps部位的染色区域扩大(图1C);从钙黄绿素染色结果分析可见:对照组有6节脊出现钙化,其中5节较为完整,不同浓度MET处理后,脊椎的钙化数量增至7到8节,钙化完整的脊椎进一步增多(图1D)。通过对上述染色区域及光密度值(IOD)进行统计学分析发现,1 mg/mL MET对骨骼矿化及钙化的促进作用最明显(图1E)。故在后续的实验中,本研究以1 mg/mL即0.1% MET为主要工作浓度。
2.2 MET促进骨骼发育调控关键因子的表达
MET对斑马鱼幼鱼的硬骨发育有明显促进作用。为了进一步探究MET对骨骼发育调控基因表达的影响,本研究首先通过原位杂交检测了0.1% MET处理24 hpf后基因家族的时空表达情况。在胚胎发育早期主要在前上颌骨及齿骨表达,本研究结果表明,MET能促进在前上颌骨的表达明显增强(图2A);MET对和在头部表达也有相同的促进作用(图2:B,C),预示着MET对斑马鱼骨骼发育的影响在胚胎发育早期开始发挥作用。本研究进一步检测了MET处理8 dpf的幼鱼,通过ELISA检测Sox9、ALP和TRAP的蛋白水平变化。其中,在MET诱导下Sox9、ALP的蛋白表达明显增加,表明MET可以明显增强成骨细胞的活性(图2:D,E);与此相反,MET能显著下调TRAP的表达水平,表明MET对破骨细胞形成具有抑制作用(图2F)。
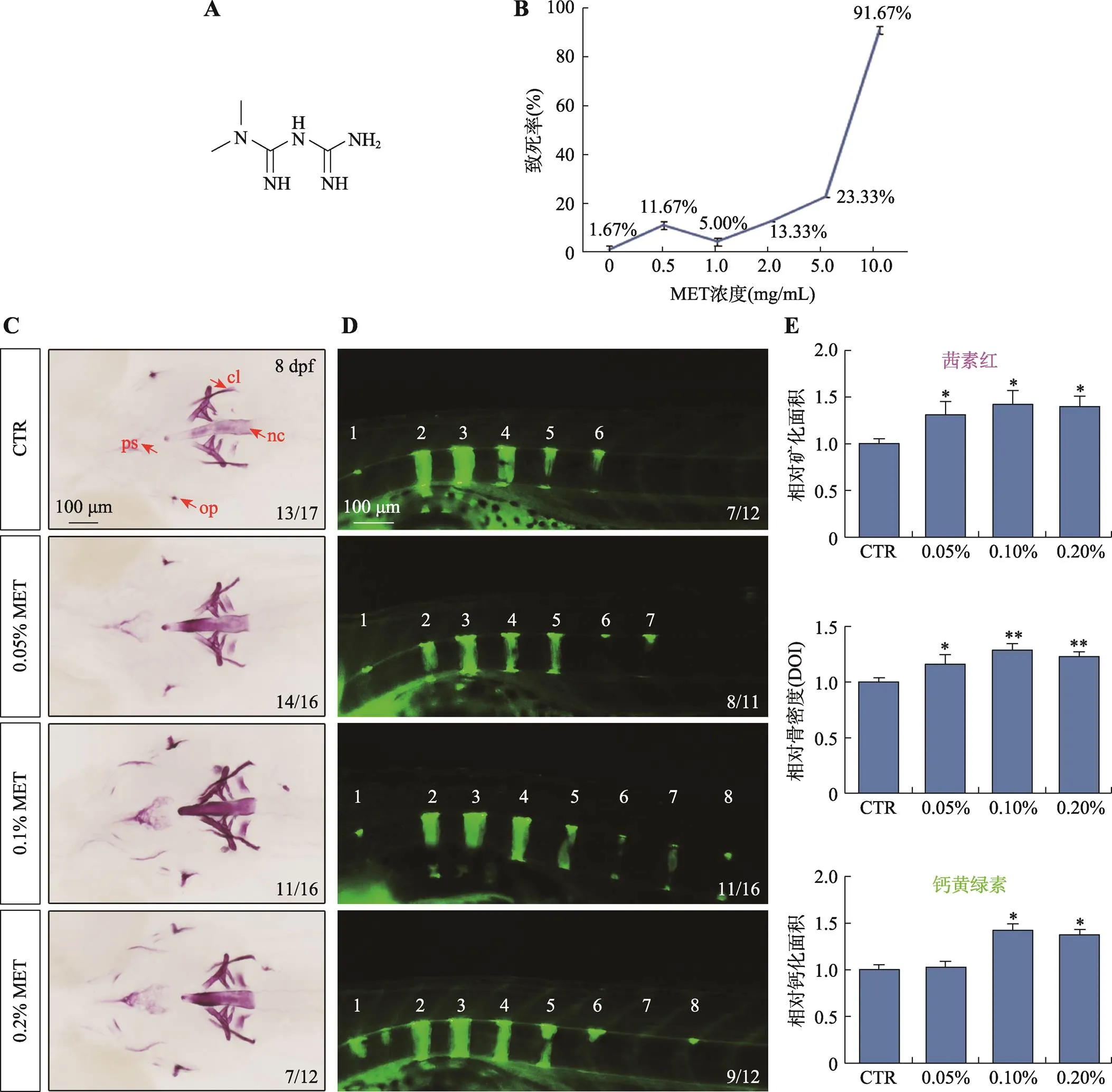
图1 胚胎致死率及骨骼染色结果
A:二甲双胍(MET)分子结构示意图;B:不同浓度下胚胎致死率;C:茜素红染色腹部观;D:钙黄绿素染色侧面观;E:统计分析结果。ps:副蝶骨;nc:脊索;cl:匙骨;op:孔盖。与空白对照(CTR)组比较,*表示<0.05,**表示<0.01。图右下角的数字例如13/17表示17枚胚胎中有13枚胚胎着色如图所示,具有统计学意义。

图2 MET处理对成骨相关表达基因在mRNA水平及蛋白质水平的影响
A~C:二甲双胍(MET)处理后检测24 hpf成骨相关基因的mRNA表达(A:胚胎背面观;B、C:胚胎侧面观);D~F:骨骼相关蛋白标识物的表达。与空白对照(CTR)组比较,*表示<0.05。
2.3 MET对斑马鱼体外骨质疏松模型的损伤修复作用
MET在不同水平上均可促进斑马鱼骨骼发育。本实验室在前期工作中成功构建了体外高铁FAC诱导的斑马鱼骨质疏松模型[19,27],基于此,为了探究MET对骨骼损伤是否也具有治疗作用,本研究进一步探索了MET是否能修复高铁诱导的骨骼损伤。采用1.4所述的给药方式(图3A),收集发育至8 dpf的幼鱼进行茜素红染色。结果表明,与CTR组相比,FAC组即模型组在孔盖(op)和脊索(nc)的染色信号完全消失,仅剩极少的染色信号在匙骨(cl)可见;MET恢复组中op、nc染色面积均有明显恢复,且cl染色面积及染色深度明显增加(图3B)。钙黄绿素染色结果表明,FAC组脊椎钙化数量减少至两节,明显少于CTR组,MET组加药后可使脊椎节数恢复为4节(图3C)。对两种染色结果进行统计学分析,发现MET可以有效修复由FAC诱导的斑马鱼体外硬骨及脊柱钙化损伤(图3:D~F)。
经1.4所述给药方式处理后,收集不同组别样品提取总RNA并进行反转录和PCR扩增获得骨骼标记基因的特异扩增片段表征mRNA表达水平,通过对电泳条带及条带灰度进行分析,可以看到FAC组的表达量明显低于CTR组,约为对照组的70%左右,MET组与FAC组相比有显著升高。而对于和,结果则相反,其中FAC诱导组中这两个基因的相对表达量均增加了3倍以上,表明破骨细胞与成骨细胞的平衡被明显破坏,MET能将这种异常升高显著下调(图3:G,H)。上述结果表明,MET可以通过调控骨骼标记基因在mRNA水平上的表达促进成骨细胞分化,抑制破骨细胞活性,有效恢复FAC诱导的斑马鱼骨骼损伤。

图3 MET对FAC诱导的体外骨质疏松模型的修复作用
A:给药示意图;B:茜素红染色腹部观;C:钙黄绿素染色侧面观;D~F:染色统计分析结果;G:、、基因PCR扩增电泳图;H:对G图中电泳条带的灰度分析;I:ALP蛋白相对表达量;J:TRAP蛋白相对表达量。CTR:空白对照组;FAC:枸橼酸铁铵诱导组;Holf:Holfreter水阴性恢复组;ED:依替膦酸二钠阳性药物组;MET:二甲双胍处理组。cl:匙骨;nc:脊索;op:孔盖。与CTR组比较,#表示<0.05,##表示<0.01,###表示<0.001;与FAC组比较,*表示<0.05,**表示<0.01,***表示<0.001。
此外,本研究通过ELISA对成骨细胞标记因子ALP及破骨细胞标记因子TRAP进行蛋白水平的检测,结果与mRNA变化趋势相似,MET可以促进由FAC引起的ALP表达降低,降低由FAC引起的TRAP的表达升高(图3:I,J)。证明MET可以在蛋白质水平上修复由FAC诱导的斑马鱼体外骨质疏松。
2.4 MET对成骨细胞再生具有明显促进作用
本研究还利用转基因品系()[29]诱导模拟斑马鱼体内骨质疏松模型。该品系中正常胚胎可在成骨细胞特异表达红色荧光蛋白,当加入NTR底物MTZ时,MTZ与NTR反应特异性杀死成骨细胞,成骨细胞减少,破骨细胞相对增加,骨平衡被打破,进一步诱发骨质疏松症。采用1.5所述的处理方式(图4A),收集发育至5 dpf的幼鱼,观察不同组别的红色荧光蛋白表达情况并进行茜素红染色。结果发现:相比于对照组,MTZ模型组的红色荧光的表达在匙骨(cl)、孔盖(op)、副蝶骨(ps)、鳃条骨(branchiostegal, bs)、麦柯耳软骨(Meckel’s cartilage, mk)及软骨内成骨(entochondrostosis, en)等区域整体明显减弱且呈点状分布(图4B);骨骼染色显示硬骨脊索(nc)、匙骨(cl)、孔盖(op)几乎完全消失(图4D),表明成骨细胞大部分被杀死、硬骨被破坏。统计数据显示,MTZ组的荧光表达区域及染色面积均显著减少,约为对照组的1/10甚至更低水平。加入MET后,红色荧光恢复完整、硬骨染色明显恢复接近于对照组,甚至超过阳性药物ED组(图4:C,E)。结果表明,MET可以有效修复MTZ诱导引起的成骨细胞损伤,且这一修复作用是通过促进成骨细胞再生实现的。

图4 MET对转基因斑马鱼Tg(osx: mCherry-Ntr)成骨细胞再生具有明显促进作用
A:给药示意图;B:荧光表达腹部观;C:相对荧光面积统计分析;D:茜素红染色腹部观;E:相对矿化面积统计分析;F:ALP、TRAP蛋白相对表达量。CTR:空白对照组;MTZ:甲硝唑诱导组;ED:依替膦酸二钠恢复组;MET:二甲双胍恢复组。cl:匙骨;op:孔盖;bs:鳃条骨;ps:副蝶骨;mk:麦柯耳软骨;en:软骨内成骨;nc:脊索。与CTR组比较,#表示<0.05,##表示<0.01,###表示<0.001;与MTZ组比较,*表示<0.05,**表示<0.01,***表示<0.001。
进一步检测成骨细胞和破骨细胞标记因子的蛋白质水平变化,得到相似的结果,MTZ诱导引起ALP蛋白水平下降至对照组的30%,MET处理能将其恢复至60%左右,MET能显著修复由MTZ引起的TRAP表达增高,降低至与对照组相当的水平(图4F)。上述结果表明MTZ诱导的体内骨质疏松模型中,MET能通过促进成骨细胞再生,增强成骨标记因子的蛋白表达水平,抑制破骨细胞活性发挥修复功效。
2.5 MET对斑马鱼成骨的促进及损伤修复的作用机制
为了探索MET对斑马鱼成骨的促进及损伤修复的作用机制,本研究检测了Bmp信号通路基因和的表达情况。收集用0.1% MET处理24 hpf的胚胎进行整胚原位杂交,结果表明:MET能促进和在头部、躯干和尾部的表达有明显增加(图5A)。用MET持续处理至8 dpf,通过ELISA检测Bmp相关蛋白,结果同样表明,与CTR组相比,MET可以显著增加Bmp2b、Bmp4相关蛋白标识物的表达量(图5B),这表明MET对Bmp信号通路的促进作用不仅可以发生在胚胎的早期发育阶段,还可以持续到晚期。
本研究还进一步检测了骨质疏松模型中Bmp信号成员的基因表达和蛋白表达水平变化。在FAC诱导的体外骨质疏松模型中,对不同组别进行反转录及PCR扩增、特异片段,通过对电泳条带及条带灰度进行分析(图5:C,D),发现FAC组表达量显著下降,约为对照组的10%,MET组与FAC组相比有显著升高,修复效果接近对照组水平,且明显高于阳性对照组。不仅如此,在MTZ诱导的斑马鱼体内骨质疏松模型中,Bmp2b和Bmp4的蛋白表达水平变化与体外诱导骨质疏松模型mRNA变化趋势相似,MET可以促进由MTZ引起的Bmp2b、Bmp4表达降低(图5E)。上述结果表明,不论是体外或是体内诱导的斑马鱼骨质疏松模型,MET通过调控Bmp家族成员的转录及蛋白水平变化,进而促进骨骼损伤修复。
BRE (Bmp response element)是Bmp信号的下游响应元件,品系可表征Bmp的信号转导活性。为了探究MET在mRNA水平对骨骼发育信号通路的作用,本研究通过原位杂交检测0.1% MET处理24 hpf后的转基因胚胎。结果可见,MET对在鳃弓(branchial arch, ba)、腹鳍原基(ventral fin primordium, fb)的表达有明显促进作用(图5F),初步表明MET不仅可以增强Bmp的转录和蛋白表达,还可以通过激活Bmp下游信号通路促进斑马鱼骨骼发育和损伤修复。
3 讨论
斑马鱼骨质疏松模型广泛应用于药物抗骨质疏松有效成分的筛选[17],MET作为治疗2型糖尿病一线药物的同时,对癌症、肿瘤以及某些慢性疾病等具有一定的预防作用[2]。本研究结果表明,二甲双胍对斑马鱼的硬骨、脊椎骨均有明显促进作用,同时,对由FAC诱导的体外骨质疏松及MTZ诱导的体内骨质疏松模型均有显著的修复作用,二甲双胍可能通过激活Bmp信号通路促进成骨细胞再生从而修复骨骼损伤。
目前,二甲双胍对骨骼影响的作用机制尚未完全明确,本研究仅对骨骼发育相关信号通路进行了初步探索,对于该信号通路的下游转录因子p-Smad1/5/8是否能在MET作用下被磷酸化入核是本课题组今后需要进一步研究的内容。其次,还可利用成鱼尾鳍再生模型和骨质疏松模型探究MET是否对斑马鱼成鱼的骨骼发育及损伤修复也具有相同的作用机制,进一步完善MET对斑马鱼不同鱼龄阶段的骨骼发育的影响。此外,由于骨质疏松症为糖尿病慢性并发症之一,两者之间的关系可能并非简单的单向影响[30,31],其相互作用关系也有待今后继续探究,后续的工作中我们将通过糖尿病诱导的骨质疏松模型研究MET对糖尿病引发的骨损伤修复作用及机理。本研究以治疗糖尿病的常用药物为研究对象,用斑马鱼构建骨质疏松模型,探究二甲双胍在骨骼发育及损伤修复的作用及机制,研究结果可为二甲双胍老药新用提出了新的研究方向和思路。

图5 MET对斑马鱼成骨的促进及损伤修复的作用机制
A:24 hpf骨骼相关信号通路基因的mRNA水平表达;B:Bmp2b、Bmp4蛋白相对表达量;C:、基因扩增电泳图;D:对C中电泳条带的灰度分析;E:Bmp2b、Bmp4蛋白相对表达量;F:表达胚胎背面观。CTR:空白对照组;FAC:枸橼酸铁铵诱导组;Holf:Holfreter水阴性对照组;MTZ:甲硝唑诱导组;ED:依替膦酸二钠恢复组;MET:二甲双胍处理组。ba:鳃弓;fb:腹鳍原基。与CTR组比较,#表示<0.05,##表示<0.01,###表示<0.001;与CTR组(B图)或FAC组(D图)或MTZ组(E图)比较,*表示<0.05,**表示<0.01,***表示<0.001。
[1] Pernicova I, Korbonits M. Metformin—mode of action and clinical implications for diabetes and cancer., 2014, 10(3): 143–156.
[2] Aroda VR, Knowler WC, Crandall JP, Perreault L, Edelstein SL, Jeffries SL, Molitch ME, Pi-Sunyer X, Darwin C, Heckman-Stoddard BM, Temprosa M, Kahn SE, Nathan DM Diabetes Prevention Program Research Group. Metformin for diabetes prevention: insights gained from the diabetes prevention program/diabetes prevention program outcomes study., 2017, 60(9): 1601–1611.
[3] Flory J, Lipska K. Metformin in 2019., 2019, 321(19): 1926–1927.
[4] Hostalek U, Gwilt M, Hildemann S. Therapeutic use of metformin in prediabetes and diabetes prevention., 2015, 75(10): 1071–1094.
[5] Heckman-Stoddard BM, DeCensi A, Sahasrabuddhe VV, Ford LG. Repurposing metformin for the prevention of cancer and cancer recurrence., 2017, 60(9): 1639–1647.
[6] Wang GX, Xu MQ, Xie MR. Research advance in anti-lung cancer mechanism of metformin., 2020, 23(4): 282–285.
王高祥, 徐美青, 解明然. 二甲双胍抗肺癌机制研究进展. 中国肺癌杂志, 2020, 23(04): 282–285.
[7] McCreight LJ, Bailey CJ, Pearson ER. Metformin and the gastrointestinal tract., 2016, 59(3): 426–435.
[8] Inzucchi SE, Davies MJ, Khunti K, Trivedi P, George JT, Zwiener I, Johansen OE, Sattar N. Empagliflozin treatment effects across categories of baseline HbA1c, body weight and blood pressure as an add-on to metformin in patients with type 2 diabetes., 2021, 23(2): 425–433.
[9] Ouyang J, Isnard S, Lin J, Fombuena B, Peng XR, Chen YK, Routy JP. GDF-15 as a weight watcher for diabetic and non-diabetic people treated with metformin., 2020, 11: 581839.
[10] Zeng XL, Zhang YF, Tian Q, Xue Y, An RF. Effects of metformin on pregnancy outcomes in women with polycystic ovary syndrome: a meta-analysis., 2016, 95(36): e4526.
[11] Lv ZQ, Guo YJ. Metformin and its benefits for various diseases., 2020, 11: 191.
[12] Dziedzic A, Saluk-Bijak J, Miller E, Bijak M. Metformin as a potential agent in the treatment of multiple sclerosis., 2020, 21(17): 5957.
[13] Chen XY, Guo HF, Qiu L, Zhang CD, Deng Q, Leng QB. Immunomodulatory and antiviral activity of metformin and its potential implications in treating coronavirus disease 2019 and lung injury., 2020, 11: 2056.
[14] 柏华, 宋璇婧. 二甲双胍临床应用现状及进展. 临床合理用药杂志, 2019, 12(16): 175–177.
[15] Li N, Felber K, Elks P, Croucher P, Roehl HH. Tracking gene expression during zebrafish osteoblast differentiation., 2009, 238(2): 459–466.
[16] Fu SQ, Wang ZY, Jiang ZM, Bi ZM, Liu EH. Integration of zebrafish model and network pharmacology to explore possible action mechanisms of morinda officinalis for treating osteoporosis., 2020, 17(5): e2000056.
[17] Bergen DJM, Kague E, Hammond CL. Zebrafish as an emerging model for osteoporosis: a primary testing platform for screening new osteo-active compounds., 2019, 10: 6.
[18] Peng W, Zhang WJ, Xue Y. Research progress of zebrafish models of bone diseases., 2019, 27(2): 248–253.
彭伟, 张文娟, 薛钰. 斑马鱼作为骨骼疾病模型的研究进展. 中国实验动物学报, 2019, 27(2): 248–253.
[19] Zhang WJ, Xu JJ, Qiu JH, Xing CC, Li XM, Leng B, Su Y, Lin JM, Lin JF, Mei XQ, Huang YQ, Pan YT, Xue Y. Novel and rapid osteoporosis model established in zebrafish using high iron stress., 2018, 496(2): 654–660.
[20] Xu JJ, Zhang WJ, Wang JY, Yao LY, Pan YT, Ou YX, Xue Y. The active component screening ofand the functional study on inhibition of melanogenesis in zebrafish., 2017, 39(12): 1178–1187.
许璟瑾, 张文娟, 王静怡, 姚丽云, 潘裕添, 欧一新, 薛钰. 金线莲抑制斑马鱼黑色素形成的活性组分筛选及机理研究. 遗传, 2017, 39(12): 1178–1187.
[21] Aceto J, Nourizadeh-Lillabadi R, Bradamante S, Maier JA, Alestrom P, van Loon JJ, Muller M. Effects of microgravitysimulation on zebrafish transcriptomes and bone physiology- exposure starting at 5 days post fertilization., 2016, 2: 16010.
[22] Huo L, Wang L, Yang ZY, Li PY, Geng DC, Xu YZ. Prednisolone induces osteoporosis-like phenotypes via focal adhesion signaling pathway in zebrafish larvae., 2018, 7(7): bio029405.
[23] Huang HX, Lin H, Lan F, Wu YF, Yang ZG, Zhang JJ. Application of bone transgenic zebrafish in anti-osteoporosis chemical screening., 2018, 1(1): 53–61.
[24] Xue Y. Organizer-drived Bmp signal is required for zebrafish embryonic dorsoventral pattering[Dissertation]Tsinghua University, 2014.
薛钰. 斑马鱼胚胎组织中心表达的Bmp信号在背腹分化中的作用[学位论文].清华大学, 2014.
[25] Yang J, Tong GX, Zhang XH, Sun ZP, Lv WH, Sun XW, Kuang YY. Comparative analysis of embryonic muscle development in wildtype zebrafish and its intermuscular bone deficiency mutant., 2019, 26(2): 296–303.
杨建, 佟广香, 郑先虎, 孙志鹏, 吕伟华, 孙效文, 匡友谊. 肌间刺缺失突变对斑马鱼胚胎发育过程中肌肉发育的影响. 中国水产科学, 2019, 26(2): 296–303.
[26] Chen SJ, Guo FJ. Progress research on mechanism of chondrogenic promotion by Sox9 gene., 2010, 31(2): 65–67.
陈少坚, 郭风劲. Sox9基因促软骨形成作用机制研究进展. 国际骨科学杂志, 2010, 31(2): 65–67.
[27] Lin ZW, Yang F, Huang TY, Chen TT, Cui J, Li MY, Hua YQ. Study on the anti-osteoporosis effect of paeoniflorin on osteoblast apoptosis and zebrafish osteoporosis model., 2019, 35(4): 426–431.
林紫微, 杨菲, 黄天一, 陈婷婷, 崔杰, 李梦雨, 华永庆. 芍药苷干预成骨细胞凋亡抗骨质疏松作用研究. 南京中医药大学学报, 2019, 35(4): 426–431.
[28] Wan M, Cao X. BMP signaling in skeletal development., 2005, 328(3): 651–657.
[29] Singh SP, Holdway JE, Poss KD. Regeneration of amputated zebrafish fin rays fromosteoblasts., 2012, 22(4): 879-886.
[30] Crandall JP, Knowler WC, Kahn SE, Marrero D, Florez JC, Bray GA, Haffner SM, Hoskin M, Nathan DM; Diabetes Prevention Program Research Group. The prevention of type 2 diabetes., 2008, 4(7): 382–93.
[31] Lecka-Czernik B. Safety of anti-diabetic therapies on bone., 2013, 11(1): 49–58.
Study on the mechanism of me tformin on zebrafish skeletal development and damage repair
Tingting Jia1, Lei Lei1, Xinyuan Wu1, Shunyou Cai2, Yixuan Chen1, Yu Xue1
Metformin (MET) is a well-known first-line drug used to treat diabetes. However, its therapeutic effect and the underlying mechanism in treatment of skeletal diseases are still unclear. In this study, we used the zebrafish osteoporosis model to explore the function and mechanism of metformin in zebrafish bone development and damage repair through fluorescence observation, bone staining, semi-quantitative PCR,hybridizationand ELISA assays. Firstly, the working concentration of MET was determined to be 0.1% through embryonic lethality, bone mineralization and calcification. At this concentration, MET enhanced the bone development of zebrafish embryos and juveniles through up-regulation of bone regulatory factors at the mRNA and protein levels. Furthermore, we used ferric ammonium citrate (FAC) and NTR/MTZ system to build zebrafish osteoporosis modelsand, followed by MET treatment, and the experimental results showed that MET can restore the osteoporotic phenotypes, such as the decreased bone mineralization area, reduced spine calcification, and weakened osteogenic differentiation induced by FAC or MTZ, and it functioned through promoting osteoblast regeneration, enhancing the expression of osteoblast markers (, ALP), and inhibiting the activities of osteoclast markers (,,TRAP). Finally, we detected the expression levels of Bmp signaling components, and our preliminary data showed that MET can not only enhance the transcriptional and protein expression levels of Bmp, but also promote zebrafish bone development and damage repair by activating Bmp downstream signaling. Taken together, our results show that in addition to treating diabetes, MET can also promote zebrafish bone development and has a significant repair effect on osteoporosis, which will provide new research directions and experimental support for the new applications of old drugs.
metformin (MET); zebrafish; osteoporosis; damage rapair; Bmp
2021-07-13;
2021-09-13;
2021-12-03
福建省自然科学基金面上项目(编号:2020J01823,2019J01744),闽南师范大学培育项目(编号:MSPY202101)和福建省教育厅中青年教师教育科研项目(编号:JAT190357)资助[Supported by the Natural Science Foundation of Fujian Province (Nos. 2020J01823, 2019J01744), Minnan Normal University Cultivation Project (No. MSPY202101) and Educational Research Project for Young and Middle-aged Teachers of Fujian Provincial Department of Education (No. JAT190357)]
贾婷婷,在读硕士研究生,专业方向:化学生物学。E-mail: 948450471@qq.com
薛钰,博士,副教授,研究方向:细胞与发育生物学。E-mail: xueyu0614@163.com
10.16288/j.yczz.21-250
(责任编委: 刘峰)
