茶碱研究进展
2022-02-12高梓琪满佳旭武思敏黄业伟张冬英
高梓琪,满佳旭,武思敏,袁 梅,黄业伟,张冬英
(1.云南农业大学 普洱茶学教育部重点实验室,云南 昆明 650201;2.云南农业大学 食品科学技术学院,云南 昆明 650201)
茶的药理作用在《神农本草经》中就被提到:“神农尝百草,日遇七十二毒,得茶而解之”,直至今天,也是众多学者研究的热点.茶中生物碱类属嘌呤碱类,是茶中重要功效成分之一,常见的包含咖啡碱、可可碱和茶碱.
茶碱(二甲基黄嘌呤)主要存在于茶和可可豆中.茶叶中茶碱最先是在1889年,被德国科学家Albrecht Kossel发现,1896年德国学者WihelmTraube通过化学方法合成得到,最初用作利尿剂,后来确定其支气管扩张剂的特性,并于1922年作为哮喘的临床治疗引入,现在药用茶碱是工业合成的[2-4].
在体内,约90%的茶碱是从肝脏排泄,从肾脏排泄约占10%,关键消除酶是肝脏中的混合功能氧化酶系,主要是细胞色素P450超家族(CYP).茶碱口服吸收相对安全性好,生物利用度高达96%,但治疗窗窄,血药浓度需控制在10~20 μg/mL 范围时疗效最好,不良反应少.所以尽管其在全球广泛使用并且使用历史长,但在许多工业化国家,茶碱只是作为部分疾病控制不佳患者的附加疗法,因为吸入β2激动剂作为支气管扩张剂更有效,吸入皮质类固醇具有更强的抗炎作用.茶碱用作口服疗法(快速或缓释片剂)或更可溶的氨茶碱,乙二胺盐,适合口服和静脉内使用[5-6].
另外,茶碱具有利尿作用,并且可以增加心排血量;具有改善气道黏膜的纤毛清除作用;能增强呼吸肌特别是膈肌和肋间肌的力量,增强低氧呼吸驱动,抵抗低氧呼吸抑制,改善通气以增强呼吸功能;能直接使呼吸中枢兴奋,防止呼吸衰竭;另外还具有抑制血小板活性和微循环血管通透性的作用.
1 茶碱的常用检测方法
生物碱是茶叶中的重要组成物质,茶树中生物碱含量,因其在茶树中部位不同,含量差异较大,例如,在生长旺盛的嫩芽中,含量是最高的,粗老叶和茶梗中含量较少,茶籽中几乎不含.另外,其含量还与阳光、施肥、生长季节、品种等都有关系.例如,红茶和绿茶多用春季新嫩的茶叶,故茶碱含量偏高;铁观音属乌龙茶,多以成熟的茶叶制做,故茶碱含量较低.除此之外,可能还与摘取茶叶的地点,茶叶产地等都有关系.
直接测定茶叶中的茶碱的文献较少,多数研究为血药浓度或药物制剂中茶碱的含量测定,因茶碱溶解度低,做药剂使用时一般选择茶碱衍生物,常用茶碱与乙二胺复盐,即氨茶碱,乙二胺增加药物水溶性,其药理作用主要为茶碱或者新一代黄嘌呤衍生物多索茶碱(图1),其第7位具有二氧戊环亚甲基基团,具有很好的药理学作用.鉴于茶碱的药用有效浓度与毒性浓度较为接近,如何快速且准确的检测茶碱含量一直是研究的热点.并且在液相、毛细管电泳等传统方法的基础上发展出了很多基于不同原理的方法.根据原理可分为色谱法、光谱法、电化学法、多种方法联用等.
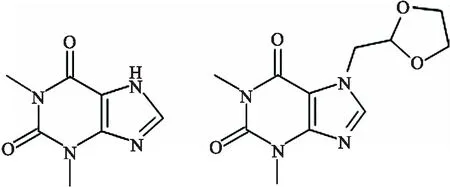
图1 茶碱和多索茶碱的结构图
1.1 色谱法
色谱法利用样品中不同组分在固定相与流动相中受到的作用力不同,而将各组分分离,并检测各组分含量.在近代分析化学中,它是发展最快应用最广的分离分析技术.在茶碱的检测方法中也有着不可替代的地位.
高效液相色谱法是茶碱检测方法中最成熟也是最权威的一种.为了探究饮茶人群如何合理使用茶碱类药物,王国钦等[1]利用Accurasil C18柱子在 38 ℃ 柱温的条件下,使用甲醇和水做流动相分析了西湖龙井、寿眉、清香810等15种不同产区、不同品种的茶叶.经测定,实验中的15种茶叶茶碱含量在0.19~1.27 mg/g 之间,不同茶叶的茶碱含量具有一定差异.来自第四军医大学药学院药物研究所的肖会敏等[7]用梯度洗脱的方法(流动相A:甲醇(0 min,5%→80 min,75%→100 min,5%)B相:水),在 35 ℃ 的柱温,199 nm 检测波长的条件下同时完成了茶叶中茶氨酸、茶碱与咖啡因的检测,大大提高了检测的效率.刘志彬等[8]同样使用了梯度洗脱的方法同时分析了10种典型武夷岩茶(5种肉桂和5种水仙)的咖啡碱、可可碱和茶碱的含量,发现其含量均低于绿茶、铁观音和红茶,并且在 60 s 沸水冲泡后仅有50.15%茶碱溶于茶汤中.黄永莲等[9]使用高效液相色谱法对9种常见的绿茶中茶碱和咖啡因的含量进行了分析,研究发现茶碱的含量相较咖啡因而言更容易受到产地气候的影响.乔小燕等[10]用高效液相的方法对云南白莺山10个古茶树群落的晒青毛茶中的茶碱含量进行了检测,结果表明其茶碱干重含量在0.30~0.84 mg/g,与乌龙茶、绿茶和南昆山白毛茶接近,在0.03%~0.08%之间,明显低于云南勐海地区古树茶.
1.2 光谱法
自然界的大部分物质在受到光的作用后均会产生光信号或者是光信号的变化,接收、检测和处理这些信号的变化,从而获得待测物质的定性和定量信息.作为现代仪器分析中应用十分广泛的一类方法在茶碱含量的测定方面同样得到应用.
张立科等[11]发现在弱碱性介质中,茶碱能显著增强双氧水与鲁米诺反应的化学发光信号,因此利用流动注射化学发光分析仪即可检测痕量的茶碱,检测限低到1.0×10-7mol/L.因为茶叶中嘌呤生物碱结构上的嘌呤环具有共轭双链体系,具有独特的吸收光谱,在272~274 nm 具有最大吸收值,所以使得紫外分光光度法检测茶碱含量成为可能.程弘夏等[12]用蒸馏水做提取溶剂建立了基于紫外可见分光光度法的茶碱缓释片中茶碱浓度的检测方法.但是该方法应用于茶叶中茶碱含量检测时具有一定的局限性,因为其检测的是样品中嘌呤碱的总量会受到样品中咖啡因等嘌呤碱的干扰.
1.3 电化学方法
电化学分析方法[13-14]是近现代分析方法的一个重要组成部分,它可以利用物质在溶液中的电化学性质及其变化规律来测定未知物质的组成和含量.
氧化石墨烯(GO)和还原氧化石墨烯(RGO)的组成作为甲基黄嘌呤的检测传感器(化学,电化学和生物传感器)受到欢迎,在极性溶剂(尤其是水)中的较高溶解度以及对这些目标的较高反应性[15].Liu等[16]开发了一种基于单分子光漂白(SMPB)技术的茶碱的超灵敏传感平台,用于茶碱的检测,其低检测限(LOD)为 0.092 nmol/L.Li等[17]利用电化学的方法制备了1种新型便携式分子印迹聚合物(MIP)-SERS纳米探针,该探针可以特异性的检测茶碱含量,最低可以检测 0.01 nmol/L 的茶碱含量,在 8 min 内即可完成检测.Yin等[19]研究基于CdSe微粒改性玻璃碳电极使用循环伏安法和差分脉冲伏安法对茶饮料中的茶碱含量进行了测定,在最佳条件下,茶碱的氧化峰电流与其浓度在1~40和40~700 μmol/L 正相关,检测下限估计为 0.4 μmol/L(S/N=3),此方法显示出良好的重现性和优异的选择性,可以用于检测茶及茶饮料中茶碱的含量.
1.4 毛细管电泳法
毛细管电泳法是近代新发明的一种分离分析技术,它可以快速、高效、灵敏的完成样品的检测.Chen等[18]应用毛细管电泳及电化学的方法分离和检测了茶叶中的茶碱、黄嘌呤、次黄嘌呤等3种嘌呤,14 min 内同时完成了茶碱及其他5种嘌呤碱的检测.虽然毛细管电泳法的检测速度较快,但是其灵敏度却低于高效液相色谱法,当进样量太少时也会影响其测定的准确性.
1.5 其他方法
Li等[20]用磁性固相萃取(M-SPE)从绿茶中快速纯化生物碱异构体(可可碱和茶碱).使用响应面方法(RSM)对M-SPE程序进行了优化,以分析最大条件,发现以甲醇(80%)为洗液,甲醇∶乙酸(体积比,V/V=8∶2)为洗脱剂,pH为3时,M-SPE中可可碱和茶碱的最佳回收条件.绿茶中茶碱的实际回收率分别为87.51%,实际提取量为 5.07 mg/g.
在检测过程中由于样品组分的复杂程度较高,单一的方法往往不能得到准确的结果,所以检测方法的联用就显得尤为重要.高效液相色谱可以对复杂基体化合物进行分离,而质谱在选择性、灵敏度、分子量以及结构信息方面的优势使得高效液相色谱与质谱联用成为可能.Aqel等[21]开发了一种基于UHPLC-MS的分析方法,用于快速测定茶叶中的甲基黄嘌呤.在使用等度洗脱由90%水和仅10%乙腈组成,流速为 0.5 mL/ min(3 mL/h 乙腈)的最佳条件下,可在 30 s 内实现基线分离.质谱仪在ESI+中以SIR模式运行.此方法在0.03~5 μg/mL 范围内呈线性,具有简单,灵敏,高效和绿色的优点.
Ahmad等[22]首次使用加速溶剂萃取(ASE)萃取甲基黄嘌呤(MX),并应用超高效液相色谱(UHPLC-DAD)定量MX.并证明,ASE在优化的温度(100 ℃)和溶剂(MeOH)条件下有较高的提取率(940.22±192.28)mg/g.该方法在商业样品中的应用同样显示出较高的提取率,其中TH浓度为0~0.55(mg/g).温度和溶剂变化与样品的提取率显示出重要的相关性.
Chen等[23]提出了一种用于茶碱检测的电化学生物传感器,首先将RNA适体分裂成2个单链RNA探针.一个与DNA四面体杂交,然后将得到的纳米结构固定在金电极上; 另一个在AuNPs的表面被修饰,AuNPs的表面也被亚甲基蓝(MB)标记为电化学物质.2种RNA探针与茶碱之间的识别过程导致AuNPs的定位和MB在电极界面上的富集.因此产生了显着的电化学反应,由此测得茶碱的浓度.
2 茶碱类药物的药理作用
2.1 茶碱的结构与药理作用的关系
茶碱(图1)分子有2个有效部位,第3位的甲基与平滑肌松弛及其抗炎作用密切相关,在肌肉和炎症细胞中,影响非特异抑制某些环核苷酸磷酸二酯酶(PDE)的活性.第1位的甲基负责与腺苷竞争受体,对神经肌肉的呼吸效应器有利,也产生毒性作用.此外,在治疗水平上,茶碱还可提高血浆儿茶酚胺水平[24].茶碱的第3位甲基通过抑制炎性细胞的PDE和神经肽的释放进而发挥抗炎功效[25];在免疫调节方面,一来茶碱能够发挥类似胸腺素的作用,诱导并调节T细胞的分化成熟和其功能.二来,茶碱还可以通过抑制PDE,提高cAMP,进而抑制细胞脱颗粒,降低抗原诱导的组胺等物质的释放,从而发挥免疫调节功效[26].
2.2 支气管舒张作用
茶碱类药物的支气管舒张作用[27-30]是通过有效抑制环核苷酸磷酸二酯酶实现的,茶碱血清浓度达到10~20 mg/L 时,可以起到对支气管平滑肌的扩张作用,非特异性地抑制环核苷酸磷酸二酯酶活性,有效增加细胞内环磷酸腺苷浓度水平,抑制细胞内的钙离子内流,促进了钙离子外流,进而达到降低细胞内钙离子,起到扩张支气管平滑肌的作用.但是这个浓度与中毒浓度非常接近,容易产生副作用.
2.3 抗炎作用
茶碱通过抑制磷酸二酯酶和神经肽的释放发挥抗炎作用.在适当的水平下,茶碱会强烈抑制抗原激活的后期反应,这与抑制中性粒细胞的活化和磷酸二酯酶诱导的炎性介质的释放有关.并且最近的临床前研究表明,“低剂量”茶碱(血浆水平1~5 mg /L)可以抑制机体炎性因子高表达,每天2次口服 0.1 g 茶碱可降低COPD患者的IL-4,IL-5,IL-6,IL-8,IL-17,TNF-α和C反应蛋白(CRP)含量[31].
低剂量的茶碱可抑制炎症细胞因子在平滑肌中诱导的ET-1异常表达,这是其降低哮喘气道高反应性的机制之一,Bin等[32-34]研究证明茶碱通过上调HDAC2表达并减少NF-κB p65活化,对肺气肿小鼠模型的骨骼肌具有抗炎作用;MitaniTakakazu等[35-36]研究结果表明,抑制糖皮质激素受体(GR)活性进而降低促炎性脂肪因子的产生也是茶碱的抗炎途径之一;此外茶碱还抑制腺苷受体,增加白介素10的释放,并抑制NF-κB的转录表达以及从外周血到气道粘膜转移的炎性细胞和T细胞的活化,从而起到抗炎和免疫调节的作用.
综上茶碱具有良好的抗炎作用[37-40],能够降低多种炎症细胞活力,具有一定的稳定炎性细胞膜作用,抑制多种炎性细胞及细胞因子进入和释放到气道中,抑制或减少炎性递质及过氧化物的释放[41-42].
2.4 免疫调节作用
越来越多的研究证明,低剂量的茶碱具有免疫调节作用.CD4+具有促进体液免疫和细胞免疫的作用,而CD8+抑制其反应,CD4+/CD8+水平可反映机体免疫系统内环境的稳定性.茶碱能起到调节CD4+细胞的作用,抑制周围血活化CD8+细胞向气道内转移,降低气道内CD8+细胞数目,并抑制CD8+细胞相关的移植和宿主反应,从而产生免疫调节作用.并且低剂量的茶碱可以激活组蛋白去乙酰化酶活性,可一定程度上增强糖皮质类激素的抗炎作用,有效降低炎性细胞水平,抑制炎性细胞的活化和聚集,茶碱还可逆转D2拮抗剂和毒蕈碱激动剂引起的运动障碍,这些同样说明茶碱起到了一定的免疫调节作用[43].
3 展望
作为一种临床应用时间较长的哮喘治疗药物的茶碱,具有治疗效果确切、价格便宜的特点.因为其不良反应较多,安全性差等原因在扩张支气管作用方面已退居三线;而近些年随着研究不断深入与发展,一些茶碱类的长效药物、缓释药物,可以通过一次服用,较长时间的保持有效的血药浓度,而有效避免了因为大剂量服用而导致的不良反应发生.并且通过对茶碱类药物进一步药理研究发现,茶碱类药物在抗炎、调节免疫等方面也具有确切的效果.相信通过继续对其不断探索研究与开发,茶碱还有广阔的应用与开发前景.
