无创DNA检测在胎儿鼻骨发育异常中的应用价值
2022-02-12张艳萍钟世林董晶王贺邓玉清
张艳萍,钟世林,董晶,王贺,邓玉清
无创DNA产前检测是通过获取孕妇外周血中胎儿游离DNA片段,应用高通量测序技术,结合生物信息分析,检测胎儿染色体异常的一种产前检测方法。DNA高通量测序技术具有所需样本量少、高通量、敏感度高、特异度高和无创性等优点[1-2],被越来越多的孕妇所接受。近年来,其检测范围从最初的检测三种最常见的非整倍体疾病逐步延伸至染色体微缺失微重复疾病的检测。本研究回顾性分析北京大学深圳医院2018年3月至2020年3月期间,孕期已行无创DNA检测并在产前超声提示胎儿鼻骨发育异常行介入性产前诊断的孕妇,通过染色体核型和染色体微阵列分析(chromosome microarray analysis,CMA)检测结果对无创DNA检测结果进行分析,了解无创DNA检测结果与染色体核型和CMA检测结果的关系,从而更好地指导临床工作中胎儿鼻骨发育异常病例是否需要进一步行介入性产前诊断。
1 对象和方法
1.1 研究对象
选取2018年3月至2020年3月期间,孕期定期产检,并在孕12周后行唐氏筛查及无创DNA检测的孕妇,孕期产前超声提示胎儿鼻骨发育异常后就诊北京大学深圳医院产前诊断中心,经获得产前诊断遗传咨询资格的医生解释后,决定进一步行介入性产前诊断的81例孕妇的资料,进行回顾性分析,孕妇年龄17~44岁,平均(29.79±4.38)岁,孕周17+3~35周,平均(24.3±3.2)周。
1.2 方法
1.2.1 无创DNA检测 签署知情同意书及保险单后,抽取静脉血5 mL,4℃ 条件下送深圳华大基因医学检验室进行检测。
1.2.2 胎儿超声 鼻骨缺失为胎儿面部正中矢状面、横切面和冠状面均未显示鼻骨声像,鼻骨发育不良包括鼻骨短小、一侧鼻骨缺失或鼻骨骨化差,鼻骨短小指鼻骨长度小于同孕周正常值的2.5百分位[3]。
1.2.3 介入性产前诊断 孕妇及家属签署介入性产前诊断同意书后,由我院产前诊断中心操作熟练的医生在超声引导下采集胎儿样本,孕17~26周行羊水穿刺术,孕26周以上行脐带穿刺术。
1.2.4 染色体核型检测 方法按照标准常规方法对胎儿羊水细胞或脐血细胞进行培养及胎儿染色体G显带核型分析。染色体核型命名根据《人类遗传学国际命名体制ISCN(2016)》。
1.2.5 染色体微阵列分析检测 采用Affymetrix CytoScan芯片检测基因组中引起DNA拷贝数不平衡改变的微缺失与微重复,其临床意义分为多态、致病性、不明确、可能致病、可能良性5种。
1.3 随访
交代所有在我院行介入性产前诊断手术的孕妇术后3天复诊,术后1周及产后有产前诊断中心专职工作人员电话咨询孕妇胎儿及新生儿情况。
1.4 统计学方法
应用SPSS 22.0 统计软件录入数据,计数资料采用频数及率表示,采用χ2检验比较鼻骨异常者无创DNA检测异常与年龄是否存在显著性差异。采用χ2检验了解无创DNA对鼻骨异常孕妇染色体及CMA异常检出情况,以及唐氏筛查联合无创DNA检测对鼻骨异常孕妇染色体及CMA异常检出情况。P<0.05为差异有统计学意义。
2 结果
81例孕妇中,共有62例接受羊水穿刺,19例接受脐带穿刺,81例孕妇无一例出现术后流产、宫内感染、胎膜破裂等并发症。共检出染色体核型异常7例,占8.64%(7/81),其中21-三体6例(染色体核型47,XN,+21),染色体不平衡易位1例(染色体核型46,XN,der(7)t(7;11)(p22;q21)pat)。CMA结果异常19例,占23.46%(19/81),致病性结果异常9例,占11.11%(9/81),其中21-三体6例(染色体21q11.2-q22.3重复33.08Mb),致病性微重复3例(分别为染色体17p12重复1.40Mb;染色体1q21.1~q21.2重复1.90Mb;染色体11q21~q25重复41.01Mb),意义不明确片段10例。其中9例经染色体核型分析及CMA检测确诊为染色体致病性异常胎儿的孕妇选择终止妊娠,其余72例孕妇继续妊娠,定期产检,通过孕妇预产期估计孕妇分娩后电话咨询新生儿情况,有1例胎儿染色体核型结果正常,CMA结果为意义不明确片段(7q11.23~q21.11杂合性缺失5.07Mb),新生儿生后检查发现尿道下裂、先天性心脏病,目前一般情况平稳,其余新生儿出生后电话随访均正常。现将鼻骨异常不同情况的染色体核型及CMA结果进行进一步分析。
2.1 孕妇不同年龄段出现鼻骨异常胎儿染色体及染色体微阵列分析结果比较
81例鼻骨发育异常胎儿,根据孕妇年龄将其分为两组(<35岁组、≥35岁组),不同年龄孕妇合并鼻骨发育异常时无创DNA检测异常率比较,差异无统计学意义(χ2=1.761,P=0.185),详见表1。

表1 无创DNA检测结果与年龄的关系
2.2 无创DNA检测预测染色体核型及染色体微阵列分析的价值
接受了介入性产前诊断手术的81例孕妇在孕期均已行无创DNA检测,将81例孕妇分为无创DNA检测低风险组和高风险组,两组病例染色体核型结果及CMA结果详见表2。可见,无创DNA高风险胎儿染色体异常及CMA致病性异常发生率较无创DNA检测低风险增高,差异有统计学意义(χ2=68.503,P<0.001;χ2=51.84,P<0.001)。无创DNA高风险时发现胎儿染色体异常的敏感度85.71%,特异度100%,阳性预测值100%,阴性预测值98.67%;无创DNA高风险时发现胎儿CMA致病性异常的敏感度66.67%,特异度100%,阳性预测值100%,阴性预测值96%。
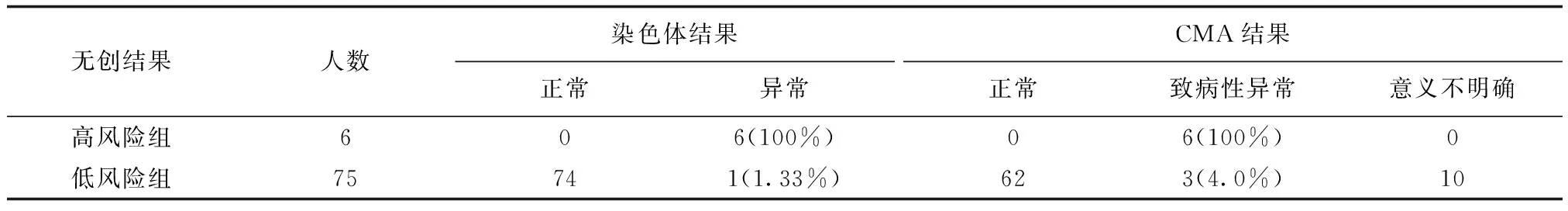
表2 无创DNA结果与染色体核型及CMA结果的关系
2.3 唐氏筛查联合无创DNA检测预测染色体核型及染色体微阵列分析的价值
本研究中有76例孕妇同时行唐氏筛查及无创DNA检测,将其按照唐氏筛查结果分为低风险(T21<1/1 000或T18<1/1 000),临界风险(1/1 000≤T21<1/270,1/1 000≤T18<1/350),高风险(T21≥1/270或T18≥1/350),结合无创DNA结果共同了解无创DNA对胎儿染色体及CMA结果的预测价值(详见表3)。唐氏筛查临界风险病例只有3例,无创DNA均为低风险,染色体结果及CMA结果均未见异常,分析时将其纳入唐氏筛查低风险组计算。唐氏筛查高风险并无创DNA高风险预测胎儿染色体异常的敏感度66.67%、特异度100%、阳性预测值100%、阴性预测值97.37%;预测胎儿CMA致病性异常的敏感度50%、特异度100%、阳性预测值100%、阴性预测值94.44%。唐氏筛查低风险并无创DNA低风险预测胎儿染色体正常的敏感度88.57%、特异度100%、阳性预测值100%、阴性预测值42.86%;预测胎儿CMA非致病性异常的敏感度89.71%、特异度87.5%、阳性预测值98.39%、阴性预测值50%。其中,有1例唐氏筛查低风险,无创DNA低风险,超声提示鼻骨缺如,胎儿染色体核型46,XN,CMA结果为致病性,(染色体17p12重复1.40Mb);有1例唐氏筛查高风险,无创DNA低风险,超声鼻骨缺如,胎儿染色体核型46,XN,CMA结果为致病性(染色体1q21.1~q21.2重复1.90Mb);1例唐氏筛查高风险,无创DNA低风险,超声鼻骨缺如并脊柱椎管内囊性结构,羊水检查染色体核型46,XN,CMA结果为致病性(染色体11q21~q25重复41.01Mb),这3例孕妇均选择引产。

表3 联合筛查结果与染色体核型及CMA结果的关系
3 讨论
传统的血清学筛查评估胎儿染色体异常的准确率及敏感度不够,假阳性率较高,长期以来很多研究者都在寻找一种安全、可靠的产前筛查方法。1997年Lo等[4]首次从孕育男胎的孕妇血清和血浆中提取并检测到了男性胎儿DNA,随后研究发现最早在妊娠第7周就可以在孕妇的血清中检测到胎儿DNA,其浓度会随着孕周的增加而上升[5]。随着高通量测序技术的广泛推广,无创DNA产前检测技术成为产前筛查的新模式。研究提示,无创DNA产前检测对21-三体综合征的总临床敏感性为99.5%,对18-三体综合征的总临床敏感性为93.1%,对13-三体综合征的总临床敏感性为92.7%[6]。朱赛娟等[7]对其医院800例无创DNA阳性结果与胎儿染色体核型结果对比中,发现无创DNA产前检测对21-三体、18-三体、13-三体和性染色体非整倍体的阳性预测值是81.6%、68.2%、8.1%和41.2%,对其他染色体非整倍体的阳性预测值是1.6%,对拷贝数变异(copy number variation,CNV)的阳性预测值是54.5%。在本研究中,81例经就诊我院产前诊断中心咨询并选择进一步行介入性产前诊断的孕妇,在孕期均已行无创DNA检测。其中无创DNA T21高风险6例,经产前诊断证实为21-三体,说明当无创DNA高风险合并胎儿超声指标异常时,咨询过程中应高度重视,并强烈建议行介入性产前诊断。本研究中无创DNA检测6例T21高风险均被检出,敏感度达100%。本研究中无创DNA检测低风险75例,经产前诊断证实为染色体不平衡易位1例(染色体核型46,XN,der(7)t(7;11)(p22;q21)pat),另CMA检测多发现致病性微重复2例(分别为染色体17p12重复1.40Mb;染色体1q21.1~q21.2重复1.90 Mb)。染色体微缺失微重复综合征(chromosome microdeletion and microduplication syndrome,CMMS)是由于染色体微小片段缺失或重复,使正常基因发生改变而导致的染色体病,会导致先天性畸形、器官功能障碍、生长发育迟缓、智力障碍等,占新生儿先天性疾病的1%~2%,给家庭和社会造成严重的负担[8]。一项大规模的无创DNA产前检测随访数据研究了无创产前筛查技术在染色体非整倍体和全基因组微缺失/微重复综合征检测中的应用价值,研究表明,无创DNA产前检测对于其他罕见常染色体非整倍体的综合PPV为29%,对性染色体非整倍体的PPV为46.7%,对CMMS总的阳性预测值为40.8%[9]。无创DNA技术也存在局限性[10],国际产前诊断协会也建议,无创DNA检测应局限于临床意义重大的疾病或明确定义的严重疾病,对一些临床意义不明确的CMMS,对结果判读和临床处理可能面临较大的风险,提示我们在临床咨询中遇到无创DNA低风险时,也不能考虑胎儿无染色体相关疾病而放松警惕,需根据实际情况对孕妇提出正确的咨询指导意见[11]。
在本研究中,有76例孕妇在孕期同时行唐氏筛查及无创DNA检测,从数据中可得知孕期唐氏筛查低风险或临界风险,且无创DNA检测低风险时,鼻骨发育异常的胎儿染色体核型异常发生率为0%(0/63),致病性CMA异常的发生率为1.59%(1/63),有1例染色体17p12重复1.40Mb通过CMA检测发现;孕期唐氏筛查高风险,且无创DNA检测低风险时,染色体核型异常发生率为11.1%(1/9),有1例染色体不平衡易位通过染色体核型分析发现,致病性CMA异常的发生率为22.2%(2/9),有1例染色体1q21.1~q21.2重复1.90Mb;1例染色体11q21~q25重复41.01Mb,这3例病例无创DNA检测结果均为低风险,但通过CMA检测均证实胎儿存在致病性染色体微重复改变,避免了出生缺陷。染色体微阵列分析技术能够在全基因组水平检测染色体不平衡的CNV,除了能够检出非整倍体异常,还能检测低水平CNV,染色体杂合性缺失等染色体异常,进一步检测染色体微缺失或微重复,较染色体核型分析具有更高的分辨率和敏感度[12],在本研究中的病例均行胎儿染色体核型分析及CMA分析,其中共检出染色体核型异常7例,占11.96%(7/81),CMA结果异常19例,占23.46%(19/81),其中致病性CMA异常9例,CMA检测较染色体核型分析多检出两例致病性微重复(分别为染色体17p12重复1.40Mb;染色体1q21.1~q21.2重复1.90Mb)。近年来,欧美[13]及我国[14]先后指出CMA检测可提高有临床意义的拷贝数变异的检出率,产前超声发现胎儿超声检查异常时可考虑行CMA检测。郭莉等[15]在其研究中就发现在G显带78例阴性结果中,CMA检出2例拷贝数变异,增加阳性检出率2.56%,这2例病例1例引产,1例失访。
在临床咨询工作中,我们经常会遇到一些孕期唐氏筛查低风险、无创DNA检测低风险,超声提示胎儿鼻骨发育不良的孕妇,拒绝介入性产前诊断治疗。辜秋阳等[16]在其研究中,298例因胎儿鼻骨发育异常进一步检查的孕妇,选择行无创DNA检测的孕妇有171例,且其研究中也建议如孕妇胎儿仅存在鼻骨缺失时,仍可考虑行无创DNA检测作为产前筛查,一定程度上有效减少了孕妇侵入性产前诊断人数,也降低了流产风险[16]。但是,在本研究中也提示了无创DNA检测可能漏诊一些染色体拷贝数变异的病例,如为致病性改变的新生儿出生后,将对家庭和社会都造成巨大的负担,无创DNA还不能完全取代介入性产前诊断。所以在临床咨询过程中,我们要详细告知胎儿超声异常的相关风险,根据孕妇和胎儿的具体实际情况,制定最适合孕妇的进一步产前诊断方案。
由于本研究是回顾性分析,所以未能对其他超声提示鼻骨异常仅行无创DNA检测的孕妇做进一步随访,所得出的数据也有偏差。如果能在后续的研究工作中将更多的病例进一步纳入研究,并制定一个最经济、创伤最小、最能让孕妇及家属接受的产前筛查及诊断方案,这将是我们未来继续研究的方向。
