大麻素受体CB1对子宫腺肌病子宫内膜-肌层交界区平滑肌细胞增殖和凋亡的影响及其作用机制
2022-02-12汪沙段华郭正晨沈雪李博涵
汪沙,段华,郭正晨,沈雪,李博涵
子宫腺肌病为妇科常见的雌激素依赖性疾病,其本质为子宫内膜异位至子宫肌层,发病机制不清[1]。随着对保留生育和生理功能要求的增加,子宫腺肌病靶向治疗成为妇科临床研究的热点[2]。近年来,随着对子宫腺肌病病因机制研究的深入,发现子宫内膜-肌层交界区(endometrial-myometrial interface,EMI)的结构与功能异常,与子宫腺肌病的发生发展密切相关[3-4]。子宫腺肌病中子宫内膜直接侵入与之紧密相连的子宫肌层,致使EMI平滑肌细胞反应性增生、细胞间距扩大、细胞正常排列被破坏,导致EMI不规则增厚[5]。但引起EMI平滑肌细胞异常增殖的具体机制尚不清楚。
内源性大麻素是上世纪90年代初期,人们通过对大麻中的主要精神活性物质△9-四氢大麻酚(△9-tetrahydrocannabinol,△9-THC)作用机制的研究所发现。大量研究表明,内源性大麻素可通过与受体结合触发不同的信号传导通路,发挥多种病理生理作用,如炎症调节、纤维化、痛觉调控、抗肿瘤、性腺功能和生殖调控等[6-8],并已成为国际上关注的热点。I型大麻素受体(cannabinoid receptor 1,CB1)属于G蛋白耦联受体,是目前公认的内源性大麻素的两大受体之一,也是其发挥生物学效应的主要配体。AM251和ACEA分别为CB1受体的选择性拮抗剂和激动剂,在多种体内外实验中用作CB1受体的干预药物[9]。既往报道显示CB1参与了子宫内膜异位症痛觉的调控[10]、病变部位神经和病灶生长[11]及小鼠子宫和人孕期子宫肌层收缩的调控[12]。此外,在生殖领域亦发现CB1较CB2有着更为重要的作用[13],然而CB1在子宫腺肌病中的研究尚未见报道。因此,本研究拟原代培养腺肌病组和对照组EMI平滑肌细胞,通过对细胞CB1受体行药理学干预以观察CB1对EMI平滑肌细胞增殖凋亡能力及相关信号通路的影响,探讨大麻素受体CB1在子宫腺肌病发生发展中的作用。
1 资料与方法
1.1 资料来源及分组
选择2017年7月至2018年8月期间于首都医科大学附属北京妇产医院妇科微创中心因子宫腺肌病行开腹或腹腔镜全子宫切除术的16例患者的子宫标本作为腺肌病组,平均(45.2±3.6)岁,同期因宫颈上皮内瘤变III级、宫颈癌IA期等切除子宫的11例非子宫腺肌病的患者的子宫标本为对照组,平均(43.7±4.4)岁。所有子宫标本均经病理检查,证实腺肌病组为子宫腺肌病,对照组子宫肌层无异常。本研究经首都医科大学附属北京妇产医院伦理委员会同意(No.2016-KY-012),患者的病例信息采集及标本收集均于术前获得患者充分的知情同意并签署了知情同意书。
1.2 方法
1.2.1 组织取材 子宫切除后立即进行组织取材,于无菌条件下自子宫前壁“Y”字型剖开,于子宫体前壁靠近宫底处切取内膜下约0.5 cm×1 cm×1 cm大小的EMI平滑肌组织2块,置于冷D-Hank’s液(内含青霉素1 000 U/mL,链霉素1 000 U/mL)后行平滑肌细胞培养及鉴定,具体方法参考本课题组已发表文献[14]。
1.2.2 蛋白印迹法检测两组细胞中CB1蛋白及通路蛋白的表达 收集腺肌病组和对照组EMI平滑肌细胞,用蛋白裂解液提取各组细胞总蛋白,BCA 法测定蛋白样品浓度。等量的蛋白经10% 十二烷基硫酸钠(SDS)-聚丙烯酰胺凝胶 (PAGE)电泳后转至聚偏二氟乙烯(PVDF)膜,加入5%脱脂奶粉封闭2 h,加入一抗(鼠抗人Cell Signaling Tchnology)4℃过夜。次日洗膜后再加入辣根过氧化物酶标记的二抗,室温孵育1 h,洗膜后,将膜置于增强化学发光(ECL)法检测试剂中,凝胶成像系统显影,以目的蛋白条带灰度值与内参照蛋白β-actin条带灰度值的比值表示目的蛋白的相对表达水平。实验重复3次。
1.2.3 CCK8检测AM251、ACEA处理后腺肌病EMI平滑肌细胞增殖情况 分别取3~6代对数生长期的腺肌病组EMI平滑肌细胞,予胰酶消化后离心收集细胞,制成细胞悬液并细胞计数,调整浓度后按照4 000个/孔接种于96孔板中,每孔100 μL体积。置于37°C,100%饱和湿度和JP5%CO2培养箱中培养24 h后进行药理学干预。加入预先用无血清无酚红培养基配好10-8mol/L、10-7mol/L、10-6mol/L、5×10-6mol/L的AM251溶液和10-7mol/L、10-6mol/L、5×10-6mol/L、10-5mol/L的ACEA溶液,另设对照孔(培养基+细胞)和空白孔(仅培养基),每孔100 μL体积,同时设5个复孔。置于培养箱孵育12 h后向每孔加入10 μL的CCK8溶液。继续孵育4 h后酶标仪下测定各孔在450 nm处的吸光度OD。增殖率=[(实验孔OD-空白孔OD)/(对照组OD-空白孔OD)]×100%。抑制率=1-增殖率=[(对照孔OD-实验孔OD)/(对照组OD-空白孔OD)]×100%。GraphPad Prism 6.0软件计算出AM251的半效抑制浓度IC50。随后,无血清无酚红培养基继续培养24 h后实验孔根据标记依次换用无血清无酚红培养基、10-6mol/L的AM251溶液、5×10-6mol/L的ACEA、10-6mol/L的AM251溶液预处理30 min后+5×10-6mol/L的ACEA,另设对照孔(培养基+细胞)和空白孔(仅培养基),每孔100 μL体积,同时设5个复孔。后续步骤同上。实验重复3次。
1.2.4 蛋白印迹法检测腺肌病组进行药理学干预后CB1及通路蛋白表达 取3~6代对数生长期的腺肌病组EMI平滑肌细胞按浓度为2×105个/孔接种于60 mm培养皿中,每孔5 mL体积,相同条件下培养24 h后,分别加入无血清无酚红培养基、10-6mol/L的AM251溶液、5×10-6mol/L的ACEA、10-6mol/L的AM251溶液预处理30 min后+5×10-6mol/L的ACEA,每孔5 mL体积,继续培养6 h后检测CB1和通路蛋白表达,方法同上。
1.3 统计学方法

2 结果
2.1 两组子宫内膜-肌层交界区平滑肌细胞CB1蛋白及增殖凋亡相关通路蛋白表达的比较
以目的蛋白条带CB1和内参β-actin灰度值进行半定量,得到CB1蛋白在腺肌病EMI平滑肌细胞中的相对表达量(0.64±0.16)与对照组EMI平滑肌细胞(0.50±0.11)相比,差异有统计学意义(P=0.018),详见图1。
行AKT和Erk1/2凋亡通路蛋白免疫印迹实验发现,腺肌病组和对照组细胞间总AKT和总Erk1/2的表达量相当,而p-AKT和p-Erk1/2表达量差异明显。其中,p-AKT/AKT在腺肌病组细胞为(0.48±0.08),高于对照组(0.27±0.08);p-Erk/ Erk在腺肌病组细胞为(2.17±0.82),高于对照组(1.18±0.35),腺肌病组和对照组相比,差异均有统计学意义(p-AKT/AKT的P=0.004,p-Erk/ Erk的P=0.036),详见下页图1。
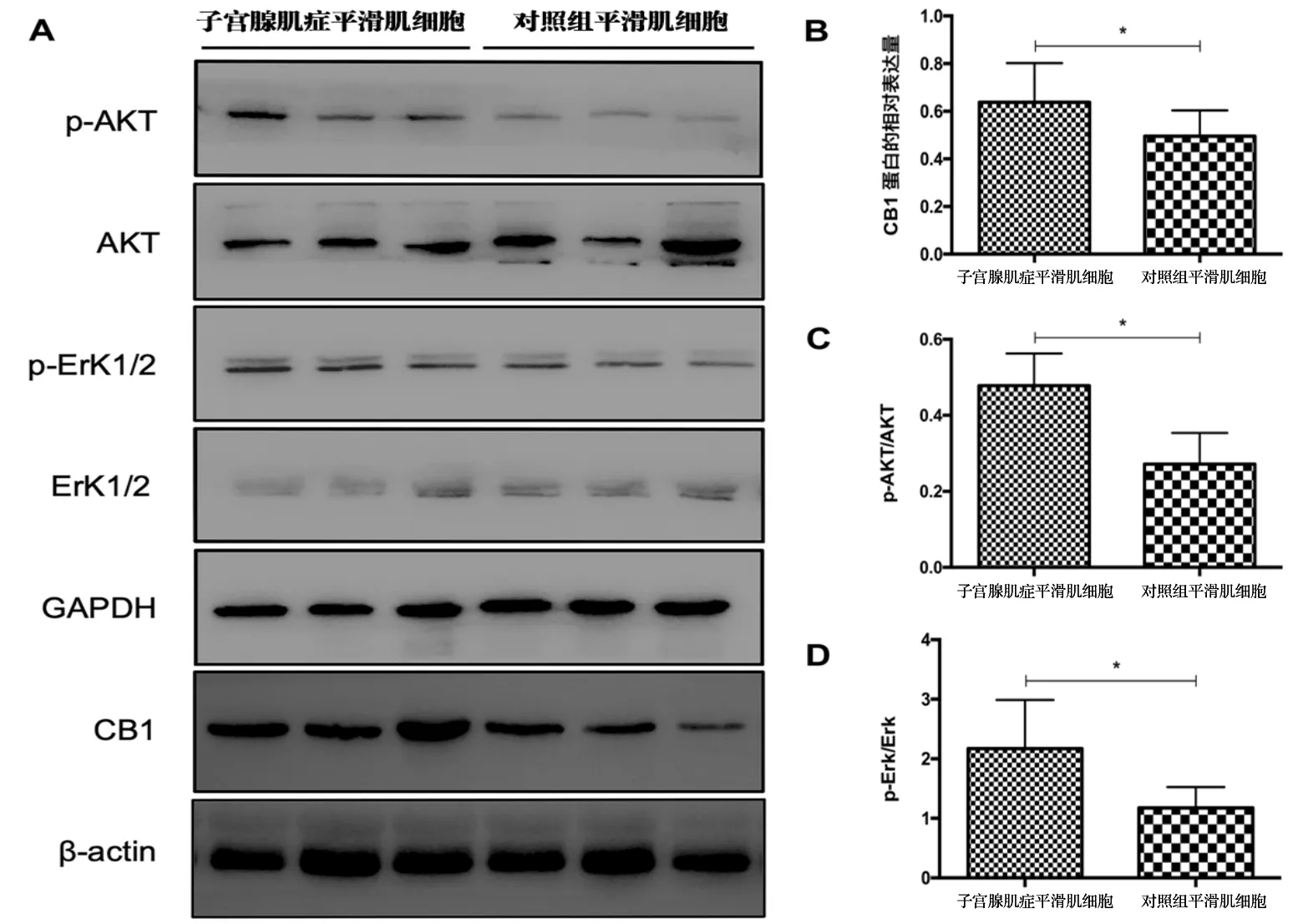
注:A:各蛋白的特征性条带;B:两组细胞间CB1蛋白表达量的比较;C:两组细胞间p-AKT/AKT值的比较;D:两组细胞间p-Erk/ Erk值的比较,*P<0.05。图1 细胞CB1、AKT、p-AKT、Erk1/2、p-Erk1/2蛋白的表达
2.2 药理学干预CB1受体对腺肌病子宫内膜-肌层交界区平滑肌细胞增殖的影响
CCK8结果显示,CB1受体拮抗剂AM251可抑制腺肌病EMI平滑肌细胞体外增殖,其作用有剂量依赖性,即随药物浓度的加大,抑制作用逐渐增强、细胞存活率逐渐下降。各用药组与未用药组相比,差异均有统计学意义(P<0.05)(下页图2A)。通过回归分析,计算得出AM251对腺肌病EMI平滑肌细胞的IC50为6.931×10-7mol/L(下页图2B),故后续实验中AM251浓度选择10-6mol/L。

注:A:不同浓度AM251作用后细胞的存活率;B:不同浓度AM251对细胞的抑制率,50%抑制率对应的X轴上的点即半效抑制浓度IC50以10为底的对数;C:不同浓度ACEA作用后细胞的存活率;D:不同药物作用后细胞存活率的比较。(Log10 M,摩尔浓度以10为底的对数;*,P<0.05,**,P<0.01,***,P<0.001,****,P<0.0001)。图2 药理学干预CB1对腺肌病子宫EMI平滑肌细胞增殖的影响
相反,CB1受体激动剂ACEA可促子宫EMI平滑肌细胞体外增殖,予10-7mol/L、10-6mol/L、5×10-6mol/L的ACEA溶液处理后,细胞存活率逐渐上升,而10-5mol/L的ACEA处理组细胞存活率(159.4±8.6)%,较5×10-6mol/L浓度组(171.1±10.86)%有下降趋势(下页图2C),故后续实验ACEA浓度选择5×10-6mol/L。
为进一步明确CB1受体的作用,我们依次予无血清无酚红培养基、10-6mol/L的AM251溶液、5×10-6mol/L的ACEA、10-6mol/L的AM251溶液预处理30 min后+5×10-6mol/L的ACEA分4组对细胞进行药理学干预CB1受体。通过CCK8检测发现,单独用ACEA组细胞存活率为(169.9±18.3)%,单独用AM251组为(41.5±3.5)%,与培养基对照组(将对照组设为100%)相比,差异均有统计学意义(ACEA组P<0.001,AM251组P<0.001)。而联合用药组细胞存活率(103.4±11.5)%,与对照组相比,差异无统计学意义(P> 0.05)(下页图2D)。
2.3 药理学干预CB1受体对腺肌病子宫内膜-肌层交界区平滑肌细胞凋亡的影响
流式结果显示,CB1受体拮抗剂AM251作用于平滑肌细胞后,细胞凋亡率为(32.75±13.00)%,较未用药组(12.89±4.16)%明显增加,而CB1受体激动剂ACEA作用后的凋亡率降至(8.08±1.86)%。单独用ACEA组和AM251组与未用药组相比,差异均有统计学意义(ACEA组P=0.003,AM251组P=0.014),而联合用药组细胞凋亡率(11.04±2.90)%与未用药组相比,差异无统计学意义(P>0.05)(下页图3)。

注:A:依次为无血清无酚红培养基、10-6 mol/L的AM251溶液、5×10-6 mol/L的ACEA、10-6 mol/L的AM251溶液预处理30 min后再加5×10-6 mol/L的ACEA作用后细胞的流式图;B:不同药物作用后细胞凋亡率(右上象限+右下象限)的比较(*,P<0.05)。图3 药理学干预CB1对腺肌病EMI平滑肌细胞凋亡的影响
2.4 药理学干预CB1受体对腺肌病子宫内膜-肌层交界区平滑肌细胞中CB1及增殖凋亡相关通路蛋白表达的影响
将各目的蛋白条带灰度值和内参灰度值进行半定量。结果显示,ACEA能升高体外培养的腺肌病EMI区平滑肌细胞CB1蛋白、磷酸化AKT及MAPKs家族中ERK1/2的磷酸化水平,分别与未用药组相比,差异均有统计学意义(CB1蛋白P=0.035,p-AKT/AKT的P<0.001,p-Erk/ Erk的P=0.039)。而AM251使其下调,与未用药组相比,差异均有统计学意义(CB1蛋白P=0.034,p-AKT/AKT的P=0.044,p-Erk/ Erk的P=0.018)。而联合用药组与未用药组差异均无统计学意义(CB1蛋白P=0.992,p-AKT/AKT的P=1.0,p-Erk/ Erk的P=0.696)详见下页图4。

注:A:各蛋白的特征性条带;B:各组细胞间CB1蛋白表达量的比较;C:细胞间p-AKT/AKT值的比较;D:细胞间p-Erk/ Erk值的比较,*P<0.05。图4 药理学干预CB1对腺肌病EMI平滑肌细胞CB1、AKT、p-AKT、Erk1/2、p-Erk1/2蛋白表达的影响
3 讨论
3.1 腺肌病子宫内膜-肌层交界区平滑肌细胞的异常增生
EMI的概念源自于正常子宫肌层在超声和磁共振下可明显分为3层的影像学表现,即高信号强度子宫内膜、低信号强度EMI和中信号强度外肌层3层,而腺肌病的存在可以改变或者扭曲这些层次的超声影像[15]。因此,EMI的改变成为腺肌病影像学诊断的重要依据[16- 17],而腺肌病影像学检查中的特征性表现——弥漫性均质的低回声则归因于平滑肌细胞的增生。本课题组前期的研究结果发现,腺肌病组EMI区平滑肌细胞的体外增生能力强于对照组细胞,直接从组织学层面解释了腺肌病EMI异常增厚的原因。
3.2 体外培养腺肌病组子宫内膜-肌层交界区平滑肌细胞CB1和通路蛋白的表达上调
进一步研究发现,腺肌病组EMI区平滑肌细胞CB1蛋白表达均显著高于对照组。既往有研究报道,腺肌病子宫存在明显的肌细胞肥大,丰富的中间丝形成胞质集合体,细胞核轮廓清晰,核仁及其周围排列的核染色质明显,胞质内粗面内质网和高尔基体更为突出,表明蛋白合成更为活跃,且所有的这些特征都在EMI区更为显著[5]。这可能是本实验观察到的腺肌病组细胞CB1表达上调的物质基础,也是腺肌病组EMI区平滑肌细胞肥大的理论基础。为了进一步明确腺肌病组和和对照组细胞体外增殖能力差异的可能原因,我们观察了两组细胞中AKT和MAPK/Erk通路蛋白的表达水平。AKT和MAPK/Erk通路作为细胞增殖凋亡相关的两大主要通路,被广泛证实参与了多种细胞的异常增殖过程,如子宫肌瘤细胞[18]、子宫内膜异位症中异位内膜细胞及多种癌细胞[19]的增殖。本研究的结果证实异常活化的AKT和MAPK/Erk通路存在于异常增殖的腺肌病子宫EMI平滑肌细胞中。
3.3 CB1受体激活对腺肌病子宫内膜-肌层交界区平滑肌细胞体外增殖能力的促进作用
通过CCK8试验,我们发现CB1受体拮抗剂AM251呈剂量依赖性抑制腺肌病EMI平滑肌细胞的体外增殖,随着药物浓度的加大,细胞存活率逐渐下降,而当预先用AM251处理后再用ACEA,细胞的存活率与未用药组相当,提示AM251可完全拮抗ACEA对CB1的药理激活作用,这点与Eckardt K等[20]的报道基本一致,在人骨骼肌细胞中AM251亦可完全阻断四烯酸乙醇胺(AEA,内源性大麻素的一种)的作用。子宫内膜异位症动物模型中的研究也提示,CB1受体的激活促进大鼠子宫内膜异位病灶神经生长[13]及小鼠子宫内膜异位症模型的病灶生长[21]。这些均提示CB1受体的激活与细胞的增殖能力增强密切相关,与本研究的结果一致。
3.4 CB1受体激活对腺肌病子宫内膜-肌层交界区平滑肌细胞体外凋亡能力的抑制作用
本研究发现,选择性CB1受体拮抗剂AM251可促进腺肌病EMI平滑肌细胞的凋亡,并可完全阻断其激动剂ACEA的抑凋亡作用。既往有关CB1受体在细胞凋亡中作用的研究报道亦提示了CB1受体对细胞凋亡的调控作用。Crunfli F等[22]发现ACEA处理可通过上调凋亡抑制蛋白Bcl-2的表达促进神经细胞的存活,Carpi S等[23]报道AM251通过下调凋亡抑制蛋白Bcl-2和survivin的表达及上调Bax的表达诱导人黑色素瘤A375细胞的凋亡。而在前列腺癌中的研究显示,内源性大麻素AEA和2-花生四烯酰甘油(2-arachidonoylglycer,2-AG)可通过激活CB1受体上调活化的含半胱氨酸天冬氨酸蛋白水解酶caspase-3及下调Bcl-2的表达促进癌细胞的凋亡[24]。但是除去各类型细胞之间的本质差异外,各研究采用的大麻素及其相关制剂均不同,实验的有效浓度和涉及的受体亦不同,尚需更深入的研究来阐明大麻素及其受体的作用。
3.5 药理学干预CB1受体对腺肌病子宫内膜-肌层交界区平滑肌细胞AKT和MAPK/Erk通路的影响及其意义
目前,大麻素在体内发挥生物学作用的机制尚未完全阐明,但是有大量研究认为大麻素受体的激活可能通过以下途径促使大麻素发挥作用[25]:① 大麻素受体偶联磷脂酶C和A介导Ca2+内流;② 对离子通道的调节,如电压门控Ca2+通道、G蛋白偶联受体内部整流K+通道;③ 介导环腺苷酸cAMP和一氧化氮的产生;④ 通过MAPKs通路,包括Erk,p38 MAPK和Jun 氨基末端激酶 (JNK)等,及磷脂酰肌醇3激酶PI3K/Akt等信号通路的介导。本研究证实,异常增殖的腺肌病EMI平滑肌细胞中存在CB1表达的上调,AKT和MAPK/Erk通路的异常激活,CB1受体的激活可以促进腺肌病EMI平滑肌细胞的体外增殖。与此同时,这些结果提示CB1受体对EMI平滑肌细胞的作用可通过激活AKT和MAPK/Erk信号通路介导,而选择性CB1受体拮抗剂AM251对子宫腺肌病有潜在的治疗作用。CB1在细胞内发挥作用的机制多样,具体因细胞及作用类型而异。在子宫内膜异位症中的研究发现,大麻素可通过激活CB1受体活化PI3K和Erk1/2信号通路促进内膜间质细胞的迁移[9],提示CB1受体抑制剂对子宫内膜异位症的潜在治疗作用,与本文的结果基本一致。而在神经祖细胞中也曾有学者清楚地描述了CB1所介导的AKT和Erk1/2通路活化的分子机制[26]。具体而言,Erk活化是由于CB1与异源三聚体Gi/o蛋白的偶联并降低cAMP水平从而在一定程度上阻断蛋白激酶A对Raf-1的抑制作用所致,而PI3K活化是Gβγ依赖性机制。这些均提示,CB1受体与AKT和MAPK/Erk通路有着千丝万缕的联系,其通过这些通路的活化或抑制在体内发挥着多种生物学作用,但具体机制尚需更多的研究证实。
综上所述,本研究已经证实腺肌病组EMI平滑肌细胞增殖能力的增强与AKT和MAPK/Erk通路的激活有关。大麻素受体CB1作为内源性大麻素发挥作用的主要受体,可通过激活AKT和MAPK/Erk信号通路促进腺肌病EMI平滑肌细胞的体外增殖并抑制其凋亡。本研究为进一步明确子宫腺肌病的病因与病理机制,延缓腺肌病发生发展提供潜在治疗靶点。
