湿法液相合成α-PbO与β-PbO
2022-02-12熊浩宇黄魁卢远桓刘玉玲董海丽
熊浩宇,黄魁,卢远桓,刘玉玲,董海丽
(广西大学资源环境与材料学院,广西 南宁 530004)
铅酸蓄电池是我国产量最大、用途最广的电池之一,其报废后带来的环境问题是人们关注的重点。同时,再生铅产铅的成本及能耗比开采铅矿分别低38%和33%,所以废铅酸蓄电池是生产再生铅的主要原料,占比达85%以上。因此,对废旧铅酸蓄电池进行资源化回收有着重要意义。回收废铅酸蓄电池的关键是回收其主要成分废铅膏。废铅膏的传统回收方法主要分为火法高温冶炼和湿法再生工艺。火法高温冶炼工艺通常采用1000℃以上的高温对含铅原料进行熔炼,不仅能耗高,而且会产生大量SO和铅尘等毒害物质。湿法再生工艺通常以强酸或强碱为电解液,然后通过电解沉积等方法将铅提取出来,这种方法虽然有效减少了SO和铅尘的排放,但其电解效率低、能耗较大。以上两种方法通常以单质铅的形式回收铅,产物再利用时通常需要以磨球法将其转化为PbO等其他形式。为了减少污染、节约能耗和简化回收利用流程,以PbO形式回收废铅酸蓄电池的新工艺引起人们的关注。PbO 有四方晶型(litharge,α−PbO)和正交晶型(massicot,β−PbO)两种晶体形态,在铅酸蓄电池制造、医疗和玻璃制造等行业有着广泛的用途。国天骄将回收得到的α−PbO 和β−PbO用作电池活性材料,发现在正极中应用时,α−PbO在初始容量、寿命、低温性能等方面有明显提升;在负极中应用时,β−PbO 的充放电容量优于α−PbO。Zhou等用β−PbO为原料制成电池,电池容量比普通PbO电池提高了66%。
目前,以PbO形式回收废铅膏的工艺主要有两种。第一种是湿法冶金和火法冶金工艺联用法,将废铅膏脱硫后,以柠檬酸、乙酸等有机酸将其转化,得到熔点相对低的前体,然后通过300~500℃的低温焙烧工艺可以得到两种晶型的PbO。这种方法虽然能减少污染物气体排放并直接得到PbO,但相对的高温条件也导致了能耗和铅尘问题。因此,第二种通过液相反应合成PbO的思路成了铅回收工艺新的研究方向。
Kwestroo 等向自制乙酸铅溶液中加入自制氨水,强烈搅拌后得到白色沉淀,继续搅拌一定时间后白色沉淀转化为绿色沉淀,通过分析得知该绿色沉淀为正交晶型的β−PbO,并推测反应过程如式(1)所示。
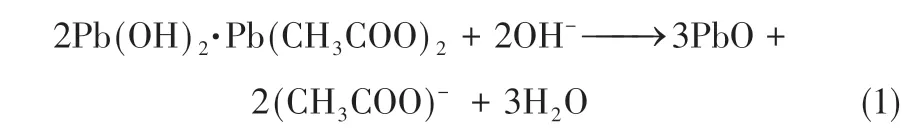
Veluchamy等用纯化后的乙酸铅溶液与NaOH颗粒反应,得到了较纯的α−PbO,并推测反应过程如式(2)所示。
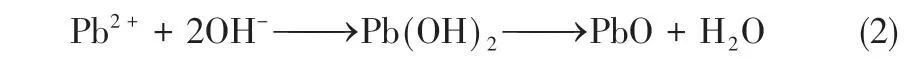
该研究还发现乙酸铅溶液与热的NaOH溶液反应,可以得到α−PbO 和β−PbO 的混合物,随着NaOH溶液投加浓度升高,产物中α−PbO的含量也随之提高,当NaOH投加量高于一定值后,产物又重新溶解于溶液中。
Yu 等利用类似方法,向加热至95℃的纯乙酸铅溶液和硝酸铅溶液中,加入以95℃去离子水快速溶解的NaOH 溶液,加热并搅拌30min 后得到纯α−PbO。
由上述研究可以看出,通过乙酸铅溶液与NaOH 反应,液相合成PbO 是一种可行的研究思路,具有环保、低能耗、反应迅速和产物纯度高等优势。但目前相关文献报道较少,反应的中间过程和机理还处于探究阶段,对该工艺下区分两种晶型PbO产物的合成条件也还未开展探究。
基于乙酸铅溶液与NaOH反应液相合成PbO工艺,通过改变投加NaOH方式分别得到了两种晶型的PbO。探究了反应温度、时间及物料投加量对合成结果的影响,分析了β−PbO 合成过程中出现的反应中间过程。通过对比两种晶型PbO 的合成结果,对反应过程进行了初步推断。以期为铅膏湿法回收液相合成PbO提供理论和数据支撑。
1 实验材料与仪器
实验以乙酸和过氧化氢浸出模拟脱硫铅膏的浸出液为原料,所用药品与试剂均为分析纯。所用仪器有六联磁力加热搅拌器、ICP−AES电感耦合等离子发射光谱仪、X射线衍射仪等。
2 实验方法
以乙酸和过氧化氢溶液浸出模拟脱硫铅膏,得到乙酸铅溶液。根据前期实验探究,氢氧化钠脱硫铅膏铅成分为PbO(质量分数58.45%)、PbO(质量分数37.13%)、PbSO(质量分数0.45%)和Pb(质量分数1.41%),总Pb质量分数约88%。以乙酸与总Pb的摩尔比/=2.00、过氧化氢与PbO的摩尔比/=1.25、液固比10∶1、浸出时间40min、搅拌速率300r/min 为实验条件浸出模拟脱硫铅膏,得到乙酸铅溶液。经测定,制得的乙酸铅溶液pH=5.37,Pb浓度为85.48g/L。
将20mL 上述乙酸铅溶液加热至一定温度,分别以3 种方式投加一定量NaOH(方式A 为投加提前一天配制的50%NaOH 溶液;方式B 为NaOH 颗粒与等质量去离子水快速混合后投加;方式C为投加NaOH 球形颗粒),恒温搅拌一定时间后过滤,将滤渣用去离子水洗净,并在75℃烘箱中烘干后,分析产物组成成分,并对滤液中Pb 的含量进行分析。改变反应温度(35℃、55℃、75℃、95℃)、反应时间(1min、5min、10min、20min)和NaOH与乙酸铅溶液中Pb的摩尔比(/=2.00、2.50、3.00、3.50)对PbO的合成条件进行探究,实验设计如表1所示。

表1 实验设计
采用化学滴定法对产物中PbO 的质量分数()、滤液中Pb 质量()以及Pb 的损失率()进行分析,计算方法如式(3)~式(5)所示。
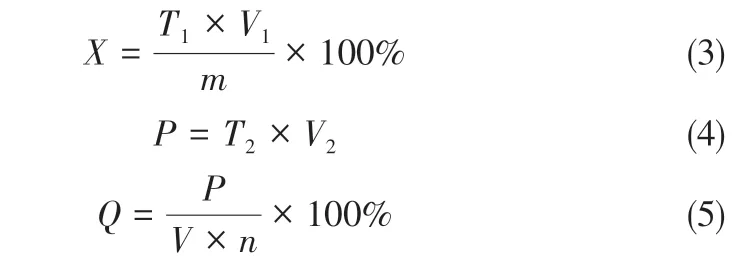
3 结果与分析
3.1 β-PbO的合成探究(NaOH投加方式A)
NaOH投加方式A条件下产物的XRD曲线及外观图如图1所示。
由图1(a)可见,反应温度在55℃以下时,产物为白色粉末,由XRD 曲线可知,该产物组成成分为PbO(OH);反应温度达到75℃时,产物颜色向墨绿色转变,且粉末表面有反光现象,XRD 曲线上出现β−PbO特征峰,这说明温度高于55~75℃之间的某一温度时产物向β−PbO 转化,此时产物XRD 曲线未能与标准卡片完全对应的原因可能是反应温度尚未达到最佳条件;反应温度上升至95℃后,产物颜色加深,呈墨绿色,此时XRD 曲线出峰稳定,且与标准卡片编号77−1971 的β−PbO 对应,这说明当温度高于75℃至95℃之间的某一温度时,该反应产物为β−PbO,反应温度升高有利于β−PbO 的合成转化,因此选择95℃作为β−PbO 的液相合成条件。
由图1(b)、(c)可见,反应产物都呈现墨绿色,随着反应时间与NaOH 与Pb 摩尔比的增加,产物颜色逐渐加深。反应1min 时,产物XRD 曲线的峰虽然无法与标准卡片一一对应,但其主晶峰的位置与β−PbO 能够较好对应,这可能是因为反应刚开始,β−PbO 仅在优势晶面择优生长导致;反应5min 后,反应产物XRD 曲线的峰与β−PbO 标准卡片能较好地对应,而随时间发生的主要变化是产物的主晶峰的相对强度。由此可见,NaOH投加方式A 合成β−PbO 的速率较快,反应在5min 内就能得到产物β−PbO。而在不同NaOH 与Pb 摩尔比条件下,产物出峰位置都比较稳定,XRD 曲线与标准卡片相吻合,产物都是β−PbO。随着NaOH 与Pb摩尔比的增加,晶峰的相对强度同样发生变化,在2=30.03°晶面(200)位置的峰强不断增加,说明其结晶度增大。因此推测,随着反应时间、NaOH与Pb 摩尔比增加,产物在晶面(200)处可能发生取向生长,产物的微观形貌出现差异导致外观不同,表现为产物颜色加深和表面呈现反光现象。

图1 NaOH投加方式A条件下产物的XRD及外观图
进一步对不同NaOH 与Pb 摩尔比条件下产物进行电镜分析,结果如图2所示。

图2 不同NaOH与Pb摩尔比条件下产物电镜图
由图2 可见,四组产物的微观形貌呈现出与β−PbO 相符的片状结构,/=2.50 条件下的β−PbO 形状为相对规则的四边形、多边形片状结构,粒径相对较小,多为5~20μm,而其他条件下的产物微观形貌从规则的四边形、多边形片状结构向不规则圆形片状结构转变,粒径也从5~20μm增加到30μm以上,由此进一步推断,产物外观表现的差异是由产物微观形貌改变所致。
为确定β−PbO 最佳合成条件,采用化学滴定法测定上述β−PbO 产物中β−PbO 含量与滤液中Pb含量,并计算Pb的损失率,结果如表2所示。
由表2可见,反应5min产物中PbO质量分数为96.95%,Pb 损失率2.90%。随着反应时间增加,PbO 含量有所上升,滤液中Pb 的损失率也有所下降,在反应20min 时产物中β−PbO 质量分数为98.16%,Pb的损失率为2.80%。NaOH与Pb摩尔比/=2.00时,产物中β−PbO质量分数为96.31%,Pb 损失率为0.33%。随着NaOH 与Pb 摩尔比增加,产物中β−PbO 质量分数可达到98%以上,但过量的NaOH 会溶解生成的β−PbO,导致滤液中Pb含量不断增高,Pb 的损失率不断升高。为了保证β−PbO 产物纯度的同时降低Pb 的损失,选取反应时间20min、NaOH 与Pb 摩尔比/=2.50 为β−PbO的液相合成条件。

表2 NaOH投加方式A条件下产物纯度、滤液中Pb含量及Pb损失率的测定结果
3.2 α-PbO的合成探究(NaOH投加方式B)
NaOH投加方式B条件下产物的XRD曲线及外观图如图3所示。
由图3(a)可见,反应温度55℃以下时,反应产物呈白色粉末状,XRD 曲线显示,该产物组成成分为PbO(OH);当温度大于75℃时,产物颜色呈橘红色,产物XRD 曲线与标准卡片编号05−0561的α−PbO 对应较好,产物中只有α−PbO。因此推断,该反应与β−PbO 液相合成反应一样,均受到反应温度的限制,只有温度高于55~75℃之间的某一温度时才能得到α−PbO,溶液温度升高有利于α−PbO 的合成转化,为了保证α−PbO 的合成效果以及后续进一步对比两种晶型的PbO产物的合成结果,以95℃作为α−PbO的合成温度。
由图3(b)、(c)可见,/=2.00 时产物颜色为橘黄色,此时产物为α−PbO 与少量β−PbO 的混合物,其余不同反应时间、NaOH与Pb摩尔比条件下产物都为橘红色的α−PbO。产物随时间和NaOH投加量增加变化不大,这说明NaOH投加方式B合成α−PbO 的反应速度快,极短的时间内就能得到产物α−PbO。而/=2.00 时出现的β−PbO,可能是由于乙酸铅溶液中残余的乙酸对NaOH的消耗影响了α−PbO的合成转化。
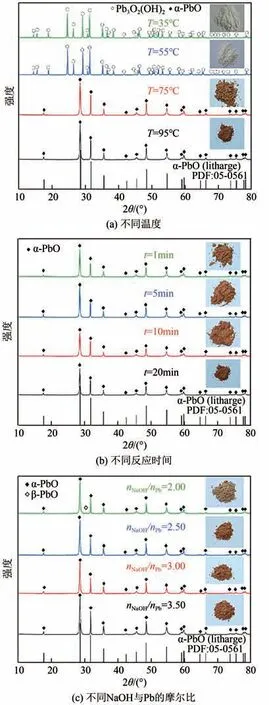
图3 NaOH投加方式B条件下产物的XRD及外观图
为确定α−PbO 最佳合成条件,采用化学滴定法测定上述β−PbO 产物中β−PbO 含量与滤液中Pb含量,并计算Pb的损失率,结果如表3所示。
由表3 可见,反应开始1min,产物中α−PbO质量分数达到了98.28%,随着反应时间增加,产物中α−PbO的纯度不断增加,在20min后可达99%以上。滤液中Pb 含量随时间变化不大,Pb 的损失率从反应刚开始的2.27%,随反应时间增加最终稳定到2.00%左右。这同样说明了α−PbO的液相合成转化是一个快速反应的过程,反应时间的增加可以提高产物α−PbO 的纯度。产物中α−PbO 质量分数在投加量/=2.50时达到99.38%,随投加量的增加α−PbO含量略有波动,但都稳定在99%以上,而滤液中Pb 含量随投加量增加而增加,Pb 的损失率从1.94%上升至6.06%,为了在保证产物纯度的同时减少Pb 的损失,选择反应时间20min、NaOH与Pb摩尔比/=2.50为α−PbO的合成条件。

表3 NaOH投加方式B条件下产物纯度、滤液中Pb含量及Pb损失率的测定结果
3.3 不同NaOH投加方式结果对比与分析
3.3.1 NaOH投加方式C的合成结果分析
由上述实验探究可知,两种晶型的PbO的液相合成皆受到温度的限制,反应温度升高有利于PbO的合成转化。同时,液相合成PbO的反应过程十分迅速,较短的时间内就能得到对应的PbO产物,反应时间在20min左右产物的回收率较高。为了更好地对比不同投加方式对PbO液相合成的影响,以温度=95℃、反应时间=20min 为条件,探究NaOH投加方式C在不同NaOH与Pb摩尔比条件下对合成结果的影响,结果如图4所示。
图4 可以看到,/=2.00 时,产物呈橘黄色粉末状,由XRD 曲线可知,此时的产物为α−PbO 以及β−PbO 的混合物;/≥2.50 时,产物都为橘红色α−PbO粉末。该实验结果与NaOH投加方式B相似,而在NaOH与Pb摩尔比较低时,出现的β −PbO 可能是乙酸铅溶液中残余的乙酸对α−PbO合成转化造成的影响。

图4 NaOH投加方式C条件下不同NaOH与Pb摩尔比产物的XRD及外观图
采用化学滴定法测定不同NaOH 与Pb 摩尔比产物中α−PbO 纯度,滤液中Pb 含量和Pb 的损失率,结果如表4所示。
由表4 可见,产物中α−PbO 质量分数在NaOH与Pb 摩尔比/=2.50 时,即可达到99.12%,α−PbO 质量分数随投加量的增加有所上升,都稳定在99%以上。滤液中Pb 含量随投加量增加而增加,Pb的损失率从0.91%上升至6.59%。为了减少Pb的损失,选择/=2.50作为最佳NaOH与Pb摩尔比。

表4 NaOH投加方式C条件下产物纯度、滤液中Pb含量及Pb损失率的测定结果
3.3.2 NaOH 溶解放热过程对液相合成PbO 产物晶型的区分
上述3 种NaOH 投加方式最佳实验条件下合成PbO的结果如表5所示。

表5 不同NaOH投加方式下合成PbO结果对比
由表5 可见,3 种投加方式在一定温度、反应时间和NaOH 与Pb 摩尔比条件下都能从乙酸铅溶液中合成PbO,而区分α−PbO 与β−PbO 两种晶型产物的关键是液相合成过程中是否有NaOH溶解放热过程参与反应。方式A投加提前配制的NaOH溶液,没有NaOH溶解放热过程参与反应,得到的产物是常温下相对不稳定的正交晶型的β−PbO。而方式B 与方式C 因为有NaOH 溶解放热过程参与反应,反应过程更加剧烈,促进了产物向更加稳定的四方晶型的α−PbO转化。
3.3.3 反应过程与机理初步推断
在β−PbO 转化过程中发现,反应开始的前几秒,先生成了某种白色中间产物,在加热搅拌过程中又迅速转变为墨绿色的β−PbO。为了对PbO的合成过程与机理进行初步推断,采用投加方式A的最佳合成条件,在反应刚开始生成白色产物时迅速过滤、冲洗并在55℃条件下烘干后分析,实验结果如图5所示。

图5 NaOH投加方式A条件下中间产物的XRD及外观图
由图5可见,产物总体呈浅绿色。XRD曲线显示,产物为PbO(OH)与β−PbO的混合物。由此推测,反应刚开始生成的白色中间产物为PbO(OH),因为β−PbO的合成转化过程快,部分PbO(OH)在反应刚开始的高温搅拌条件下向β−PbO 转化,导致产物中出现绿色的β−PbO 粉末,使得产物呈现浅绿色。而PbO(OH)中Pb原子与O原子之间呈现一种方锥状单侧配位结构,这种结构与α−PbO与β−PbO 中Pb 原子与O 原子之间形成的单侧配位结构相似。同时,在氧气氛围中,以25~170℃持续加热PbO(OH),可以分解得到α−PbO与β−PbO的混合物。由此推断,中间产物PbO(OH)与最终产物PbO之间,在一定条件下存在转化关系。结合上述不同条件下的合成实验分析结果,乙酸铅溶液与NaOH 液相合成PbO 过程中,PbO 的产生也与中间产物PbO(OH)的分解转化有关,反应过程如式(6)、式(7)所示。

乙酸铅与NaOH在加热、搅拌条件下先合成中间产物PbO(OH),随后PbO(OH)又快速分解得到β−PbO。该反应受到温度的限制,在75℃以上的加热恒温、搅拌条件下才会发生转化,溶液温度越高越有利于β−PbO的转化。
而α−PbO 的合成转化反应过程更加迅速,无法观察到中间反应过程。基于α−PbO 与β−PbO 在常温条件下不同的稳定性推断,α−PbO 的液相合成过程与β−PbO 相似,反应刚开始生成中间产物PbO(OH),但NaOH 溶解放热过程参与了反应,使得反应过程更剧烈,中间产物PbO(OH)在极短的时间内向常温下更加稳定的α−PbO分解转化。
4 结论
(1)乙酸铅溶液与NaOH反应液相合成PbO的工艺是可行的,反应先生成中间产物PbO(OH),随后PbO(OH)迅速分解得到β−PbO。
(2)NaOH 溶解放热过程参与反应可以加速反应进程,并使中间产物PbO(OH)的分解向α−PbO转化,因此通过改变NaOH 的投加方式可以得到α−PbO与β−PbO两种晶型的产物。
(3)β−PbO 的合成条件为:温度95℃,投加提前一天配制的50%NaOH溶液,NaOH与Pb摩尔比/=2.50,恒温搅拌20min。
(4)α−PbO 的合成条件为:温度95℃,NaOH颗粒与等质量去离子水快速混合后投入,NaOH与Pb摩尔比/=2.50,恒温搅拌20min。
符号说明
—— 用于PbO滴定的样品质量,g
—— 乙酸铅溶液浓度,g/L
—— 滤液中Pb质量,g
—— Pb损失率,%
—— EDTA标准溶液对PbO的滴定度,g/mL
—— EDTA标准溶液对Pb的滴定度,g/mL
—— 乙酸铅溶液体积,mL
,—— EDTA标准溶液用量,mL
—— PbO质量分数,%
