温敏印迹硅胶微球对薯蓣皂素的吸附及控制释放
2022-02-12毛琳许国强罗晓玥田海希李辉
毛琳,许国强,罗晓玥,田海希,李辉
(吉首大学化学化工学院,湖南 吉首 416000)
薯蓣皂素是一种存在于豆类、葫芦巴及山药等药用植物中的生物活性物质,具有抗炎、抗感染、抗癌、抗衰老、抗血栓形成和抗神经病等药理活性,对糖尿病、高血脂、癌症、心血管疾病、氧化应激和炎症具有明显疗效。药理研究揭示薯蓣皂素对肺纤维化、非酒精性脂肪性肝病、心脏病和癌症具有较好疗效。但薯蓣皂素治疗人体疾病过程中在细胞内渗透力差,导致其在病灶部位堆积效率低有效浓度不高,疗效甚微。构建有效的药物传输系统,促成薯蓣皂素在病灶部位持续有效释放极具价值。
探寻合适药物载体对控制药物有效释放以提高疾病治疗效果具有积极意义。理想药物传递系统要求药物在指定位置以合适的浓度释放合适的时间。以人工合成的聚合物材料作为药物载体近年来已取得了一些进展和应用,但是仍然有大量问题限制了这些聚合物材料的广泛应用。尤其是常规聚合物材料不能根据外界环境条件变化而对其药物控制释放具有灵敏响应,无法控制药物分子在不同环境条件下释放的浓度和时间,不能达到最佳治疗效果。为了提升药物载体对药物分子的有效负载及外部条件响应释放,智能水凝胶引起了广泛关注,其可以根据环境条件如温度、pH、离子强度、磁场等条件改变而发生形变。温敏水凝胶是智能水凝胶的一种,其主要随温度变化而产生形变。−异丙基丙烯酰胺是制备温敏水凝胶常用的单体,因其临界温度(LCST)为32℃,比较接近人体温度而应用广泛。以−异丙基丙烯酰胺为单体合成的温敏水凝胶在低于临界温度时会吸水而膨胀,在高于临界温度时会失水而收缩。常规水凝胶虽已用于药物载体,但由于缺乏特异识别性,因此在载药和控制药物释放的过程中不能对特定药物分子进行高效装载和有效释放。研制具备特异识别性能的新型水凝胶作为药物载体具有积极意义。分子印迹聚合物(molecular imprinted polymer,MIP)是以特定化合物为模板,采用化学合成制备的一种对目标分子具有高选择识别能力的聚合物。这种聚合物因其对目标分子的特异识别性和易合成性备受关注。将分子印迹的高选择性和水凝胶的可控变形性结合可发挥二者优势,获得性能优越的药物载体。为制备分子印迹水凝胶,研究者们尝试了不同的合成方法。Kobayashi 等使用本体聚合法合成环糊精分子印迹聚合物膜,但在研磨过程中印迹位点破坏较为严重,影响了聚合物的特异识别性。Kan 等用沉淀聚合法制备了对苯二酚印迹微球,其作为药物载体在对苯二酚的控制释放中效果较好。Lin 等用悬浮聚合法制备了孔雀石绿磁性印迹聚合物用于鱼样分析,虽产物粒径均一,但较多的有机溶剂残留限制了其在药物释放中的应用。表面印迹是一种将印迹位点布局在载体表面,以获得高传质动力学的新型印迹技术。
本研究以烷基化硅胶为载体,以甲基丙烯酸(MAA)和−异丙基丙烯酰胺(NIPAm)为共同功能单体,制备薯蓣皂素温敏印迹微球,进而研究这种印迹微球的载药性及外部环境控制的药物释放响应性。
1 实验
1.1 主要试剂与仪器
薯蓣皂素(纯度99%)、−甲基丙烯酰氧基丙基三甲氧基硅烷(纯度98%)、乙二醇二甲基丙烯酸酯(纯度98%)、−异丙基丙烯酰胺(纯度98%),河南省万家标准物质研发中心有限公司;−甲基丙烯酸(纯度99%)、偶氮二异丁腈(纯度98%),美国阿拉丁工业公司;正硅酸乙酯、乙腈、甲醇,成都金山化学试剂有限公司;十二胺、乙醇、丙酮、甲苯,天津市永大化学试剂有限公司。
高效液相色谱仪,LC10−AD,日本岛津公司;傅里叶红外变换红外光谱仪,IR−Affinity−1,日本岛津公司;扫描电子显微镜,S−3400N,日立公司;高速台式离心机,TGL−16,金坛市大地自动化仪器厂;电子天平,FA2104N,上海菁海仪器有限公司;真空干燥箱,DZ−1AⅡ,天津市泰斯特仪器有限公司;超声波清洗器,KQ250E,昆山市超声仪器有限公司;磁力加热搅拌器,DF−101S,巩义市予华仪器设备有限公司;恒温水浴锅,GSY−Ⅱ,北京市医疗设备厂;循环水式多用真空泵,SHZ−D(Ⅲ),巩义市科华仪器设备有限公司。
1.2 温敏印迹硅胶微球的制备
温敏印迹硅胶微球的制备主要包括三步:①硅胶微球的制备;②硅胶微球的表面修饰;③温敏印迹硅胶微球的制备。其主要过程如图1所示。
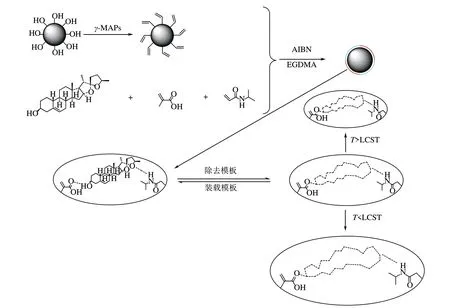
图1 温敏印迹硅胶微球的制备过程
1.2.1 硅胶微球的制备
称取2.0g 十二胺(DDA),于303K 下溶于50.0mL乙醇−水(体积比2∶1)混合溶剂中,搅拌约40min,然后在搅拌下缓慢滴入10.0mL正硅酸乙酯(TEOS)。在此温度下保持24h后,过滤反应混合物并用10.0mL蒸馏水洗涤三次。残渣在373K下干燥6h,然后用乙醇索氏提取10h。在353K 下干燥6h得到的固体为硅胶微球。
1.2.2 硅胶微球表面修饰
称取2.0g 上述步骤制备的硅胶微球,并与10.0mL 甲醇和4.0mL−甲基丙烯氧基丙基三甲氧基硅烷(−MAPs)充分混合,在313K下搅拌反应12h,然后过滤,用10.0mL蒸馏水洗涤三次。固体在333K下干燥24h,得到烷基化修饰的硅胶微球。
1.2.3 温敏印迹硅胶微球(TMIP)的制备
准确称取83.0mg薯蓣皂素充分溶解在20mL乙腈中,向溶液中添加32μL−甲基丙烯酸(MAA)和0.0806g−异丙基丙烯酰胺(NIPAm)。恒温磁力搅拌4h 后,加入0.7128g 乙二醇二甲基丙烯酸(EGDMA)和0.0396g 偶氮二异丁腈混匀后加入2.0g烷基化修饰的硅胶微球混合,超声处理15min,通15min N除去反应体系中的O。体系在60℃油浴下反应24h。反应完成后产物用甲醇−冰乙酸(体积比9∶1)的混合溶液反复洗涤至洗涤液中检测不到薯蓣皂素为止,再用甲醇洗涤多余的乙酸。将固体放入真空干燥箱于40℃干燥24h。
不添加模板,按同样的方法制备温敏非印迹硅胶微球(TNIP)。
1.3 温敏印迹硅胶微球的等温吸附性能
以乙腈为溶剂配制薯蓣皂素标准溶液(0.04~0.4mg/mL),分别向其中加入20mg TMIP,体系于30℃水浴中吸附4h。然后,用高效液相色谱分析各溶液中薯蓣皂素浓度,按式(1)计算薯蓣皂素吸附量(,mg/g)。每组实验平行测定3次取其平均值。
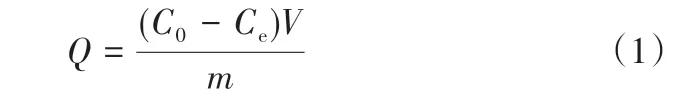
式中,、分别为吸附前后溶液中薯蓣皂素浓度,mg/mL;为溶剂体积,mL;为吸附剂质量,g。
1.4 温敏印迹硅胶微球的控制释放
1.4.1 薯蓣皂素的装载
以乙腈为溶剂配制浓度为0.4mg/mL 薯蓣皂素溶液50mL,加入100mg 温敏印迹硅胶微球(或100mg 非印迹硅胶微球),体系置于30℃水浴中吸附12h后,用高效液相色谱分析溶液中薯蓣皂素浓度,按式(1)计算薯蓣皂素装载量(,mg/g)。吸附有薯蓣皂素的分子印迹聚合物用0.45μm 微孔滤膜过滤后于40℃真空干燥12h。
1.4.2 薯蓣皂素的释放动力学
在5mL 甲醇溶液中,加入20mg 已载药温敏印迹硅胶微球。体系置于30℃水浴中释放,每间隔1h,取少量上清液用高效液相色谱测定其中薯蓣皂素浓度C,按式(2)计算薯蓣皂素释放率。

式中,C为不同时刻溶液中薯蓣皂素浓度,mg/mL;为溶剂体积,mL,'为薯蓣皂素载药量,mg/g。
1.4.3 不同温度下薯蓣皂素的释放
在5mL 甲醇溶液中,加入20mg 已载药温敏印迹硅胶微球。体系置于水浴中,控制水浴温度分别为20℃、25℃、30℃、35℃及40℃释放4h后,离心分离,取适量上清液测定其中薯蓣皂素浓度,按式(2)计算不同温度下薯蓣皂素释放率。每组实验平行测定3次,取平均值。
1.4.4 不同溶剂中薯蓣皂素的释放
准确称取20mg 已载药温敏印迹硅胶微球,分别加入5mL 水、乙醇、甲醇、乙酸、乙腈、丙酮及甲苯溶液,体系置于水浴中,控制水浴温度为30℃,释放4h 后,离心分离,取适量上清液测定其中薯蓣皂素浓度,按式(2)计算不同溶剂中薯蓣皂素释放率。每组实验平行测定3 次,取平均值。
1.4.5 不同离子强度下薯蓣皂素的释放
以甲醇为溶剂加入不同质量的固体NaCl,搅拌至NaCl 固体充分溶解,配制成不同离子强度(0.5×10~2.5×10mol/L)的NaCl−甲醇溶液,分别加入20mg 已载药温敏印迹硅胶微球,体系置于30℃水浴中释放4h 后,离心分离,取适量上清液测定其中薯蓣皂素浓度,按式(2)计算不同离子强度甲醇溶剂中薯蓣皂素释放率。每组实验平行测定3次,取平均值。
1.5 高效液相色谱分析
1.5.1 标准曲线的制备
准确称取40mg 薯蓣皂素放入小烧杯中,加入20mL 乙腈,搅拌至薯蓣皂素充分溶解后移入100mL 容量瓶中,用乙腈定容至100mL。摇匀得到0.4mg/mL 薯蓣皂素标准溶液。分别取1.0mL、2.0mL、3.0 mL、4.0mL 及5.0mL 薯蓣皂素标准溶液于10mL 容量瓶中,用乙腈定容至刻度线。制得浓度分别为0.04mg/L、0.08mg/L、0.12mg/L、0.16mg/mL及0.20mg/mL的薯蓣皂素标准溶液。
高效液相色谱分析在C柱上进行,流动相为乙腈−水(体积比9∶1),流速为1.5mL/min,检测波长为203nm,进样量为5μL,柱温为室温。薯蓣皂素物质色谱图如图2所示,拟合方程为式(3)。

图2 不同浓度薯蓣皂素标准物质的高效液相色谱图
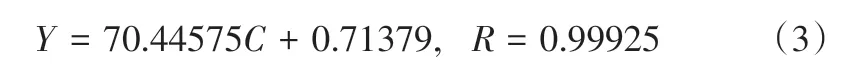
式中,为峰面积;为底物浓度;为拟合系数。
1.5.2 样品分析
固定色谱条件不变,取待测溶液用0.45μm 的微孔滤膜过滤后进样5μL。用标准曲线法测定样品溶液中薯蓣皂素浓度。
2 结果与讨论
2.1 温敏印迹硅胶微球的制备与表征
作为药物载体,低毒性材料显然可以降低药物传输系统对细胞以及人体的损害。本文使用低毒性的硅胶为基质,通过表面化学修饰,再接枝分子印迹聚合物以制备薯蓣皂素温敏印迹硅胶微球。制备时使用了较大的溶剂用量,分子印迹聚合物接枝在硅胶表面后以沉淀形式生成印迹硅胶微球。印迹聚合物的分离只需过滤即可,不需经过研磨过程,避免了印迹损伤。
图3 显示了硅胶微球、烷基化修饰硅胶微球、薯蓣皂素标准样品以及温敏印迹硅胶微球的红外光谱图。在硅胶微球的红外光谱图中,3170cm、1629cm处出现的吸收峰为O—H 伸缩和弯曲振动吸收峰,1074cm处的吸收峰为Si—O—Si 拉伸振动峰;在烷基化修饰硅胶微球的红外光谱图中,3170cm、1629cm处出现的峰为O—H 伸缩和弯曲振动吸收峰,1074cm处的吸收峰为Si—O—Si伸缩振动吸收峰,在1722cm处的吸收峰为C= O伸缩振动吸收峰,这表明−MAPs对硅胶微球修饰成功;在薯蓣皂素红外光谱图中,3170cm处的吸收峰为O—H 伸缩振动吸收峰,2960cm处的吸收峰为—CH中C—H键伸缩振动吸收峰,1644cm处的吸收峰为C=C键伸缩振动吸收峰,1456cm处的吸收峰为C—H 键弯曲振动吸收峰,1246cm处的吸收峰为C—O—C伸缩振动吸收峰,1058cm处为C—C 伸缩振动吸收峰;在温敏印迹硅胶微球的红外光谱图中,3438cm处的吸收峰为N—H 伸缩振动吸收峰,3172cm处的吸收峰为O—H 伸缩振动吸收峰,1730cm处的吸收峰为C=O 伸缩振动吸收峰,1644cm处的吸收峰为C=C伸缩振动吸收峰,1456cm处为C—H弯曲振动吸收峰,1074cm处的吸收峰为Si—O—Si 振动吸收峰。这些结果表明薯蓣皂素印迹聚合物成功接枝到硅胶表面。
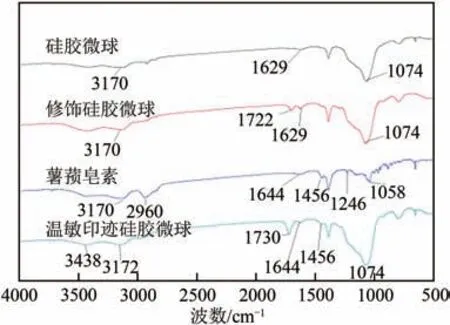
图3 4种样品的FTIR
图4(a)~(c)显示了硅胶微球、温敏印迹硅胶微球以及非印迹硅胶微球的扫描电镜图。从图4(a)可以看出,硅胶微球粒径较为均匀,平均粒径约为5μm。当硅胶表面接枝聚合物后生成的硅胶微球粒径增大至约15μm[图4(b)、(c)],另外,温敏印迹硅胶微球以及非印迹硅胶微球的颗粒均匀性比硅胶微球变差。这些现象表明分子印迹聚合物成功接枝到硅胶表面。

图4 3种样品的SEM
2.2 温敏印迹硅胶微球的吸附性能
设定温度为30℃,分别考察了温敏印迹硅胶微球和非印迹硅胶微球对薯蓣皂素的等温吸附性能,结果如图5所示。由图5可知,两种聚合物硅胶微球对薯蓣皂素的吸附量随溶液浓度的升高而增加。当薯蓣皂素浓度高于0.40mg/mL时,温敏印迹硅胶微球对薯蓣皂素的吸附达到饱和,其饱和吸附量为21.6mg/g;而非印迹硅胶微球对薯蓣皂素的饱和吸附量仅为9.79mg/g。此外,当底物浓度相同时,温敏印迹硅胶微球的吸附量明显大于非印迹硅胶微球,这主要是由于温敏印迹硅胶微球中存有大量与模板分子在大小、形状以及功能基方面相匹配的结合位点,即印迹位点,而非印迹聚合物基体中仅存有一些非选择性吸附位点。

图5 温敏印迹硅胶微球及非印迹硅胶微球的吸附等温线
为了探讨温敏印迹硅胶微球基体中吸附位点的类型及特征,对印迹聚合物的吸附等温值进行Scatchard 分析,采用式(4)对等温吸附数据进行了线性拟合。
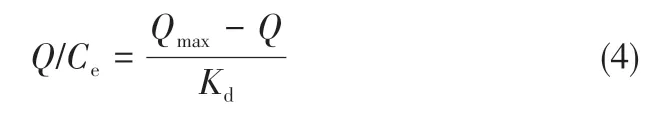
式中,为结合位点的平衡解离常数;为结合位点的最大表观结合量,mg/g;为吸附达到平衡后薯蓣皂素的平衡浓度,mg/mL;为聚合物对薯蓣皂素的吸附量,mg/g。以对作图,结果如图6所示,可以看出,对于温敏印迹硅胶微球而言,对作图给出两条拟合直线,表明温敏印迹硅胶微球基体主要存在两类吸附位点,从拟合直线的斜率和截距可以求出两类吸附位点的平衡解离常数()和最大表观结合量(mg/g)。对于非印迹硅胶微球而言,以对作图仅能给出一条直线,说明非印迹硅胶微球基体中主要存在一类吸附位点。表1 给出了两种聚合物吸附等温值的Scatchard分析结果。
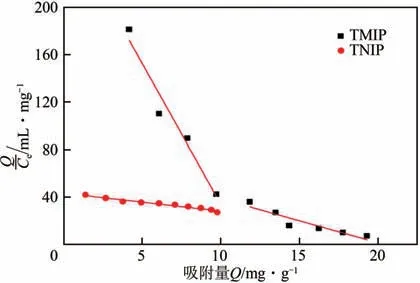
图6 温敏印迹硅胶微球及非印迹硅胶微球吸附等温值的Scatchard分析
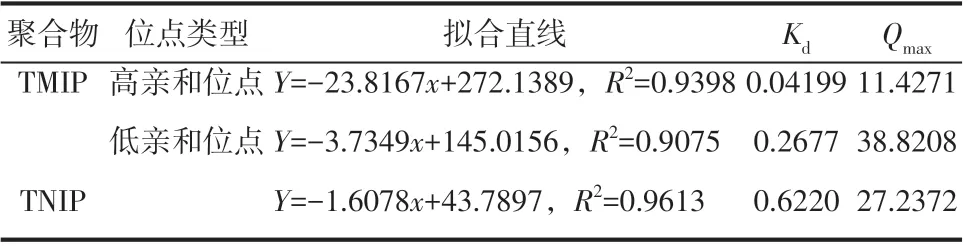
表1 吸附等温值的Scatchard分析
2.3 温敏印迹硅胶微球对薯蓣皂素的控制释放
2.3.1 释放动力学
研究了温敏印迹硅胶微球及非印迹硅胶微球的释放动力学,结果如图7所示。从图7中可以看出,非印迹硅胶微球对薯蓣皂素的释放量迅速增大,在3h 内,薯蓣皂素释放率达到了98.78%,这表明非印迹硅胶微球对薯蓣皂素不具有缓释性。而温敏印迹硅胶微球对薯蓣皂素的释放率显然前2h 增加比较快,但之后逐渐变缓。当释放时间为12h,薯蓣皂素释放率为81.9%。这是由于在温敏印迹硅胶微球中存在薯蓣皂素印迹位点,这些印迹位点对薯蓣皂素分子具有较强的滞留能力,能延缓目标分子从吸附位点的脱附,使其缓慢释放。这种印迹保留来源于印迹空隙(或印迹位点)与薯蓣皂素分子结构和化学功能基的匹配作用。这一结果表明温敏印迹硅胶微球对薯蓣皂素具有较好的控制释放能力。

图7 温敏印迹硅胶微球及非印迹硅胶微球的释放动力学
2.3.2 温度对温敏印迹硅胶微球释放的影响
图8为不同温度下(20℃、25℃、30℃、35℃、40℃)薯蓣皂素的释放率。可以看出,在30℃时薯蓣皂素的释放率最高,其次是25℃和20℃,分别为64.9%和56.4%,当温度为35℃和40℃时,薯蓣皂素释放率较低,分别为40.8%和36.1%。由于制备分子印迹聚合物时使用了−异丙基丙烯酰胺作为共同功能单体,其临界温度为32℃。在临界温度附近,温敏印迹聚合物中的交联骨架具有亲水作用,聚合物因水合而溶胀,导致印迹聚合物空隙体积增大,有利于吸附位点中被吸附分子的释放,释放率高。低于临界温度时,一方面聚合物因水合作用而膨胀促进释放,另一方面降低温度吸附位点上的被吸附分子动能降低,不利于释放。二因素结合作用致使20℃时的释放率低于25℃和30℃。当温度高于临界温度时,此时聚合物表现为疏水性,分子链相互聚集,印迹孔穴缩小。处在印迹位点上的被吸附分子难以从聚合物中脱离出来,释放率降低。
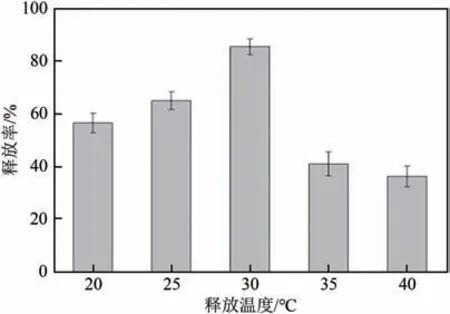
图8 不同温度下温敏印迹硅胶微球的释放(释放4h)
为了比较不同温度时温敏印迹硅胶微球的溶胀行为。将等量的温敏印迹硅胶微球置于等体积不同温度的水中,静置1h,然后用光学显微镜观察了不同温度(30℃、40℃)的微球大小,结果如图9所示。从图9可以看到,在30℃溶胀1h后,温敏印迹硅胶微平均球粒径约为15μm,而处在40℃水溶液中的印迹微球平均粒径约为5μm,这表明温敏印迹硅胶微球在低于临界温度时膨胀作用明显,具有较好的温度响应性,可以根据温度变化来控制温敏印迹硅胶微球的膨胀行为及其对薯蓣皂素的释放速率。

图9 分子印迹硅胶微球分别在不同温度水溶液中的光学显微照片
2.3.3 溶剂对温敏印迹硅胶微球释放的影响
图10 为30℃下不同溶剂中温敏印迹硅胶微球的释放率。可以看出,印迹硅胶微球在甲醇溶液中释放率最高,为84.0%。其次为乙醇和乙酸,释放率分别为77.1%和77.6%,释放率较低的溶剂为甲苯和乙腈。在丙酮中释放率最低,仅为38.7%。另外,当溶剂为质子性溶剂时,薯蓣皂素释放率高于非质子性溶剂中的释放率。这可能是由于质子性溶剂分子易与功能单体残基发生氢键作用,破坏了模板分子与印迹位点的物理化学作用,促进了模板分子的解吸。在测试溶剂对温敏印迹硅胶微球释放的影响时,也研究了水作为溶剂对薯蓣皂素释放率的影响,发现在释放后的水溶液中未能检测到分析物(薯蓣皂素),这可能是由于薯蓣皂素在水中的溶解性低(溶解度<1mg/mL),导致色谱分析中低于仪器检测限的缘故。
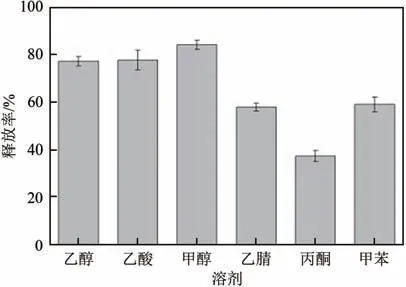
图10 30℃时温敏印迹硅胶微球在不同溶剂中的释放(释放4h)
2.3.4 离子强度对温敏印迹硅胶微球释放的影响
图11为30℃下不同离子强度的NaCl−甲醇溶液中温敏印迹硅胶微球的释放率。可以看出随着溶液中离子强度的增加,印迹微球的释放率先增加后降低。当离子强度为1.5×10mol/L时,薯蓣皂素释放率最大,达99.28%。这可能是由于溶液中离子强度增加时,溶液中带电物质降低了功能单体残基与模板分子的结合力,增加了印迹微球对模板分子的脱附,释放率提高。随着NaCl 浓度进一步增大,分子印迹聚合物疏溶剂作用不断增强,致使印迹聚合物发生相变,印迹孔隙收缩,降低了印迹微球基体中模板分子的渗透性,从而导致释放率降低。
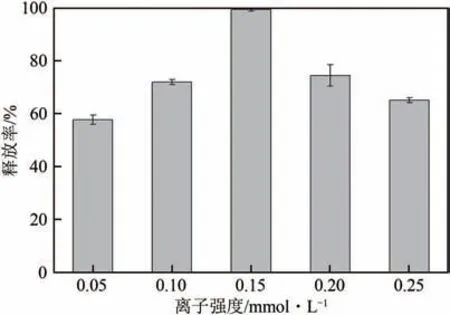
图11 30℃时温敏印迹硅胶微球在不同离子强度NaCl−甲醇溶液中的释放(释放4h)
3 结论
以薯蓣皂素为模板分子,硅胶为基质成功制备了一种热缩型温敏印迹硅胶微球。该种印迹微球基体内存在两类吸附位点,对薯蓣皂素的饱和载药量为21.6mg/g。装载有薯蓣皂素的分子印迹微球可控制药物分子缓慢释放。在12h 内释放率为81.9%,而非印迹硅胶微球不具备缓释性。环境条件如温度、溶剂种类及离子强度等影响印迹硅胶微球的释放率,当温度为30℃、溶剂为甲醇、NaCl−甲醇溶液的离子强度为1.5×10mol/L时,印迹微球具有最高的释放率,达99.28%。这种通过改变环境条件触发薯蓣皂素释放的温敏印迹硅胶微球有利于开发薯蓣皂素新型载体控制其释放,提高其疾病治疗效果及生物利用度。
