犬瘟热病毒单克隆抗体的研制及胶体金试纸条检测方法的建立
2022-02-11舒金秀冯超林石宝兰郑良益牟林琳胡玉立刘国兴闵娟娟顾素云谢红玲
张 敏,李 建,舒金秀,冯超林,石宝兰,郑良益,牟林琳,柏 娇, 胡玉立,徐 松,刘国兴,闵娟娟,石 瑛,顾素云,谢红玲*
(1.国药集团动物保健股份有限公司,武汉 430075;2. 湖北省兽药监察所,武汉 430070)
犬瘟热(Canine distemper, CD)是由犬瘟热病毒(Canine distemper virus, CDV)引起的一类在多种肉食性犬类(尤其是幼仔)、貂类等动物中急性高度接触性、致死性传染病,同时可感染非人灵长类动物[1]。该病广泛分布全球,且各季节均有发生。根据临床症状可分急性和慢性期,常引起剧烈的如结膜炎、肠胃炎等炎症反应和各种慢性神经症状[2],感染动物死亡率高达80%[3]。犬瘟热已成为阻碍宠物饲养业、毛皮动物养殖业等发展的主要疫病之一。由于缺乏简便快捷、准确、便于操作的检测方法,常常延误病机,错过治疗机会,导致动物死亡[4]。因此,开展对于CDV感染早期临床诊断检测研究具有重要意义。
CDV为有囊膜的单股负链RNA病毒,基因组6个开放阅读框分别编码6种结构蛋白:核衣壳蛋白(N)、磷蛋白(P)、基质膜蛋白(M)、融合蛋白(F)、血凝蛋白(H)和大蛋白(L),其中核衣壳蛋白在病毒装配、转录和复制过程中起重要作用,能刺激机体产生强烈的体液免疫反应[5-6]。核衣壳蛋白的结构核心和功能核心高度保守,是保守性较强的免疫原性蛋白,为单克隆抗体、胶体金检测试纸条的研制等研究提供必要条件[7]。
目前CDV检测方法包括病毒学诊断、电镜显微镜诊断、病毒分离与鉴定[8]、免疫学诊断、分子生物学等多种检测手段,免疫胶体金试纸条检测技术无疑是最为简便、快捷、高效、灵敏的病毒诊断方法,不受环境及人员限制,无需仪器设备辅助,对于动物感染的早期诊断及控制具有重要意义[9]。本研究用原核表达的N蛋白,免疫小鼠制备单克隆抗体,建立一种敏感性、特异性良好的免疫胶体金试纸条检测方法。
1 材料与方法
1.1 毒种、细胞和其他试剂 SP2/0细胞、表达载体pET-28a、Vero细胞、MDCK细胞、F81细胞、BHK细胞、CDV(YD株、Snyder Hill株、WH-G株)、犬细小病毒(canine parvovirus, CPV)、犬腺病毒2型(canine adenovirus type 2, CAV2)、狂犬病病毒(rabies virus, RV)为国药集团动物保健股份有限公司保存;FITC标记羊抗小鼠IgG、HRP标记羊抗小鼠IgG,Thermo公司;DMEM培养基,Hyclone公司;HAT、HT,Sigma公司;单抗亚类鉴定试剂盒,洛阳赛尔维公司。安捷犬瘟热病毒抗原快速检测试纸,购自韩国安捷公司,货号RG1103DF。
1.2 CDV N蛋白表达载体的构建与蛋白表达纯化
1.2.1 引物设计 根据GenBank中登录的CDV N全基因序列,设计RT-PCR扩增引物,预期扩增片段为1572 bp。引物序列如下:
CDV-NF:5′-GGTGCCGCGCGGCAGCCATATGATGGCTAGCCTTCTCAAGAG -3′ (NdeI)
CDV-NR:5′-GTGGTGGTGGTGGTGGTGCTCGAGATTAAGTAGCTCTCTATCATTATA-3′ (XhoI)
1.2.2 CDV中N基因的扩增及重组表达质粒的构建 参照RNA 提取试剂盒说明书提取总RNA并以其为模板,按上述引物扩增CDV的N基因。RT-PCR 的反应参数是:98 ℃预热2 min,98 ℃变性10 s,55 ℃退火温度15 s,72 ℃延伸2 min(从第二步98 ℃变性到第四步72 ℃延伸进行35个循环),72 ℃延伸10 min。回收纯化的PCR产物经NdeI和XhoI酶切后克隆至pET-28a载体中,构建重组表达质粒。
1.2.3 重组CDV N蛋白的表达、纯化及鉴定
将pET-28a-N转化至受体菌BL21,待OD600达到0.4~0.5时,IPTG诱导表达,将BL21诱导后的培养物离心取菌体进行超声破碎,破碎后的上清和沉淀进行SDS-PAGE电泳。表达的上清过Ni柱进行纯化,分别收集流穿液和各洗脱峰,并将各样品进行SDS-PAGE电泳。将纯化后的CDV N蛋白样品进行SDS-PAGE电泳、转膜,加入合适稀释倍数的阳性兔血清作一抗,用羊抗兔IgG-HRP为二抗,进行Western Blotting鉴定。
1.3 单克隆抗体的研制
1.3.1 动物免疫 将CDV N蛋白与等体积的弗氏完全佐剂混合并完全乳化后,小鼠腹股沟两侧靠近淋巴结区和颈部皮下多点免疫,每只50 μg/0.5 mL,21 d后2免,免疫剂量为首次免疫的一半,佐剂用弗氏不完全佐剂,间隔21 d后3免,免疫剂量和佐剂同2免,10 d之后采用腹腔注射进行加强免疫,剂量同首免,3 d后融合。
1.3.2 细胞融合 按照常规方法无菌采取小鼠的脾细胞,与骨髓瘤细胞按10∶1比例混合,用PEG1450进行融合,将融合之后的细胞加入铺好饲养细胞的96孔板中。
1.3.3 杂交瘤细胞株筛选 利用间接ELISA法和间接免疫荧光法对所培养的杂交瘤上清进行检测,有限稀释法对检测阳性的杂交瘤细胞进行至少三次以上的克隆直至阳性率为100%为止。
1.4 单克隆抗体的鉴定
1.4.1 腹水的生产及其纯化 选择12周龄以上的雌性BALB/C小鼠,腹腔注射单克隆杂交瘤细胞,7 d之后收取小鼠腹水,采用辛酸-硫酸铵法纯化腹水。
1.4.2 单克隆抗体的亚类测定 按照洛阳赛尔维公司单抗亚类试剂盒说明书进行单克隆抗体亚类的测定。
1.4.3 单克隆抗体敏感性鉴定 将不同CDV株(YD株、Snyder Hill株、WH-G株)分别接种长满单层的Vero细胞的96孔板中,置37 ℃ 5% CO2培养箱中进行培养72 h后用冷丙酮固定;以CDV N蛋白单克隆抗体作为一抗,FITC标记的抗鼠IgG作为二抗进行间接免疫荧光检测,于荧光显微镜下观察试验结果。
1.4.4 单克隆抗体特异性鉴定 将CDV、CPV、CAV2、RV分别接种长满单层的Vero细胞、F81细胞、MDCK细胞、BHK细胞的96孔板中,置37 ℃ 5% CO2培养箱中进行培养72 h后用冷丙酮固定;以CDV N蛋白单克隆抗体作为一抗,FITC标记的抗鼠IgG作为二抗进行间接免疫荧光检测,于荧光显微镜下观察试验结果。
1.5 免疫胶体金试纸条的制备及检测
1.5.1 CDV胶体金快速检测试纸条的制备 用柠檬酸三钠还原法制备25 nm的金颗粒溶液,标记量为30 μg/mL胶体金溶液的单克隆抗体D3,搅拌30 min,在加入终浓度20%的PEG 20000稳定未结合的胶体金颗粒,8700 r/min离心30 min,弃上清,再用金标缓冲溶液定容至2 mL。标记好的胶体金溶液均匀涂布于金标垫上,37 ℃烘干2 h备用。再将羊抗小鼠IgG二抗和单克隆抗体D6分别以1 mg/mL浓度包被硝酸纤维素膜作为质控线和检测线,37 ℃烘干2 h备用。将准备好的硝酸纤维素膜、样品垫、金标垫和吸水纸按顺序粘贴到背衬板上,切条机切割成4 mm条,组装成检测试纸条。
1.5.2 CDV胶体金快速检测试纸条检测
1.5.2.1 试纸条对不同毒株CDV的敏感性检测 将Snyder Hill株和WH-G株进行1∶50、1∶100、1∶200、1∶400、1∶800、1∶1600、1∶3200系列稀释,YD株进行1∶5、1∶10、1∶20、1∶40系列稀释;加样量均为0.1 mL/孔,分别用本试纸条进行检测,评判试纸条检测敏感性。
1.5.2.2 试纸条特异性检测 取CPV、CAV2、RV、CDV阴性对照样品,分别用本试纸条进行检测,评判试纸条特异性。
1.5.3 临床试验样本适用性试验及对比试验
分别用本研究制备试纸条、安捷试纸条及PCR扩增法检测50份犬鼻液或眼分泌物样品,具体参照《犬瘟热病毒病诊断技术国家标准》(GB/T 27532-2011),计算本研究试纸条与安捷试纸条、PCR检测方法的符合率。
符合率=结果符合的样品数/总样品数×100%
2 结果与分析
2.1 CDV重组N蛋白表达及鉴定
2.1.1 CDV N基因的PCR扩增 PCR扩增出CDV N蛋白基因片段,电泳检测结果(图1)显示,目的基因CDV N蛋白基因片段长度为1572 bp,与预期结果相符。

1-6:CDV N基因;M:Trans2K Plus Ⅱ DNA Marker1-6:CDV N gene;M:Trans2K Plus Ⅱ DNA Marker图1 CDV N基因PCR扩增图Fig 1 The PCR results of CDV N gene
2.1.2 CDV N蛋白表达、纯化及鉴定 原核表达系统诱导表达CDV N蛋白,菌体破碎后上清及沉淀进行SDS-PAGE电泳结果(图2)显示,表达纯化后的N蛋白分子量大小在58 kD 附近,大量存在于破碎后的上清液中。上清液纯化后杂蛋白被去除,可见明显单一目的蛋白条带(图3)。同时将纯化后的N蛋白进行Western Blotting鉴定,N蛋白样品孔出现一条与目的蛋白大小相同的条带,表明纯化后的N蛋白反应原性良好(图4)。

1:菌体破碎后上清;2:菌体破碎后沉淀;M:PageRuler非预染蛋白Marker1:Supernatant after induction;2:Supernatant of the bacteria lysate after induction;M:PageRuler unstained protein ladder图2 CDV N蛋白表达各成分鉴定图Fig 2 Identification of CDV N protein

1:CDV N蛋白纯化前;2:流穿杂蛋白样;3-9:各洗脱时间段收获CDV N蛋白样;M:PageRuler非预染蛋白Marker1:Unpurified CDV N protein;2:Impure protein;3-9:Purified CDV N protein;M:PageRuler unstained protein ladder图3 CDV N蛋白柱纯化鉴定图Fig 3 Identification and purification of CDV N protein

1:阴性对照;2:CDV N蛋白;M:PageRuler预染蛋白Marker1:Negative control;2:Purified CDV N protein;M:PageRuler prestained protein ladder图4 CDV N蛋白纯化Western blotting鉴定图Fig 4 Western blotting identification of purified CDV N protein
2.2 单克隆抗体研制及鉴定 共筛选2株分泌CDV N蛋白抗体单克隆杂交瘤细胞株,分别命名为D3和D6。
2.2.1 单克隆抗体亚类测定 D3、D6亚类均为IgG1。
2.2.2 腹水的纯化 纯化抗体D3、D6进行SDS-PAGE鉴定分析,结果见图5,2株单克隆抗体均出现大小50 kD左右的重链和25 kD左右的轻链,且杂蛋白去除较好,单抗纯净度较高。

1:D3单抗;2:D6单抗;M:PageRuler非预染蛋白Marker1:Monoclonal antibody D3;2:Monoclonal antibody D6;M:PageRuler unstained protein ladder图5 CDV N蛋白单抗纯化SDS-PAGE鉴定图Fig 5 SDS-PAGE identification of purified McAbs against CDV N protein
2.2.3 单克隆抗体敏感性鉴定 D3、D6单克隆抗体均能与不同CDV株(YD株、Snyder Hill株、WH-G株)感染的Vero细胞反应,可见明显绿色荧光,与阴性细胞无荧光,说明D3、D6单克隆抗体敏感性良好,能识别结合多株CDV(图6、图7)。
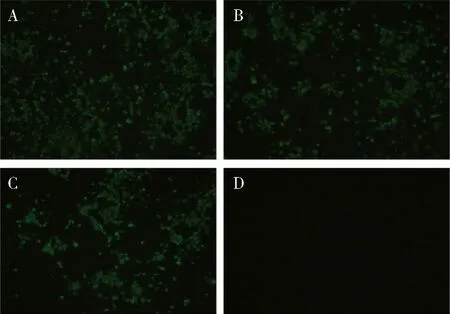
A:感染CDV-YD株细胞孔;B:感染CDV-Snyder Hill株细胞孔;C:感染CDV- WH-G株细胞孔;D:正常细胞对照A:Infected CDV-YD;B:Infected CDV-Snyder Hill;C:Infected CDV- WH-G;D:Negative control图6 单克隆抗体D3敏感性鉴定(×40)Fig 6 Immunofluorescence assay(IFA) analyze the binding sensitivity of antibody D3(×40)
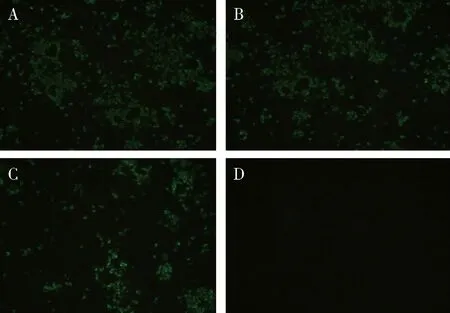
A:感染CDV-YD株;B:感染CDV-Snyder Hill株;C:感染CDV- WH-G株;D:正常细胞对照A:Infected CDV-YD;B:Infected CDV-Snyder Hill;C:Infected CDV- WH-G;D:Negative control图7 单克隆抗体D6敏感性鉴定(×40)Fig 7 Immunofluorescence assay(IFA) analyze the binding sensitivity of antibody D6(×40)
2.2.4 单克隆抗体特异性鉴定 D3、D6单克隆抗体均能与感染CDV的Vero细胞反应,可见明显绿色荧光,与阴性细胞无荧光。与感染CPV、CAV2、RV的细胞均不发生特异性反应,无荧光信号,说明D3、D6单克隆抗体仅与CDV发生特异性反应,与CPV、CAV2、RV均不结合,单克隆抗体特异性良好(图8、图9)。

A:感染CDV;B:感染CPV;C:感染CAV2;D:感染RV;E:正常细胞对照A:Infected CDV;B:Infected CPV;C:Infected CAV2;D:Infected RV;E:Negative control图8 单克隆抗体D3特异性鉴定(×40)Fig 8 Immunofluorescence assay(IFA) analyze the binding specificity of antibody D3(×40)

A:感染CDV;B:感染CPV;C:感染CAV2;D:感染RV;E:正常细胞对照A:Infected CDV;B:Infected CPV;C:Infected CAV2;D:Infected RV;E:negative control图9 单克隆抗体D6特异性鉴定(×40)Fig 9 Immunofluorescence assay(IFA) analyze the binding specificity of antibody D6(×40)
2.3 免疫胶体金试纸条检测方法的敏感性及特异性
2.3.1 试纸条检测敏感性 本试纸条检测不同CDV株,检测105.3TCID50/mL的YD株病毒液,1∶5、1∶10稀释度检测结果均为阳性,1∶20、1∶40稀释度检测结果为阴性;检测106.5TCID50/mL的Snyder Hill株和WH-G株病毒液,1∶50、1∶100、1∶200、1∶400稀释度检测结果均为阳性,1∶800、1∶1600、1∶3200稀释度检测结果为阴性(图10)。本试纸条检测不同株CDV的最低限均为1000 TCID50,敏感性良好。

A:YD株;B:Snyder Hill株;C:WH-G株A:YD;B:Snyder Hill;C:WH-G图10 试纸条敏感性结果Fig 10 Sensitivity test of dipstick
2.3.2 试纸条检测特异性 本试纸条检测CPV、CAV2、RV、CDV阴性对照,结果均为阴性,表明该试纸条不与犬其他常见病毒反应,特异性良好,检测结果见图11。

1:CPV;2:CAV2;3:RV;4:阴性对照1:CPV;2:CAV2;3:RV;4:Negative control图11 试纸条特异性检测结果Fig 11 Specificity test of dipstick
2.4 试纸条临床适用性及同类产品、PCR法符合率 检测临床犬鼻液或眼分泌物样品50份,其中阳性样品16份,阴性样品34份,阳性率为32%。安捷试纸条检测阳性结果17份,阴性结果33份。两种试纸条的检测符合率为98%。PCR检测阳性结果17份,阴性结果33份。本试纸条与PCR检测符合率为98%。各检测结果见表1。

表1 临床试验检测结果Tab 1 Clinical test
3 讨论与小结
CDV自然感染的宿主范围广泛,造成的危害及经济损失逐步扩大,以幼犬最为易感。目前实验室诊断虽快速高效、特异性强,但常用的RT-PCR法、电镜法等对人员的专业技术和仪器设备要求较高。基于单克隆抗体和免疫胶体金技术构建的检测方法完美地规避上述难题,提供一种可现场检测、操作简单、结果直观可见的诊断方法[9-10]。犬瘟热胶体金试纸条为目前宠物医院等临床用于CDV检测中使用最广泛的检测方法,但主要存在的问题为敏感性较低,为解决该问题,高敏感性单克隆抗体的研制显得尤为关键[11-12]。使用CDV全“+”为阳性,“‐”为阴性病毒研发的单克隆抗体,应用于试纸条产品较为常见[13],但存在不同来源的病毒株检测敏感性低、假阳性、特异性不强等问题[14-15]。区别于传统的试纸条研发,本研究专注于开发针对CDV亚单位的单克隆抗体并进行试纸条的研发,能较大幅度地提高试纸条检测方法的敏感性及特异性。CDV N蛋白结构及功能高度保守,以其作为免疫抗原得到的单克隆抗体,构建胶体金试纸条检测方法,灵敏性特异性强[16]。本研究研制的CDV胶体金检测试纸条有很好的临床适用性,与目前宠物诊所广泛使用的韩国安捷公司生产的CDV抗原快速检测试纸对比有较高的符合率,为临床快速诊断CDV提供参考方法,同时降低了动物诊所的使用成本。
本研究成功构建了CDV N蛋白原核表达载体,通过大肠杆菌表达系统高效表达,纯化获得免疫原性良好的CDV N蛋白。应该杂交瘤技术,成功筛选到2株敏感性及特异性良好的单克隆抗体D3、D6,可识别不同CDV株(YD株、Snyder Hill株、WH-G株)。以此单抗为基础,成功构建免疫胶体金试纸条检测方法,实验室检测证实能有效区分CDV、CPV、CAV2、RV,特异性良好。本研究研制的CDV检测试纸条,在临床应用方面仍需进一步研究完善,临床样本(口鼻、眼结膜分泌物)杂质多[17],检测方法需进一步优化验证。
