基于网络药理学与分子对接探索人参-五味子配伍治疗特发性肺间质纤维化的分子机制
2022-02-11顾一丹任允琰章朱峰高平
顾一丹,任允琰,章朱峰,高平
(无锡市第二中医医院 呼吸科,江苏 无锡 214121)
特发性肺间质纤维化(idiopathic pulmonary fibrosis,IPF)是特发性间质性肺炎中最常见的类型,是呼吸系统危重症之一。患者起初仅表现为干咳,随着肺纤维化加重,出现胸闷、呼吸困难、发绀等临床表现[1]。肺纤维化不可逆,终末期患者多因心肺功能衰竭失救,目前中位生存期约为3~5年,低于多种癌症[2]。IPF发病机制尚不明确,目前主要认为与免疫功能紊乱、炎症反应、氧化应激等密切相关[3]。目前临床暂无可以治愈IPF的药物,指南推荐使用尼达尼布或吡非尼酮抗肺纤维化,但该类药物仅推荐用于轻中度IPF患者,且只能达到延缓肺纤维化的效果,而不能有效改善患者临床症状,疗效未能令患者满意[4- 5]。
中医药治疗IPF具有一定优势,相关临床研究证实中医药能改善IPF患者症状,提高生存质量[6]。传统中医理论无IPF病名,根据临床症状多将IPF归于“肺萎”范畴,其病机属本虚标实,重在虚和瘀。目前其辨证分型尚不统一,相关的证型分析研究指出,气阴两虚证在患者中占比最大,各医家临床治疗亦以益气养阴法施治最为常见,收效令人满意。人参-五味子配伍出自孙思邈《千金要方》生脉散,有益气养阴之功效,是临床常用药对。现代药理学研究表明,人参-五味子化学成分具有抗氧化作用,能直接清除活性氧,减轻氧化应激反应[7];可调节机体免疫[8],抑制呼吸道炎症[9],防治肺癌[10]。目前关于人参-五味子配伍治疗IPF的作用机制尚缺乏研究,本文立足中医药辨证论治理论,运用网络药理学分析与生物信息学数据挖掘理论方法,探索人参-五味子药对治疗IPF的潜在分子机制,以期为IPF的治疗提供新的靶点与方向。
1 材料与方法
1.1 特发性肺间质纤维化靶标基因挖掘筛选
以“idiopathic pulmonary fibrosis”为关键词检索人类基因数据库(GeneCards)(http://www.genecards.org/)、比较毒物基因组学数据库(comparative toxicogenomics database,CTD)(http://ctdbase.org/)以及高通量基因表达数据库(gene expression omnibus data base,GEO)(https://www.ncbi.nlm.nih.gov/geo/)获得IPF治疗靶标基因。从GEO数据库获得了编号GSE24206、GSE44723两个基因芯片的原始数据及对应的GPL基因注释文件,通过R语言多矩阵平均分析算法对基因芯片进行原始数据背景校正归一化处理,以表达差异检验P<0.05、差异表达倍数(fold change,FC)绝对值>2为条件,运行Limma程序包[11]筛选获得显著差异表达的IPF靶标基因。
1.2 人参-五味子药对活性成分筛选及作用靶标预测
通过中药系统药理学数据库与分析平台[12](Traditional Chinese Medicine systems pharmacology database and analysis platform,TCMSP)(http://tcmspw.com/tcmsp.php)分别获取中药人参、五味子的全部化学成分,根据口服中药的药代动力学ADME[13]参数筛选药对有效活性成分。设置筛选标准为药物口服生物利用度(oral bioavailability,OB)≥30%、类药性(drug-likeness,DL)≥0.18,筛选药对有效活性成分,并收集其作用靶标基因,使用蛋白组数据库[14](UniProt Knowledgebase,UniProtKB)(https://www.uniprot.org)对靶标基因进行基因符号Gene Symbol标准化命名。
1.3 基因映射及调控网络构建
将GeneCards、CTD及GEO获得的IPF靶标基因分别整理,使用R语言VennDiagram程序包对药对有效活性成分作用靶标基因与上述获得的IPF靶标基因取交集,获得药对调控的IPF靶标基因。将人参-五味子药对、有效活性成分及其调控的IPF靶标基因导入网络可视化分析软件Cytoscape 3.6.1进行调控网络构建。分别以不同的节点表示中药、活性成分及靶标基因,节点间以边线相联系代表其从属或作用关系。
1.4 靶标基因互相作用关系分析及关键基因筛选
将药对调控的IPF靶标基因上传至STRING数据库(https://string-db.org/),进行蛋白质-蛋白质相互作用(protein-protein interaction,PPI)分析。根据PPI网络中各靶标基因的度值(degree)大小筛选出其中的关键基因。关键基因是与较多其他靶标基因发生相互作用的基因,可能是多个相关通路调控多基因发挥多靶点作用的枢纽,在疾病治疗的生物学过程中发挥重要作用。
1.5 分子对接验证
分子对接验证是通过将药物化合物分子与基因分子进行三维化合结构的结合,计算其分子对接消耗的能量,以评估分子间稳定结合的潜力[15]。本研究通过对人参-五味子调控IPF的关键基因及其相互作用的药对活性成分进行分子对接验证,评估药对活性成分调控IPF关键靶标基因的结合潜力。首先从基因蛋白结构数据库Protein Data Bank(https://www.rcsb.org/)[16]检索关键基因的三维化合结构,下载保存为PDB文件;从有机小分子生物活性数据库PubChem(https://pubchem.ncbi.nlm.nih.gov/)[17]获取药对活性成分三维结构SDF文件,通过OpenBabel软件转化为MOL2文件;将关键基因的PDB文件上传至分子对接预测数据库SwissDock(http://www.swissdock.ch/)[18]作为对接主体,将药对活性成分MOL2文件上传作为配体,进行分子对接预测分析。
1.6 基因本体与信号通路富集分析
采用R语言生物信息学分析Bioconductor工具包对关键基因进行基因本体(gene ontology,GO)[19]生物学注释过程富集分析与京都基因与基因组百科全书(Kyoto encyclopedia of genes and genomes,KEGG)[20]信号通路富集分析,预测人参-五味子治疗IPF的潜在分子机制。
2 结果
2.1 特发性肺间质纤维化靶标基因
GSE24206、GSE44723基因芯片共包含22例IPF病人与10例正常组病人的肺组织样本测序数据,运行Limma包对基因表达数据进行对比分析,共筛选获得140个显著差异表达基因,其中差异倍数(fold change,FC)>2的上调基因78个,FC<-2的下调基因62个。根据P值及FC值绘制差异基因表达火山图(图1(a))。以“idiopathic pulmonary fibrosis”为关键词于GeneCards、CTD数据库检索分别获得2754、2395个IPF疾病靶标基因。
2.2 人参-五味子药对活性成分及作用靶标基因
在TCMSP平台分别检索人参、五味子的活性成分,根据OB≥30%、DL≥0.18的药代动力学参数筛选获得药对有效活性成分42个,对应不同疾病靶标基因92个。将获得的药对靶标基因与上述获得的IPF疾病靶标基因通过VennDiagram程序包取交集,获得药对调控IPF靶标基因48个,见图1(b)。共有23个药对有效活性成分参与调控上述48个IPF靶标基因,如表1所示。

图1 人参-五味子药对活性成分调控IPF靶点基因Fig.1 IPF target genes of Ginseng Radix Et Rhizoma-Schisandrae Chinensis Fructus couple medicine
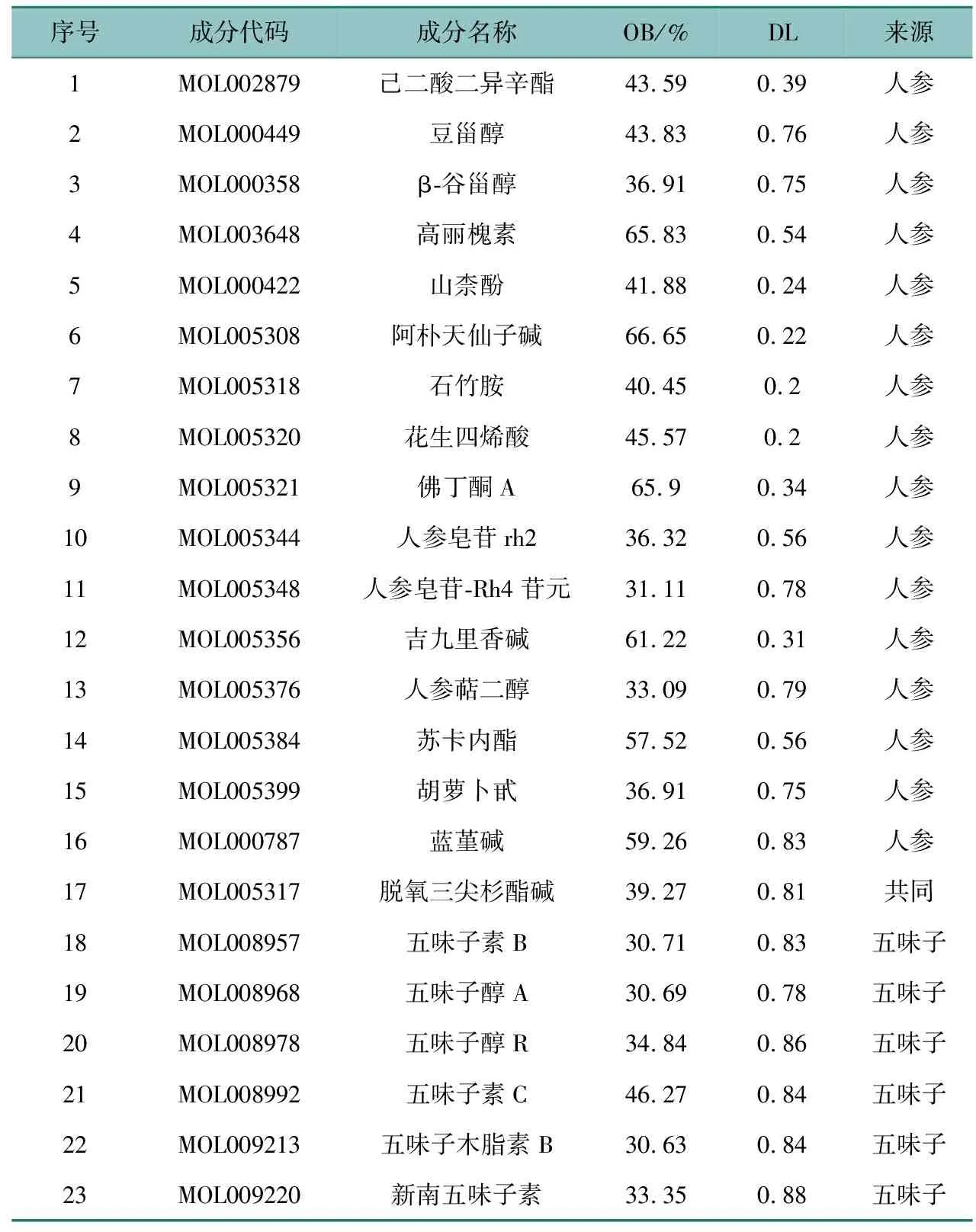
序号成分代码成分名称OB/%DL来源1MOL002879己二酸二异辛酯43.590.39人参2MOL000449豆甾醇43.830.76人参3MOL000358β-谷甾醇36.910.75人参4MOL003648高丽槐素65.830.54人参5MOL000422山柰酚41.880.24人参6MOL005308阿朴天仙子碱66.650.22人参7MOL005318石竹胺40.450.2人参8MOL005320花生四烯酸45.570.2人参9MOL005321佛丁酮A65.90.34人参10MOL005344人参皂苷rh236.320.56人参11MOL005348人参皂苷-Rh4苷元31.110.78人参12MOL005356吉九里香碱61.220.31人参13MOL005376人参萜二醇33.090.79人参14MOL005384苏卡内酯57.520.56人参15MOL005399胡萝卜甙36.910.75人参16MOL000787蓝堇碱59.260.83人参17MOL005317脱氧三尖杉酯碱39.270.81共同18MOL008957五味子素B30.710.83五味子19MOL008968五味子醇A30.690.78五味子20MOL008978五味子醇R34.840.86五味子21MOL008992五味子素C46.270.84五味子22MOL009213五味子木脂素B30.630.84五味子23MOL009220新南五味子素33.350.88五味子
2.3 药对-活性成分-靶标基因调控网络可视化
将人参-五味子药对、23个有效活性成分及48个IPF靶标基因共同导入至Cytoscape软件中,构建药对-活性成分-靶标基因调控网络,将结果输出为可视化网络,如图2所示。该调控网络包含73个节点和144条边线,共同构成复杂调控网络。

图2 人参-五味子药对-活性成分-IPF靶标基因调控网络Fig. 2 Network of Ginseng RadixEt Rhizoma-Schisandrae Chinensis Fructus couple medicine-active ingredients-IPF target genes
2.4 靶标基因互相作用网络关键基因筛选
将48个IPF靶标基因上传至STRING网站,设置物种为“Homo sapiens”(人类),最小互作分数为0.4,进行PPI网络构建及分析,使用R语言对靶标基因在网络中的度值进行统计,根据度值大小进行排序,筛选其中度值最高的前20位靶标基因为网络的关键基因,并以条形图呈现,见图3。

图3 靶标基因度值排序(前20位)Fig. 3 Sequence diagram of target genes′ degree (Top 20)
2.5 关键基因GO富集分析
将关键基因进行整理,使用R语言clusterProfiler程序包进行GO生物学注释过程富集分析,筛选检验统计P<0.05的基因产物注释过程,并按照P值从小到大进行排序,以可视化图形展示排名前20位的GO过程。如图4所示,关键基因主要富集于核受体活性、类固醇激素受体活性、血红素结合、RNA聚合酶II转录因子结合、Hsp90蛋白结合等GO生物学过程。

图4 关键基因GO富集结果(前20)Fig.4 Enriched GO processes of hub genes(Top 20)
2.6 关键基因KEGG信号通路富集分析
运行R语言clusterProfiler程序包对关键基因进行KEGG信号通路富集分析,设置物种归属为“hsa”(人类),以Benjamini校正法对富集通路检验统计进行校正,筛选P<0.05的通路并根据P值从小到大排序,列表展示富集程度最高的前10个信号通路,见表2。

表2 关键基因KEGG信号通路富集分析(前10位)Table 2 Enriched KEGG pathways of hub genes (Top10)
2.7 分子对接分析
本研究通过SwissDock平台将排名前5位的关键基因(AKT1、PTGS2、IL1B、MAPK8、CASP3)与其相互作用的人参-五味子活性成分进行分子对接验证,结果见表3。关键基因与药对活性成分分子对接能量ΔG大致波动在-26~-40 kJ/mol范围内,认为两者总体能稳定对接结合,是人参-五味子有效调控IPF关键基因的重要物质基础。

表3 分子对接验证结果Table 3 Results of molecular docking
3 讨论
中医学将IPF归于“肺萎”范畴,《金匮要略心典》总结“痿者萎也,如草木之萎而不荣,为津烁而肺焦也”,指出肺萎的根本病机为肺脏气阴亏损。《神农本草经》记载 “人参,味甘微寒,主补五脏,安精神,定魂魄”,《本草别录》记载“五味子,养五脏,除热,生阴中肌“,人参-五味子是经典的益气养阴药物配伍,被广泛应用于气阴亏损所致的喘逆哮咳等呼吸系统疾病的治疗中[21],在IPF治疗中具有良好的前景。
本研究立足中医辨证论治观念,借助网络药理学研究方法,共筛选出人参-五味子药对含有人参萜二醇、五味子素B等23个有效活性成分,作用于48个IPF靶标基因,通过多成分、多靶点、多通路的调控网络,从调控免疫功能、抑制纤维化、抗氧化应激、抑制炎症等几方面发挥治疗IPF的作用。
活性成分山奈酚分别与NOS2、PTGS1、PTGS2等多个靶标基因发生相互作用,是调控网络中连接度最高的活性成分,研究认为山奈酚具有抑制炎症、抗氧化应激的作用[22],PTGS1、PTGS2是前列腺素内过氧化物合酶同工酶,山奈酚可能通过PTGS1、PTGS2参与上调炎症产物环氧合酶(COX-2)表达,促进抗纤维化代谢产物 PGE2生成,发挥抗IPF作用[23];生物利用度较高的吉九里香碱具有抑制细胞凋亡、抗炎等保护作用[24];人参皂苷Rh2通过调控IL1B介导的免疫反应改善机体免疫功能[25];人参、五味子共有成分脱氧三尖杉酯碱在肺癌相关研究中表现出良好的肺间质细胞保护特性[26]。
关键基因富集的KEGG信号通路结果显示,富集基因数目最多、显著性最高的白介素17信号通路,下游通路中由多种IL-17亚家族蛋白参与调控CD4+、CD8+等多种T淋巴细胞的增殖凋亡及自身免疫反应,关键基因IFNG、IL-1B等共同参与不同环节信号转导。相关研究表明,IPF患者外周血中IL2、血清干扰素IFNG水平明显下降,CD4+淋巴细胞比例下降,CD8+淋巴细胞增加,免疫功能明显紊乱,可能与IL-17信号通路的调控密切相关[27]。关键基因PPARG富集于过氧化物酶体增殖物激活受体(PPAR)信号通路,PPAR属于核受体超家族,其下游活化可产生抗炎、调控代谢活动等效应。有研究表明,PPARG配体可抑制转化生长因子β(TGF-β)对肺成纤维细胞的活化刺激及胶原蛋白的分泌,抑制氧化应激损伤[28]。刘豹等[29]研究发现益气养阴方剂麦门冬汤含有PPARG激活剂,有助于抑制IPF肺纤维化进程。炎症反应可能是IPF发病的关键环节[30],关键基因在肿瘤坏死因子(TNF)信号通路、核因子KB(NF-kappa B)及TGF信号通路等经典炎症相关通路中均有较显著的富集。研究表明TGF-β、TNF-α是促进成纤维细胞增殖的关键炎症因子,并可介导肺泡上皮细胞凋亡坏死,益气养阴方剂在IPF大鼠模型试验中降低TGF-β、TNF-α的表达,抑制炎症反应[31]。
本研究通过预测分析,发现人参-五味子的23个活性成分参与调控48个IPF疾病靶点基因,其中的关键基因AKT1、PTGS2、IL1B、MAPK8、CASP3等可能通过参与IL17、PPAR、TNF信号通路等在调控免疫功能、抑制纤维化、抗氧化应激、抑制炎症等几方面发挥抗IPF的作用,人参-五味子治疗IPF存在多成分、多靶点、多通路的特点。但本研究仅基于网络药理学理论进行数据预测分析,不涉及药物成分在机体的代谢变化及协调作用,存在一定局限性,后续仍需进一步实验以验证人参-五味子抗IPF的具体作用机制。
