TWIST1在人脐静脉内皮细胞增殖、迁移及血管形成中的作用
2022-02-11谢月樵郭丹王楠尤娜黄琬玲马小彤
谢月樵, 郭丹, 王楠, 尤娜, 黄琬玲, 马小彤
中国医学科学院血液病医院(中国医学科学院血液学研究所),北京协和医学院,实验血液学国家重点实验室,国家血液系统疾病临床医学研究中心,细胞生态海河实验室,天津300020
实体肿瘤的进展过程中一般伴随血管新生,以满足肿瘤生长的需求。因此,血管内皮细胞的增殖和迁移速度会间接决定肿瘤的生长速度,同时新生血管也是肿瘤细胞转移至其他组织的重要途径。肿瘤血管新生的程度可作为肿瘤预后的重要指标[1-2]。抗血管生成也逐渐成为临床上肿瘤治疗的新途径[3]。
TWIST1在生物进化过程中高度保守,是影响胚胎发育和肿瘤生成的重要转录因子[4-5]。TWIST1可促进肿瘤细胞增殖,降低肿瘤细胞凋亡和药物敏感性[6-7],此外,TWIST1与肿瘤的转移、侵袭和浸润能力也密切相关[6,8-10],是诱导上皮间质转化(epithelial-mesenchymal transition,EMT)的关键调节因子,而EMT 是癌症转移起始的关键过程[11]。
研究表明,TWIST1高表达可以促进肿瘤血管的形成[11]。在乳腺癌和肝癌细胞中TWIST1 的高表达被证明是血管形成的关键因素[12-13];肿瘤细胞中凝血酶促进内皮细胞迁移,基质小管和肿瘤血管的形成也与TWIST1 上调表达相关[14];此外,TWIST1 还通过激活Jagged-1 诱导肿瘤细胞向内皮细胞分化,促进血管拟态(vasculogenic mimicry,VM)生成[15]。
近年来,有研究发现,TWIST1 与血管内皮细胞密切相关。在斑马鱼的胚胎脉管系统、猪的动脉内皮以及人脐静脉内皮细胞(human umbilical vein endothelial cells,HUVECs)中均有 TWIST1 的表达[16]。有报道指出,TWIST1 可以通过调节内皮细胞中Tie2的转录控制小鼠肺血管的通透性[17],还可通过改变血管内皮生长因子受体2(vascular growth factor receptor 2,VEGFR2)的表达控制新生小鼠的视网膜血管生成[18]。VEGF 和VEGFR 在早期胚胎血管发育以及后期新生血管形成中均具有关键作用[19],且VEGF-VEGFR2 是调控血管通透性的重要信号通路。有研究发现vegfr2突变体小鼠肿瘤内的血管通透性明显降低,对化疗的敏感性增加,且肿瘤细胞的转移扩散也受到抑制[20]。
HUVECs 常被作为体外实验的细胞模型,用于研究内皮细胞生物学特性及其与各种疾病的关系。但目前TWIST1 对HUVECs 的功能是否具有调控作用,以及是否能影响VEGFR2 的表达尚不明确。本研究旨在探究TWIST1在HUVECs增殖、迁移和体外血管生成中的作用,以及其与VEGFR2表达间的关系,以期为进一步揭示TWIST1与肿瘤血管新生和迁移的关系奠定理论基础。
1 材料与方法
1.1 材料
新鲜脐带由天津中心妇产医院提供,293T 细胞系均由本实验室保存。pLL3.7-shTwist1-GFP和pLL3.7-shCtrl-GFP 质粒由本实验室构建、鉴定并保存[21]。
内皮细胞专用培养基购自美国Sciencell 公司;FBS、RPMI 1640 均购自美国 GIBCO 公司;MatrigelTMMatrix 购自美国 Corning 公司;RNA 小量提取试剂盒(RNeasy Mini Kit)购自Qiagen 公司;SYBR green PCR 试剂盒购自日本TaKaRa 公司;AnnexinV/7AAD 细胞凋亡试剂盒购自美国BD 公司;LipofectamineTM2000、OPTI-MEM、反转录试剂盒购自Invitrogen公司。StepOnePlus/7500 Realtime PCR 仪购自美国 Applied Biosystems 公司;LSRII 流式细胞仪购自美国BD 公司;CO2细胞培养箱购自德国Thermo Fisher Scientific 公司;TE2000-S荧光倒置显微镜购自日本Nikon公司。
1.2 方法
1.2.1 细胞提取与培养 无菌条件下,用预热PBS 彻底清洗脐带。0.25%的胰酶/EDTA 充盈整根脐带,37 ℃消化15 min 后收集细胞,用含血清的完全培养基轻轻吹打混匀,接种至25T 塑料培养瓶中,37 ℃5% CO2的孵箱培养24 h 后更换为内皮细胞专用培养基。换液间隔为2~3 d,观察待细胞融合后,以1∶3的比例消化传代,选取处于对数生长期的细胞进行后续实验。
1.2.2 病毒的制备和感染 将载体质粒和包装质粒通过脂质体法共转染HEK293T 细胞,包装慢病毒。分别于48、72 h 后收集病毒上清并浓缩,于-80 ℃冰箱保存备用。内皮细胞完全培养基培养HUVECs,选用第 2~3 代,以每孔 2×105个接种于6 孔板,待细胞生长过夜,用有靶向人TWIST1基因shRNA(pLL3.7-shTwist1-GFP)的慢病毒液感染试验组细胞,同时以携带Scramble shRNA 的慢病毒(pLL3.7-shCtrl-GFP)感染对照组细胞,37 ℃5%CO2培养箱培养。感染72 h 后,用流式细胞仪检测GFP+细胞的比例即为感染效率(试验组和对照组细胞感染效率均为80%以上)。
1.2.3 qRT-PCR 检 测 TWIST1 及VEGFR2基 因 的表达 流式细胞仪分选pLL3.7-shTwist1-GFP 和pLL3.7-shCtrl-GFP 感染后的 GFP+细胞,用 RNA 提取试剂盒提取细胞mRNA,步骤按说明书进行。将RNA 反转录为cDNA,按照SYBR PCR Master Mix说明书配置10 μL的混合液体系进行qPCR反应。以 Actin 为内参,采用 2-ΔΔCt法计算TWIST1和VEGFR2的mRNA 相对表达量,引物序列见表1。

表1 PCR引物序列Table 1 Sequence of primer in PCR
1.2.4 细胞计数法测定HUVECs 细胞增殖活性取处于对数生长期的HUVECs-shCtrl 和HUVECsshTwist1细胞,调整至合适浓度(1×104cells·mL-1),混合均匀后分别以500 μL·孔-1接种至24 孔板。37℃5% CO2培养箱培养。每隔24 h 两组各取3个复孔进行消化计数,取平均值,并绘制细胞生长曲线。
1.2.5 划痕实验检测细胞迁移能力 将试验组和对照组细胞以合适浓度(2×105个·mL-1)接种于6孔板中,待细胞融合度超过80%时,用200 μL 吸头垂直细胞平面,作出一条平整均匀的划痕,使用无菌PBS 洗掉脱落的细胞,更换新鲜不含血清的培养基。将细胞置于37 ℃5% CO2培养箱中培养。培养24 h 后于显微镜下记录划痕的宽度,计算方式如公式(1)所示。

1.2.6 小管形成实验检测HUVECs 血管形成能力 提前在4 ℃冰箱将基质胶解冻过夜,并将所有塑料制品提前冷却。用无血清培养基将基质胶稀释后,以每孔250 μL 加入提前冷却好的24孔板中。37 ℃培养箱放置1 h,待基质胶固化后备用。将试验组、对照组细胞以每孔2×105个接种于基质胶表面。孵箱中培养24 h 后,用倒置显微镜(×100)拍照记录。每组细胞各取3 个视野,记录总小管分支长度和毛细血管样结构形成数。
1.2.7 Annexin V/7AAD 染色检测细胞凋亡 在病毒感染后,取试验组、对照组细胞各1×106个,离心后弃上清,用Annexin V-APC/7AAD 进行双染色,1 h内上机检测,比较两组细胞的凋亡比例。
1.2.8 统计学处理 采用GraphPad Prism 软件进行绘图,SPSS 24.0 软件进行数据分析,实验数据以平均值±标准差()表示,比较采用t检验,以P<0.05表示差异有统计学意义。
2 结果与分析
2.1 shCtrl 和shTwist1 慢病毒载体感染HUVECs结果分析
经 293T 细胞包装后的 shCtrl 和 shTwist1 慢病毒载体感染72 h 后,倒置荧光显微镜检测表明,HUVECs-shCtrl 和 HUVECs-shTwist1 绝大 多 数细胞均带有GFP 标记的绿色荧光,表明pLL3.7-shC-trl-GFP和pLL3.7-shTwist1-GFP成功感染HUVECs细胞(图1)。对照组和试验组细胞中GFP+细胞占比分别为81%±2.8%和82%±1.4%,差异无统计学意义(P>0.05)。
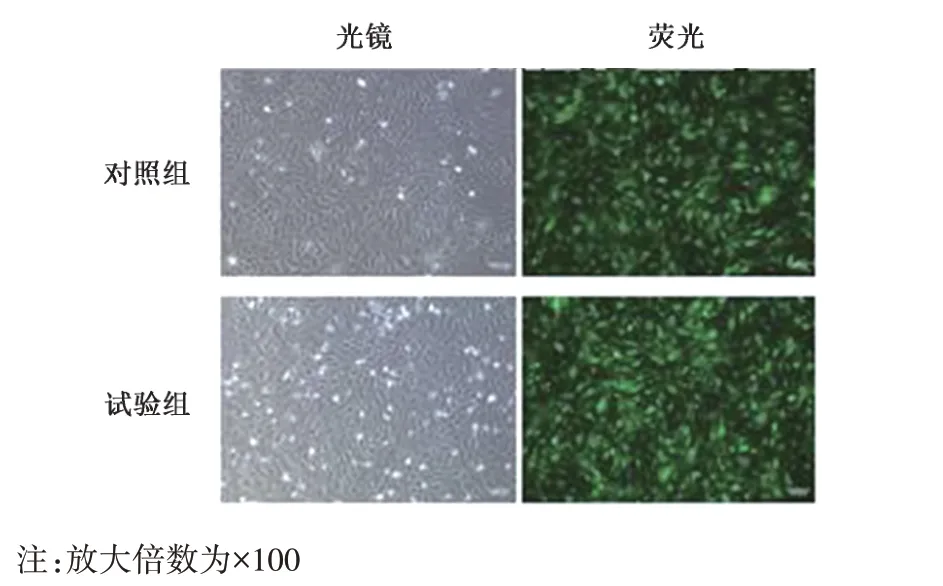
图1 感染72 h后对照组和试验组HUVECs光镜和荧光显微镜下的观察结果Fig.1 The observation results of HUVECs in the control group and the experimental group under light microscope and fluorescence microscope after 72 hours infection
2.2 感染敲降载体pLL3.7-shTwist1-GFP对HUVECs中TWIST1 mRNA表达水平的影响
qRT-PCR 检测结果显示,试验组细胞TWIST1的表达水平是对照组的30%(图2),表明感染pLL3.7-shTwist1-GFP使HUVECs中TWIST1mRNA的表达水平显著下降(P<0.01),提示试验组的TWIST1成功敲低。

图2 试验组和对照组HUVECs中TWIST1 mRNA水平比较Fig.2 Comparison of TWIST1 mRNA levels in HUVECs between experimental group and control group
2.3 TWIST1 表达对 HUVECs 细胞增殖、凋亡的影响
通过细胞计数法,绘制对照组和试验组的细胞生长曲线(图3A)。结果显示,与对照组相比,试验组生长速度明显减慢(P<0.01)。Annexin V/7AAD 检测凋亡发现试验组细胞凋亡比例显著高于对照组(P<0.05)(图3B),提示TWIST1 表达降低会抑制HUVECs细胞增殖,促进细胞凋亡。

图3 HUVECs生长曲线和凋亡率Fig.3 Growth curve and apoptosis rate of HUVECs
2.4 TWIST1 表达下降对HUVECs 细胞迁移的影响
HUVECs 细胞划痕实验表明,划痕后24 h,试验组细胞划痕愈合率明显低于对照组(P<0.01)(图4),表明TWIST1 表达下降明显抑制了HUVECs细胞的迁移能力。

图4 HUVECs细胞划痕实验和划痕愈合率Fig.4 Scratch test and scratch healing rate of HUVECs cells
2.5 TWIST1 表达下降对HUVECs 血管样结构形成的影响
体外小管形成实验表明,与对照组相比,试验组HUVECs 在体外形成的血管样结构明显减少(P<0.01),试验组总小管分支长度也显著短于对照组(P<0.01)(图5),表明TWIST1基因沉默抑制HUVECs细胞增殖、促进细胞凋亡。

图5 HUVECS血管样结构、总小管分支长度和毛细血管样结构数Fig.5 Vascular-like structure of HUVECs,total tubular branch length and capillary like structure number
2.6 TWIST1敲降对HUVECs中VEGFR2 mRNA水平的影响
如图6所示,试验组VEGFR2mRNA水平显著低于对照组(P<0.01),提示TWIST1基因下调抑制了HUVEC中VEGFR2的表达。

图6 试验组和对照组HUVECs中VEGFR2 mRNA水平比较Fig.6 Comparison of VEGFR2 mRNA levels in HUVECs between experimental group and control group
3 讨论
肿瘤的生长、转移及侵袭依赖于血管新生,在该过程中,肿瘤细胞可以诱导血管内皮细胞从静止状态转变为快速增殖状态,且多以发芽的方式生成新的毛细血管,并可以在短时间内建立血流供应。若失去血管新生的能力,大多数实体瘤将停止生长,进入休眠状态[22]。因此,探索调节肿瘤血管形成能力的新基因和机制,已成为抗肿瘤血管新生治疗领域的热点[23]。
在脊椎动物中,TWIST1 参与调节细胞发育、上皮间质转化和肿瘤转移,在各种上皮来源的恶性肿瘤[9,24-26]、肉瘤[27]、黑色素瘤[28]和神经胶质瘤[29]中均可检测到TWIST1 的表达,并且TWIST1 常与肿瘤的侵袭和转移呈正相关[30]。新生血管也是介导大多数肿瘤细胞转移和侵袭的重要途径。已有报道表明血管内皮细胞中TWIST1 呈高表达[16-17,31],提示TWIST1 可能与肿瘤中的血管生成密切相关。
本研究采用慢病毒载体pLL3.7-shTwist1感染HUVECs 敲降 TWIST1 的表达,发现 TWIST1 表达下降能够抑制内皮细胞的增殖,促进细胞凋亡。Valsesia-wittmann 等[32]研究表明 TWIST1 过表达可使神经母细胞瘤参与凋亡反应的ARF/p53通路受到抑制。TWIST1 抑制血管内皮细胞凋亡的具体分子机制尚有待后续试验阐明。血管内皮细胞迁移是新生血管形成的基础。本研究中敲降TWIST1后,明显抑制了HUVECs 的迁移能力。E-钙粘素是一种重要的细胞粘附分子,与细胞迁移能力密切相关。有研究报道,TWIST1可以直接与E-钙粘素启动子结合,抑制E-钙粘素基因的表达[33],显著增强肝癌细胞的运动能力和侵袭性[34]。在HUVECs中,TWIST1是否通过E-钙粘素促进内皮细胞迁移还需要进一步研究。VEGF和VEGFR在生理、病理条件下的血管生成中发挥重要作用[35]。其中,VEGFR2 是导致肿瘤血管生成最重要的通路之一,目前临床上有多种靶向VEGFVEGFR2 通路的抗体,已广泛用于癌症治疗[36]。有报道指出VEGFR2 的启动子区存在能结合TWIST1 的 E-box 结构域[31]。本研究发现,VEGFR2mRNA 水平随着TWIST1 的表达下降而显著降低,表明TWIST1可能通过调控VEGFR2的表达影响血管生成。同时,通过检测TWIST1 与多种肿瘤血管内皮细胞特征的关系,均证实TWIST1具有促进作用,提示其可能参与肿瘤血管新生和转移行为。但本研究采用的模式细胞体外模型仍存在一定的局限性,TWIST1如何影响各类肿瘤内皮细胞功能,未来还需进一步体内试验证实。
综上所述,TWIST1在血管内皮细胞功能中发挥重要作用,本研究为进一步研究其在肿瘤血管新生中的作用奠定了理论基础,也为肿瘤的抗血管生成治疗提供了新的思路。
