组蛋白甲基转移酶ASH2的研究进展
2022-02-11王婉洁陈南珠郝海生赵学明朱化彬杜卫华
王婉洁, 陈南珠, 郝海生, 赵学明, 朱化彬, 杜卫华
中国农业科学院北京畜牧兽医研究所,家畜胚胎工程与繁殖创新团队,北京100193
作为一种重要的表观调控机制,组蛋白甲基化修饰在多种生命过程中发挥重要作用,尤其是基因组活性和转录。缺失的、小的、同源异形2(absent,small,or homeotic 2,ASH2)是组蛋白甲基转移酶复合物的核心成分,具有甲基转移酶活性;其通过催化H3K4 甲基化调控基因的转录,且还参与基因表达的维持、多种癌症的发生发展和细胞分化等过程。本文通过对ASHL2 组蛋白甲基转移酶的结构、功能和调控机制等方面的研究进展进行综述,旨在进一步探索ASHL2 在疾病发生、发展及治疗方面的功能,以期为其在家畜胚胎发育和大家畜繁育中的应用研究提供参考。
1 组蛋白甲基化
组蛋白是球形蛋白质,具有突出于核小体的非结构性N端尾巴,两者均能发生翻译后修饰,包括甲基化、乙酰化、磷酸化和泛素化等[1-2]。作为重要的表观遗传调控形式,组蛋白修饰不仅为染色质重塑因子、组蛋白伴侣、DNA 或组蛋白修饰酶和通用转录因子等提供结合位点[3];还通过影响染色质的结构在基因表达、DNA 复制和修复、染色质凝聚和细胞周期调节等细胞事件中发挥重要作 用[4]。 在 胚 胎 干 细 胞(embryonic stem cell,ESCs)中,具有转录活性的染色质存在多种组蛋白修饰,且组蛋白修饰的失调与癌症的发病和发育缺陷相关,表明组蛋白修饰具有重要的调控功能[5]。
组蛋白甲基化作为重要的表观修饰之一,参与基因的转录调控是生命科学研究的热点和焦点。组蛋白甲基化因修饰的残基、残基位点、甲基化水平的不同而具有不同的生物学功能,如组蛋白赖氨酸甲基化是基因活性转录或抑制的标记;组蛋白H3第4位、第36位和第79位赖氨酸(H3K4、H3K36、H3K79)的甲基化标志着活性转录,与基因激活有关;而组蛋白H3 第9 位、第27 位、第20位赖氨酸(H3K9、H3K27、H3K20)的甲基化则与基因沉默或异染色质形成有关[6]。组蛋白中赖氨酸残基的甲基化主要由组蛋白赖氨酸甲基转移酶(histone lysine methyltransferase,HKMTs)和组蛋白赖氨酸残基去甲基化酶(histone lysine demethylase,HKDMs)严格调控,前者负责赖氨酸的甲基化修饰,而后者负责去甲基化,以维持细胞命运和基因组的稳定性[7]。另外,组蛋白甲基化在异染色质的形成、X 染色体的失活和癌症的形成等生物过程中具有重要作用[8]。
2 ASH2甲基转移酶
2.1 ASH2蛋白
ASH2 是组蛋白赖氨酸的甲基转移酶,最初在果蝇中被鉴定,许多真核生物中均有其同源蛋白,在进化上相对保守。果蝇ash2基因的缺失会降低发育相关基因启动子区域的H3K4me3,影响该基因的转录激活,导致果蝇翅膀的缺刻变化[9]。ASH2L 是果蝇ASH2 的哺乳动物同源物(60%),在胚胎早期发育和心脏发育中具有重要作用[10];1999 年,日本学者通过测序在人类染色体8p11.2位点得到了一段与果绳发育调控基因Ash2高度同源的基因序列ASH2L[11],并于2001 年首次在胎儿大脑cDNA 文库中克隆到人类异构体,证实ASH2L是一种人体编码基因,对造血系统发育及白血病进程有重要的调控作用[12],自此人和小鼠的ASH2L被成功克隆和鉴定;目前关于ASH2L的研究主要集中于果蝇、小鼠和人中。此外,ASH2L也是一个原癌基因,其异常表达与肿瘤的发生密切相关[13]。
ASH2L 蛋白含 628 个氨基酸,具有 4 个高度保守的特定结构域,从N端向C端依次为植物同源结构域(plant homeodomain,PHD)、翼状螺旋结构域(wing-helix domain,WH)、SPRY 结构域(spla and ryanodine receptor,SPRY)以及 SDI 结 构域(SCD1/DPY30 interaction,SDI)[14],这些特殊的结构决定了其在复合体中发挥独特功能[9]。ASH2L作为一种组蛋白甲基转移酶,可催化组蛋白H3K4 甲基化,被认为是基因转录激活的表观遗传因素;且还参与多个转录因子的调节,发挥多种生物学功能[15]。但ASH2L自身不具备甲基转移酶活性,需要与其他蛋白质形成复合体才具有酶活性,参与细胞周期、信号转导、凋亡和基因调控等细胞过程[16]。ASH2L 属于三胸腔结构蛋白(trithorax group,TrxG)家族,其基因突变导致的同源异形表型与TrxG蛋白的突变体相似[9]。
2.2 TrxG
TrxG 是多种蛋白质的集合,最初只有小部分从果蝇中分离出来,其表型与果蝇同源异形基因(homeobox gene,Hox)缺失突变体的表型相似;该家族包括Trx、ASH1、ASH2 和雌性不育同源异形蛋白(female sterile homeotic,FSH)[17]。TrxG 蛋白广泛存在于植物和哺乳动物等多细胞生物体内,分为组蛋白修饰、染色质重塑蛋白、DNA 结合蛋白和其他TrxG 蛋白,因其结构的差异而具有不同的分子功能[18]。TrxG 共包含6 种组蛋白修饰复合体,每种复合体仅包含1 种甲基转移酶。在TrxG复合体中,各组成成分间相互作用,可稳定复合体的结构,参与组蛋白甲基化修饰,使目的基因所在的染色质处于开放状态,从而促进基因的转录和表达[19]。其中,ASH2L 在体外对于 H3K4me3 是必需的,H3K4me3 更靠近转录的起始位点,通常与染色质的开放以及基因的表达有关[20]。除了Hox基因外,TrxG 蛋白还调控其他基因,以维持染色质的活性状态,调节肿瘤的发生、胚胎干细胞的自我更新[21]和细胞增殖[22]。此外,TrxG 蛋白与 X 染色体的失活[23]、细胞周期的调节[24]、细胞凋亡[25]、细胞可塑性生长和再生、应激反应有关。因此,TrxG蛋白是生命过程中重要的调控因子。
多梳蛋白家族(polycomb group,PcG)也是组蛋白修饰复合物,在进化上高度保守,与TrxG 蛋白相互拮抗[20]。PcG 和TrxG 的动态平衡影响多种生物学功能,如细胞增殖、分化、易染色质的形成、肿瘤发生发展等(图1A)。TrxG 和PcG 蛋白通过Polycomb/Trithorax 反应元件(polycomb/trithorax response elements,PREs)的调节起拮抗作用。常见的为多梳抑制复合物1(polycomb repressive complex 1,PRC1)和多梳抑制复合物1(PRC2),分别通过泛素化H2AK119 和三甲基化H3K27 抑制基因表达;TrxG 则通过乙酰化H3K27、三甲基化H3K4 和二甲基化H3K36 激活基因的表达(图1B)[20]。目前,Hox 家族基因是研究最为透彻的 TrxG/PcG 调控的靶标,TrxG 蛋白是果蝇hox表达所必需的,可维持基因的转录活跃状态;而PcG蛋白则为hox转录的阻遏物,维持基因的沉默状态[17]。

图1 TrxG和PcG相互拮抗的动态平衡[20]Fig.1 Dynamic equilibrium of mutual antagonism between TrxG and PcG[20]
PcG 蛋白是由不同的、具有特定生化活性的亚基形成的复合物(表1)[26]。生化研究表明,许多PcG 蛋白以多梳蛋白复合物形式存在,如PRC1和PRC2,它们通过染色质修饰来抑制转录[27]。PRC1和PRC2 在后生动物中是保守的,可分别单泛素化、二/三甲基化组蛋白H2A 和H3 上特定的赖氨酸残基[28]。在小鼠和人中,PcG 蛋白主要占据基因启动子周围的区域,在早期胚胎发生过程中维持同源异形基因的抑制状态,从而决定胚胎发育,如PcG 蛋白的缺陷影响Hox基因的表达,并最终通过染色质浓缩、基因组不稳定或有丝分裂失调干扰细胞增殖[29]。此外,有研究者发现,在人和小鼠胚胎干细胞中几乎所有的PRC2 结合位点均位于CpG岛或其他高GC富集序列,表明PcG复合物在表观遗传记忆中具有重要作用[30]。PcG 和TrxG蛋白与DNA 甲基化和翻译后修饰的关系密切,目前大多数研究均集中于果蝇上,其在大家畜中的作用及机制仍需要进一步研究。

表1 PcG复合物成分[26]Table 1 Composition of PcG complex[26]
2.3 ASH2甲基转移酶催化H3K4甲基化
H3K4 甲基化是一种进化上保守的组蛋白修饰,以单甲基化、二甲基化或三甲基化(H3K4me1/2/3)的形式高度富集于启动子区和转录起始位点[31-32],与基因的转录激活有关[33]。H3K4 甲基化作为组蛋白重要修饰之一,在调控靶基因的转录过程中发挥重要作用,其甲基化由H3K4甲基转移酶催化,包括SET1A(Su[var]3-9,enhancer-of-zeste,trithorax 1A)、SET1B、混合谱系白血病 1(mixed lineage leukemia1 1,MLL1)、MLL2、MLL3 以 及MLL4[34]。值得注意的是,SET1 复合物即 SET1 相关蛋白复合物(complex of proteins associated with SET1,COMPASS),包 含 SET1、SWD1、SWD2、SWD3、BRE2、SDC1 和 SPP1 亚基[35];其中 SWD1、SWD3 和BRE2 是维持甲基转移酶活性所必需的[36]。组蛋白甲基化转移酶组成和结构具有高度复杂性,H3K4 甲基化对高等真核动物具有重要作用[37]。
另外,H3K4甲基化也参与基因抑制,尤其是在沉默基因座中[38],如酵母端粒的沉默交配型基因座;SET1突变时,端粒长度维持正常,而端粒报告基因沉默[39]。通过结构域缺失研究发现,Set1突变体在端粒沉默基因座中存在缺陷,同时H3K4me3存有缺陷,而在H3K4me1/me2保持正常水平,表明H3K4me3是基因座发挥沉默功能所必需的[40]。此外,H3K4甲基化还发挥其他重要作用,如在脊椎动物中H3K4me3与机体发育有较强的相关性[41];在滋养层和胚胎内、外胚层干细胞中含有大量H3K4me3修饰,以维持胚胎干细胞的稳定性,并表观调控胚胎发育和细胞分化[42]。因此,H3K4甲基化参与调控基因表达、细胞生长发育和疾病形成等生物过程[43-44]。在哺乳动物体内,细胞中H3K4甲基化主要由组蛋白赖氨酸甲基转移酶MLL1介导,其只有与4个共同调节甲基转移酶活性的核心成员——WD重复蛋白5(WD repeat domain 5,WDR5)、ASH2L、视网膜母细胞瘤结合蛋白 5(retinoblastoma-binding protein 5,RBBP5)和DPY30组蛋白甲基化酶复合体调节亚基(Dpy-30 histone methyltransferase complex regulatory subunit,DPY30),共同形成复合物后才具有较高的甲基转移酶活性[45-46](图2)。ASH2L是MLL复合物的核心亚单位之一,主要作用是调节MLL 的活性,促进H3K4me3修饰的形成,激活基因转录,参与表观调控。ASH2L表达的缺失会降低H3K4甲基化的表达水平,进而影响细胞的生长及癌变[47]。
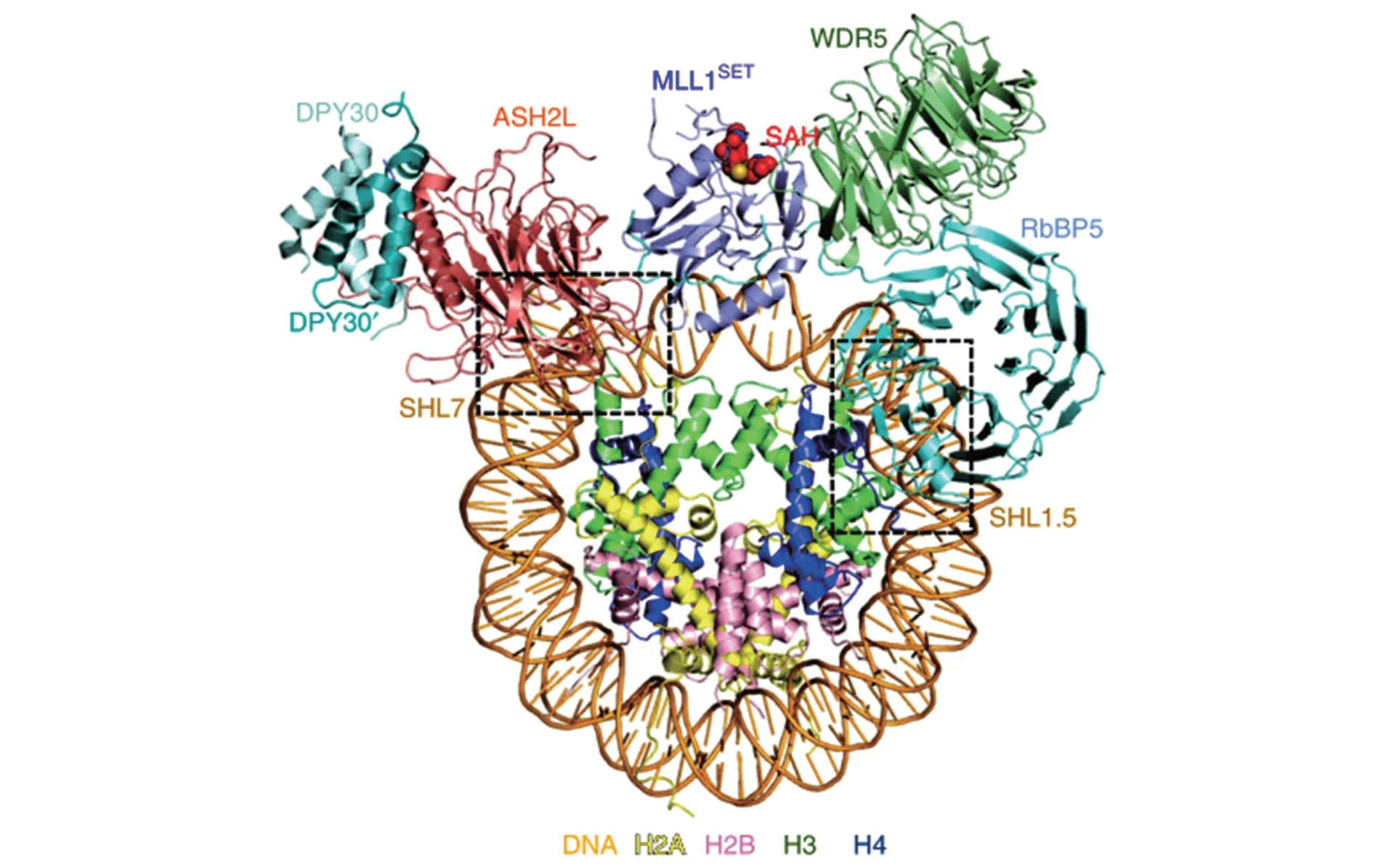
图2 组蛋白赖氨酸甲基转移酶MLL1介导的甲基化示意图[46]Fig.2 Methylation mediated by histone lysine methyltransferase MLL1[46]
3 ASH2蛋白的调控功能
ASH2L 作为一种组蛋白甲基转移酶,能调控基因表达,参与细胞有丝分裂、DNA 损伤应答、细胞分化、造血过程等重要生命活动,在胚胎发育过程中也发挥重要的作用。
3.1 ASH2参与基因转录的调控
染色质在基因调节和控制启动子活性的过程中扮演着重要的角色;而组蛋白及组蛋白修饰通过改变染色质的结构和动态变化来调控基因转录[48],如ASH2是COMPASS复合物的核心亚单位,可调节MLL 家族组蛋白赖氨酸甲基转移酶的活性,催化H3K4 甲基化及调控基因的转录[49]。ASH2 蛋白的缺失会导致H3K4me3 甲基化水平的整体降低,从而负调控基因转录[50]。
在黑腹果蝇中,ASH2 调控的靶基因涉及细胞周期、细胞增殖和细胞粘附等生理过程[51]。在线虫中,亲代个体中H3K4me3甲基转移酶ASH2L或WDR5 的缺失均能延长子代的生存期,直至第三代;生存期延长的跨代遗传是H3K4me3甲基化复合物所特有的,与大量基因的表观修饰变化相关[52]。在哺乳动物细胞中,ASH2L与果蝇ASH2有60%同源性,通过与DNA 序列相互作用或形成蛋白复合物来调节基因表达[16]。ASH2L 蛋白的N 端含有PHD 和WH 结构域,能识别DNA 和组蛋白[53]。在小鼠胚胎干细胞中,ASH2L 被招募和富集到开放染色质调控相关的基因中,包括染色质重编程因子染色质解旋酶DNA结合蛋白(chromodomain helicase DNA binding protein 7,CDH7)、转录因子c-MYC 和H3K9 去甲基化酶4C(lysine demethylase 4C,KDM4C);敲降 ASH2L 后,c-Myc、Cdh7、Kdm4c、Nanog和Oct4mRNA 表达水平显著降低,说明ASH2L 可调控染色质开放状态和基因的转录[47]。另外,ASH2L 也可作为转录因子的辅因子参与基因转录的调控,如通过提高H3K4me3甲基化水平,ASH2L 可增强T-同源盒因子(T box 1,TBX1)、配对盒因子7(paired box 7,PAX7)和肌细胞增强因子2(myocyte enhancer factor 2,MEF2)介导的转录活性,参与胚胎发生和干细胞分化[13]。小鼠肌生成过程中,含ASH2L 的甲基转移酶复合物被招募至转录激活子MEF2D 调控的肌肉特异表达基因的启动子区进行H3K4 甲基化修饰,拮抗PcG 蛋白的转录抑制作用,促进肌肉相关基因的大量表达[54]。
3.2 ASH2调控Hox基因的表达
Hox基因是一种同源异形基因,根据其与果蝇同源物的同源性命名,分为A、B、C 和D 4个簇,并编码含同源结构域的转录因子家族。果蝇hox基因通过影响细胞分裂、纺锤体方向,以及硬毛、附肢等部位发育相关基因的表达而调控生物的形体发育,其突变会导致身体某部分发生形变[55]。另外,人类HOX基因对维持机体正常发育及肿瘤发生有重要作用;且在不同类型肿瘤中,不同HOX基因表达趋势不同,如HOXC13、HOXC3、HOXC9和HOXC8等基因的表达对白血病、乳腺癌、神经母细胞癌等的预后有重要意义[56]。同时,在胚胎发育中,HOX基因的差异表达决定细胞分化的方向,如在造血过程中HOX基因被认为是多能干细胞分化的重要控制环节[57]。TrxG 家族蛋白是HOX基因的上游调控因子,在染色质水平上调节其表达。因此,TrxG 家族蛋白能够通过HOX基因间接调节发育和细胞分化[58]。
ASH2L 作为TrxG 家族成员之一,其可维持HOX基因表达,最终在发育、细胞增殖与分化过程中起重要作用。ASH2L 具有多个蛋白结合位点,与位于12 号染色体上的HOXC8基因的启动子结合,可启动核小体的运动,从而激活靶基因,参与MLL基因重排急性白血病的发生[59]。干扰人白血病细胞系中ASH2L基因表达后,HOXC8基因及其蛋白的表达均显著降低;同时,结合在HOXC8基因启动子区的WDR5 和MLL 亚基的活性也降低,HOXC8基因启动子区转录起始位点上游的H3K4me3 水平降低,表明ASH2L 通过与MLL 亚基的互作、调控启动子区H3K4me3水平而直接或间接地影响靶基因HOXC8表达[60]。在人293T 细胞中,ASH2L 可与转录因子 AP2δ 特异性结合,并以剂量依赖方式正向介导AP2δ的反式激活;同时,其与AP2δ 和MLL 家族蛋白肝再生增强因子(augmenter of liver regeneration,ALR)共同形成复合物,并被招募到HOXC8位点,催化H3K4me3,从而激活基因的转录[61]。含ASH2L 亚基的MLL 复合物的激活诱导HOXA9、HOXA5、HOXA7和HOXA10基因表达水平的异常增高,其中HOXA9增高幅度最大;而敲降MLL基因使HOXA9mRNA 水平降低50%,因而该基因被认为是导致小鼠发生MLL白血病的关键因素[62]。在人牙囊干细胞中,小泛素样修饰蛋白(small ubiquitin-related modifier,SUMO)与MLL复合物中的ASH2L 和多发性内分泌腺瘤蛋白(multiple endocrine neoplasia protein,MENIN)亚基结合,可提高H3K4 甲基化水平,并促进活性RNA 聚合酶Ⅱ的聚集,进而调控HOX家族基因远端缺失同源盒3(distal-less homeobox 3,DLX3)的转录,调节干细胞的成骨分化[63]。
3.3 ASH2调控癌症的发生发展
组蛋白甲基化修饰是肿瘤表观遗传学修饰异常的研究热点,其涉及肿瘤细胞的生物学行为,并参与肿瘤发生、发展和病理转归。在多种人类肿瘤和肿瘤细胞系中,虽然ASH2LmRNA 水平无异常变化,而ASH2L 蛋白的表达水平上调;且敲降ASH2L可抑制肿瘤细胞的增殖,降低某些肿瘤的发生率[15]。滤泡辅助性T 细胞(follicular helper T cell,Tfh)在生发中心、记忆性B 细胞和浆细胞的形成中起关键作用,是机体正常免疫所必需的,其功能失调可引起自身免疫性疾病、免疫缺陷和肿瘤等免疫性疾病;ASH2L 可以调节Tfh 细胞分化,维持Tfh 细胞功能,在机体免疫中发挥重要作用[64]。在维甲酸(retinoic acid,RA)诱导的人髓系白血病U937细胞中,ASH2L和维甲酸受体α(retinoic acid receptor α,RARα)相互作用,并被募集到RA 应答基因的启动子区,调控这些基因的表达[65];另外,ASH2L结合于抗凋亡基因BCL-XL的启动子区,促进其过表达,提高U937细胞的存活率;而经地塞米松处理后,ASH2L 的聚集被减弱,BCL-XL的表达水平降低,细胞凋亡率升高。可见,ASH2L参与髓系恶性肿瘤的发生和转归[66]。在具有终末红细胞系和巨噬细胞系等多向分化潜能的白血病细胞K562 中,ASH2L 的表达量极高;当K562细胞经诱导向巨噬细胞样分化后,其表达水平急剧下调,所以ASH2L 在造血中具有重要作用,并与一些特殊类型的白血病相关[9]。
ASH2L 甲基转移酶也参与女性高发癌症的发生和发展。雌激素及其受体α(estrogen receptor α,ERα)信号通路作为一种致癌途径,在子宫内膜癌(endometrial cancer,ECa)的发生中具有至关重要的作用;ASH2L 在ECa 中高表达,且与ECa的不良愈后呈正相关;且其可增强ERα 诱导的反式激活作用,即ASH2L被招募到ERα 靶基因成对框2(paired box 2,PAX2)的顺式调控元件位点,调节 H3K4m3 和 H3K27me3 水平,进而增强PAX2基因的表达水平;敲除ASH2L导致PAX2基因的转录水平降低,抑制ECa 细胞的增殖和迁移[11]。此外,在原发性乳腺癌和乳腺癌细胞中,ASH2L和ERα基因均异常高表达,且ASH2L与转录因子GATA3结合,增强ERα转录[67]。ASH2L 与癌基因Ha-RAS共同作用于大鼠胎儿成纤维细胞转化为肿瘤,同时敲除其在人类肿瘤细胞HeLa 中的表达可抑制细胞增殖[12]。在上皮性卵巢癌中,高水平表达的ASH2L 促进肿瘤细胞的增殖,表明ASH2L 与乳腺癌、卵巢癌和子宫内膜癌等女性常见的恶性肿瘤密切相关[68]。在过表达ASH2L 的结肠癌细胞中,ASH2L被招募到P53介导的促凋亡基因的启动子区,且该区域的H3K4me3 水平升高,使促凋亡基因表达水平升高,促进P53 依赖性细胞凋亡[69]。可见,ASH2L 通过表观遗传学机制调控多种癌症的发生过程,因而其可作为癌症治疗的一个新靶点。
3.4 ASH2调控细胞分化
已有研究表明,表观遗传调控在哺乳动物的早期胚胎发育及干细胞的细胞命运决定过程中发挥重要的作用[70]。作为特异性催化H3K4 的甲基转移酶,ASH2L 通过调控多种靶基因参与胚胎发育和细胞分化。敲除ASH2L基因的小鼠在妊娠期死亡,表明其在早期胚胎发育中是必需的[10]。对小鼠胚胎干细胞(mouse embryonic stem cell,mESC)进行全基因组ChIP-seq 分析,结果发现ASH2L 具有多个参与开放染色质调控的潜在靶点;敲降ASH2L后,H3K4 甲基化水平降低,H3K9me3 水平升高,细胞染色质进入沉默状态,多能性基因表达水平降低和碱性磷酸酶染色阳性细胞减少,分化细胞的比例增加,因此ASH2L 对维持染色质的开放状态有重要的调节作用[47]。然而,ASH2L 异构体 ASH2L-1 缺失 mESC 能维持全能性,碱性磷酸酶染色和多能性转录因子的表达均与野生型无显著差异,但其外胚层和内胚层起源的器官具有发育缺陷。
同时,ASH2L 甲基酶也参与前体细胞的分化。在小鼠大脑新皮层发育早期,特异性敲除ASH2L 后小鼠存活率降低,大脑发育畸形,中后期生成的上层神经元数量显著减少,且分布异常;敲除皮质神经前体细胞的ASH2L基因引起WNT-β-Catenin 通路相关因子的表达量下降,前体细胞的细胞周期进程中断,导致细胞数量减少,因此ASH2L 是晚期前体细胞有丝分裂和自我更新所必需的[19]。在肌肉前体细胞中,磷酸化的转录因子MEF2D 激活P38-MAPK 信号通路,并与ASH2L 共同结合到靶基因的启动子区,诱导前体细胞分化为肌细胞[45]。
在多能性干细胞如造血干细胞中,ASH2L能够招募OCT4/SOX2/NANOG(OSN)形成ASH2L-OSN复合物,与 Jumonji 富含 AT 结合结构域2(Jumonji,AT rich interactive domain 2,JARID2)、OCT4、SOX2和NANOG等多能性基因的超级增强子结合,上调多能性基因表达,维持多能性状态[65]。在牙间充质细胞中,含Jumonji 结构域蛋白质3(jumonji domaincontaining protein 3,JMJD3)是H3K27me3去甲基化酶,其与ASH2L共同调节无翅型MMTV整合基因5A(wingless-type MMTV integrated 5A,WNT5A)启动子区的H3K4me3水平,最终促进细胞的分化[71]。
4 展望
作为组蛋白甲基转移酶,ASH2L 通过催化H3K4 甲基化调控基因表达、癌症发生和细胞分化等多种生物学过程。随着组蛋白甲基化修饰在人类疾病与治疗、干细胞自我更新与分化、胚胎与个体发育等方面的研究逐渐深入,对组蛋白甲基转移酶ASH2L 的结构、功能及其调控机制的探索必将成为研究的焦点。同时,以大家畜为材料,研究ASH2L 对胚胎发育和家畜繁殖的调控及其应用,将会为提高优质家畜的高效快速繁殖提供理论基础。
