敲除集胞藻PCC 6803 中编码乳酸脱氢酶的slr1556 基因对生物合成乙醇的影响
2022-02-11许慧露徐岷张炜
许慧露, 徐岷, 张炜*
1.江苏大学附属医院,江苏镇江 212000;2.江苏大学医学院,江苏 镇江212000
乙醇具有燃烧无污染、应用广泛等特点,可作为再生生物燃料,乙醇再生已成为全世界研究的重点[1]。传统的乙醇生产成本高且产量低,近年来利用蓝藻等光合微生物合成乙醇被广泛应用[1-2]。然而多数基于蓝藻的乙醇生物合成系统产量不高,在工业生产中的应用有待进一步研究。很多生产化学品的代谢合成途径是以内源代谢物作为起始合成前体,而这些内源代谢物通常在细胞生长和生理活动等内源性代谢途径中被消耗[3]。
合理优化内源性代谢途径可提高乙醇合成前体含量,已成为实现乙醇高效合成的有效策略。基于内源性代谢物含量的比较,丙酮酸被广泛选作集胞藻PCC 6803 中乙醇合成的前体[4-5]。本研究选取来自运动型发酵单胞菌的丙酮酸脱羧酶基因(pdc)和来自大肠杆菌的NADPH 依赖型醛还原酶基因(yqhD),通过密码子优化,在集胞藻PCC 6803 中组合表达,构建了一条以丙酮酸为前体的乙醇生物合成途径,其中丙酮酸被丙酮酸脱羧酶催化为乙醛,然后乙醛被NADPH 依赖型醛还原酶催化为乙醇,从而实现乙醇在培养基中的积聚(图1)。

图1 乙醇合成代谢流程图Fig.1 Ethanol synthesis and metabolism flow chart
为进一步实现集胞藻PCC 6803 中乙醇的高效合成,本研究通过代谢组学的分析,敲除集胞藻PCC 6803 基因组中编码乳酸脱氢酶的slr1556基因,阻断丙酮酸与乳酸的相互转化途径,减少前体丙酮酸的消耗,旨在探究丙酮酸转化乳酸代谢途径的阻断对集胞藻PCC 6803 乙醇合成的影响,以期实现乙醇的高效合成。
1 材料与方法
1.1 材料与试剂
利用高保真Star酶与Taq酶[NEB(北京)有限公司]分别对基因片段进行PCR 扩增。利用限制性内切酶[NEB(北京)有限公司]酶切载体与片段构建载体。构建的中间载体转大肠杆菌DH5α,获得对应大肠杆菌菌株。利用质粒提取试剂盒[生工生物工程(上海)股份有限公司]提取大肠杆菌中的质粒。其他试剂均购自生工生物工程(上海)股份有限公司。
1.2 菌株和生长条件
利用大肠杆菌DH5α 构建质粒。将不同抗性的大肠杆菌菌株分别在含有相应抗生素的液体以及含有1.5%琼脂的固体LB 培养基中培养,设置培养温度为30 ℃。野生型集胞藻PCC 6803 和工程菌株在BG11 含有相应抗生素的液体以及含有1.5%琼脂的固体BG11 培养基中培养,均采取光自养培养。光自养培养条件设置:温度30 ℃,光强100 μmol photons·m-2·s-1,于光照培养箱中无人为干预培养[6]。野生型集胞藻PCC 6803 和工程菌株在优化培养下设置培养温度为30 ℃,利用曝气装置向培养体系中人为通入5%CO2和95%空气进行优化培养,设置光强为100 μmol photons·m-2·s-1。
1.3 质粒的构造
利用从生工生物工程(上海)股份有限公司购买的pMD18-T 载体作为基础。在pMD18-T 上插入slr1556上下游600 bp 同源臂,构建载体ETH1556。以提取的集胞藻PCC 6803 的基因组DNA 为模板,分别用引物slr1556Up-F、slr1556Up-R 和 slr1556Dw-F 和 slr1556Dw-R(引物序列见表1)扩增slr1556上下游600 bp 同源基因并克隆到pMD18-T 的SphⅠ/MluⅠ和XbaⅠ/KpnⅠ位点上。将壮观霉素基因克隆到质粒ETH1556 上,构建质粒ETH1556-Ω。以生工生物工程(上海)股份有限公司优化后的壮观霉素基因为模板,用SP-F和SP-R引物(表1)扩增壮观霉素基因并克隆到质粒ETH1556 的XhoⅠ/XbaⅠ位点上。以集胞藻PCC 6803 的基因组DNA 为模板,分别用引物Prbc-F、Prbc-R 和 TrbcL-F、TrbcL-R(表 1)扩增启动子和终止子基因并克隆到ETH1556-Ω 的BamH Ⅰ/SalⅠ 和SalⅠ/Hind Ⅲ 位 点 上 获 得ETH-1pt。根据集胞藻PCC 6803 的密码子偏好性,对运动型发酵单胞菌pdc和大肠杆菌yqhD的核苷酸序列进行优化。优化的序列由生工生物工程(上海)股份有限公司合成。分别以优化的合成菌株为模板,用 Pdc-F、Pdc-R 和 YqhD-F、YqhD-R(表1)为引物扩增基因,并插入到ETH-1pt 的NdeⅠ/BamHⅠ和XbaⅠ/KpnⅠ位点,构建质粒ETH02。构建整合点为slr0168的质粒ETH01 作为对照,构造方法与ETH02 类似,用引物slr0168 Up-F、slr0168Up-R 和 slr0168Dw-F、slr0168Dw-R(表1)扩增slr0168上下游600 bp同源基因并克隆到pMD18-T的SphⅠ/MluⅠ和XbaⅠ/KpnⅠ位点上构建载体ETH0168。将SpR-PrbcL-pdc-yqhD-TrbcL基因簇转入ETH0168 构建载体ETH01,构建质粒的特点如表2所示。

表1 本研究所使用的引物Table 1 The primers used in this study

表2 构建的质粒及相关特点Table 2 Constructed plasmids and related characteristics
1.4 工程藻株的构建
将质粒ETH01、ETH02 分别转入野生型集胞藻PCC 6803 中,根据同源替换原理[14],质粒ETH01 含有slr0168基因上下游 600 bp 的同源序列,同源序列间的PrbcL-SpR-pdc-yqhD-TrbcL基因簇经同源替换整合到集胞藻PCC 6803 中slr0168基因位点上。将质粒ETH02slr1556上下游600 bp 同源序列间的PrbcL-SpR-pdc-yqhD-TrbcL基因簇整合到集胞藻PCC 6803 中slr1556基因位点上。为测定编码乳酸脱氢酶的slr1556基因的敲除对丙酮酸含量的变化,将质粒ETH1556Ω 转化集胞藻PCC 6803,ETH1556Ω 中的SpR基因整合到集胞藻PCC 6803 中slr1556基因位点上。通过转入基因簇中SpR抗性基因筛选,获得相应的转化菌株SETH01、SETH02 和SETHΩ。具体操作步骤如下。培养细胞至指数生长阶段(OD730在0.6~0.8),用新鲜的BG11 培养基收集细胞,将质粒与新鲜的藻细胞混合。混合物在30 ℃恒定光照下孵育5 h,并定期摇动。然后将混合物转移至无抗的BG11 固体培养基的无菌核孔膜上,置于光照培养箱,设定温度为30 ℃,并在恒定光照下孵育过夜。培养过夜后,将无菌膜转移到带有相应抗性的固体BG11培养基中,培养2周后出现相应的单菌落[7]。
1.5 高效液相色谱法(high performance liquid chromatography,HPLC)分析
根据相关研究[8]报道,合成的乙醇主要分泌于胞外,因此,本研究直接检测BG11 液体培养基中的乙醇含量。在乙醇测定试验中,所有改造菌株保持初始OD730=0.1,在新鲜BG11 培养基中培养。根据文献[9]的方法对藻液离心并保留滤液。过滤后的溶液用HPLC进行乙醇分析。
1.6 酶活性测定
按Hoppner等[10]报道的方法进行酶活性检测。PDC 与YqhD 的酶活性通过利用NADP 与NADPH在340 nm时吸光度的增减来计算[8,11]。
1.7 丙酮酸含量的检测
将藻细胞培养至指数生长阶段后,以6 000 g离心5 min,弃上清保留沉淀。沉淀在冰浴下,采用超声破碎仪进行细胞破碎。设置细胞破碎仪功率为20%,超声3 s,间隔10 s,重复30 次。破碎后静置30 min,于常温下以12 000 r·min-1转速离心30 min,保留上清。利用丙酮酸测试试剂盒(北京索莱宝科技有限公司)检测上清液丙酮酸含量。
1.8 数据转换方法
利用紫外分光光度计测量波长λ=730 nm 的透光度并以此确定藻细胞浓度OD730的数值。根据 Choi 等[12]报道的方法,认为 OD730/0.171 即为干细胞重量(dry cell weight,DCW)。
1.9 数据分析
利用Origin 9.0 进行图像绘制与数据分析[13],以P<0.05为差异具有统计学意义。
2 结果与分析
2.1 工程藻株的成功构建
转化的菌株经PCR 验证并鉴定基因序列,经验证,整合基因位点大小正确,且被整合位点基因完全被消除,表明成功构建工程藻株。
2.2 乙醇的合成与菌株的生长
观察对比菌株生长状态,同时定期采集SETH01 和SETH02 的样品进行乙醇的测定。在乙醇测定试验中,野生型集胞藻PCC 6803 与菌株SETHΩ 在7 d 的观察期内未合成任何乙醇。如图 2 所示,菌株 SETH01 与 SETH02 均成功合成乙醇,且随着培养时间的增加,累积的乙醇含量逐渐上升。培养7 d 后,菌株SETH01 乙醇产量达到445 mg·L-1,菌株 SETH02 产量达到 593 mg·L-1,其在相同时间内,合成的乙醇产量约为菌株SETH01 的1.3 倍。随着培养天数的增加,在相同培养条件下,SETH02 的乙醇产量增长明显快于SETH01,两菌株的产量差距由第1 天的26 mg·L-1增至第7天的148 mg·L-1。结果显示,slr1556基因的敲除明显促进了菌株乙醇的合成。
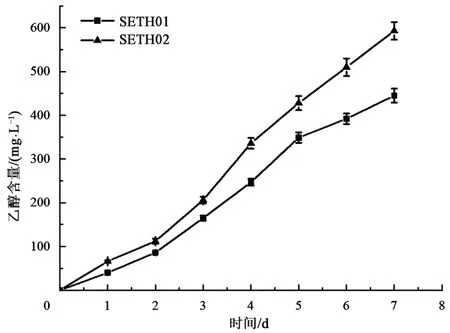
图2 菌株的乙醇生产曲线Fig.2 Ethanol production curve of the strains
如图3 所示,多个菌株在7 d 的观察期内生长趋势基本一致,方差分析表明结果差异无统计学意义(P>0.05),证明slr1556基因的敲除对集胞藻细胞的生长无明显的影响。
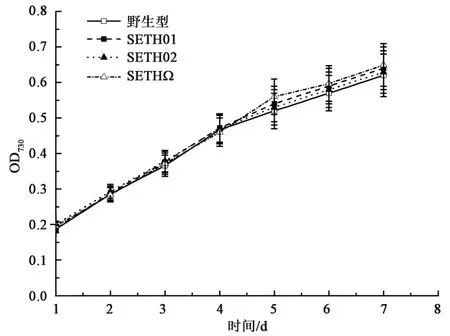
图3 菌株的生长情况Fig.3 The growth condition of the strains
2.3 丙酮酸含量的检测
如图4 所示,野生型集胞藻中丙酮酸含量约为 0.85 μmol·g-1·DCW-1。在菌株 SETHΩ 中检测到丙酮酸含量为 1.25 μmol·g-1·DCW-1,其含量约为野生型集胞藻中丙酮酸含量的1.5 倍。结果表明敲除slr1556基因阻断了丙酮酸与乳酸之间的相互转化,造成了内源性代谢物丙酮酸的积聚,增加了集胞藻中内源性丙酮酸含量。
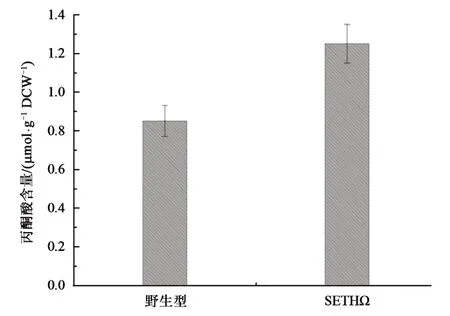
图4 不同菌株的丙酮酸含量Fig.4 The content of pyruvate in different strains
2.4 酶活性检测
如 图 5 所 示 ,SETH02 中 的 PDC(300 μmol·min-1·mg-1)、YqhD(780 μmol·min-1·mg-1)酶活性均高于 SETH01(240、690 μmol·min-1·mg-1),表明阻断丙酮酸可逆转化乳酸代谢途径,一定程度上促进了合成乙醇相关酶活性的升高。
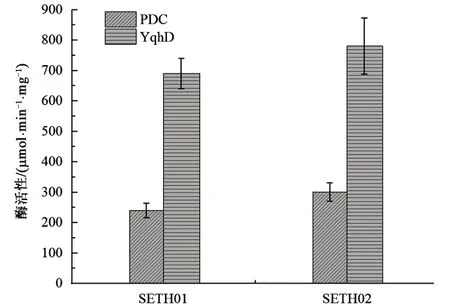
图5 不同菌株的酶活性Fig.5 The enzyme activity in different strains
2.5 菌株优化培养
为高产量的合成乙醇,对菌株SETH02 进行优化培养。优化方式为向培养体系中通入5% CO2和95%空气。在优化培养条件下,持续观察菌株SETH02 生长30 d,并记录30 d 内乙醇合成情况。如图6 所示,在优化培养的前15天,集胞藻细胞迅速增殖,在15 d 后趋于平稳,OD730达到14 左右。累积的乙醇产量在前25 天急速增加,并在 28 d(OD730≈14.6)达到最大值(1.8 g·L-1)。
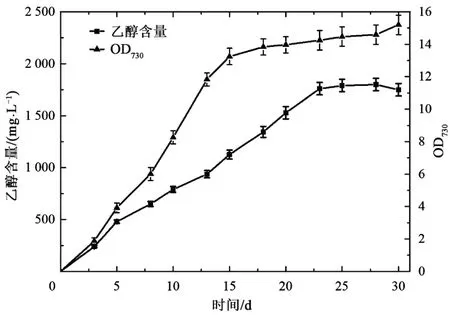
图6 SETH02的菌株生长与乙醇生产情况Fig.6 The growth condition and ethanol production in strain SETH02
3 讨论
以丙酮酸作为乙醇合成前体,丙酮酸脱羧酶与醛还原酶的组合表达被广泛应用于集胞藻乙醇合成研究中[1]。在乙醇合成关键酶的选择上,考虑到集胞藻细胞内NADPH 辅助因子含量远高于NADH,引入的醛还原酶与NADPH 相互作用,可有效促进乙醇的合成[15]。YqhD 在SETH01中的活性达到 690 μmol·min-1·mg-1,约为相同条件下丙酮酸脱羧酶活性的3倍,结果表明,yqhD基因的选择有效促进了乙醇的合成。
在集胞藻生物合成的研究中,多个启动子被应用于驱动外源乙醇合成基因的表达,如NblA[16]、PpetE[17]、PrbcL[1]等。PrbcL 作为光强启动子,其被归类为强启动子[17]。光强启动子PrbcL可以消除金属离子诱导启动子(PpetE 等)可能造成的关键酶活性降低与外源基因低表达等不利影响[18]。在选择PrbcL作为启动子的基础上,选用来源于集胞藻编码核酮糖1,5-双磷酸羧化酶/加氧酶的rbcL基因设计终止子TrbcL。PrbcL 搭配TrbcL的设计在之前的研究中被广泛应用于集胞藻的合成实验中,并显示出高表达效率[1]。
内源性代谢与目标生物合成途径之间的代谢不平衡往往限制微生物系统的合成产量。为进一步提高乙醇合成的产量,需平衡内源性代谢与生物合成途径之间相互冲突的关系而进行基因敲除[17,19]。在集胞藻PCC 6803 中内源性代谢生成的丙酮酸被大量的内源性途径消耗。中间代谢物丙酮酸的含量限制了合成乙醇的产量[20]。由藻细胞糖酵解生成的丙酮酸在内源性代谢过程中由乳酸脱氢酶可逆地转化为乳酸[21],该乳酸脱氢酶由基因slr1556编码,表明敲除slr1556基因可以有效地消除乳酸脱氢酶酶活性,从而促进乙醇合成前体丙酮酸的积累,促进乙醇的合成。本研究结果显示,敲除slr1556基因,中间代谢物丙酮酸的含量提高为原来的1.5倍,同时合成的乙醇产量提高为原来的1.3倍,表明阻断丙酮酸转化乳酸代谢途径可提高乙醇合成产量。
研究表明,100 μmol photons·m-2·s-1的光强能完全驱动PrbcL 启动子进行表达并最有利于集胞藻的生长[22]。本研究在优化培养下,设置光强为100 μmol photons·m-2·s-1持 续 照 射 ,利 用 菌 株SETH02 最后合成了约1.8 g·L-1的乙醇,与前人相比产量仍存在一定的差距[1,23]。酶活性分析表明,SETH02 中 PDC 活性为 300 μmol·min-1·mg-1,而YqhD 活性约为PDC 活性的2.5 倍。另外通过SETH02 培养基中中间产物乙醛含量的检测,发现SETH02 培养基中并无乙醛的存在,表明YqhD活性远高于PDC 活性,PDC 活性限制了乙醇的高产量合成,因此,提高PDC 酶活性,突破PDC 对乙醇合成的限制,可以有效促进乙醇的合成。未来可将质粒ETH01 转入菌株SETH02 中,以提高乙醇生物合成量。
综上所述,在集胞藻PCC6803 中敲除编码乳酸脱氢酶的slr1556基因,有效地增加了乙醇合成前体丙酮酸含量并促进PDC、YqhD酶活性从而提高了集胞藻乙醇合成的产量。另外,集胞藻PCC 6803 中竞争性丙酮酸转化乳酸代谢途径的阻断对集胞藻细胞的生长无明显影响。
