一氧化氮对甘蔗锰积累的影响
2022-02-10肖京林覃美杨曙唐新莲黎晓峰凌桂芝
肖京林 覃美 杨曙 唐新莲 黎晓峰 凌桂芝





摘 要:近年來在广西主要的甘蔗种植区出现了土壤中锰含量过高所导致的甘蔗宿根蔗幼苗黄化问题,这严重降低了甘蔗的产量和品质,制约了甘蔗产业发展。一氧化氮(NO)是植物体内介导植物响应重金属胁迫的信号分子,在缓解重金属毒害方面起着重要作用。采用水培试验方法研究了锰胁迫下NO积累与甘蔗植株锰含量及细胞壁多糖组分的关系,旨在为揭示甘蔗锰毒耐受机制提供科学依据。结果表明,锰处理后植株锰含量显著增加,并且植株中的锰主要积累在细胞壁及其果胶组分中;0.5、1.0 mmol/L锰处理24 h,后根尖中NO的积累量显著增加。在0.5 mmol/L锰溶液中添加NO供体硝普钠(SNP,0.2 mmol/L)增加植株NO积累后,根系锰含量为1215.4 mg/kg,叶片锰含量为525.5 mg/kg,相对于对照增加了37.1%,根及叶片中的锰含量、根细胞壁及其果胶组分中的锰含量均显著增加;一氧化氮清除剂(cPTIO,0.1 mmol/L)处理后,有效减少植株NO积累,并降低了根系、根系细胞壁及细胞壁果胶组分中的锰含量,根系锰含量相较于对照降低了78.2%,根系细胞壁和细胞壁果胶的锰含量相对于对照分别降低57.4%、40.6%;与此相同,硝酸还原酶抑制剂钨酸钠(0.3 mmol/L)处理抑制了硝酸还原酶(NR)活性并降低了植株NO积累,甘蔗植株、根系细胞壁及其果胶组分中的锰含量均显著下降。虽然钨酸钠处理后根系细胞壁中的半纤维素I和半纤维素II组分含量变化不显著,但细胞壁果胶组含量、果胶甲酯酶活性以及果胶去甲酯程度显著降低,从而减少了细胞壁的锰吸附。可见,锰胁迫引起甘蔗细胞积累NO,而NO通过调控细胞壁的多糖组分及果胶甲酯化程度介导植株锰积累与分布。
关键词:甘蔗;锰毒胁迫;锰积累;细胞壁;果胶;一氧化氮
中图分类号:S566.1 文献标识码:A
Mechanisms of Manganese Accumulation in Sugarcane Seedling by Nitric Oxide Signaling Pathway
XIAO Jinglin1, QIN Mei1, YANG Shu1, TANG Xinlian1, LI Xiaofeng1, LING Guizhi2*
1. Guangxi Key Laboratory for Sugarcane Biology / Co-innovation Center of Sugar Industry, Ministry of Education / College of Agriculture, Guangxi University, Nanning, Guangxi 530004, China; 2. Institute of Agriculture and Animal Husbandry Industry Development, Guangxi University, Nanning, Guangxi 530004, China.
Abstract: Sugarcane, as an important tropical crop in China, is mainly planted in subtropical acidic soil areas. In recent years, in the main sugarcane growing areas of Guangxi, the problem of the yellowing of sugarcane seedlings caused by excessive manganese in the soil has seriously reduced the yield and quality of sugarcane and restricted the development of sugarcane industry. Nitric oxide (NO) is a signal molecule that mediates plant response to heavy metal stress, and plays an important role in alleviating heavy metal toxicity. In order to explore the effect of NO on manganese stress in sugarcane, the relationship between NO accumulation and manganese content and polysaccharide components in sugarcane cell wall under manganese stress was studied by the hydroponic experiment in order to provide scientific basis for revealing the mechanism of manganese toxicity in sugarcane. The manganese content in plants increased significantly after manganese treatment, and the manganese content was mainly accumulated in cell wall and pectin components. After treatment with 0.5 and 1.0 mmol/L manganese for 24 h, the accumulation of NO in root tips significantly increased. After adding NO donor sodium nitroprusside (SNP, 0.2 mmol/L) in 0.5 mmol/L manganese solution, the accumulation of NO in plants increased, The manganese content in roots was 1215.4 mg/kg, and that in leaves was 525.5 mg/kg, which increased by 37.1% compared with the control. The manganese content in root and leaf, root cell wall and pectin components increased significantly. Nitric oxide scavenge (cPTIO, 0.1 mmol/L) could effectively remove NO accumulation in plants, and reduce root manganese content and root cell wall and pectin content. Root manganese content decreased by 78.2%, root cell wall and root cell wall pectin manganese content decreased by 57.4% and 40.6%, respectively. Similarly, nitrate reductase inhibitor sodium tungstate (0.3 mmol/L) inhibited nitrate reductase (NR) activity and reduced NO accumulation in plants, and manganese content in sugarcane, root cell wall and its pectin components decreased significantly. Although the content of hemicellulose I and hemicellulose II in the root cell wall was not significantly changed after sodium tungstate treatment, the pectin group content, pectin methyl esterase activity and the degree of methyl demethylation of pectin significantly decreased, thus reducing manganese adsorption on cell walls. It can be seen that manganese causes the accumulation of NO in sugarcane cells, and NO mediates the accumulation and distribution of manganese in sugarcane plants by regulating the polysaccharide components of cell wall and the degree of pectin methylation.
Keywords: sugarcane; stress of manganese; manganese accumulation; cell wall; pectin; nitric oxide
DOI: 10.3969/j.issn.1000-2561.2022.01.019
土壤中的锰含量过高是限制植物生长的主要因素[1]。植物吸收积累过多的锰后会出现叶片黄化、皱缩,根尖和茎尖末端出现坏死等症状,并导致植物生长受阻甚至枯死[2]。根系作为植株吸收和积累锰的主要部位,根系细胞壁是植物抵御锰毒害的第一道屏障。细胞壁中的果胶等多糖组分,因含带负电荷的羧基、羟基、氨基等基团而有很强的重金属阳离子结合能力[3]。
一氧化氮(NO)是植物体内介导植物响应重金属胁迫的信号分子,参与锰、镉、铜等重金属的毒害反应[4-5]。一氧化氮合酶(NOS)途径和硝酸还原酶(NR)途径是植物体内2条NO合成的主要途径[6-7],抑制NO合成会抑制植物对重金属离子的吸收。一氧化氮合成酶抑制剂L-NAME 和NO清除剂cPTIO能有效抑制烟草细胞吸收Cd[8],而外源添加NO能够增加番茄幼苗根系、茎中Mn 含量[5]。NO也能够上调拟南芥根系IRT1基因的表达从而增加镉的吸收[9]。NO还能够改变细胞壁组分从而调节细胞壁对重金属离子的吸附[10]。因此NO在调控植株对金属离子吸收积累和影响细胞壁组分以及性质的过程中起着重要的作用。
甘蔗作为我国重要的热带作物,主要种植在亚热带酸性土壤地区。然而随着锰矿的开发,更多的锰进入土壤中导致土壤的锰含量严重超标[11],近年来在广西主要的甘蔗种植区出现了土壤中锰过多所导致的宿根蔗幼苗黄化问题,这严重降低了甘蔗的产量和品质[12-14],因此锰毒是酸性土壤中制约甘蔗产业发展的关键科学问题。 NO作为植株的一种信号分子,在缓解重金属毒害方面起着重要作用。近年来,NO响应植株镉、铝、铜等金属胁迫的相关机制已经被越来越多植物营养学和植物生理学领域的研究团队所关注,人们提出了一些相关解毒机制的假设,这为缓解酸性土壤上甘蔗锰毒黄化提供了一种新思路,然而NO调控植株重金属积累的全部生理机制至今仍未被完全阐明,关于NO在甘蔗锰胁迫方面的研究更是未见报道。本文探究了NO对甘蔗锰胁迫的响应机制以及NO对甘蔗锰积累的影响,旨在揭示锰胁迫与甘蔗锰积累的相关机制,为进一步研究甘蔗锰毒黄化的抗性机制奠定基础。
1 材料与方法
1.1 材料
供试甘蔗品种为‘桂糖32’,参照武欣等[15]的方法在温室中育苗和培育。
1.2 方法
1.2.1 甘蔗幼苗的锰含量 为探究锰处理对甘蔗幼苗锰含量影响,挑选长势一致(下同)15 d苗龄的幼苗,在含MnCl2(0、0.5 mmol/L)的1/5霍格兰溶液中培养。培养8、12 d后采集根系及新叶(+1叶以上的叶)样品,并提取根系细胞壁、分离出其果胶组分,测定锰含量。
1.2.2 锰胁迫对内源NO积累的影响 为探究锰处理对甘蔗幼苗内源NO积累的影响,选取3 d苗龄的幼苗转移至分别含不同浓度的MnCl2(0、0.5、1.0 mmol/L)的1/5霍格兰营养液中培养24 h后剪取根尖0.5 cm,进行NO的原位测定,设置5个重复,用PBS清洗去表面吸附的处理液,然后与100 μL的DAF-FM DA(NO荧光探针,10 μmol)在200 μL的PCR管中混合,黑暗条件下(37℃)孵育30 min后用PBS(pH 7.4)清洗3次,每次5 min。标记后的根尖用荧光显微镜观测,荧光在波长为500 nm的光下激发,产生绿色荧光(515 nm)。
1.2.3 一氧化氮積累对甘蔗锰含量的影响 为探究NO供体硝普钠(SNP)对甘蔗幼苗内源NO积累及对甘蔗幼苗锰含量的影响,选取3 d苗龄的幼苗分别转移至添加SNP(0.2 mmol/L)或缺少SNP的含0.5 mmol/L MnCl2的1/5霍格兰营养液中培养24 h后,剪取根尖0.5 cm进行NO原位测定,设置5个重复,方法同1.2.2。
将15 d苗龄的幼苗分别移至添加SNP(0.2 mmol/L)或缺少SNP的含0.5 mmol/L MnCl2的1/5霍格兰营养液中培养8 d后采集根系及新叶样品,提取根系细胞壁,并分离出根系细胞壁的果胶组分,采用以下方法测定锰含量。
1.2.4 抑制NO积累对锰含量的影响 为探究NO清除剂(cPTIO)对甘蔗幼苗内源NO积累及对甘蔗幼苗锰含量的影响,取3 d苗龄的幼苗分别转移至添加cPTIO(0.1 mmol/L)或缺少cPTIO的含0.5 mmol/L MnCl2的1/5霍格兰营养液中培养24 h后,剪取根尖0.5 cm进行NO原位测定,设置5个重复,方法同上。
将15 d苗龄的幼苗分别转移至添加cPTIO(0.1 mmol/L)或缺少cPTIO的含0.5 mmol/L MnCl2的1/5霍格兰营养液中培养8 d采集植株根系样品,提取根系细胞壁,并分离出根系细胞壁的果胶组分,采用以下方法测定锰含量。上述处理均设3次重复。
为探究NO合成抑制剂钨酸钠对甘蔗幼苗内源NO积累及对甘蔗幼苗锰含量的影响,取3 d苗龄的幼苗分别移至添加钨酸钠(0.3 mmol/L)或缺少钨酸钠的含0.5 mmol/L MnCl2的1/5霍格兰营养液中培养24 h后,剪取根尖0.5 cm进行NO原位测定,设置5个重复,方法同上。选取同批次的幼苗剪取根尖0.5 cm,称取0.5 g根尖用于测定硝酸还原酶(NR)活性。
将15 d苗龄的幼苗分别移至添加钨酸钠(0.3 mmol/L)或缺少钨酸钠的含0.5 mmol/L MnCl2的1/5霍格兰营养液中培养8 d采集植株根系及新叶样品,称取根系样品0.5 g用于根系甲酯酶活性(PME)的测定,提取植株根系细胞壁、并分离出根系细胞壁的果胶,采用以下方法测定锰含量。分离半纤维素组分,测定细胞壁多糖含量以及甲酯化程度。
1.2.5 检测指标与方法 参考朱晓芳[16]的方法进行NO的原位测定。硝酸还原酶活性测定采用Solarbio公司的硝酸还原酶测定试剂盒(BC0080),规格为50T/48S,检测方法为紫外分光光度法。细胞壁及其多糖组分的提取、分离、果胶甲酯酶活性、果胶甲酯化程度测定均参照Yang等[17]的方法。锰含量的测定参照标准GB 5009.242—2017方法。
1.3 数据处理
采用Excel软件以Duncan’s新复极差法进行差异显著性分析,荧光显微镜拍摄的NO绿色荧光强度使用Photoshop CS5软件处理。
2 结果与分析
2.1 甘蔗幼苗的锰含量
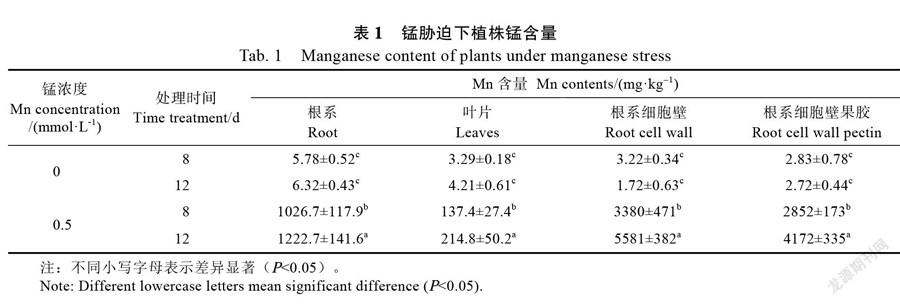
植物吸收过多的锰,就会出现锰中毒现象[18]。在培养液中添加MnCl2后,甘蔗幼苗中的锰含量显著增加(表1)。0.5 mmol/L MnCl2处理8、12 d后,甘蔗幼苗叶片的锰含量分别为137.4、214.8 mg/kg,而根系中的锰含量分别达到1222.7、1026.7 mg/kg,根系中的锰含量为叶片的5.7倍。根细胞壁的锰含量以及果胶锰的积累量也随着处理时间的延长而显著增加,0.5 mmol/L MnCl2处理8、12 d后,根系细胞壁的锰含量分别为3380、5581 mg/kg,根系细胞壁中果胶组分的锰含量分别为2852、4172 mg/kg。可见,锰胁迫下,甘蔗幼苗根系对Mn有较强的截留能力,且随处理时间增加,根系细胞壁中的果胶组分锰含量也显著增加。
2.2 锰胁迫对内源NO积累的影响
在不同浓度MnCl2溶液中培养24 h后,甘蔗幼苗根尖的NO积累见图1。0.5、1.0 mmol/L MnCl2处理后,根尖绿色荧光强度明显增强。绿色荧光主要集中在根尖分生区。通过对根尖分生区荧光强度的半定量分析结果显示,锰处理后根尖的相对荧光强度要显著高于CK。0.5、1.0 mmol/L MnCl2处理后相对荧光强度分别是CK处理的1.3、1.5倍。以上结果说明,锰毒胁迫会诱导根尖NO的积累。
2.3 一氧化氮积累对锰含量的影响
2.3.1 一氧化氮供体对根尖NO积累的影响 在0.5 mmol/L MnCl2溶液中添加0.2 mmol/L硝普钠(SNP)处理24 h后,甘蔗幼苗根尖的NO积累见图2。SNP能使得根尖积累更多的NO。SNP处理后使根尖NO的荧光强度与对照相比增加20%。以上结果说明,锰胁迫下,添加SNP能使甘蔗幼苗根尖的内源NO积累增加。
2.3.2 一氧化氮供体对甘蔗幼苗锰含量的影响 在含0.5 mmol/L MnCl2溶液中培养中添加0.2 mmol/L SNP处理8 d后,甘蔗幼苗的根系和叶片锰含量见表2。添加SNP能显著增加甘蔗幼苗根系和叶片的锰含量。SNP处理后根系锰含量为1215.4 mg/kg,与此相似的叶片锰含量为525.5 mg/kg,相对于对照增加了37.1%。以上结果说明,SNP能够增加植株锰含量。
SNP能显著增加根细胞壁锰含量,SNP处理8 d后,根系细胞壁锰含量为15.5 mg/g,相较于对照提高了21.2%。SNP也能显著增加根系细胞壁中果胶组分锰的含量,SNP处理8 d后果胶的锰含量为3.56 mg/g,相较于对照提高了21.4%。以上结果说明,SNP能够增加根系细胞壁和果胶的锰含量。
2.4 抑制NO积累对锰含量的影响
2.4.1 一氧化氮清除剂对根尖NO积累的影響 在0.5 mmol/L MnCl2溶液中添加0.1 mmol/L cPTIO处理24 h后,根尖的NO积累见图3。cPTIO能显著降低根尖NO积累,根尖荧光强度相较于对照降低了41%。以上结果说明,cPTIO能显著降低锰胁迫下根尖NO积累。
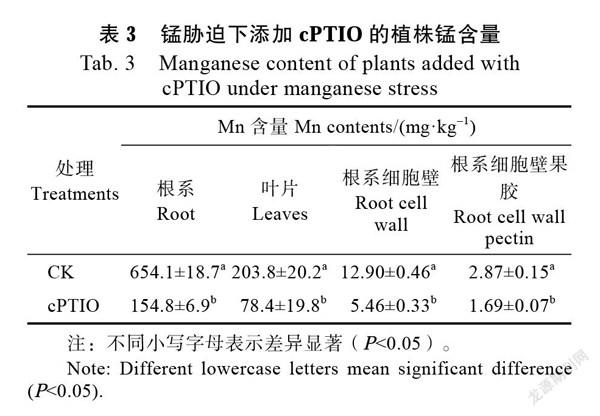
2.4.2 一氧化氮清除剂对甘蔗幼苗锰含量的影响 在0.5 mmol/L MnCl2溶液中添加0.1 mmol/L cPTIO处理8 d后,甘蔗幼苗的根系、叶片锰含量和根系细胞壁锰含量见表3。cPTIO能显著降低根系的锰含量,相较于对照根系锰含量分别降低了78.2%,与此相似的是cPTIO也能显著降低根细胞壁和根系细胞壁果胶的锰含量,根系细胞壁锰含量相对于对照降低57.4%,果胶锰含量降低了40.6%。以上结果说明,减少NO积累能显著降低根系细胞壁和细胞壁中果胶组分的锰含量。
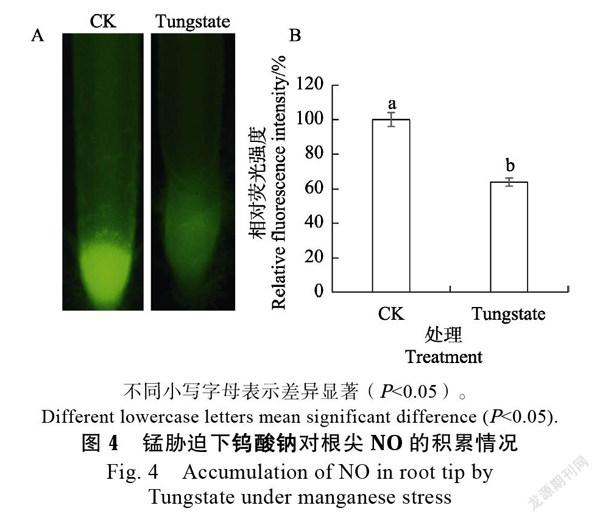
2.4.3 一氧化氮合成抑制剂对根尖NO积累影响 在含0.5 mmol/L MnCl2溶液中添加0.3 mmol/L 一氧化氮合成抑制剂钨酸钠处理24 h后,甘蔗幼苗根尖NO积累见图4。添加钨酸钠能够使得根尖NO积累显著降低,其荧光强度相较于CK降低了36%。以上结果说明了锰胁迫下,添加钨酸钠能够显著减少根尖NO的积累。
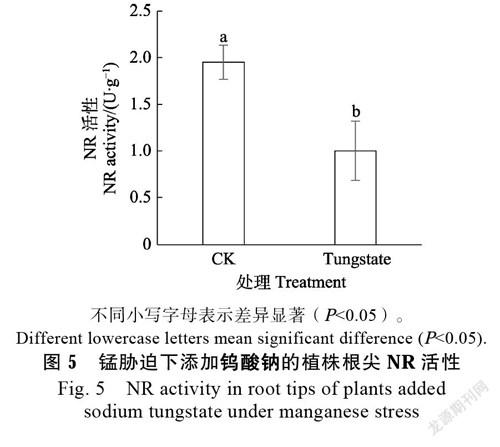
在含0.5 mmol/L MnCl2溶液中添加0.3 mmol/L 钨酸钠处理24 h后,根尖的硝酸还原酶活性见图5。添加钨酸钠能够显著降低了硝酸还原酶活性,相较于对照降低了48.6%。可见,钨酸钠能够显著降低锰胁迫下的甘蔗幼苗根尖的硝酸还原酶活性,从而减少NO的积累。
2.4.4 一氧化氮合成抑制剂对甘蔗幼苗锰含量的影响 在含0.5 mmol/L MnCl2溶液中添加0.3 mmol/L一氧化氮合成抑制剂钨酸钠培养8 d,甘蔗幼苗锰含量见表4。钨酸钠处理能显著降低甘蔗幼苗根系和叶片锰含量,钨酸钠处理的根系锰含量为458.6 mg/kg,相较于对照,锰含量降低了62.4%。与此相似,钨酸钠处理的叶片的锰含量为101.7 mg/kg,相较于对照分别降低了52.6%。可见,抑制NO合成能够显著降低根系和叶片的锰含量。
錳胁迫下,添加钨酸钠也能显著降低根系细胞壁的锰含量,钨酸钠处理8 d后根系细胞壁锰含量为2.9 mg/g,相较于对照降低了70.1%。与此相似钨酸钠处理会显著降低果胶的锰含量,相对于对照降低了61.6%。以上结果说明,抑制NO合成能显著降低根系细胞壁和果胶的锰含量。
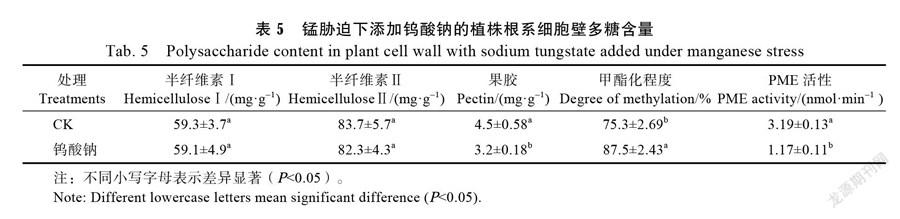
2.4.5 一氧化氮合成抑制剂对细胞壁多糖组分含量及甲酯酶活性的影响 在0.5 mmol/L MnCl2溶液中添加0.3 mmol/L一氧化氮合成抑制剂钨酸钠处理8 d后,细胞壁多糖组分含量见表5。钨酸钠处理后根系细胞壁的半纤维Ⅰ和半纤维素Ⅱ组分含量均无显著影响,且随着处理时间的延长,差异依然不显著。半纤维Ⅰ多糖含量为59.1 mg/g,半纤维素Ⅱ多糖含量为82.3 mg/g。可见,抑制一氧化氮的合成对根系细胞壁半纤维含量的影响不
显著。
钨酸钠处理会显著降低果胶的含量。处理8 d后,果胶含量为3.2 mg/g,相对于对照降低了29.2%。可见,抑制NO的合成能够显著降低细胞壁的果胶含量。添加钨酸钠能显著增加果胶甲酯化程度,处理8 d后果胶甲酯化程度为87.5%显著高于对照的甲酯化程度75.3%。以上结果说明,抑制一氧化氮合成会显著降低果胶含量和增加果胶甲酯化程度。
钨酸钠显著降低甲酯酶活性,在含0.5 mmol/L MnCl2溶液中添加0.3 mmol/L 钨酸钠处理8 d后,根系的果胶甲酯酶活性相较于对照降低了57.3%。可见抑制NO的合成能降低PME的活性。
3 讨论
与传统观点认为的细胞壁对重金属离子区隔化固定,减少金属离子向细胞内的运输,减轻重金属毒害[19]相反的是,细胞壁作为细胞重要组成成分,细胞壁积累过量金属离子也会造成重金属毒害。对铝毒的研究发现,植物细胞壁吸附过量的铝离子是造成铝毒胁迫的重要原因[20]。本研究发现锰胁迫下,植株的锰含量显著增加,而根系和叶片中细胞壁作为植株主要积累锰的部位,超过70%的锰储存在细胞壁的果胶组分中。
重金属胁迫会诱导植株内源的NO水平发生改变[4, 21]。NO含量的变化与植株的种类、重金属的浓度有关[22]。如50 μmol/L的Al处理的大豆,根尖NO含量增加[6]。与此相反是水稻幼苗在镉胁迫24 h后,其根冠内NO含量显著降低,进一步研究发现,镉胁迫导致植物叶片缺钙,从而降低NOS酶的活性,导致NO的合成受到抑制[23]。本研究发现0.5、1 mmol/L MnCl2处理1 d后,甘蔗根尖的NO水平显著提高,NO主要积累在根尖的分生区。由此可见,锰胁迫会诱导甘蔗内源NO的积累。
NO积累与植物对重金属的吸收积累的关系并不是固定的,它也与NO含量、植株的种类、重金属的浓度有关。对苜蓿的研究发现,外源NO的添加能够显著抑制植株对镉的吸收[24]。与此相反,镉胁迫下添加0.1 mmol/L SNP,水稻根系和茎中的镉含量分别增加30%和20%,而叶片的镉含量降低[25]。在本研究中,锰胁迫下SNP能增加植株锰的含量。SNP处理也能增加根细胞壁和果胶组分的锰含量。由此可见,NO的积累会促进甘蔗幼苗Mn的积累。
抑制NO积累能够调控植株对金属离子的吸收和积累。如镉胁迫会诱导烟草悬浮细胞积累NO,而NOS的抑制剂L-NAME和NO清除剂c- PTIO能显著降低烟草细胞对Cd的吸收,并降低烟草悬浮细胞凋亡数量[8]。在本研究中,锰胁迫下,NO清除剂cPTIO能通过清除根尖NO积累从而降低根系锰含量以及根系细胞壁和果胶的锰含量。与此相似,NO合成抑制剂钨酸钠能抑制NR活性并降低植株NO积累后植株根系和叶片锰含量、根细胞壁及其果胶组分中锰含量均显著下降。由此推测,硝酸还原酶途径是甘蔗根尖合成NO的重要途径,通过添加NO合成抑制剂钨酸钠和NO清除剂cPTIO都能够有效减少细胞中NO积累从而抑制甘蔗对锰吸收和细胞壁锰的积累。可见,锰胁迫下,通过降低NO积累,能够显著减少甘蔗对锰的吸收和细胞壁对锰的积累,从而起到缓解锰毒胁迫的作用。
NO能够调节植物细胞壁多糖组分的代谢。对水稻镉毒害的研究发现,镉胁迫下水稻根系纤维素含量会降低,而果胶和半纤维素含量会增加,提高植株的NO水平,能够增加细胞壁果胶和半纤维素的含量,增强细胞壁对镉的吸附能力,使得更多镉被细胞壁所积累[26]。因此NO能够调控细胞壁多糖组分的改变,最终调控细胞壁与重金属离子的结合能力。前人研究发现,甘蔗细胞壁果胶因富含游离的羟基和羧基是结合锰离子的主要多糖组分[17]。利用果胶酶对芹菜根细胞壁镉根细胞壁改性处理后,细胞壁的果胶质含量会降低,细胞壁对镉的吸附能力也降低了40.5%[27]。以石竹为材料的研究发现,根细胞壁的果胶甲酯化程度越高,细胞壁结合的铜的含量越低[19]。这些结果说明,细胞壁果胶积累与甲酯化修饰可能与植株适应重金属胁迫环境密切相关。在本研究中,锰胁迫下,添加钨酸钠对根细胞壁半纤维的含量并无影响,却降低果胶组分含量及其锰含量,本研究还发现NO调控的果胶含量减少及果胶甲酯化程度增加与果胶锰含量减少有关,NO调控PME的活性降低进而使得果胶甲酯化程度增加,减少细胞壁游离的羧基、羟基含量,调控细胞壁带电性,降低细胞壁果胶对锰的吸附能力,并最终减少细胞壁锰的积累。可见,锰胁迫下,降低NO的积累能够降低果胶的积累并增加细胞壁的甲酯化,从而减少细胞壁的锰吸附。
综上所述,锰引起甘蔗细胞积累NO,而NO通过调控细胞壁的多糖组分及果胶甲酯化程度介导植株锰积累与分布。
参考文献
[1] SIKORA F J, MCBRIDE M B. Comments on “A possible mechanism for manganese phytotoxicity in Hawaii soils amended with a low-manganese sewage sludge”[J]. Journal of Environmental Quality, 1989, 18(2): 249.
[2] HORIGNCHI T. Mechanism of manganese toxicity and tolerance of plants[J]. Soil Science and Plant Nutrition, 1987, 33(4): 595-606.
[3] WEBER M, DEINLEIN U, FISCHER S, CLEMENS S. A mutation in the Arabidopsis thaliana cell wall biosynthesis gene pectin methylesterase 3 as well as its aberrant expression cause hypersensitivity specifically to Zn[J]. Plant Journal, 2013, 76(1): 151-164.
[4] SUN C, LIU L, LU L, LIN X. Nitric oxide acts downstream of hydrogen peroxide in regulating aluminum-induced antioxidant defense that enhances aluminum resistance in wheat seedlings[J]. Environmental and Experimental Botany, 2018, 145: 95-103.
[5] 张 敏,梁国鹏,姜春辉. 外源一氧化氮介导铜胁迫下番茄幼苗中铁、锌、锰的累积及亚细胞分布[J]. 植物营养与肥料学报, 2014, 20(3): 670-680.
ZHANG M, LIANG G P, JIANG C H. Accumulation and subcellular distribution of iron, zinc and manganese in tomato seedlings under copper stress mediated by exogenous nitric oxide [J]. Plant Nutrition and Fertilizer Science, 2014, 20(3): 670-680. (in Chinese)
[6] WANG Y S,YU Z M. Nitric oxide reduces aluminum toxicity by preventing oxidative stress in the roots of Cassia tora L.[J]. Plant & Cell Physiology, 2005(12): 1915-1923.
[7] CHRISTINE S, ULLRICH W R. Generation and possible roles of NO in plant roots and their apoplastic space[J]. Journal of Experimental Botany, 2002(379): 2293-2303.
[8] MA W, XU W, XU H, CHEN Y, He Z, Mi M. Nitric oxide modulates cadmium influx during cadmium-induced programmed cell death in tobacco BY-2 cells[J]. Planta, 2010, 232(2): 325-335.
[9] BESSON-BARD A, GRAVOTA, RICHAUD P, AUROY P, DUC C, GAYMARD F, TACONNAT L, RENOU JP, PUGIN A, WENDEHENNE D. Nitric oxide contributes to cadmium toxicity in Arabidopsis by promoting cadmium accumulation in roots and by up-regulating genes related to iron uptake[J]. Plant Physiology, 2009, 149(3): 1302-1315.
[10] CORREA-ARAGUNDE N, LOMBARDO C, LAMATTINA L. Nitric oxide: an active nitrogen molecule that modulates cellulose synthesis in tomato roots[J]. New Phytologist, 2008, 179(2): 386-396.
[11] 许丹丹, 李金城, 阙光龙, 吴 蕾, 陈小玲. 酸性土壤锰毒及其防治方法[J]. 环境科学与技术, 2010, 33(S2): 472-475.
XU D D, LI J C, QUE G L, WU L, CHEN X L. Manganese toxicity in acidic soil and its control methods[J]. Environmental Science & Technology, 2010, 33(S2): 472-475. (in Chinese)
[12] 于 華,陈杨明珠,黎晓峰. 氮素形态对甘蔗锰毒黄化的影响[J]. 西南农业学报, 2018, 31(9): 1821-1824.
YU H, CHEN Y M Z, LI X F. Effects of nitrogen forms on manganese toxicity in sugarcane [J]. Southwest China Journal of Agricultural Sciences, 2018, 31(9): 1821-1824. (in Chinese)
[13] 吴 星. 锰诱导甘蔗幼苗黄化及成因分析[D]. 南宁: 广西大学, 2013.
WU X. Etiolation of sugarcane seedlings induced by manganese and its genetic analysis[D]. Nanning: Guangxi University, 2013. (in Chinese)
[14] 凌桂芝,蒋雄英,杨 曙. 硅对甘蔗锰毒的缓解作用研究[J]. 西南农业学报, 2016, 29(7): 1639-1643.
LING G Z, JIANG X Y, YANG S. Study on the mitigation effect of silicon on manganese toxicity in sugarcane[J]. Southwest China Journal of Agricultural Sciences, 2016, 29(7): 1639-1643. (in Chinese)
[15] 武 欣,陈杨明珠,凌桂芝. 生长素萘乙酸对甘蔗锰毒的调控[J]. 广东农业科学, 2018, 45(5): 14-18.
WU X, CHEN Y M Z, LING G Z. Regulation of manganese toxicity in sugarcane by auxin naphthalene acetic acid[J]. Guangdong Agricultural Sciences, 2018, 45(5): 14-18. (in Chinese)
[16] 朱晓芳. 拟南芥细胞壁半纤维素结合铝的机制及其调控[D]. 杭州: 浙江大学, 2014.
ZHU X F. Mechanism and regulation of cell wall hemicelluloses bindingaluminum in Arabidopsis thaliana[D]. Hangzhou: Zhejiang University, 2014. (in Chinese)
[17] YANG S, YI K, CHANG M M, ZHAO Z K, LI X F. Sequestration of Mn into the cell wall contributes to Mn tolerance in sugarcane (Saccharum officinarum L.)[J]. Plant and Soil. 2019, 436(1-2): 475-487.
[18] 王晓霞, 陈杨明珠, 覃 美, 肖京林, 黎晓峰. 氮源对甘蔗锰毒的效应研究[J]. 广东农业科学, 2020, 47(8): 1-6.
WANG X X, CHEN Y M Z, QIN M, XIAO J L, LI X F. Effects of nitrogen sources on manganese toxicity in sugarcane[J]. Guangdong Agricultural Sciences, 2020, 47(8): 1-6. (in Chinese)
[19] COLZI I, DOUMETT S, DEL M, FORMAINI J, AMETOLI M, GABBRIELLI R, GONNELLI C. On the role of the cell wall in the phenomenon of copper tolerance in Silene paradoxa L.[J]. Environmental and Experimental Botany, 2011, 72(1): 77-83.
[20] 孙雅慧. 锰毒害对拟南芥主根生长影响的生理与分子机制初探[D]. 西宁: 青海师范大学, 2016.
SUN Y H. Physiological and molecular mechanism of manganese toxicity on taproot growth of Arabidopsis thaliana[D]. Xining: Qinghai Normal University, 2016. (in Chinese)
[21] 关美艳. 一氧化氮清除系统在拟南芥应答镉胁迫过程中的作用及其机制[D]. 杭州: 浙江大学, 2018.
GUAN M Y. Role and mechanism of nitric oxide scavenging system in response to cadmium stress in Arabidopsis thaliana[D]. Hangzhou: Zhejiang University, 2018. (in Chinese)
[22] STOHR C. Generation and possible roles of NO in plant roots and their apoplastic space[J]. Journal of Experimental Botany, 2002, 53(379): 2293-2303
[23] GLENGL S A, KREC A, OKUTAN T. The relationship between nitric oxide and cadmium toxicity in wheat (Triticum aestivum L.) seedlings[J]. Bitlis Eren University Journal of Science and Technology, 2020, 10(2): 62-66.
[24] XU J, WANG W, YIN H, LIU H, HONG S, MI Q. Exogenous nitric oxide improves antioxidative capacity and reduces auxin degradation in roots of Medicago truncatula seedlings under cadmium stress[J]. Plant and Soil, 2010, 326: 321.
[25] 熊 杰. 一氧化氮缓解水稻镉毒害的作用及其生理机制[D]. 杭州: 浙江大学, 2009.
XIONG J. Effect of nitric oxide on alleviating cadmium toxicity in rice and its physiological mechanism[D]. Hangzhou: Zhejiang University, 2009. (in Chinese)
[26] XIONG J, AN L, Lu H. Exogenous nitric oxide enhances cadmium tolerance of rice by increasing pectin and hemicellulose contents in root cell wall[J]. Planta, 2009, 230(4): 755-765.
[27] 徐 劼, 保積庆. 芹菜根细胞壁对镉的吸附固定机制及其FTIR表征研究[J]. 环境科学学报, 2015, 35(8): 2605-2612.
XU J, BAO J Q. Adsorption and fixation mechanism of cadmium on celery (Apium graveolens L.) root cell wall and the analysis of FTIR[J]. Chinese Journal of Environmental Science, 2015, 35(8): 2605-2612. (in Chinese)
