韭菜根系分泌物对苦瓜枯萎病菌的化感作用
2022-02-10谢一琪牛玉刘子记于仁波韩旭
谢一琪 牛玉 刘子记 于仁波 韩旭




摘 要:為探究韭菜根系分泌物对苦瓜枯萎病菌的化感作用,本研究以‘山东雪韭6号’韭菜和苦瓜枯萎病菌为试验材料,水培法收集韭菜根系分泌物,采用菌丝生长速率和孢子萌发法研究韭菜根系分泌物对苦瓜枯萎病菌的化感作用;利用气相色谱-质谱联用技术(GC-MS)鉴定根系分泌物组成成分,筛选可能的主效化感物质,进一步通过体外抑菌试验验证其化感作用,明确主效化感物质。结果表明,随着韭菜根系分泌物浓度的升高,苦瓜枯萎病菌的菌落直径和孢子萌发数均呈先降后升的趋势,当分泌物浓度为3.22 mg/mL时,抑制作用最大,满足化感作用低浓度促进、高浓度抑制的特性。通过GC-MS鉴定出韭菜根系分泌物中的主要成分为酚类、酯类、烷烃类、醇类、烯类、芳香类,可能的化感物质为邻苯二甲酸二丁酯、2,4-二叔丁基苯酚、2,2-亚甲基双-(4-甲基-6-叔丁基苯酚)。通过体外抑菌试验证实这3种物质对苦瓜枯萎病菌菌丝生长和孢子萌发都有不同程度的化感抑制作用,且抑菌效果为2,4-二叔丁基苯酚>邻苯二甲酸二丁酯>2,2-亚甲基双-(4-甲基-6-叔丁基苯酚),明确其为化感物质。由此可知,韭菜根系分泌的主效化感物质对苦瓜枯萎病菌有显著的化感抑制作用,这为苦瓜间套轮作韭菜防控苦瓜枯萎病和研制植物源抑菌剂提供了理论依据和技术支撑。
关键词:韭菜根系分泌物;苦瓜枯萎病;尖孢镰刀菌;化感作用;化感物质
中图分类号:S642.5 文献标识码:A
Allelopathy of Chinese Chives Root Exudates on Fusarium Wilt of Bitter Gourd
XIE Yiqi1,2, NIU Yu2, LIU Ziji2, YU Renbo2, HAN Xu2*
1. College of Horticulture, Hainan University, Haikou, Hainan 570228, China; 2. Tropical Crops Genetic Resources Institute, Chinese Academy of Tropical Agricultural Sciences, Haikou, Hainan 571101, China
Abstract: Fusarium wilt of bitter gourd is a soil-borne disease caused by Fusarium oxysporum f. sp. momodicae, which seriously harms the yield and quality of bitter gourd. In traditional production, chemical pesticides mostly used to prevent and control Fusarium wilt of bitter gourd, but there are potential risks of environmental pollution and ecological damage. Although the method of grafting and replacing roots is also used in the production to control Fusarium wilt of bitter gourd, lack of high-resistance rootstock resources and high production costs have led to poor control effects and difficult to achieve. Therefore, there is an urgent need for an eco-environmental, green and effective method to prevent and control Fusarium wilt of bitter gourd. The cultivation patterns of intercropping relay intercropping and crop rotation are one of the effective methods to reduce soil-borne diseases. Bulb vegetable (Allium), such as garlic, green garlic, and onions, are recognized as good previous crops, and the root exudates can effectively reduce the occurrence of soil-borne diseases by improving the soil micro-ecological environment, thereby alleviating continuous cropping obstacles. Studies have shown that the volatile and extract components of Chinese chives have the potential to resist fungal diseases. However, there are few studies on the Chinese chive root exudates, especially the allelopathy of Chinese chive root exudates on regulating resistance to Fusarium wilt of bitter gourd has not been reported. In order to explore the allelopathy of Chinese chive root exudates on Fusarium oxysporum f. sp. momdicae, the study used Chinese chive variety ‘Shandong Xuejiu No. 6’ and Fusarium oxysporum f. sp. momdicae as test materials, and Chinese chive root exudates were collected by hydroponics. The methods of mycelia growth rate and spore germination were used to study the allelopathy of Chinese chive root exudates on Fusarium oxysporum f. sp. momodicae. The components of root exudates were identified by gas chromatography-mass spectrometry (GC-MS). According to the identification results of GC-MS, the possible main allelochemicals of root exudates were screened, and the allelopathy were further verified by in vitro antifungal test, then the main antifungal allelochemicals were clarified. With the increase of the concentration of Chinese chive root exudates, both the colony diameter and the number of spore germinations showed a trend of decreasing first and then increasing. When the concentration of Chinese chive root exudates was 3.22 mg/mL, the maximum inhibitory effect was achieved, the mycelia growth inhibition rate was 21.6%, and the spore germination inhibition rate was as high as 36.8%. This result satisfies the characteristics of the allelopathy which could promote antifungal effect at low concentration and inhibit antifungal effect at high concentration. The results of GC-MS indicated that the main components of Chinese chive root exudates were identified as phenols, esters, alkanes, alcohols, alkenes, and aromatics. According to the results of GC-MS identification and previous studies, the possible allelochemicals were dibutyl phthalate, 2,4-di-tert-butylphenol, 2,2-methylenebis-(4-methyl 6-tert-butylphenol). The in vitro antifungal test confirmed that the three substances had varying degrees of allelopathic inhibition effects on the mycelia growth and spore germination of F. oxysporum f. sp. momodicae, and its antifungal effect was determined to be 2,4-di-tert-butylphenol>dibutyl phthalate> 2,2-methylenebis-(4-methyl-6-tert-butyl phenol). Among them, the inhibitory effect of 2,4-di-tert-butylphenol on the mycelia growth and spore germination of Fusarium oxysporum f. sp. momdicae increased with the increase of concentration. The effect of dibutyl phthalate and 2,2-methylenebis-(4-methyl-6-tert-butylphenol) at different concentrations on the mycelia growth and spore germination of F. oxysporum f. sp. momdicae showed the allelopathic effect of promoting at low concentration and inhibiting at high concentration. 2,4-Di-tert-butylphenol had the best antifungal activity among them. When its concentration was 0.1 mmol/L, the inhibition rate of colony diameter reached 82.93%, and the inhibition rate of spore germination reached 77.59%. Both dibutyl phthalate and 2,2-methylenebis-(4-methyl-6-tert- butylphenol) reached the highest allelopathic inhibitory effect on F. oxysporum f. sp. momodicae at a concentration of 0.5 mmol/L. It can be seen that the main effect allelochemicals exudated by Chinese chive roots have a significant allelopathic inhibitory effect on F. oxysporum f. sp. momdicae. It is expected to provide theoretical basis and technology support for the study of prevention and control of Fusarium wilt of bitter gourd by using Chinese chives intercropping, relay intercropping and rotation with bitter gourd and development of plant-derived antifungal agents.
Keywords: Chinese chive root exudates; Fusarium wilt of bitter gourd; Fusarium oxysporum f. sp. momdicae; allelopathy; allelochemicals
DOI: 10.3969/j.issn.1000-2561.2022.01.022
苦瓜(Momordica charantia L.)属葫芦科苦瓜属一年蔓生草本植物,又名凉瓜,起源于东印度,现热带、亚热带和温带区域为主栽地区,加勒比海和南美地区也有栽培[1]。与一些常见的蔬菜相比,苦瓜的营养成分含量更高,富含多种维生素、矿物质及纤维素[2-3]。苦瓜枯萎病是由尖孢镰刀菌苦瓜专化型(Fusarium oxysporum f. sp. momodicae)引起的一种严重危害苦瓜产量和品质的土传病害[4],任何时期均可发病,严重时导致整株死亡[5]。传统生产上多采用化学农药防治苦瓜枯萎病的发生,但普遍存在污染环境和破坏生态的潜在风险;虽然生产中也选用嫁接换根的方式防治苦瓜枯萎病,但高抗砧木资源的匮乏和较高的生产成本导致防效欠佳且难以实现。因此急需一种生态环保、绿色有效的方法来防控苦瓜枯萎病的发生。
化感作用这一概念是由奥地利科学家MOLISCH在1937年首次提出,主要是指植物之间相互作用的化学关系[6]。现被定义为一种植物通过向环境释放化感物质而对另外一种植物(或微生物)所产生的直接或间接的有害或有益的作用[7]。化感作用是植物通过向环境释放化感物质而实现的,化感物质主要通过雨雾淋溶、自然挥发、根系分泌、植株分解4种途径释放到环境中。植物根系分泌的化感物质对防治土壤线虫、土传真菌病害都具有重要作用[8-9]。间套轮作模式是减轻土传病害的有效方法之一,寄主植物的根系分泌物能够刺激尖孢镰刀菌孢子萌发,因此与非寄主植物轮作能够抑制寄主植物枯萎病的发生[5]。葱蒜类作物是良好的前茬作物,也是公认的化感作物,已广泛应用到间套轮作的栽培模式中。大蒜、蒜苗、洋葱等葱蒜类蔬菜作物的根系分泌物通过改善土壤微生态环境,能够有效减少土传病害的发生,从而缓解连作障碍[10-12]。
植物源杀菌剂对环境和人类健康的危害较小,长期以来被认为是化学杀菌剂的理想替代品。韭菜(Allium tuberosum L.)也是主要的葱蒜类蔬菜作物。韭菜提取物对多种植物致病菌的生长均有显著的抑制作用,如甘蓝枯萎病菌[13]、香蕉枯萎病菌[14]、苹果轮纹病菌[15]、棉花黄萎病菌[16]、柑橘青霉病菌[17]、芒果蒂腐病菌[18]等。韭菜提取物通过影响孢子营养物质的代谢来抑制番茄尖孢镰刀菌(Fusarium oxysporum f. sp. radicis- lycopersici)孢子的萌发[19]。香蕉和辣椒与韭菜间作可以有效控制香蕉枯萎病和辣椒疫病的发生,实现生态防控[20-21]。关于韭菜根系分泌物化感作用的研究较少,特别是研究韭菜根系分泌物对苦瓜枯萎病菌的化感作用尚未见报道。
本研究采用水培法收集韭菜根系分泌物,通过菌丝生长速率和孢子萌发法研究韭菜根系分泌物对苦瓜枯萎病菌的化感作用,采用气相质谱-色谱联用技术(GC-MS)鉴定化合物组成成分,根据鉴定结果筛选韭菜根系分泌物中可能的有效化感物质,进一步通过菌丝生长速率法和孢子萌发法验证其对苦瓜枯萎病菌的化感作用,明确主效化感物质,以期为利用韭菜间套作苦瓜诱导枯萎病抗性的研究和研制植物源抑菌剂提供理论依据和技术支撑。
1 材料与方法
1.1 材料
韭菜品种:‘山东雪韭6号’。
供试病原菌:苦瓜枯萎病致病菌尖孢镰刀菌(Fusarium oxysporum f. sp. momodicae),由广西农业科学院蔬菜研究所陈振东研究员提供。
1.2 方法
1.2.1 韭菜根系分泌物的收集 参考韩旭等[22]的方法,略有改动。用蒸馏水洗净韭菜根系,尽量保证不伤根系,置于水培装置中;将配制好的Hoagland营养液注入水培装置,用量以刚好没过韭菜整个根部为宜,每5 d收集一次根系分泌物,并更换新的营养液,共收集6次并混匀;最后一次收集根系分泌物后用蒸馏水冲洗韭菜根系,去除营养液残留,用滤纸拭干其表面多余水分并称重。将已收集的根系分泌物通过0.45 μm的水系微孔滤膜抽滤,再减压浓缩到0.5 g/mL(以韭菜鲜根重量计算),即为根系分泌物的母液,4℃保存备用。
1.2.2 苦瓜枯萎病菌菌落直径的测定 采用菌丝生长速率法[23]测定菌落直径。待PDA培养基冷却,将根系分泌物按不同比例加入PDA培养基中,配制终浓度为0 mg/mL(CK)、1.76 mg/mL(T1)、3.22 mg/mL(T2)、4.46 mg/mL(T3)、5.52 mg/mL(T4)的平板;用直徑为7 mm的灭菌打孔器在供试苦瓜枯萎病病原菌菌落边缘打制大小一致的菌饼,将其接种在含有根系分泌物的各平板中央,每皿1个菌饼,每个处理3次重复,26℃恒温培养7 d,采用十字交叉法测量菌落直径(cm),计算菌丝生长抑制率(%)。
菌丝生长抑制率=(对照菌落直径-处理菌落直径)/对照菌落直径×100%
1.2.3 苦瓜枯萎病菌孢子萌发的测定 采用田丹丹等[24]等方法测定孢子萌发率。将供试苦瓜枯萎病病原菌接种在PDB培养基中,120 r/min、26℃振荡培养7 d,四层无菌纱布过滤,用无菌水将孢子悬浮液稀释至103 CFU/mL。配制不同浓度PDA培养基(同1.2.2),取100 μL配制好的孢子悬浮液加至平板中,用涂布棒均匀涂抹,26℃恒温培养3 d,统计每个处理的孢子萌发个数,每个处理3次重复,计算孢子萌发抑制率(%)。
孢子萌发抑制率=(对照孢子萌发数-处理孢子萌发数)/对照孢子萌发数×100%
1.2.4 韭菜根系分泌物分离及GC-MS鉴定 采用萃取法[25]对韭菜根系分泌物进行分离。取根系分泌物母液200 mL,按溶液极性依次用石油醚、正己烷、乙醚、乙酸乙酯、三氯甲烷5种有机溶剂按体积比1∶1的比例萃取后,将上述各组分分别经旋转蒸发仪减压浓缩至干,溶于5 mL色谱纯甲醇中,用于GC-MS鉴定。
采用GC-MS鉴定(Agilent 7890B-5977A气相色谱-质谱联用仪)韭菜根系分泌物的化合物组成。色谱条件:DB-5石英毛细管柱(30 m× 0.25 mm,膜厚度0.25 μm);载气He,流速1.0 mL/min;进样口温度250℃;程序升温:柱温50℃(保持2 min),以6℃/min程序升温至250℃(保持15 min)。质谱条件:离子源温度230℃;四极杆温度150℃;EI源(电子轰击源),轰击电压70 eV;扫描范围m/z 30~600 amu;1 μL进样,不分流,溶剂延迟时间为2.8 min。根据数据库比对结果,选择相似度≥70%的化合物作为根系分泌物中可能的有效化感物质。
1.2.5 韭菜根系分泌物主效化感物质的验证 根据GC-MS鉴定结果,筛选韭菜根系分泌物可能的有效化感物质为邻苯二甲酸二丁酯(A)、2,4-二叔丁基苯酚(B)、2,2-亚甲基双-(4-甲基-6-叔丁基苯)(C)。将A溶于色谱纯甲醇溶液中,配制成5、10、50、100 mmol/L母液,按1∶100的比例添加到已灭菌的PDA培养基中制成终浓度为0.05 mmol/L(A1)、0.1 mmol/L(A2)、0.5 mmol/L(A3)、1.0 mmol/L(A4)的平板待用;将B配制成0.5、1、5、10 mmol/L母液,同样按1∶100的比例制成终浓度0.005 mmol/L(B1)、0.01 mmol/L(B2)、0.05 mmol/L(B3)、0.1 mmol/L(B4)的平板备用;将C溶于色谱纯甲醇溶液中,配制成5、10、50、100 mmol/L母液,按1∶100的比例添加到已灭菌的PDA培养基中制成终浓度为0.05 mmol/L(C1)、0.1 mmol/L(C2)、0.5 mmol/L(C3)、1.0 mmol/L(C4)的平板待用。3种化感物质的验证均以含有1%色谱纯甲醇的PDA培养基为对照(CK)。接种菌饼和涂布方法同1.2.3和1.2.4。
1. 3 数据处理
使用Excel 2010软件对试验数据进行统计分析,使用SPSS 22.0软件进行显著性检验。
2 结果与分析
2.1 不同浓度韭菜根系分泌物对苦瓜枯萎病菌的化感作用
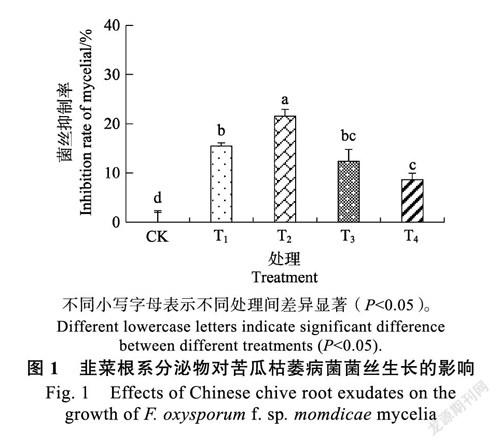
2.1.1 对菌丝生长的影响 由图1可以看出,随着根系分泌物浓度的增加,菌落直径呈现先降后升的趋势,T2处理达到最小值。培养7 d时,CK的菌落直径为7.3 cm,T1、T2、T3、T4处理的菌落直径分别为6.2、5.8、6.4、6.7 cm,均显著低于CK(P<0.05),菌丝生长抑制率分别为15.45%、21.6%、12.4%、8.64%。表明韭菜根系分泌物对苦瓜枯萎病菌菌丝生长有明显的抑制作用,低浓度的根系分泌物抑制作用较强,随着浓度增加,抑制作用反而降低。
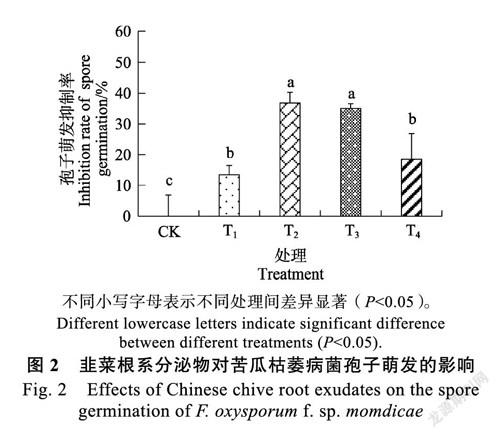
2.1.2 对孢子萌发的影响 随着韭菜根系分泌物浓度逐渐升高,孢子萌发数量呈现先下降后上升的变化趋势(图2)。培养3 d后,CK孢子萌发个数达到146个,T1、T2、T3、T4处理的孢子萌发个数分别为126、92、95、119个,且各浓度处理均显著低于对照(P<0.05),孢子萌发抑制率分别为13.50%、36.84%、35.01%、18.54%。T2处理孢子萌发数量最低,抑制率达最高(36.8%)。表明韭菜根系分泌物对苦瓜枯萎病菌孢子萌发有明显的抑制作用,并表现为低浓度抑制作用强,高浓度反而弱。
2.2 韭菜根系分泌物不同組分的化感物质GC-MS鉴定
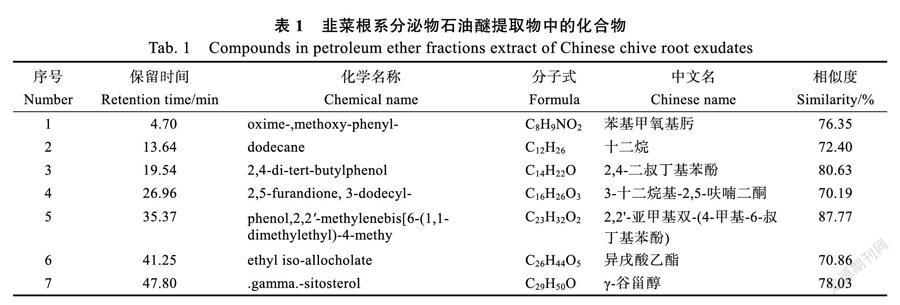
2.2.1 石油醚组分鉴定结果 石油醚组分共检测出113个化合物,相似度≥70%的化合物有7个(表1),分别为苯基甲氧基肟、十二烷、2,4-二叔丁基苯酚、3-十二烷基-2,5-呋喃二酮、2,2-亚甲基双-(4-甲基-6-叔丁基苯酚)、异戌酸乙酯、γ-谷甾醇。此组分中可能的有效化感物质为2,4-二叔丁基苯酚和2,2-亚甲基双-(4-甲基-6-叔丁基苯酚),相似度分别为80.63%和87.77%。
2.2.2 正己烷组分鉴定结果 正己烷组分共检测出133个化合物,相似度≥70%的化合物有7个(表2),分别为正辛烷、六甲基环三硅氧烷、对二甲苯、正十二烷、3,5-二叔丁基苯酚、2,2-亚甲基双-(4-甲基-6-叔丁基苯酚)、邻苯二甲酸二辛酯。此组分中可能的有效化感物质为2,2-亚甲基双-(4-甲基-6-叔丁基苯酚),相似度为91.99%。
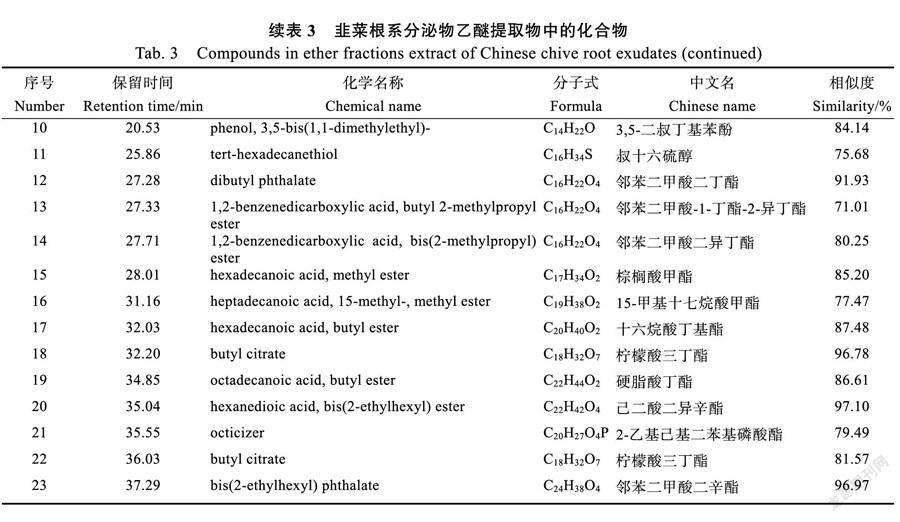
2.2.3 乙醚组分鉴定结果 乙醚组分共检测出189个化合物,相似度≥70%的化合物有23个(表3)。其中烷烃类包括2-乙氧基-3-氯丁烷、正十二烷;酯类包括邻苯二甲酸二丁酯、邻苯二甲酸-1-丁酯-2-异丁酯、邻苯二甲酸二异丁酯、棕榈酸甲酯;醇类包括1,2-丁二醇、(2R,3R)-(-)-2,3-丁二醇、叔十六硫醇;酚类有3,5-二叔丁基苯酚;醛类有甘油缩甲醛,烯类包括(+)-长叶环烯、异长叶烯、长叶烯,醚类有辛基缩水甘油醚。乙醚组分中可能的有效化感物质有邻苯二甲酸二丁酯,相似度为91.93%
2.2.4 乙酸乙酯组分鉴定结果 乙酸乙酯组分共检测出160个化合物,相似度≥70%的化合物有4个(表4),分别为3-羟基-2-丁酮、(2R,3R)-(-)-2,3-丁二醇、3,5-二叔丁基苯酚、2,4-二叔丁基苯酚。此组分中可能的有效化感物质为2,4-二叔丁基苯酚,相似度为76.92%。
2.2.5 三氯甲烷组分鉴定结果 三氯甲烷组分共检测出129个化合物,相似度≥70%的化合物有4个(表5),分别为(2R,3R)-(-)-2,3-丁二醇、间二甲苯、2,4-二叔丁基苯酚、2,2-亚甲基双-(4-甲基-6-叔丁基苯酚)。此组分中可能的有效化感物质为2,4-二叔丁基苯酚和2,2-亚甲基双-(4-甲基-6-叔丁基苯酚),相似度分别为78.69%和74.24%。
2.3 韭菜根系分泌物主效化感物质的验证
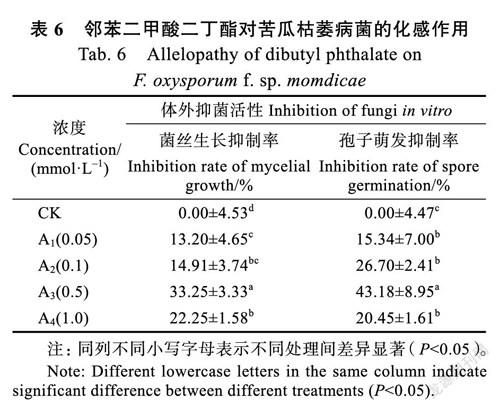
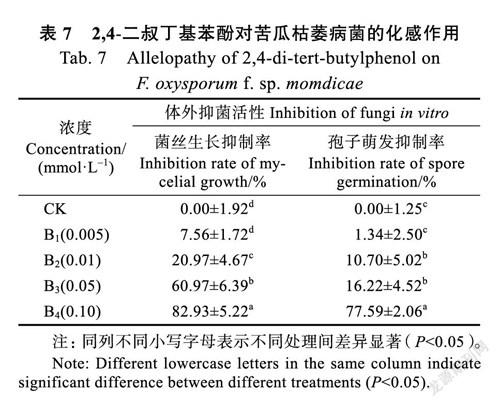
根据GC-MS鉴定结果和前人研究结果[26-28]确定邻苯二甲酸二丁酯、2,4-二叔丁基苯酚和2,2-亚甲基双-(4-甲基-6-叔丁基苯酚)为韭菜根系分泌物的主效化感物质,并对其进行验证。3种主效化感物质对苦瓜枯萎病菌菌丝生长和孢子萌发均有不同程度的抑制作用。
2.3.1 邻苯二甲酸二丁酯对苦瓜枯萎病菌的化感作用 由表6可知,随着邻苯二甲酸二丁酯浓度的升高,苦瓜枯萎病菌菌落直径和孢子萌发数整体呈先下降后上升的趋势,且A3(0.5 mmol/L)处理的抑制作用最大,菌落直径最小,孢子萌发个数最少,此时抑菌率为33.25%,孢子萌发抑制率为43.18%,且显著低于对照(P<0.05),其余各浓度处理对菌丝生长和孢子萌发的抑制作用也均达显著水平(P<0.05)。
2.3.2 2,4-二叔丁基苯酚对苦瓜枯萎病菌的化感作用 随着2,4-二叔丁基苯酚浓度增加,对苦瓜枯萎病菌菌丝生长和孢子萌发抑制作用越来越强,各处理菌落直径和孢子萌发数逐渐降低。即CK>B1>B2>B3>B4,除B1(0.005 mmol/L)处理外,其他各处理均显著低于对照(P<0.05),B4(0.1 mmol/L)处理对菌丝生长的抑制率最高,达82.93%,对孢子萌发抑制率也达最高,为77.59%(表7)。
2.3.3 2,2'-亚甲基双-(4-甲基-6-叔丁基苯酚)对苦瓜枯萎病菌的化感作用 随着2,2-亚甲基双-(4-甲基-6-叔丁基苯酚)浓度的升高,菌落直径先减后增,各处理均显著低于对照(P<0.05),且在C3(0.5 mmol/L)处理时菌落直径达到最小,此时菌落直径为4.2 cm,抑菌率达到30.96%。C3(0.5 mmol/L)处理的孢子萌发数显著低于对照(P<0.05),孢子萌发抑制率达21.48%,其他各处理孢子萌发数虽均低于对照,但无显著差异(P>0.05)(表8)。
3 讨论
植物在生长过程中常常受到病原微生物,尤其是病原真菌的危害。近年来,植物根系分泌物在防治真菌病害上深受关注。植物根系是各种土传病害的发生场所。面对病原菌的侵染,植物通过根系分泌的化感物质抑制病原菌,进行化学防御。
韭菜挥发物和提取物对植物病害的调控具有十分重要的作用,如韭菜挥发物和浸提液均能抑制香蕉枯萎病菌的生长[29]。香蕉与韭菜间作能够降低香蕉枯萎病的发病率[30-31],韭菜提取液处理苹果枝条和果实能够抑制苹果轮纹病的发生[15]。姚琴等[32]研究发现水培韭菜根系分泌物对棉花大丽轮枝菌菌丝生长和孢子萌发均表现出显著的抑制作用。在本研究中,水培韭菜根系分泌物对苦瓜枯萎病菌的菌丝生长和孢子萌发菌具有显著的化感抑制作用。本研究结果与姚琴等的研究结果类似,均证明水培韭菜根系分泌物对植物致病菌具有抑制作用。韭菜和大蒜同属于葱蒜类作物,已有研究证实大蒜根系分泌物对黄瓜枯萎病菌和西瓜枯萎病菌均有显著的化感作用[33],因此韭菜根系分泌物对蔬菜作物致病菌同样应该具有化感作用,本研究发现韭菜根系分泌物对苦瓜枯萎病致病菌具有显著的抑制作用,且随着浓度的升高,抑制作用表现为先升高后降低的趋势,满足化感作用低浓度促进,高浓度抑制的作用规律,由此证实了韭菜根系分泌物对苦瓜枯萎病菌具有显著的化感作用,本研究结果与其一致。廉法卓等[29]采用菌丝生长速率法和孢子萌发法研究发现,韭菜浸提液可抑制香蕉枯萎病菌的生长,虽然本研究选用的是韭菜根系分泌物和苦瓜枯萎病菌为研究对象,但是研究结果也与其相同。前人研究发现,大葱根系分泌物對黄瓜枯萎病病原菌菌丝生长和孢子萌发的抑制作用随着分泌物浓度的升高而逐渐增强[34],本研究抑制作用规律与其不一致,可能是因为不同植物根系分泌物主效化感物质的种类与含量存在差异,导致对致病菌的抑制作用规律也不同,但一致的是,二者均对枯萎病致病菌有明显的抑制作用。
RICE[7]将化感物质分为15类,分别为简单的水溶性有机酸、直链醇、脂肪醇、脂肪族醛和酮;简单的不饱和内酯;长链脂肪酸和多炔;醌类;简单的酚、苯甲酸及其衍生物;肉桂酸及其行生物;香豆素类;黄酮类;单宁;萜类和甾族化合物;氨基酸和多肽;生物碱和氰醇;糖苷硫氰酸酯;嘌呤和核酸和。本研究通过对韭菜根系分泌物的GC-MS鉴定分析表明,其主要成分为酚类、酯类、烷烃类、醇类、烯类、芳香族,均属于化感物质范畴。吴晓婷等[35]通过GC-MS鉴定水培收集的大蒜根系分泌物,主要成分只有酚类和脂类,本研究鉴定结果也包含酚类和酯类,但其他组分不同。李敏等[36]鉴定出大蒜连作土壤中的根系分泌物主要有烷烃类、醇类、酯类、苯类等,本研究鉴定结果与其基本一致。刘素慧[37]鉴定组培大蒜根系分泌物,主要成分有酚类、酸类、酯类和硫化物。周艳丽[38]鉴定水培大蒜主要成分有酚类、酯类、烷烃类、醇类、烯类、芳香族和硫化物。除硫化物外,本研究鉴定结果与前人的基本一致,可能是蔬菜种类、培养分离条件不同等导致蔬菜生理代谢不同,产生的根系分泌物也不同。
根据GC-MS鉴定和前人研究结果,筛选确定韭菜根系分泌物可能的主效化感物质为2,4-二叔丁基苯酚、邻苯二甲酸二丁酯和2,2-亚甲基双-(4-甲基-6-叔丁基苯酚)。邻苯二甲酸二丁酯已被证实为大豆、辣椒和马铃薯根系分泌物中的主效化感物质[39-41],2,4-二叔丁基苯酚被证实为兰州百合根系分泌物中的化感物质[42]。2,2-亚甲基双-(4-甲基-6-叔丁基苯酚)广泛存在于多种植物的根系分泌物中,例如大蒜[43]、核桃[44]、大葱[45]、兰州百合[46]。因此,本研究将进一步验证这3种化感物质对苦瓜枯萎病菌的化感作用。
通过验证2,4-二叔丁基苯酚、邻苯二甲酸二丁酯和2,2-亚甲基双-(4-甲基-6-叔丁基苯酚)对苦瓜枯萎病菌的化感作用,明确其抑菌效果强弱顺序为2,4-二叔丁基苯酚>鄰苯二甲酸二丁酯>2,2-亚甲基双-(4-甲基-6-叔丁基苯酚),且随着2,4-二叔丁基苯酚浓度的增加抑菌效果逐渐增加,不同浓度的邻苯二甲酸二丁酯和2,2-亚甲基双-(4-甲基-6-叔丁基苯酚)对苦瓜枯萎病菌菌丝生长和孢子萌发表现为低浓度促进,高浓度抑制的化感作用规律。邻苯二甲酸二丁酯可以有效控制杂草[47]和土传病害[48-49],能抑制茄子根际黄萎菌的增殖,有效控制茄子土传病害黄萎病的发生[48];施用外源邻苯二甲酸二丁酯能够有效降低西瓜枯萎病的发病率[49];大蒜根系分泌物的有效化感物质为邻苯二甲酸二丁酯,分别对烟草枯萎病菌菌丝生长和孢子萌发具有较强的抑菌作用[26],本研究结果与以上研究结果一致。2,4-二叔丁基苯酚可以延缓杂草的生长发育[27]、影响幼苗生长发育和光合作用[50-52]。不仅如此,2,4-二叔丁基苯酚对秀丽隐杆线虫和朱砂叶螨有较好的毒杀作用[53-54]。黄炜[55]研究得出百合根系分泌物中的化感物质2,4-二叔丁基苯酚与致病镰刀菌对百合枯萎病的发生具有协同作用,0.05~0.2 mmol/L的2,4-二叔丁基苯酚还能够促进致病镰刀菌的产孢量,本研究结果与其不一致,本研究证实随着2,4-二叔丁基苯酚浓度的增加,对苦瓜枯萎病菌的抑制作用不断增加,0.1 mmol/L处理的孢子萌发抑制率高达77.59%,造成不同结果的原因可能是供试菌种不同导致达到抑菌作用的浓度不同。已有研究表明2,2'-亚甲基双-(4-甲基-6-叔丁基苯酚)是野生果实刺梨(Rosa roxburghii)挥发油中的主要成分,对4株多药耐药金黄色葡萄球菌均有抑菌活性,并具有抗肿瘤的功效[28, 56],但其在对植物病害的抑制作用方面尚未见报道。本研究证实2,2-亚甲基双-(4-甲基-6-叔丁基苯酚)对苦瓜枯萎病菌具有一定的化感抑制作用,且满足低浓度促进,高浓度抑制的化感作用规律,可将其研发成植物源杀菌剂防治苦瓜枯萎病。
本研究证实在体外抑菌试验中,韭菜根系分泌物对苦瓜枯萎病菌有较强的化感抑制作用,为生产上利用间套轮作韭菜以防控苦瓜枯萎病奠定基础和提供技术支撑。通过主效化感物质验证试验得出韭菜根系分泌物对苦瓜枯萎病菌的抑制作用与邻苯二甲酸二丁酯、2,4-二叔丁基苯酚和2,2-亚甲基双-(4-甲基-6-叔丁基苯酚)3种物质有关,为研制植物源杀菌剂防控苦瓜枯萎病提供理论依据,但关于韭菜根系分泌物调控苦瓜枯萎病致病菌的分子机制和化感作用机理还需要进一步的研究。
4 结论
本研究通过体外抑菌试验证实,水培收集的韭菜根系分泌物对苦瓜枯萎病菌具有化感作用;通过GC-MS鉴定分析,明确邻苯二甲酸二丁酯、2,4-二叔丁基苯酚和2,2-亚甲基双-(4-甲基-6-叔丁基苯酚)可能是导致韭菜根系分泌物对苦瓜枯萎病菌化感抑制作用的主效化感物质,进一步选用这3种物质的外源化学品验证了其对枯萎病菌的化感抑制作用,进而明确了这3种物质均为韭菜根系分泌物发挥化感作用调控苦瓜枯萎病菌的主效化感物质。
参考文献
[1] 杜文丽, 陈中钐, 许端祥, 徐同伟, 高 山, 温庆放. 低温胁迫下苦瓜叶片转录组差异基因分析及生理响应特征[J]. 核农学报, 2021, 35(2): 338-348.
DU W L, CHEN Z S, XU D X, XU T W, GAO S, WEN Q F. Physiological response and differentially expressed genes analysis of transcriptome in Momordica charantia L. leaf under cold stress[J]. Journal of Nuclear Agricultural Sciences, 2021, 35(2): 338-348. (in Chinese)
[2] 丁 雷, 朱怡霏, 李 梅, 吴丽丽, 秦灵灵, 刘铜华. 苦瓜的降糖作用及机制研究进展[J]. 中国实验方剂学杂志, 2021, 27(10): 204-212.
DING L, ZHU Y F, LI M, WU L L, QIN L L, LIU T H. Progress on hypoglycemic effect and mechanism of Momordica charantia[J]. Chinese Journal of Experimental Traditional Medical Formulae, 2021, 27(10): 204-212. (in Chinese)
[3] 姜 英, 肖家美, 宋 超, 王 峰, 高月明. 苦瓜营养成分分析及抑菌试验研究[J]. 特产研究, 2017, 39(1): 36-39.
JIANG Y, XIAO J M, SONG C, WANG F, GAO Y M. The study of nutrient analysis and antibacterial effect on Momordica charantia L.[J]. Special Wild Economic Animal and Plant Research, 2017, 39(1): 36-39. (in Chinese)
[4] SUN S K, HUANG J W. A new Fusarium wilt of bitter gourd in Taiwan[J]. Plant Disease, 1983, 67(2): 226-227.
[5] 关 峰, 万新建, 张景云, 缪南生, 孙 卓. 苦瓜枯萎病研究进展[J]. 中国瓜菜, 2018, 31(5): 1-4.
GUAN F, WAN X J, ZHANG J Y, MIAO N S, SUN Z. Research progress on Fusarium wilt of bitter gourd[J]. China Cucurbits and Vegetables, 2018, 31(5): 1-4. (in Chinese)
[6] RICE E L. 天然化學物质与有害生物防治[M]. 胡敦孝, 译. 北京: 科学出版社, 1988: 9-10.
RICE E L. Natural chemical substance and pest control operation[M]. Trans. by HU D X. Beijing: Science Press, 1988: 9-10. (in Chinese)
[7] RICE E L. Allelopathy [M]. 2nd ed. New York: Academic Press, 1984: 1-5, 309-315
[8] 任改弟, 王光飞, 马 艳. 根系分泌物与土传病害的关系研究进展[J]. 土壤, 2021, 53(2): 229-235.
REN G D, WANG G F, MA Y. Research progresses on relationship between plant root exudates and soil-borne diseases[J]. Soils, 2021, 53(2): 229-235. (in Chinese)
[9] 刘彤彤, 卢巧芳, 王男麒, 王天琪, 刘环环, 左元梅. 根系分泌物抑制连作障碍线虫病的根际调控机制及其应用[J]. 植物营养与肥料学报, 2019, 25(6): 1038-1046.
LIU T T, LU Q F, WANG N Q, WANG T Q, LIU H H, ZUO Y M. The rhizosphere regulation mechanism and use of root exudates to inhibit continuous monocropping barrier by nematode disease[J]. Journal of Plant Nutrition and Fertilizers, 2019, 25(6): 1038-1046. (in Chinese)
[10] HAO W Y, REN L X, RAN W, SHEN Q R. Allelopathic effects of root exudates from watermelon and rice plants on Furarium oxysporium f. sp. niveum[J]. Plant and Soil, 2010, 336: 485-497.
[11] LING N, RAZA W, MA J H, HUANG Q W, SHEN Q R. Identification and role of organic acids in watermenlon root exudaties for recruiting Paenibacillus polymyxa SQR-21 in the rhizosphere[J]. Eurpean Journal of Soil Biology, 2011, 47: 374-379.
[12] DING H Y, ALI A, CHENG Z H. An allelopathic role for garlic root exudates in the regulation of carbohydrate metabolism in cucumber in a hydroponic co-culture system[J]. Plants, 2019, 9(1): 45.
[13] 曾 凤, 黄永红, 凌 键, 茆振川, 谢丙炎, 杨宇红. 韭菜水提液对甘蓝枯萎病菌抑制作用初探[J]. 中国蔬菜, 2016(1): 60-63.
ZENG F, HUANG Y H, LING J, MAO Z C, XIE B Y, YANG Y H. Primary studies on inhibitory effect of water extracts from Allium tuberosum on Fusarium oxysporum f. sp. conglutinans in cabbage[J]. Chinese Vegetables, 2016(1): 60-63. (in Chinese)
[14] 穆 雷, 国俊红, 何华敏, 赵 惠, 谢 俊, 韦双双, 夏幽泉, 吴繁花, 阮云泽, 汤 华. 4种葱科植物粗提液对香蕉枯萎病菌的抑制效果[J]. 热带生物学报, 2014, 5(3): 239-243.
MU L, GUO J H, HE H M, ZHAO H, XIE J, WEI S S, XIA Y Q, WU F H, YUAN Y Z, TANG H. Antagonistic effects of crude extracts from four Alliaceae plants on Fusarium oxysporum f. sp. cubense[J]. Journal of Tropical Biology, 2014, 5(3): 239-243. (in Chinese)
[15] 赵 刚, 张卫娜, 左存武, 黄永红. 韭菜提取物及其主要活性物质防控苹果轮纹病发生的研究[J]. 中国生物防治学报, 2017, 33(2): 273-280.
ZHAO G, ZHANG W N, ZUO C W, HUANG Y H. Control effect of Chinese leek extract and its main bioactive components on apple ring rot incidence[J]. Chinese Journal of Biological Control, 2017, 33(2): 273-280. (in Chinese)
[16] 王美入, 姚 琴, 杨家荣, 胡小平. 5种植物提取物及残体对棉花黄萎病菌的抑制作用[J]. 西北农林科技大学学报(自然科学版), 2014, 42(4): 137-142.
WANG M R, YAO Q, YANG J R, HU X P. Inhibition of plant extracts and residues on Verticillium dahlia[J]. Journal of Northwest A & F University (Natural Science Edition), 2014, 42(4): 137-142. (in Chinese)
[17] 毕璋友, 吴惠君. 韭菜粗提取物对柑橘青霉菌的抑菌效果研究[J]. 安徽农业科学, 2014, 42(4): 1002-1003, 1005.
BI Z Y, WU H J. Study on the inhibiting effects of extracts from Allium tuberosum on Penicillium italicum in stored citruses[J]. Journal of Anhui Agricultural Sciences, 2014, 42(4): 1002-1003, 1005. (in Chinese)
[18] 张爱玉, 刘 岩, 梁伟能, 李 俊, 戴宏芬, 劉传和. 韭菜提取物对芒果炭疽菌和蒂腐菌的抑制作用[J]. 食品科学, 2011, 32(S1): 68-71.
ZHANG A Y, LIU Y, LIANG W N, LI J, DAI H F, LIU C H. Inhibition effects of Allium tuberosum on colletotrichum gloeosporioides Penz. and Botryodiplodia theobromae Pat.[J]. Food Science, 2011, 32(S1): 68-71. (in Chinese)
[19] ZHANG X, WANG H, ZHU W Y, LI W L, WANG F. Transcriptome analysis reveals the effects of Chinese chive (Allium tuberosum R.) extract on Fusarium oxysporum f. sp. radicis-lycopersici spore germination[J]. Current Microbiology, 2020, 77(1): 855-864.
[20] LI Z F, WANG T, HE C L, CHEN K L, ZENG R S, SONG Y Y. Control of Panama disease of banana by intercropping with Chinese chive (Allium tuberosum Rottler): cultivar differences[J]. BMC Plant Biology, 2020, 20(1): 432.
[21] 江冰冰, 张 彧, 郭存武, 杨翠枝, 朱书生, 杨 敏. 韭菜和辣椒间作对辣椒疫病的防治效果及其化感机理[J]. 植物保护学报, 2017, 44(1): 145-151.
JIANG B B, ZHANG Y, GUO C W, YANG C Z, ZHU S S, YANG M. Control effects and allelopathic mechanism of pepper and Chinese chives intercropping on pepper Phytophthora blight[J]. Journal of Plant Protection, 2017, 44(1): 145-151. (in Chinese)
[22] 韩 旭, 杜公福, 牛 玉, 曹振木. 水培法收集甜椒根系分泌物化学成分鉴定[J]. 长江蔬菜, 2016(4): 47-52.
HAN X, DU G F, NIU Y, CAO Z M. Chemical components identification on root exudates of Capsicum fructescens L. by nutrient solution culture[J]. Journal of Changjiang Vegetables, 2016(4): 47-52. (in Chinese)
[23] 张潇丹, 廖静静, 邓维萍, 宋冬冬, 梅 琼, 朱书生, 杨 敏. 镰刀菌对大蒜根系分泌物的敏感性与其致病力相关分析[J].植物保护, 2014, 40(6): 53-58.
ZHANG X D, LIAO J J, DENG W P, SONG D D, MEI Q, ZHU S S, YANG M. Correlation analysis of the sensitivity of Fusarium spp. to garlic root exudates and their pathogenicity to garlic bulb[J]. Plant Protection, 2014, 40(6): 53-58. (in Chinese)
[24] 田丹丹, 周 维, 黄素梅, 覃柳燕, 韦 弟, 韦绍龙, 龙盛风, 李朝生. 不同香蕉品种根系分泌物对香蕉枯萎病致病菌的影响及组成分析[J]. 热带作物学报, 2017, 38(5): 910-914.
TIAN D D, ZHOU W, HUANG S M, QIN L Y, WEI D, WEI S L, LONG S F, LI C S. The effects of root exudates screated by different resistant Bababa varieties on Fusaiurm oxysporum f. sp. cubense and the components analysis[J]. Chinese Journal of Tropical Crops, 2017, 38(5): 910-914. (in Chinese)
[25] 周艳丽, 程智慧. 大蒜根系分泌物化感作用及化感物质的比较[J]. 西北农林科技大学学报(自然科学版), 2012, 40(2): 116-120.
ZHOU Y L, CHENG Z H. Comparative analysis of allelopathy and allelochemicals of the root exudates in garlic[J]. Journal of Northwest A & F University (Natural Science Edition), 2012, 40(2): 116-120. (in Chinese)
[26] 吴晓婷, 賴荣泉, 米月娥, 顾 钢, 张 榜, 王巧妮. 大蒜根系分泌物对烟草镰刀菌根腐病的控制作用[J]. 中国生物防治学报, 2021, 37(3): 555-563.
WU X T, LAI R Q, MI Y E, GU G, ZHANG B, WANG Q N. Control effects of garlic root exudates on Fusarium oxysporum root rot of tobacco[J]. Chinese Journal of Biological Control, 2021, 37(3): 555-563. (in Chinese)
[27] CHUAH T S, NORHAFIZAH M Z, ISMAIL B S. Evaluation of the biochemical and physiological activity of the natural compound, 2,4-ditert-butylphenol on weeds[J]. Crop and Pasture Science, 2015, 66(2): 214-223.
[28] YANG Q Q, ZHANG D, FARHA A K, YANG X, LI H B, KONG K W, ZHANG J R, CHAN C L, LU W Y, CORKE H. Phytochemicals, essential oils, and bioactivities of an underutilized wild fruit Cili (Rosa roxburghii)[J]. Industrial Crops & Products, 2020, 143: 111928.
[29] 廉法卓, 薛蓉蓉, 林娴慧, 杨玉瑞, 张 晖, 曾任森, 宋圆圆. 韭菜和胜红蓟水浸提液和挥发物对香蕉枯萎病菌的抑制作用[J]. 华南农业大学学报, 2019, 40(4): 40-46.
LIAN F Z, XUE R R, LIN X H, YANG Y R, ZHANG H, ZHANG R S, SONG Y Y. Inhibitory effects of aqueous leachates and volatiles from Allium tuberosum and Ageratum conyzoides on Fusarium oxysporum f. sp. cubense[J]. Journal of South China Agricultural University, 2019, 40(4): 40-46. (in Chinese)
[30] 王 彤. 六种韭菜品种抑菌物质分析及其对香蕉枯萎病的抑制效果评价[D]. 福州: 福建农林大学, 2018.
WANG T. Analysis of the chemical substances in six different Chinese chive (Allium Tuberosum Rottler) cultivars and evaluation of their inhibitory effect to panama disease of banana[D]. Fuzhou: Fujian Agriculture and Forestry University, 2018. (in Chinese)
[31] 黄永红. 韭菜对香蕉枯萎病的防控效果及其作用机理的研究[D]. 长沙: 湖南农业大学, 2011.
HUANG Y H. The effect and mechanism of Chinese leek (Allium tuberosum) on the control of banana Fusarium wilt[D]. Changsha: Hunan Agriculture University, 2011. (in Chinese)
[32] 姚 琴, 王美入, 杨家荣, 胡小平. 韭菜等几种植物根系分泌物对棉花黄萎病菌的影响[J]. 植物保护, 2013, 39(6): 37-42.
YAO Q, WANG M R, YANG J R, HU X P. Effects of root exudates on the pathogen of cotton Verticillium wilt[J]. Plant Protection, 2013, 39(6): 37-42. (in Chinese)
[33] 周艳丽, 王 艳, 李金英, 薛艳杰. 大蒜根系分泌物的化感作用[J]. 应用生态学报, 2011, 22(5): 1368-1372.
ZHOU Y L, WANG Y, LI J Y, XUE Y J. Allelopathy of garlic root exudates[J]. Chinese Journal of Applied Ecology, 2011, 22(5): 1368-1372. (in Chinese)
[34] 徐 寧, 王 超, 魏 珉, 时 伟, 王秀峰. 大葱根系分泌物对黄瓜种子萌芽和枯萎病病原菌的化感作用及其GC-MS分析[J]. 园艺学报, 2012, 39(8): 1511-1520.
XU N, WANG C, WEI M, SHI W, WANG X F. Allelopathy of welsh onion root exudates on cucumber seed germination and Fusarium oxysporum f.sp. cucumerinum and the GC-MS analysis[J]. Acta Horticulturae Sinica, 2012, 39(8): 1511- 1520. (in Chinese)
[35] 吴晓婷, 常 悦, 赖荣泉, 陈志厚, 郭萍婷, 白晶晶. 大蒜根系分泌物分离、鉴定及其对烤烟的化感作用[J]. 武夷科学, 2019, 35(1): 21-28.
WU X T, CHANG Y, LAI R Q, CHEN Z H, GUO P T, BAI J J. Isolation and identification of the main components of garlic root exudates and its their allelopathic effects on flue-cured tobacco[J]. Wuyi Science Journal, 2019, 35(1): 21-28. (in Chinese)
[36] 李 敏, 李长田, 范丙全. 大蒜根际土壤有机化合物的GC/MS分析[J]. 吉林农业, 2012(3): 48-49.
LI M, LI C T, FAN B Q. GC/MS analysis of organic compounds in garlic rhizosphere soil[J]. Agriculture of Jilin, 2012(3): 48-49. (in Chinese)
[37] 刘素慧. 大蒜连作障碍形成机理及EM缓解效应的研究[D]. 泰安: 山东农业大学, 2011.
LIU S H. Studies on mechanism of garlic (Allium sativum L.) replanting problem and ameliorative effect of EM[J]. Taian: Shandong Agricultural University, 2011. (in Chinese)
[38] 周艳丽. 大蒜(Allium sativum L.)根系分泌物的化感作用研究及化感物质鉴定[D]. 杨凌: 西北农林科技大学, 2007.
ZHOU Y L. Research on allelopathy and allelochemicals of garlic root exudates[D]. Yangling: Northwest A&F University, 2007. (in Chinese)
[39] 韩丽梅, 王树起, 鞠会艳, 阎 飞. 吸附树脂提取的大豆根分泌物种类的GC-MS分析[J]. 大豆科学, 2003(4): 301-305.
HAN L M, WANG S Q, JU H Y, YAN F. GC-MS analysis on the kinds of soybean root exudates extracted with adsorption resin[J]. Soybean Science, 2003(4): 301-305. (in Chinese)
[40] 孙海燕, 王 炎. 辣椒根系分泌的潜力化感物质对生菜幼苗抗氧化代谢的影响[J]. 植物生理学报, 2012, 48(9): 887-894.
SUN H Y, WANG Y. Effect of root exudated potential allelochemicals in hot pepper (Capsicum annumm L.) on antioxidative metabolism for lettuce (Lactuca sativa L.)[J]. Plant Physiology Journal, 2012, 48(9): 887-894. (in Chinese)
[41] 张文明, 邱慧珍, 张春红, 刘 星, 高怡安, 沈其荣. 连作马铃薯不同生育期根系分泌物的成分检测及其自毒效应[J]. 中国生态农业学报, 2015, 23(2): 215-224.
ZHANG W M, QIU H Z, ZHANG C H, LIU X, GAO Y A, SHEN Q R. Identification and autotoxicity of root exudates of continuous cropping potato at different growth stages[J]. Chinese Journal of Eco-Agriculture, 2015, 23(2): 215-224. (in Chinese)
[42] 陈君良. 兰州百合根系分泌物自毒作用的研究及化感物質的GC-MS分析[D]. 兰州: 甘肃农业大学, 2016.
CHEN J L. Research on autotoxicity of Lanzhou lily root exudates and GC-MS analysis of allelochemical[D]. Lanzhou: Gansu Agriculture University, 2016. (in Chinese)
[43] 刘素慧, 刘世琦, 张自坤, 尉 辉, 黄治军, 张 宇. 大蒜根系分泌物对同属作物的抑制作用[J]. 中国农业科学, 2011, 44(12): 2625-2632.
LIU S H, LIU S Q, ZHANG Z K, WEI H, HUANG Z J, ZHANG Y. Inhibition effect of garlic root exudates on the genus Allium[J]. Scientia Agricultura Sinica, 2011, 44(12): 2625-2632. (in Chinese)
[44] 崔 翠, 蔡 靖, 张硕新. 核桃根系分泌物化感物质的分离与鉴定[J]. 林业科学, 2013, 49(2): 54-60.
CUI C, CAI J, ZHANG S X. Isolation and identification of the allelochemicals in walnut (Juglans regia) root exudates[J]. Scientia Silvae Sinicae, 2013, 49(2): 54-60. (in Chinese)
[45] 王 菲, 孙文帅, 张秀婷, 衣凌飞, 祝丽香, 葛春妹, 孙湄婷. 间作大葱对桔梗根系分泌物的影响[J]. 山东农业科学, 2019, 51(11): 68-73.
WANG F, SUN W S, ZHANG X T, YI L F, ZHU L X, GE C M, SUN M T. Effects of intercropping Allium fistulosum on root exudates of Platycodon grandiflorum[J]. Shandong Agricultural Sciences, 2019, 51(11): 68-73. (in Chinese)
[46] 黄钰芳, 张恩和, 张新慧, 王惠珍, 王 琦, 刘青林, 石雨仟. 兰州百合连作障碍效应及机制研究[J]. 草业学报, 2018, 27(2): 146-155.
HUANG Y F, ZHANG E H, ZHANG X H, WANG H Z, WANG Q, LIU Q L, SHI Y Q. Problems associated with continuous cropping of Lilium davidii var. unicolor[J]. Acta Prataculturae Sinica, 2018, 27(2): 146-155. (in Chinese)
[47] CHUAH T S, OH H Y, HABSAN M, NORHAFIZAH M Z, ISMAIL B S. Potential of crude extract and isolated compounds from golden beard grass (Chrysopogon serrulatus) for control of sprangletop (Leptochloa chinensis) in aerobic rice systems[J]. Crop and Pasture Science, 2014, 65(5): 461-469.
[48] 周宝利, 孙传齐, 韩 琳, 武建霞, 雷 斌. 邻苯二甲酸二丁酯对茄子根际土壤黄萎菌数量及土壤微生物组成的影响[J].华北农学报, 2010, 25(6): 150-153.
ZHOU B L, SUN C Q, HAN L, WU J X, LEI B. Effects of dibutyl phthalate on amount of Verticllium dahlia and soil microbial composition in rhizosphere of eggplant[J]. Acta Agriculturae Boreali-Sinica, 2010, 25(6): 150-153. (in Chinese)
[49] 黃业昌, 孙吉庆, 陈勇兵. 邻苯二甲酸二丁酯对西瓜光合作用及枯萎病的影响[J]. 北方园艺, 2017(4): 111-115.
HUANG Y C, SUN J Q, CHEN Y B. Effects of dibutyl phthalate on photosynthesis and Fusarium wilt of watermelon[J]. Northern Horticulture, 2017(4): 111-115. (in Chinese)
[50] 张新慧, 张恩和, 何庆祥, 任宝仓. 2,4-二叔丁基苯酚对啤酒花幼苗生长与光合特性的影响[J]. 草业学报, 2008, 17(6): 47-51.
ZHANG X H, ZHANG E H, HE Q X, REN B C. Effects of phenol, 2,4-bis(1,1-dimethylethyl) on growth and photosynthesis in Humulus lupulus[J]. Acta Prataculturae Sinica, 2008, 17(6): 47-51. (in Chinese)
[51] 黄翔杰, 李宇超, 蒋 鹏, 张 昕, 张欣怡, 覃品燕, 田 薇. 野菊根系分泌物的鉴定及其对三种植物的化感效应[J]. 湖北农业科学, 2017, 56(6): 1061-1065, 1071.
HUANG X J, LI Y C, JIANG P, ZHANG X, ZHANG X Y, QIN P Y, TIAN W. Identification of chrysanthemum root exudates and allelopathic effects of the three plants[J]. Hubei Agricultural Sciences, 2017, 56(6): 1061-1065, 1071. (in Chinese)
[52] 张新慧, 张恩和, 柴 强, 何庆祥, 任宝仓. 2,4-二叔丁基苯酚对啤酒花幼苗光合特性的影响[J]. 甘肃农业大学学报, 2006(5): 50-54.
ZHANG X H, ZHANG E H, CHAI Q, HE Q X, REN B C. Effects of phenol, 2,4-bis(1,1-dimethylethyl) on photosynthetic characters of hops seedling[J]. Journal of Gansu Agricultural University, 2006(5): 50-54. (in Chinese)
[53] 王再强, 吴毅歆, 周 红, 何月秋. 2,4-二叔丁基苯酚对秀丽隐杆线虫的毒杀作用[J]. 农药, 2014, 53(4): 298-300.
WANG Z Q, WU Y X, ZHOU H, HE Y Q. Nematicidal activity of 2,4-di-tert-butylphenol against Caenorhabditis elegans[J]. Agrochemicals, 2014, 53(4): 298-300. (in Chinese)
[54] 陈义娟. 香樟(Cinnamomum camphora)叶提取物中杀螨活性物质的分离鉴定及作用机理研究[D]. 上海: 上海交通大学, 2017.
CHEN Y J. Isolation, identificantion and mechanism of the acaricidal compound from Cinnamomum camphora against Tetranychus cinnabarinus[D]. Shanghai: Shanghai Jiao Tong University, 2017. (in Chinese)
[55] 黄 炜. 2,4-二叔丁基苯酚与镰刀菌在兰州百合枯萎病发生过程中的协同作用研究[D]. 兰州: 甘肃农业大学, 2018.
HUANG W. Study on the synergetic effect of 2,4-DTBP and Fusarium on the occurrence of Fusarium wilt in Lanzhou lily[D]. Lanzhou: Gansu Agricultural University, 2018. (in Chinese)
[56] JANG M S, KIM H J, PARK R, JO D, LEE E J, OH W K, PARK J. 2,2'-Methylenebis (6-tert-butyl 4-methylphenol) enhances the antitumor efficacy of belotecan, a derivative of camptothecin, by inducing autophagy[J]. Oncotarget, 2017, 8(70): 115068-115078.
