中国辣椒(Capsicumchinense)对象耳豆根结线虫的抗性鉴定及机理研究
2022-02-10田潇潇姜秉政曹振木刘子记凌鹏谢尚潜朱婕
田潇潇 姜秉政 曹振木 刘子记 凌鹏 谢尚潜 朱婕


摘 要:根结线虫(Meloidogyne spp.)是一类高度专化性的杂食性植物病原线虫。目前,世界上已报道的根结线虫种类有98种,我国危害农作物最为严重的根结线虫有6种,包括南方根结线虫(M. incognita)、北方根结线虫(M. hapla)、爪哇根结线虫(M. javanica)、花生根结线虫(M. arenaria)、拟禾谷根结线虫(M. graminicola)和象耳豆根结线虫(M. enteroloblii)。象耳豆根结线虫寄主范围广、致病力强,选育抗病品种是防治该线虫最为经济有效的手段。由于象耳豆根结线虫在辣椒生产中造成的危害越来越大,急需筛选高抗象耳豆根结线虫的辣椒种质,为抗病育种工作提供物质前提。本研究采用苗期接种鉴定法,对27份中国辣椒(Capsicum chinense)接种象耳豆根结线虫,60 d后开展抗病性鉴定工作。从根结指数和卵粒指数可以看出,不同種质材料在抗病性上存在显著差异。L529-10-1-2-1的根结指数和卵粒指数均最大,L550-1-3的根结指数最小,L518×L535的卵粒指数最小,可推测L529-10-1-2-1对象耳豆根结线虫的抗病性最弱,L550-1-3和L518×L535抗病性最强。结合隶属函数值和聚类分析,将27份供试辣椒种质分为抗病、低抗、感病和高感4类。其中抗病种质16份,隶属函数值在1.60以上;低抗种质4份,隶属函数值在1.26~1.51之间;感病种质5份,隶属函数值在0.64~0.93之间;高感种质2份,隶属函数值在0.42以下。选取高抗的L501M-1M和高感的L529-10-1-2-1接种象耳豆根结线虫,并在接种后0、3、6、9、12、15、20、25、30 d观察线虫侵染量和根系木质素含量。发现L501M-1M根系中的根结线虫数量远远少于L529-10-1-2-1,且L501M-1M中根结线虫的发育受到了阻滞。L501M-1M和L529-10-1-2-1在接种前木质素含量均较低,而接种后抗感种质木质素含量均有所上升,且L501M-1M的木质素含量明显高于L529-10-1-2-1,从而推测木质素与中国辣椒的象耳豆根结线虫抗性存在一定关联。该结果将为深入开展辣椒的根结线虫抗性机理研究奠定基础。
关键词:象耳豆根结线虫;中国辣椒;抗病性鉴定;线虫侵染量;木质素
中图分类号:S436.418 文献标识码:A
Identification of Capsicum chinense Germplasms Resistant to Meloidogyne enterolobii and Preliminary Analysis on Resistance Mechanism
TIAN Xiaoxiao1, JIANG Bingzheng1, CAO Zhenmu2, LIU Ziji2, LING Peng3, XIE Shangqian3, ZHU Jie1,3*
1. College of Horticulture, Hainan University, Haikou, Hainan 570228, China; 2. Tropical Crops Genetic Recourses Institute, Chinese Academy of Tropical Agricultural Sciences, Haikou, Hainan 571101, China; 3. Hainan University / Key Laboratory of Genetics and Germplasm Innovation of Tropical Special Forest Trees and Ornamental Plants, Ministry of Education, Hainan 570228, China
Abstract: Meloidogyne spp. is highly specialized omnivorous plant pathogenic nematodes. At present, 98 species of root-knot nematodes have been reported in the world, and there are 6 species of root-knot nematodes that harm crops most seriously in China, including M. incognita, M. hapla, M. javanica, M. arenaria, M. graminicola and M. enterolobii. M. enterolobii has wide host range and strong pathogenicity. Selecting and breeding resistant varieties could be the most economic and efficient way to control this disease. Since M. enterolobii is causing larger and larger damage to chili pepper production, It is emergent for breeders to screen pepper germplasms with high M. enterolobii resistance to provide material premise for disease resistance breeding. The seedling inoculation identification method was used in this study, twenty-seven C. chinense germplasms were inoculated with M. enterolobii for 60 days to carry out resistance identification work. The gall index and egg mass index showed that there were significant differences among different C. chinense germplasms on nematode resistance. L529-10-1-2-1 had the largest gall index and egg mass index, l550-1-3 had the smallest gall index, and l518 × L535 had the smallest egg mass index. It can be inferred that l529-10-1-2-1 has the weakest disease resistance to M. enteroloblii, and l550-1-3 and l518 × L535 have the strongest disease resistance. According to the total value of the subordinate function values and clustering results, the 27 pepper germplasms could be divided into four categories: resistant, lowly resistant, susceptible and highly susceptible. The 16 resistant germplasms had subordinate function values higher than 1.60. The four lowly resistant germplasms had subordinate function values of 1.26-1.51. The five susceptible germplasms had subordinate function values of 0.64-0.93, and the two highly susceptible germplasms had subordinate function values lower than 0.42. Resistant L501M-1M and susceptible L529-10-1-2-1 were inoculated with M. enterolobii to measure the nematode number and lignin content in roots after 0, 3, 6, 9, 12, 15, 20, 25 and 30 days. The nematode number in resistant variety was much lower than that of L529-10-1-2-1, the susceptible variety. Furthermore, the development of nematode juveniles in resistant variety was relatively obstructed. Before inoculation, the lignin content of L501M-1M and L529-10-1-2-1 was very low. Whereas after inoculated with M. enterolobii, the lignin content of resistant variety L501M-1M was significantly higher than that of susceptible variety L529-10-1-2-1. As a result, lignin content was speculated to be related with M. enterolobii resistance in C. chinense. The results above could lay strong foundation for further research on the mechanism of root-knot nematode resistance in chili pepper.
Keywords: Meloidogyne enterolobii; Capsicum chinense; resistance identification; invasion number of nematode; lignin
DOI: 10.3969/j.issn.1000-2561.2022.01.021
辣椒(Capsicum spp.)起源于中南美洲热带、亚热带地区,16世纪80年代传入中国[1]。吃辣能够抑制肠道炎症,改善心血管健康,抗癌,杀菌止痛等[2],辣椒在中国人日常饮食中占据了举足轻重的地位。我国已经成为世界辣椒生产量和消费量最大的国家。
根结线虫(Meloidogyne spp.)是辣椒生产中的重要土传病害。在我国,根结线虫主要在南方危害辣椒生产,包括海南、广东、广西、云南等地,特别是不能与水稻倒茬的旱作地区[3]。根结线虫种类繁多,近年来,象耳豆根结线虫(M. enterolobii)已逐渐演变为海南[4]、广东[5],福建[6]等华南地区蔬菜栽培中最重要的一种根结线虫。象耳豆根结线虫致病力强、寄主范围广、能克服Mi、N、Rk等已知的根结线虫抗病基因,在辣椒生产中造成的危害越来越大[7]。
生产中往往使用化学药剂进行根结线虫的防治。然而,出于对环境保护的重视,许多国家已经禁止在土壤中使用溴甲烷等杀线虫剂,对根结线虫的防治提出了更高的要求[8]。在育种过程中将抗病基因导入商业品种或砧木品种,利用植物本身的抗性来防治根结线虫,对种植者有着极大的价值,可节省成本,保护环境,无疑是一条经济有效而又安全的根结线虫防治途径[9]。
辣椒属中大约有30个种,中国辣椒(C. chinense Jacq.)是其中广为人知的6个种之一[10]。中国辣椒植株矮,节间距离短,分枝能力强,根系发达粗壮,在实际生产中发现其抗根结线虫的能力相对较强,是很好的抗病种质潜在来源。本研究对27份中国辣椒种质资源进行象耳豆根结线虫抗性鉴定,结合隶属函数和聚类分析等方法,明确不同材料抗根结线虫的能力,筛选出抗根结线虫的辣椒种质资源,并通过对比抗、感种质在接种象耳豆根结线虫后的侵染率和木质素含量的变化,对辣椒种质的抗病机理进行了初步探索。
1 材料与方法
1.1 材料
供试的27份中国辣椒种质资源由中国热带农业科学院热带作物品种资源研究所提供(表1)。
1.2 方法
1.2.1 根结线虫的采集和扩繁 从海南省主要辣椒产区东方市蔬菜生产基地采集了感染根结线虫病的辣椒根系,挑取根结线虫卵粒,常温下孵化出二龄幼虫,液氮研磨,提取幼虫DNA,通过PCR分子鉴定,鉴定为象耳豆根结线虫的作为供试线虫。将象耳豆根结线虫二龄幼虫接种到空心菜根部进行扩繁。
1.2.2 穴盘育苗 挑选完整饱满的辣椒种子,用25~30℃的温水浸泡7~8 h,然后将种子用湿润的毛巾包裹后置于30℃的培养箱催芽2 d。待种子露白发芽后,将其播种到装配制好基质的21孔穴盘中,覆盖遮阴网,浇透水。出苗后撤去遮阴网。
1.2.3 人工接种根结线虫 选择长着大量根结的空心菜病根,洗净表面的基质,用镊子挑取根结线虫卵粒,置于铺有湿纸巾的培养皿中在黑暗条件下进行孵化。孵化出二龄幼虫后,制成1000条/ mL根结线虫悬液,对4片真叶的辣椒苗进行接种。用注射器分5次将1 mL的根结线虫悬液接种到每株辣椒苗周围的土壤中,深度2~5 cm。试验采用完全随机区组设计,共种植并接种10个随机区组。
1.2.4 抗病性鉴定 接种60 d后,进行根结线虫抗病指标的测定。将接种根结线虫的辣椒植株整株带土拔出,去除地上部分,清水洗净根部,用滤纸吸干水分,剪去主根,称量须根的鲜重,计数每株辣椒的根结数和卵粒数。参照BOITEUX等[11]的方法计算测定根结指数和卵粒指数。根结指数(GI)=单株根结数/单株根鲜重;卵粒指数(EI)=单株卵粒数/单株根鲜重。
参照许立志等[12]和李翔等[13]的方法计算隶属函数值,因所测指标与辣椒抗病性呈正相关,所使用的计算公式为Xμ=1-(X-Xmin)/(Xmax-Xmin)。其中X为品种某一指标的测定值,Xmax为所有供试品种中该指标的最大值,Xmin为所有供试品种中该指标的最小值。隶属函数值越大,表示该品种对象耳豆根结线虫的抗性越强。
1.2.5 根结线虫侵染量的观察 分别在接种后0、3、6、9、12、15、20、25、30 d取辣椒根系,采用次氯酸钠-酸性品红染色法进行染色和压片,重复3次,统计根系中的平均根结线虫数量[14]。
1.2.6 木质素含量的测定 分别在接种后0、3、6、9、12、15、20、25、30 d取辣椒根系,采用Solarbio木质素含量检测试剂盒(#BC4200)进行木质素含量的测定,重复3次,取平均值。
1.3 数据处理
利用SPSS 22.0软件计算试验数据的平均值和标准差,并对根结指数、卵粒指数和抗、感种质不同时间点的木质素含量分别进行单因素方差分析,通过LSD或Duncan’s法进行数据点的多重比较分析,从而明确不同种质的根结指数或卵粒指数是否存在显著性差异。利用SPSS 22.0软件采用离差平方和法进行病情指标的聚类分析。
2 结果与分析
2.1 象耳豆根结线虫侵染对辣椒种质抗病指标的影响
相同条件下,根结指数和卵粒指数的数值越大,表明辣椒种质抗根结线虫的能力越弱。由表1可知,在接种象耳豆根结线虫后,不同辣椒种质的抗病指标有所差异。从根结指数来看,L529-10-1-2-1的根结指数最大,为68.09±18.79,L530绿-7-1-1M的根结指数为62.81±28.21,位居第二。L529-10-1-2-1、L530绿-7-1-1M、L517M-1× L529-1-1、L506M×L529-7-1、L512×L526-2-4-1间无显著差异,L529-10-1-2-1和L530绿-7-1-1M的根結指数显著高于其余22份种质。L538M、L529-2-1×L535-1、L515-2-1-1M-1×L529-1-1、L512×L529-1-1间无显著差异,但显著高于L547- 2M、L530绿-7-1×L535-1、L518×L538、L502-6-1× L538、L502×L543、L501M-1M、L518×L535、L550-1-3。L550-1-3的根结指数最小,为5.33± 1.36,推测其抗病能力最强。
从卵粒指数看,L529-10-1-2-1的卵粒指数最
大,为45.04±19.77,显著高于其余26份种质,L530绿-7-1-1M的卵粒指数为29.99±22.20,位居第二。L506M×L529-7-1、L538M、L529-2-1×L535- 1、L512×L526-2-4-1、L554M间无显著差异,但显著高于L530绿-4-1-2M、L530绿-7-1×L535-1、L502-6-1×L538、L518×L538、L547-2M、L502× L543、L501M-1M、L550-1-3、L518×L535。L518× L535的卵粒指数最小,为1.17±0.49,推测其抗根象耳豆根结线虫的能力最强。
2.2 象耳豆根结线虫侵染后辣椒相关抗病指标的隶属函数值
根据根结指数和卵粒指数对27份中国辣椒种质的隶属函数总值进行抗病性排名(表2)。隶属函数值越大,表示该种质对象耳豆根结线虫的抗性越强。由表2可知,L550-1-3隶属函数总值
最大,为2.00,表明其根结线虫抗性最强。L518×L535、L501M-1M、L502×L543、L502-6-1×L538、L518×L538、L547-2M、L530绿-7-1×L535-1、L530绿-1-2×L501、L530绿-4-1-2M、L539-1M、L543- 1M、L550-28M、L535-1-1M、L555-1M、L528M-1× L529-1-1隶属函数总值高于1.60,对根结线虫表现较强的抗性。L517M-1×L529-1-1、L529-2-1× L535-1、L538M、L512×L526-2-4-1、L506M× L529-7-1、L530绿-7-1-1M、L529-10-1-2-1隶属函数总值低于1.00,对根结线虫表现感病。L529-10-1-2-1的隶属函数总值最小,表明其对象耳豆根结线虫抗性最弱。
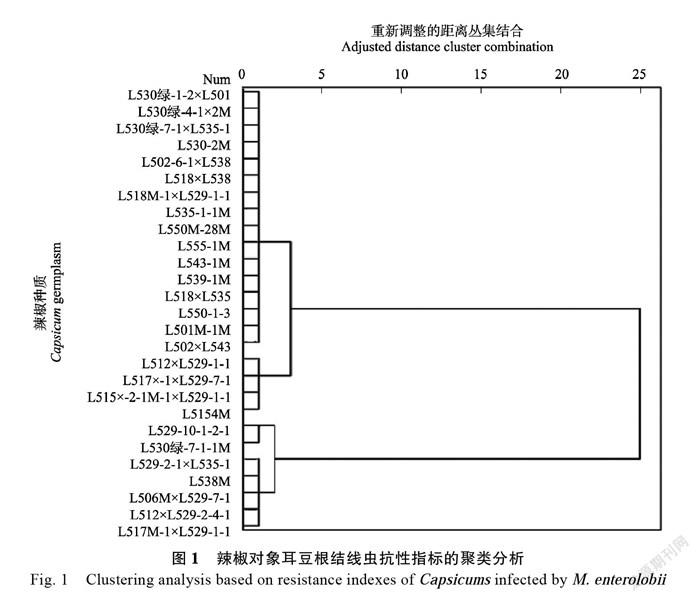
2.3 辣椒种质对根结线虫抗性的聚类分析
采用SPSS 22.0软件,以根结指数和卵粒指数2个指标为系统变量,对27份辣椒种质进行聚类分析。结果表明,当欧氏距离为2时,可将27
份供试辣椒种质分为抗病、低抗、感病和高感4大类。由图1可知,抗病种质有16份,分别为L550-1-3、L518×L535、L501M-1M、L502×L543、L502-6-1×L538、L518×L538、L547-2M、L530绿-7-1×L535-1、L530绿-1-2×L501、L530绿-4-1-2M、L539-1M、L543-1M、L550-28M、L535-1-1M、L555-1M、L528M-1×L529-1-1。低抗种质有4份,分别为L517M-1×L529-7-1、L512×L529-1-1、L515-2-1-1M-1×L529-1-1、L554M。感病种质有5份,分别为L517M-1×L529-1-1、L529-2-1×L535-1、L538M、L512×L526-2-4-1、L506M×L529-7-1。高感种质材料为L530绿-7-1-1M、L529-10-1-2-1。该结果与根结指数、卵粒指数和隶属函数值分析所得结果高度一致,可见该聚类分析具有较高科学性和可信度。
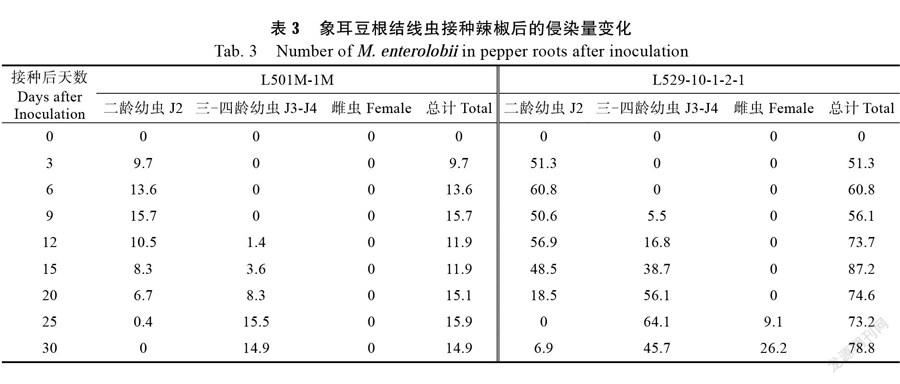
2.4 抗、感辣椒接种象耳豆根结线虫后侵染量的变化
16份抗病种质中,L501M-1M不但抗病性较强,且农艺性状比较优良,将优先用于后续抗病育种工作,故对其抗病机理的关注度较高。为此,选取高抗种质L501M-1M和高感种质L529-10- 1-2-1接种象耳豆根结线虫,并在接种后观察线虫侵染量。由表3可以看出,抗病种质L501M-1M根系中的根结线虫数量远远少于感病种质L529-10-1-2-1。不仅如此,L501M-1M根系中的线虫发育比较缓慢,出现三-四龄线虫(J3-J4)的时间比L529-10-1-2-1晚,且第30天仍未出现雌虫,而L529-10-1-2-1在第25天已出现雌虫。第一轮侵染中,L529-10-1-2-1根系内的二龄幼虫(J2)在第25天已全部发育到其他阶段,却在第30天又出现J2,推测在30 d内开始了第二轮侵染。
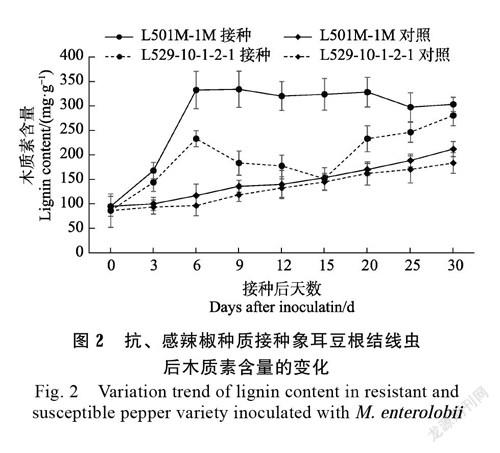
2.5 抗、感辣椒接种象耳豆根结线虫后木质素含量的变化
接种象耳豆根结线虫后,抗病种质L501M- 1M和感病种质L529-10-1-2-1根系木质素含量的变化见图2。发现抗、感种质在未接种的情况下木质素含量相似。抗病种质接种后在各时间点的木质素含量均显著高于抗病对照(P<0.05),而感病种质木质素含量仅在第15天与感病对照相似,其余时间点的木质素含量均显著高于感病对照(P<0.05),说明接种象耳豆根结线虫能刺激辣椒产生更多的木质素。抗病种质L501M-1M的木质素含量在接种后第3天(P=0.000)和第6天(P=0.000)连续显著升高,直至331.97 mg/g, 并在接下来的时间一直保持在较高水平。而感病种质L529-10-1-2-1的木质素含量在接种后第3天(P=0.003)和第6天(P=0.000)连续显著升高至232.96 mg/g,随后显著下降(P=0.011),并维持在较低水平,第15天降至最低,第20天再次显著升高(P=0.000)。总体而言,接种后6~25天,抗病种质L501M-1M的木质素含量均显著高于感病种质L529-10-1-2-1(P<0.05)。抗、感种质在接种后第30天木质素含量趋于接近(P=0.237)。
3 讨论
国内广泛种植的辣椒栽培种大部分属于一年生辣椒(Capsicum annuum)。然而,中国辣椒(C. chinense)栽培种中包含了一些世界最辣的辣椒品种。随着人们对高辣品种的日渐青睐,中国辣椒得到了越来越多的关注。FERY等[15]曾对59份中国辣椒种质材料进行南方根结线虫的抗病性评价,发现其中的商业品种皆不具明显抗性。然而,却在3个中国辣椒地方品种中检测到较高的抗性。为此,FERY等[16-18]对中国辣椒地方品种中的根结线虫抗性进行转育,培育了高抗南方根结线虫的中国辣椒品种‘TigerPaw-NR’‘PA-559’和‘PA-560’。近年来,象耳豆根结线虫快速蔓延,并克服了辣椒中广泛应用的根结线虫抗性基因N基因,研究者正加快筛选对其具较大抗性的辣椒种质。GONÇALVES等[19]对39个辣椒品系進行象耳豆根结线虫的抗病性评价,发现中国辣椒(C. chinense)的抗病性总体高于辣椒(C. annuum)。随后在MARQUES等[20]和PINHEIRO等[21]的研究中得出了相似的结论,并筛选出一些抗象耳豆根结线虫的中国辣椒种质。然而,目前国内尚无大量此类研究。本研究从27份中国辣椒材料中筛选出16份抗病种质,反映出中国辣椒确实是较好的象耳豆根结线虫抗性种质来源,这些抗病材料将成为改良商业品种抗象耳豆根结线虫的重要资源。
通过对接种象耳豆根结线虫后抗、感种质侵染量的观察,发现抗病种质L501M-1M的抗病机理较为复杂:一方面阻止大量根结线虫的侵染,将根系内的线虫数量控制在较低的范围;另一方面还能阻滞根结线虫的发育,拉长其生命周期,减少雌虫的产生。木质素是植物体内重要的次生代谢产物。植物受到病原物侵染时,木质素合成途径相关基因往往上调表达,导致木质素含量增加,从而限制病原物的入侵。LI等[22]克隆了一个玉米纹枯病抗病基因ZmFBL41,发现该基因通过自然变异避免病原菌对木质素合成的抑制从而提高玉米纹枯病抗性。FUJIMOTO等[23]发现香紫苏醇能诱导番茄和拟南芥根系中的乙烯生物合成,从而诱发乙烯介导的木质素生物合成,达到部分抑制根结线虫侵染力的作用。DE WAELE等[24]发现香蕉在被相似穿孔线虫(Radopholus similis)侵染后,根部维管束次生细胞壁的木质化显著增加,推测木质素可能参与了香蕉对相似穿孔线虫的防御机制。可见木质素对提高植物抗病性具有重要的作用。本研究发现辣椒抗病种质接种象耳豆根结线虫后的木质素含量明显高于感病种质,且在接种后6 d内木质素含量急剧升高。对比根结线虫侵染量数据,抗病种质根系中的象耳豆根结线虫数量在木质素升高3 d后达到高峰,随后便有所降低。从而初步推测木质素与中国辣椒的象耳豆根结线虫抗性有较大关联。对该相关性还需进一步开展深入研究。
THIES等[25]测定了中国辣椒在24、28、32℃条件下抗南方根结线虫的稳定性,研究表明随着温度的升高,各基因型辣椒的根结数、卵粒产量、每克鲜根产卵粒数和繁殖系数均有所增加,抗病性减弱。但部分抗病品种在高温条件下仍能有效地抑制根结线虫的侵染。本研究是在26℃溫室中进行,缺乏对中国辣椒抗象耳豆根结线虫热稳定性的研究。后续研究可进一步设置不同温度,研究辣椒种质抗象耳豆根结线虫的最适温度范围,继而加深了解这些抗性种质的抗病机理。
参考文献
[1] 邹学校, 朱 凡. 辣椒传入中国的途径与传播路径[J]. 湖南农业大学学报(自然科学版), 2020, 46(6): 629-640.
ZOU X X, ZHU F. The path of pepper introduction into China and its spreading route in China[J]. Journal of Hunan Agricultural University(Natural Sciences), 2020, 46(6): 629-640. (in Chinese)
[2] 周 军. 辣椒也有好处[J]. 养生月刊, 2020, 41(7): 646-647.
ZHOU J. Hot peppers are also good for you[J]. Health Monthly, 2020, 41(7): 646-647. (in Chinese)
[3] 朱更瑞, 王力荣, 左覃元, 张学炜. 桃根结线虫种的鉴定及最佳接种方法研究[J]. 果树科学, 2000(S1): 30-35.
ZHU G R, WANG L R, ZUO Q Y, ZHANG X W. Study on the peach root knot nematode species identi-fication and the optimum inoculation method[J]. Journal of Fruit Science, 2000(S1): 30-35. (in Chinese)
[4] 龙海波, 孙艳芳, 白 成, 郭建荣, 曾凡云. 海南省象耳豆根结线虫的鉴定研究[J]. 热带作物学报, 2015, 36(2): 371-376.
LONG H B, SUN Y F, BAI C, GUO J R, ZENG F Y. Identification of the root knot nematode Meloidogyne enterolobii in Hainan Province[J]. Chinese Journal of Tropical Crops, 2015, 36(2): 371-376. (in Chinese)
[5] 冯 岩, 阮贤聪, 陈 军, 罗 梅, 刘淑娴, 鞠海岩, 谢中辉, 徐仕金. 广州地区番石榴根结线虫鉴定与14-3-3基因的克隆[J]. 果树学报, 2017, 34(7): 875-883.
FENG Y, RUAN X C, CHEN J, LUO M, LIU S X, JU H Y, XIE Z H, XUE S J. Identification of guava root-knot nematodes in Guangzhou and the cloning of 14-3-3 gene[J]. Journal of Fruit Science, 2017, 34(7): 875-883. (in Chinese)
[6] 陈淑君. 福建省蔬菜象耳豆根结线虫的发生、鉴定与分子检测[D]. 福州: 福建农林大学, 2017.
CHEN S J. Occurrence, identification and molecular detection of Meloidogyne enterolobii on vegetable in Fujian Province[D]. Fuzhou: Fujian agriculture and Forestry University, 2017. (in Chinese)
[7] 刘 昊. 象耳豆根结线虫生物学和分子生物学特征的研究[D]. 南京: 南京农业大学, 2005.
LIU H. Biological and molecular characterization of Meloidogyne enterolobii[D]. Nanjing: Nanjing Agricultural University, 2005. (in Chinese)
[8] FERY R L, DUKKE P D. The inheritance of resistance to southern root-knot nematode in ‘Carolina Hot’ cayenne pepper[J]. Journal of the American Society for Horticultural Science American Society for Horticultural Science, 1996, 121(6): 597-600.
[9] DIAN-CAPORALIN C, PIJAROWSKI L, JANUEL A, LEFEBVRE V, DAUBÈZE A, PALLOIX A, DALMASSO A, ABAD P. Spectrum of resistance to root-knot nematodes and inheritance of heat-stable resistance in pepper (Capsicum annuum L.)[J]. Theoretical and Applied Genetics, 1999, 99(3): 496-502.
[10] ZAMLJEN T, ZUPANC V, SLATNAR A, 魏小英, 孔秋生. 灌溉对两種辣椒产量及初生和次生代谢产物的影响[J]. 辣椒杂志, 2020, 18(2): 41-50.
ZAMLJEN T, ZUPANC V, SLATNAR A, WEI X Y, KONG Q S. Effects of irrigation on yield and primary and secondary metabolites of two kinds of pepper[J]. Journal of China Capsicum, 2020, 18(2): 41-50. (in Chinese)
[11] BOITEUX L S, CHARCHAR J M. Genetic resistance to root-knot nematode (Meloidogyne javanica) in eggplant (Solanum melongena)[J]. Plant Breeding, 1996, 115(3): 198-200.
[12] 许立志, 庞胜群, 刁 明, 张国儒, 李 琦, 牛 宁. 隶属函数法评价不同加工番茄品种耐盐性[J]. 新疆农业科学, 2017, 54(5): 833-842.
XUE L Z, PANG S Q, DIAO M, ZHANG G R, LI Q, NIU N. Comprehensive evaluation of salt tolerance of different processing tomato cultivars by membership function method [J]. Xinjiang Agricultural Sciences, 2017, 54(5): 833-842. (in Chinese)
[13] 李 翔, 杨 敏, 李 慧, 许红叶, 李 敏. 抗南方根结线虫辣椒品种的筛选[J]. 北方园艺, 2017(21): 71-74.
LI X, YANG M, LI H, XU H Y, LI M. Screening of hot pepper cultivars for resistance to Meloidogyne incognita[J]. Northern Horticulture, 2017(21): 71-74. (in Chinese)
[14] BYBD D W, KIRKPATRICK J T, BARKER K R. An improved technique for clearing and staining plant tissues for detection of nematodes[J]. Journal of Nematology, 1983, 15(1): 142-143.
[15] FERY R L, THIES J A. Evaluation of Capsicum chinense Jacq cultigens for resistance to the southern root-knot nematode[J]. HortScience, 1997, 32(5): 923-926
[16] FERY R L, THIES J A. ‘TigerPaw-NR’, a root-knot nematode-resistant, habanero-type pepper[J]. HortScience, 2007, 42(7): 1721-1722.
[17] FERY R L, THIES J A. PA-559, a root-knot nematode-resis¬tant, red-fruited, habanero-type pepper[J]. HortScience, 2010, 45(5): 822-823.
[18] FERY R L, THIES J A. PA-560, a southern root-knot nematode-resistant, yellow-fruited, habanero-type pepper[J]. HortScience, 2011, 46(6): 946-947.
[19] GONÇALVES L S A, GOMES V M, ROBAINA R R, VALIM R H, RODRIGUES R, ARANHA F M. Resistance to root-knot nematode (Meloidogyne enterolobii) in Capsicum spp. accessions[J]. Revista Brasileira de Ciências Agrárias - Brazilian Journal of Agricultural Sciences, 2014, 9(1): 49-52.
[20] MARQUES M L S, CHADUD J V G, OLIVEIRA M F, NASCIMENTO A R, ROCHA M R. Identification of chili pepper genotypes (Capsicum spp.) resistant to Meloidogyne enterolobii[J]. Agricultural Science, 2019, 11(8): 165-175.
[21] PINHEIRO J B, SILVA G O, MACÊDO A G, BISCAIA D, RAGASSI C F, RIBEIRO C S C, CARVALHO S I C de, REIFSCHNEIDER F J B. New resistance sources to root-knot nematode in Capsicum pepper[J]. Horticultura Brasileira, 2020, 38: 33-40.
[22] LI N, LIN B, WANG H, LI X M, YANG F F, DING X H, YAN J B, CHU Z H. Natural variation in ZmFBL41 confers banded leaf and sheath blight resistance in maize[J]. Nature Genetics, 2019, 51: 1540-1548.
[23] FUJIMOTO T, MIZUKUBO T, ABE H, SEO S. Sclareol induces plant resistance to root-knot nematode partially through ethylene-dependent enhancement of lignin accumulation[J]. Molecular Plant-Microbe Interactions, 2015, 28(4): 398-407.
[24] DE WAELE D, ELSEN A, MARIAMA K, DHAKSHINA¬MO¬ORTHY S. Phenols and lignin are involved in the defense response of banana (Musa) plants to Radopholus similis infection[J]. Nematology, 2014, 16: 565-576.
[25] THIES J A, FERY R L. Heat stability of resistance to Meloidogyne incognita in Scotch Bonnet peppers (Capsicum chinense Jacq.)[J]. Journal of Nematology, 2000, 32(4): 356-361.
