多效唑影响朱顶红植株生长的转录组分析
2022-02-10黄宝华许小琼陈晓慧徐小萍张春渝林玉玲赖钟雄
黄宝华 许小琼 陈晓慧 徐小萍 张春渝 林玉玲 赖钟雄





摘 要:朱頂红具有较高观赏价值,但其高花茎和叶太长成为其发展盆栽的限制因素。本研究应用不同浓度的多效唑(paclobutrazol, PBZ)对朱顶红进行处理,观测其表型性状的特征,并应用RNA-seq技术进行转录本分析。结果表明,PBZ对朱顶红的株高及叶片长度具有抑制作用,随着PBZ浓度的增加,其株高越矮,叶长逐渐变短,各处理间呈显著差异,成熟的花茎高度也随PBZ浓度的增加而降低。经转录组分析,Q20介于98.320%~98.450%之间,均值为98.385%,说明测序质量较好,可以用于后续分析。差异基因富集最显著的途径为苯并噁唑嗪酮类化合物生物合成途径。对差异表达基因的GO功能分类进行分析,在生物过程分类下的6个比对中,差异表达基因富集到的前3个词条分别是:代谢过程、细胞过程、单一生物过程。在细胞组成的6个比对中,差异表达基因富集到的前7个词条都是一致的,分别是细胞、细胞部分、膜、细胞器、膜部分、细胞器部分、大分子复合物,其富集相似度很高。在分子功能的6个比对中,前3个的富集词条分别是催化活性、绑定、运输活动。表明不同浓度PBZ主要通过影响植物体内各种生物学过程来调控朱顶红矮化,同时也涉及改变植物组织细胞组分以及调控分子功能来影响朱顶红矮化。KEGG功能分类中,代谢占比最大,都达60%以上。Pathway富集分析也显示差异基因显著富集在代谢途径和次生代谢产物的生物合成中。通过对代谢通路进行分析,表明影响脂肪酸的合成及丙二酰COA的提升是矮化的影响因素之一。木质素的大量合成和微管蛋白TUBA、TUBB的提升促使茎粗的增加。茉莉酸甲酯和不饱和脂肪酸类的提升和合成促使其抗性的提升。HSF、hsp70及HSP90基因表达的提升,提高了其耐热性。研究结果为进一步了解PBZ对朱顶红的影响机理奠定了基础,也为朱顶红育种提供了参考。
关键词:朱顶红;多效唑;RNA-seq;生长
中图分类号:S682.2.5 文献标识码:A
Transcriptome Analysis of the Effect of Paclobutrazol on the Growth of Hippeastrum
HUANG Baohua1, XU Xiaoqiong2, CHEN Xiaohui2, XU Xiaoping2, ZHANG Chunyu2, LIN Yuling2,
LAI Zhongxiong2*
1. Zhangzhou Institute of Technology, Zhangzhou, Fujian 363000, China; 2. Institute of Horticultural Biotechnology, Fujian Agriculture and Forestry University, Fuzhou, Fujian 350002, China
Abstract: Hippeastrum has high ornamental value, but its long flower stem and leaf are the limiting factors for its potted development. In this study, different concentrations of paclobutrazol (PBZ) were used to treat Hippeastrum for observing the characteristics of its phenotypic traits, and using RNA-seq technology for transcript analysis. PBZ could inhibit the plant height and leaf length of Hippeastrum. With the increase of PBZ concentration, the plant height and the leaf length became shorter, and there were significant differences among different treatments. The mature flower stem height also decreased with the increase of PBZ concentration. After transcriptome analysis, Q20 ranged from 98.320% to 98.450%, and the average percentage was 98.385%, indicating that the sequencing quality was good and could be used for subsequent analysis. The most significant pathway of differential gene enrichment was the biosynthesis pathway of benzoxazozinone compounds. GO functional classification of differentially expressed genes was analyzed. Among the six comparisons under biological process classification, the first three terms enriched by differentially expressed genes were metabolic process, cellular process and single biological process. Among the six comparisons of cell composition, the first seven terms enriched by differentially expressed genes were all the same, namely cell, cell part, membrane, organelle, membrane part, organelle part and macromolecular complex, with high similarity in enrichment. Among the six comparisons of molecular functions, the first three enrichment terms were catalytic activity, binding and transport activity respectively. The results indicated that different concentrations of PBZ mainly regulated the dwarfism mechanism of Hippeastrum through affecting various biological processes in plants, and also involve changing plant tissue cell components and regulating molecular functions to affect Hippeastrum dwarfism. In the functional classification of KEGG, metabolism accounts for the largest proportion, reaching more than 60%. Pathway enrichment analysis also showed that differential genes were significantly enriched in metabolic pathways and biosynthesis of secondary metabolites. The metabolic pathway analysis indicated that the influence of fatty acid synthesis and the promotion of malonyl COA was one of the factors affecting the dwarfing. The massive synthesis of lignin and the increase of tubulin TUBA and TUBB promoted the increase of stem thickness. The enhancement and synthesis of methyl jasmonate and unsaturated fatty acids promoted the enhancement of its resistance. The increase of HSF, hsp70 and HSP90 gene expression improved its heat resistance. The experimental results would lay a foundation for further understanding the effect mechanism of PBZ on Hippeastrum, and also provide a reference for Hippeastrum breeding.
Keywords: Hippeastrum; paclobutrazole; RNA-seq; growth
DOI: 10.3969/j.issn.1000-2561.2022.01.023
朱顶红(Hippeastrum)是多年生草本球根花卉[1],在花卉产业中具有很大的商业价值。可根据其不同用途分为切花、盆花、景观植物等三类。近年来,随着朱顶红产业的不断发展,盆栽朱顶红越来越受到人们的青睐。但在朱顶红盆栽过程中,其高茎和叶长成为其发展的限制因素。一方面高茎和叶长易折断,影响其商品价值;另一方面,增加了其运输难度及成本。为减少其运输体积及提高商品价值,对朱顶红进行矮化是较为有效的一种方式。而应用植物生长调节剂(plant growth regulators, PGRs)是矮化植株的重要手段,多效唑(paclobutrazol, PBZ)是PGRs其中一种,在园艺作物及农作物中已得到了广泛使用[2-11]。多项研究表明,PBZ较为显著的作用之一就是矮化植株,同时也可促使植物叶片发生形态及生理方面的变化,如叶面积减少[12-13],叶绿素含量增加,提高其抗非生物胁迫能力及抗氧化水平[14-16]。目前对朱顶红矮化方面的研究还相对较少,沈健等[17]及吕文涛等[18]的研究表明,PBZ对朱顶红有较好的矮化效果,但对朱顶红矮化分子基础的了解相对较少。转录组测序技术(RNA-Seq)是最近发展起来的一种新型转录组研究手段,它以高通量和定量的方式对整个转录组进行较为快速、精确、灵敏的调查[19],因其无参考基因组的限制,为没有基因组序列的non-model生物提供了一个较为全面有效的方式来分析转录组。本研究以盆栽朱顶红为材料,对经过PBZ处理和未经处理的朱顶红叶片进行转录组测序,利用转录组数据分析朱顶红矮化的分子机制。转录组数据集将为朱顶红新基因的发现、基因组学和功能基因组学提供有价值的资源。此外,研究矮化的分子机制对朱顶红基因育种改变植株类型具有重要意义。
1 材料与方法
1.1 材料与处理
将盆栽朱顶红(Hippeastrum)植株(4片叶,株高15 cm左右)于1月放入温室中(20~25℃)生长20 d后,应用不同浓度PBZ对其进行7 d 2次的灌根处理,清水处理为对照,处理组分别设置浓度处理为0.1、0.2、0.3 g/L,编号分别为PBZ1、PBZ2、PBZ3,每组处理20株,每株100 mL,对其进行控水促使其快速长出新叶,抽出花葶,全部植株都抽出花葶穩定生长时进行表型性状的观测。每处理取3株生长较为一致的植株叶片进行混样,取完快速用液氮处理,-80℃保存备用。提取RNA后进行转录组测序。试验共进行3次生物学重复。
1.2 RNA分离和文库的构建
采用天根生化科技(北京)有限公司的RNA植物纯化试剂盒提取样品总RNA,使用Agilent 2100 Bioanalyzer(Agilent RNA 6000 Nano Kit)检测total RNA的浓度、RIN值、28S/18S和片断大小,纯度使用紫外分光光度计NanoDropTM进行测定。质量合格的总RNA,用带有Oligo(dT)的磁珠富集纯化mRNA,在高温条件下使用二价阳离子于NEBNext第1链合成反应缓冲液(5×)中使其片断化,以打断后的mRNA为模板合成一链cDNA,然后配置二链合成反应体系合成二链cDNA,并使用试剂盒纯化回收、粘性末端修复、cDNA的3¢末端加上碱基“A”并连接接头,然后进行片段大小选择,最后进行PCR扩增;构建好的文库用Agilent 2100 Bioanalyzer和ABI StepOnePlus Real-Time PCR System质检,合格后进行测序。
1.3 差异表达基因及其功能分类和富集分析
本项目使用基于泊松分布原理的PossionDis方法进行差异基因的检测。参照参数为Fold Change≥2和FDR(false discovery rate)≤0.01来筛选差异基因。对差异检验的Q-value作多重的假设检验校正,通过控制FDR来决定Q-value的域值[20]。在获得差异检验的FDR值时,根据FPKM值计算该基因在不同样本间的差异表达倍数。FDR值越小,差异倍数越大,则表明差异越显著。
根据GO(gene ontology)注释结果及官方分类,将差异基因进行功能分类,同时基于GOseq R软件中的phyper函数进行富集分析。KEGG(kyoto encyclopedia of genes and genomes)途径中的差异表达基因的富集分析应用R软件,基于NCBI非冗余蛋白质数据库、大型蛋白质家族数据库、NCBI非冗余核苷酸数据库、蛋白质直系同源数据库、KEGG同源基因数据库、手动注释和鉴定蛋白质序列数据库、基因功能分类数据库等数据库注释基因功能。
1.4 部分差异表达基因在不同PBZ浓度处理下的特异性表达
为进一步了解代谢途径中重要差异表达基因在不同PBZ浓度处理下的特异性表达,基于转录组数据,提取HIDH(CL7862.Contig1_All)、7-IOMT(CL5344.Contig3_All)、EPHX2(Unig¬e-ne1460_All)、HSPA1s(CL10622.Contig2_ All)、FAB2(CL12018.Contig4_All)、FATA(Unig-ene56852_All)、PA04(CL9035.Contig5_All)在对照组及不同PBZ浓度处理下的FPKM值,分析其表达情况,并且利用TBtools绘制热图。
1.5 表型测定方法
用直尺测定朱顶红的植株高度,游标卡尺测量朱顶红叶片的长度、宽度和鳞茎粗,并观测其生长状态和花期等指标。植株高度测其盆面到苗顶最高位置,叶片测量从里向外数第2个叶片的叶长和叶宽(叶片最宽处),每处理重复6株,取平均值。
2 结果与分析
2.1 表型性状特征
不同浓度PBZ处理朱顶红后,对其进行性状观测(表1)。随着PBZ浓度的增加,其株高越矮,叶长逐渐变短,各处理间呈显著差异,成熟的花茎高度也随PBZ浓度的增加而降低。而叶宽及茎粗逐渐增加,各处理间叶宽呈显著差异,茎粗无显著差异。表明PBZ对朱顶红的株高及叶长抑制效果显著,而且对朱顶红的花期也有一定影响。经群体观测发现,PBZ处理使朱顶红推迟开花,花期延后。
2.2 朱顶红PBZ处理前后的转录组质量评估及差异表达基因分析
测序包括对照组(CK)、处理组(PBZ1、PBZ2、PBZ3)共4个样品。各样品数据过滤后的reads占总reads数的比例介于79.020%~83.930%之间,均值为81.990%;Q20介于98.320%~98.450%之间,均值為98.385%,说明测序质量较好,可以用于后续分析。其中,无论是从过滤后的reads的比例还是Q20的数值来看,均为PBZ3>PBZ2> PBZ1,说明PBZ3的测序质量优于PBZ2与PBZ1。
测序结果中,在CK vs PBZ1中检测到最多数量的差异表达基因(differential expressed genes, DEGs),其中差异上调表达基因766条,差异下调表达基因6542条;PBZ1 vs PBZ2中的差异表达基因最少,其中差异上调表达基因1802条,差异下调表达基因975条。此外,本次差异基因富集最显著的途径为苯并噁唑嗪酮类化合物生物合成途径。
2.3 朱顶红PBZ处理前后的基因表达量分析
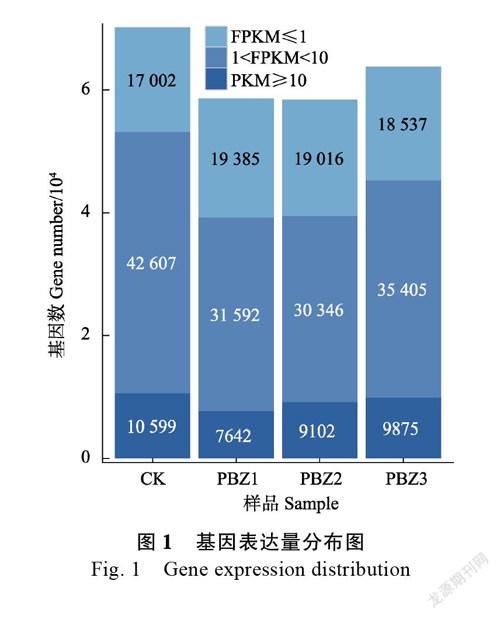
根据各处理的基因表达量信息,为了较为直观地展示每个处理样品在FPKM区间的基因数目,分别对FPKM≤1、1
对样品间的差异表达基因进行层次聚类分析(图2)。图中红色愈深表明其上调倍数越大,蓝色愈蓝表明下调倍数越大。各PBZ处理与对照之间、各PBZ处理之间的比较呈两大类。其中处理PBZ1与对照比较下降倍数较大,而处理PBZ1与PBZ2、PBZ3比较其上调倍数较大。
2.5 差异表达基因的GO功能分类
根据差异基因的检测结果,为了更好地分析差异基因的生物学功能及其参与的代谢通路,对其进行了GO功能分类(表2)。GO分为三大类:生物过程、细胞组分和分子功能。表2展示了这三大分类下的最主要的一些词条,CK与其他处理之间的差异表达基因的数量不同,但富集到的主要词条基本一致。在生物过程分类下的6个比对中,差异表达基因富集到的前3个词条分别是:代谢过程、细胞过程、单一生物过程。CK vs PBZ1、CK vs PBZ2、CK vs PBZ3、PBZ1 vs PBZ2第4位词条为定位,PBZ1 vs PBZ3、PBZ2 vs PBZ3的第4位词条为生物调节。在细胞组成的6个比对中,差异表达基因富集到的前7个词条都是一致的,分别是细胞、细胞部分、膜、细胞器、膜部分、细胞器部分、大分子复合物,其富集相似度很高。在分子功能的6个比对中,前3个的富集词条分别是催化活性、绑定、运输活动。这说明,不同浓度PBZ主要通过影响植物体内各种生物学过程来调控朱顶红矮化,同时也涉及改变植物组织细胞组分以及调控分子功能来影响朱顶红矮化,因此通过GO功能分类出来的富集途径解释朱顶红矮化机理的调控网络具有较为积极的意义。
2.6 差异表达基因的KEGG生物通路分类及富集分析
2.6.1 KEGG功能分类 根据差异表达基因参与的KEGG代谢通路主要将其分为5个分支,分别为细胞过程、环境信息处理、遗传信息处理、代谢及有机系统。共有差异表达Unigene数目为22 468个。其中CK vs PBZ1的差异Unigene数目为5497,占24.47%;CK vs PBZ2的差异Unigene数目为3804,占16.93%;CK vs PBZ3的差异Unigene数目为2890,占12.86%;PBZ1 vs PBZ2的差异Unigene数目为2269,占10.10%;PBZ1 vs PBZ3的差异Unigene数目为4995,占22.23%;PBZ2 vs PBZ3的差异Unigene数目为3013,占13.41%(表3)。6个对比中5个分支的类别一致,其中细胞过程仅含运输和分解代谢,环境信息处理包括信号转导和膜运输,遗传信息处理包括翻译、转录、折叠分类降解、复制和修复,代谢则包含全局和总览图、碳水化合物代谢、氨基酸代谢、脂质代谢、能量代谢、其他次生代谢产物的生物合成、核苷酸代谢、萜类和多酮类化合物的代谢、辅助因子和维生素的代谢、其他氨基酸的代谢、多糖的生物合成和代谢,有机系统仅包含环境适应。6个比对中,细胞过程的占比分别为是5.08%、5.57%、3.98%、4.85%、4.76%、5.18%,环境信息处理的占比分别为是6.19%、7.75%、7.09%、5.95%、5.33%、6.77%,遗传信息处理的占比分别为是19.28%、19.98%、17.44%、17.58%、16.64%、16.43%,代谢的占比分别为是64.13%、62.01%、66.12%、67.30%、69.25%、67.61%,有机系统的占比分别为是5.33%、4.68%、5.36%、2.56%、4.02%、4.02%。可见,6个比对中,各分类所占比例大致相同,代谢占比最大,均达60%以上,而代谢中前2位的为全局和总览图、碳水化合物代谢,这表明PBZ处理影响了朱顶红的代谢,进而影响了其生长发育,进而有了矮化的表型性状特征。
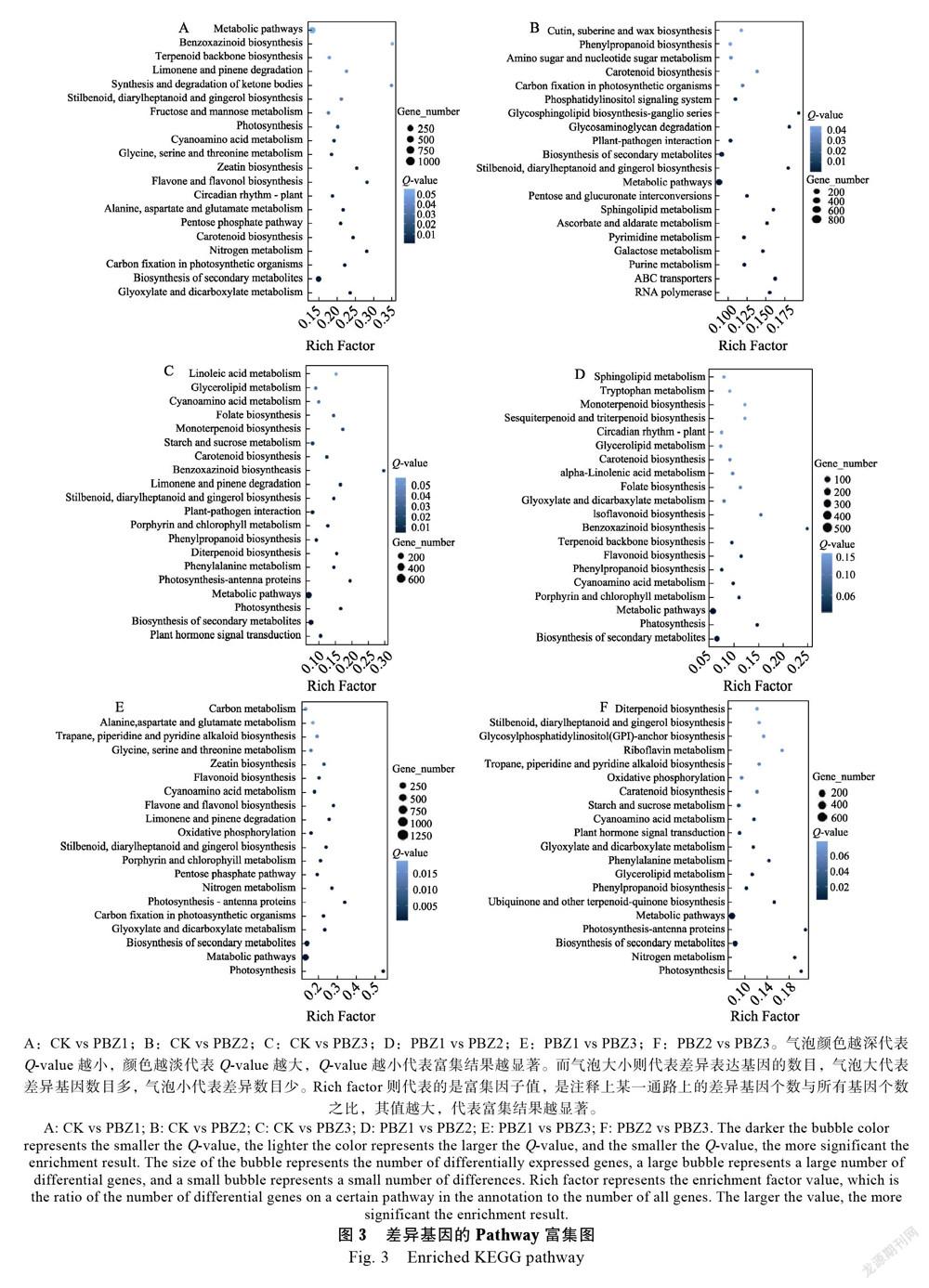
2.6.2 差异基因的Pathway富集分析 通过对差异基因所参与的途径进行分析,有助于了解朱顶红矮化机制所涉及的途径,从而进一步了解PBZ调控朱顶红矮化的分子机理。图3所示是对DEGs进行KEGG分类中Q-value较小的前20个通路。从图3中可看出,基于富集因子,在CK vs PBZ1比对中显著富集的前5个途径为苯并噁嗪类生物合成、酮体的合成与降解、氮素代谢、黄酮和黄酮生物合成、玉米素的生物合成(图3A);CK vs PBZ2显著富集的前5个途径有糖鞘脂生物合成-神经节系列、糖胺聚糖降解、二苯乙烯,二芳基庚烷和姜酚的生物合成、ABC转运蛋白、鞘脂类代谢(图3B);CK vs PBZ3显著富集的前5途径有苯并噁嗪类生物合成、光合作用-触角蛋白、单萜生物合成、光合作用、柠檬烯和蒎烯降解(图3C);PBZ1 vs PBZ2显著富集的前5个途径有苯并噁嗪类生物合成、异黄酮的生物合成、光合作用、单萜生物合成、倍半萜和三萜生物合成(图3D);PBZ1 vs PBZ3显著富集的前5个途径有光合作用、光合作用-觸角蛋白、黄酮和黄酮生物合成、氮素代谢、柠檬烯和蒎烯降解(图3E);PBZ2 vs PBZ3显著富集的前5个途径有光合作用-触角蛋白、光合作用、氮素代谢、核黄素代谢、泛醌和其他萜类醌的生物合成(图3F)。在CK vs PBZ1、CK vs PBZ2、CK vs PBZ3、PBZ1 vs PBZ2、PBZ1 vs PBZ3和PBZ2 vs PBZ3各组对比中,差异基因数目最多的是代谢途径,其次为次生代谢产物的生物合成,且都显著富集到了这2个途径。总之,苯并噁嗪类生物合成途径明显参与响应PBZ处理。
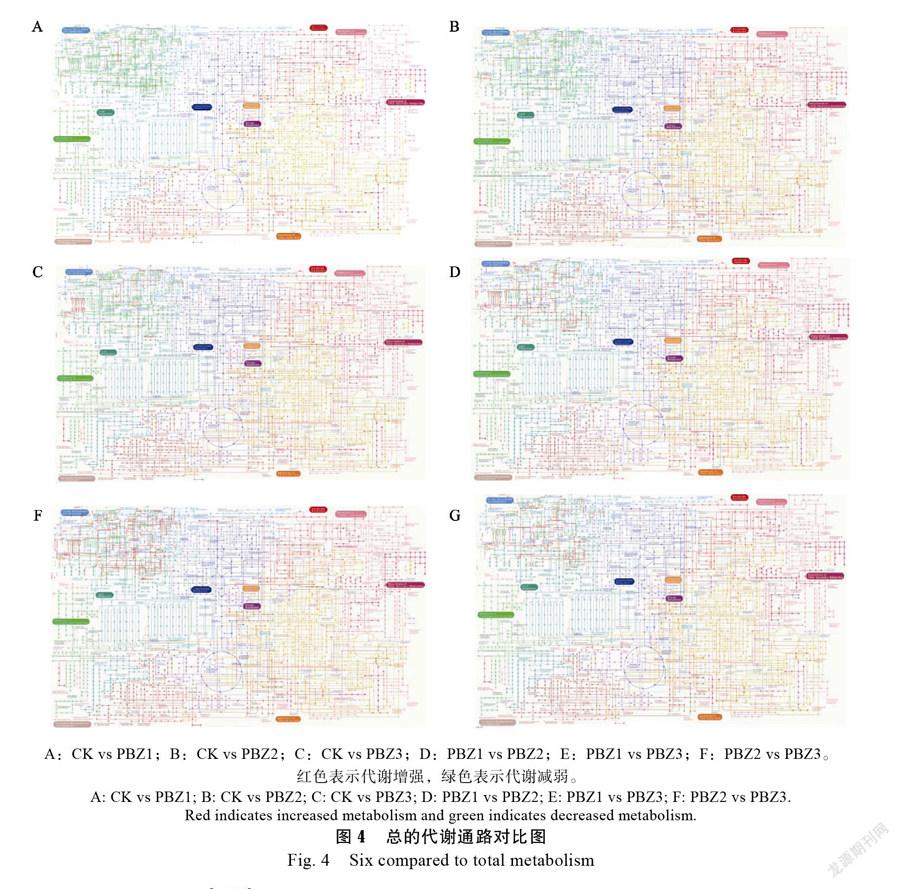
2.6.3 代谢通路的分析 图4是6个对比中几个代谢的大致变化,红色代表代谢增强,绿色代表代谢减弱。可看出,6个对比的代谢变化大致相同。其中核苷酸代谢、辅助因子和维生素的代谢、其他次生代谢产物的生物合成等代谢途径都增强,其中嘌呤、嘧啶、β-丙氨酸、咖啡因、核黄素、硫胺素、维生素B6、卟啉和叶绿素、叶酸、苯丙烷生物合成、类黄酮生物合成、黄酮和黄酮醇生物合成、吲哚生物碱生物合成、异喹啉生物碱生物合成、泛酸和CoA生物合成、泛醌和其他萜类醌生物合成等呈上升趋势。聚糖的生物合成和代谢途径、脂类代谢、萜类和聚酮化合物的代谢减弱,其中糖鞘脂生物合成-乳酸和新乳酸系列、糖鞘脂生物合成-球状体、糖基转移酶、N-聚糖生物合成、其他聚糖降解、蛋白聚糖、亚油酸代谢、糖胺聚糖生物合成硫酸角蛋白、α-亚麻酸代谢、类胡萝卜素生物合成、单萜、倍半萜类和三萜类生物合成、玉米素生物合成、柠檬烯和蒎烯降解、脂肪酸生物合成和降解、鞘脂类代谢、甘油酯类代谢、甘油磷脂代谢、花生四烯酸代谢、不饱和脂肪酸的生物合成、脂类生物合成蛋白质等呈下降趋势。在脂肪酸生物代谢途径中,丙二酰辅酶A、十六碳烯酸、十八碳烯酸上调,其他脂肪酸都受到抑制,可能是朱顶红经过PBZ处理后,抑制了大部分脂肪酸的合成和降解,而一些特殊的脂肪酸合成增加。α-亚麻酸途径中,最终产物是茉莉酸甲酯增加。异黄酮途径中,大量合成葡萄糖苷-丙二酸,刚好下一步形成丙二酰COA。在苯丙烷生物合成途径中,促进木质素的合成。在内质网中的蛋白质加工代谢中,与耐热相关的基因HSF、hsp70、HSP90都上调,表明可提高其耐热性。
2.7 部分差异表达基因在不同PBZ浓度处理下的特异性表达
基于转录组数据,挑选7个与代谢途径显著相关的差异表达基因,即HIDH、7-IOMT、EPHX2、HSPA1s、FAB2、FATA、PA04,结合其FPKM值通过TBtools在线软件进行聚类热图分析。结果(图5)表明,与对照组相比,大多数差异表达基因(HIDH、FATA、PAO4、7-IOMT、EPHX2及FAB2)在PBZ2浓度处理下表现为下调表达,其中HIDH、7-IOMT以及FAB2为显著下调。在PBZ1浓度处理下,FATA和PAO4表达下调,7-IOMT和HSPA1s则为表达上调。在PBZ3浓度处理下,HIDH、FATA及PAO4表达显著上调,HSPA1s及EPHX2则为下调表达,其中HSPA1s表达显著下调。这些结果为进一步研究朱顶红矮化机制提供了借鉴。
3 讨论
朱顶红经不同浓度的PBZ处理后,植株变矮,叶长变短,叶宽变宽,茎粗增加。与沈健等[17]及吕文涛等[18]的研究结果一致,都认为PBZ对朱顶红的矮化效果显著。不同浓度的矮壮素(CCC)对朱顶红的矮化效应则不尽相同,300 mg/L的CCC对朱顶红的叶长有一定抑制作用,其他浓度抑制效果不明显,表明不同植物生长调节剂对朱顶红生长特征的影响不同。多效唑(paclobutrazol, PBZ)是一种较为高效的生长延缓剂,主要作用是阻碍赤霉素的生物合成[21-22],加速体内生长素的分解,从而延缓、抑制植株的营养生长,还具有抑制茎杆伸长,缩短节间、促进植物分蘖、增加植物抗逆性能,提高产量等效果。除应用于果树的矮化栽培外,曾广泛用于防止连晚秧苗徒长,大豆、大麦和小麦等农作物的降矮抗倒。对经PBZ处理后的朱顶红进行形态特征观察后,认为与多效唑的作用基本吻合。
本研究首次采用RNA-seq技术对PBZ处理后的朱顶红基因表达谱进行了比较,发现其差异表达主要集中在代谢途径及次生代谢产物的生物合成中。根据该结果,试图全面了解PBZ对朱顶红生长发育的影响,并进一步研究朱顶红矮化的分子机制,为朱顶红的分子育种研究提供一定的理论基础。将重点放在4个浓度处理后基因表达的对比上,其中核苷酸代谢、辅助因子和维生素的代谢、其他次生代谢产物的生物合成这些代谢途径增强,聚糖的生物合成和代谢途径、脂类代谢、萜类和聚酮化合物的代谢减弱。β-酮脂酰-ACP还原酶、β-酮脂酰-ACP合成酶的降低,使催化从乙酰CoA及丙二酰CoA合成长链脂肪酸的反应降低,从而使整个脂肪酸的合成降低,而脂肪酸合成的降低会导致肥胖、生长发育迟缓等问题。而1-氨基环丙烷-1-羧酸(ACC)的矮化作用也是在催化乙酰CoA羧化成丙二酰CoA时降低,PBZ和ACC的作用类似。丙二酰辅酶A的增加则是由于异黄酮途径中大量合成的葡萄糖苷-丙二酸促使丙二酰辅酶A的形成。在动物上,丙二酰COA会导致肥胖[23]。苯丙烷类生物合成中促进了木质类的合成。在花生四烯酸代谢中,20-羟二十烷四稀酸(20-HETE)下降,四氢呋喃二元醇显著升高,四氢呋喃型也属于木质素类,木质素类也显著提高。吞噬体中,2个关键基因TUBA、TUBB上调,TUBA和TUBB以非共价键的形式连接形成异二聚体,异二聚体首尾相连则形成微管蛋白原纤维,这在一定程度上可以解释PBZ处理促使木质素类的合成及微管蛋白的提升,使茎粗增加。通过对银杏基因组的研究发现,古树主要通过持续合成木质素等物质,增加树干的密度和强度,以支撑不断增粗的树体。十六碳烯酸、十八碳烯酸、十八碳二烯酸在代谢途径中大量合成,这些物质都属于ω-3脂肪酸(omega-3 fatty acids)的家族成员,又称n-3脂肪酸,是一类不饱和脂肪酸,不饱和脂肪酸具有提高抗性、抗衰老、抗氧化的功能。亚麻酸代谢途径中,茉莉酸甲酯显著提升,在其他途径中还形成了3,6-壬二烯醛、9-醛基壬酸、乙烯醚类脂肪酸等不饱和脂肪酸类。可见,PBZ的作用机制是通过提高茉莉酸甲酯和不饱和脂肪酸类的合成,从而提高免疫力。赵曼如等[24]认为茉莉酸甲酯作为植物激素和信号分子,外用则可激发植物防御基因的表达,提高其抗逆性。徐建祥等[25]也认为茉莉酸甲酯具有诱导和激活植物体内自身免疫系统来抵御外来虫害侵害的功能。王文霞等[26]也认为不饱和脂肪酸及其衍生物在植物抗逆反应中发挥着重要的生理功能。值得特别指出的是,显著富集的苯并噁嗪类生物合成途径,代谢产物是丁布,对于提高植物抗性具有重要意义。
在內质网中的蛋白质加工代谢中,基因HSF、hsp70及HSP90都上调,hsf是耐热转录因子,hsp70和HSP90是热胁迫的时候,与hsf形成复合体,启动耐热反应,所以PBZ处理后可以提高耐热性。研究发现,耐热番茄Hsf24基因在提高番茄耐热性上有着尤为重要的作用[27]。在动物上,李秋玲等[28]也认为HSF1基因microRNA SNPs可作为奶牛抗热应激的候选分子标记应用于育种实践。
细胞数量的多少和大小控制着叶片的大小,而细胞分裂和细胞膨胀则控制着细胞的数量和大小,参与这些过程的基因表达变化与叶片的变化和植株矮化相关。基因统计结果显示,很多有关细胞分裂和细胞膨胀的相关基因在PBZ处理下都呈现出较为明显的变化。
参考文献
[1] 刘 燕. 园林花卉学[M]. 北京: 中国林业出版社, 2003.
LIU Y. Ornamental flowers[M]. Beijing: China Forestry Publishing House, 2003. (in Chinese)
[2] 崔向东, 史素霞. 多效唑对水仙高度和花期的影响[J]. 安徽农业科学, 2011, 39(12): 6979-6980.
CUI X D, SHI S X. The effects of PP333 on the height and florescence of Narcissus tazetta[J]. Journal of Anhui Agricultural Sciences, 2011, 39(12): 6979-6980. (in Chinese)
[3] 华智锐, 李小玲. 多效唑与矮壮素对百合试管苗生长的影响[J]. 中国农学通报, 2015, 31(13): 144-149.
HUA Z R, LI X L. Effect of paclobutrazol and chloride on the growth of lily plantlets[J]. Chinese Agricultural Science Bulletin, 2015, 31(13): 144-149. (in Chinese)
[4] 聂 艳. 乙烯利和多效唑对簕杜鹃观赏性状调控的生理基础及花芽分化进程研究[D]. 北京: 中国林业科学研究院, 2017.
NIE Y. Study on the physiological basis and flower bud differentiation process of ethephon and paclobutrazol on the regulation of ornamental characters of Bougainvillea[D]. Beijing: Chinese Academy of Forestry, 2017. (in Chinese)
[5] 李 芸, 虞 毅, 汤 锋, 原伟杰, 肖 芳, 王 猛. 多效唑对2年生沙地柏生长和生理特征的影响研究[J]. 干旱区资源与环境, 2015, 29(6): 110-116.
LI Y, YU Y, TANG F, YUAN W J, XIAO F, WANG M. Effect of paclobutrazol on growth and physiological characteristics of two-year-old Sabina vulgaris[J]. Journal of Arid Land Resources and Environment, 2015, 29(6): 110-116. (in Chinese)
[6] 杨瑞斌. 多效唑对盆栽芭蕾苹果矮化效果[J]. 河北果树, 2015(1): 5.
YANG R B. Paclobutrazol on the dwarfing effect of potted ballet apple[J]. Hebei Fruits, 2015(1): 5. (in Chinese)
[7] 何文芳. 多效唑对水培风信子矮化作用研究[J]. 中国园艺文摘, 2013, 29(5): 29-30.
HE W F. Study on the dwarfing effect of paclobutrazol on hydroponic hyacinth[J]. China Horticulture Digest, 2013, 29(5): 29-30. (in Chinese)
[8] 吕长平, 陈海霞. 多效唑对盆栽花叶美人蕉的矮化效果[J]. 湖南农业大学学报(自然科学版), 2003, 29(2): 129-130.
LV C P, CHEN H X. The dwarfing effect of paclobutrazol on potted Canna[J]. Journal of Hunan Agricultural University (Natural Science), 2003, 29(2): 129-130. (in Chinese)
[9] 蔡建国, 王丽英, 涂海英, 胡本林, 余有祥, 刘 静. 多效唑对盆栽北美冬青的矮化效应[J]. 福建林业科技, 2014, 41(3): 36-39.
CAI J G, WANG L Y, TU H Y, HU B L, YU Y X, LIU J. Effect of paclobutrazol on dwarfing of potted Ilex verticillata[J]. Fujian Forestry Science and Technology, 2014, 41(3): 36-39. (in Chinese)
[10] 陆海英. 多效唑对两种草坪草形态、生理及解剖结构的影响[D]. 扬州: 扬州大学, 2015.
LU H Y. The effect of paclobutrazol on the morphology, physiology and anatomical structure of two kinds of turfgrass[D]. Yangzhou: Yangzhou University, 2015. (in Chinese)
[11] 刘云强. 三种植物生长延缓剂在草地早熟禾上的应用研究[J]. 辽宁农业职业技术学院学报, 2019, 21(6): 1-3.
LIU Y Q. Study on application of three plant growth retardants on Kentucky bluegrass[J]. Journal of Liaoning Agricultural Technical College, 2019, 21(6): 1-3. (in Chinese)
[12] NAIR V D, JALEEL C A, GOPI R, PANNEERSELVAM R. Changes in growth and photosynthetic characteristics of Ocimum sanctum under growth regulator treatments[J]. Frontiers of Biology in China 2009, 4: 192-199.
[13] COHEN Y, ALONI D D, ADUR U, HAZON H. Characterization of growth-retardant effects on vegetative growth of date palm seedlings[J]. Journal of Plant Growth Regulation, 2013, 32: 533-541.
[14] OZMEN A D, TUKAN F O. Effects of paclobutrazol on response of two barley cultivars to salt stress[J]. Biologia Plantarum, 2003, 46: 263-268.
[15] LIN K H, PAI F H, HWANG S Y, LO H F. Pre-treating with paclobutrazol enhanced chilling tolerance of sweetpotato[J]. Plant Growth Regulation, 2006, 49: 249-262.
[16] SRIVASTAV M, KISHOR A, DAHUJA A, SHARMA R R. Effect of paclobutrazol and salinity on ion leakage, proline content and activities of antioxidant enzymes in mango (Mangifera indica L.)[J]. Scientia Horticulturae, 2010, 125: 785-788.
[17] 沈 健, 陸信娟, 王春彦. 生长延缓剂对盆栽朱顶红的矮化效应[J]. 江苏农业科学, 2008(2): 149-151.
SHEN J, LU X J, WANG C Y. The dwarfing effect of growth retardant on potted Hippeastrum[J]. Jiangsu Agricultural Sciences, 2008(2): 149-151. (in Chinese)
[18] 吕文涛, 周玉珍, 娄晓鸣, 成海钟, 陈 艳. 多效唑和矮壮素对盆栽朱顶红矮化的影响[J]. 湖北农业科学, 2016, 55(16): 4214-4216.
LV W T, ZHOU Y Z, LOU X M, CHENG H Z, CHEN Y. Dwarfing effects of paclobutrazol and chlorocholine chloride on potted Hippeastrum vittatum[J]. Hubei Agricultural Scie¬¬n¬ces, 2016, 55(16): 4214-4216. (in Chinese)
[19] WANG Z, GERSTEIN M, SNYDER M. RNA-Seq: a revol-¬utionary tool for transcriptomics[J]. Nature Reviews Geneti¬¬cs, 2009, 10(1): 57-63.
[20] BENJAMINI Y, YEKUTIELI D. The control of the false discovery rate in multiple testing under dependency[J]. The Annals of Statistics, 2001, 29: 1165-1188.
[21] 潘瑞炽. 植物生长延缓剂的生理作用及其应用[J]. 华南师范大学学报(自然科学版), 1984(2): 121-129.
PAN R Z. The physiological function and application of plant growth retardant[J]. Journal of South China Normal University Natural Science, 1984(2): 121-129. (in Chinese)
[22] GROSSMANN K. Plant growth retardants as tools in physi¬o¬logical research[J]. Plant Physiology, 1990, 78(4): 640-648.
[23] RUDERMAN N B, SAHA A K, KRAEGEN E W. Minirev-¬iew: malonyl CoA, AMP-activated protein kinase, and adip¬¬osity[J]. Endocrinology, 2003, 144(12): 5166-5171.
[24] 赵曼如, 胡文忠, 于皎雪, 管玉格, 高红豆, 龙 娅. 茉莉酸甲酯对果蔬抗性、抗氧化活性及品质影响的研究进展[J]. 食品工业科技, 2020, 41(4): 328-332.
ZHAO M R, HU W Z, YU J X, GUAN Y G, GAO H D, LONG Y. Research progress on effects of methyl jasmonate on resistance, antioxidant activity and quality of fruits and vegetables[J]. Science and Technology of Food Industry, 2020, 41(4): 328-332. (in Chinese)
[25] 徐建祥, 曹卫菊. 外用茉莉素诱导植物抗虫性研究进展[J]. 昆虫知识, 2005, 42(3): 250-254.
XU J X, CAO W J. Advances in researches on induced plant resistance to insects by external-used jasmonates[J]. Insect Knowledge, 2005, 42(3): 250-254. (in Chinese)
[26] 王文霞, 李曙光, 白雪芳, 杜昱光. 不饱和脂肪酸及其衍生物在植物抗逆反应中的作用[J]. 植物生理学通讯, 2004, 40(6): 741-748.
WANG W X, LI S G, BAI X F, DU Y G. The role of uns-¬aturated fatty acids and their derivatives in plant stress res¬¬istance[J]. Plant Physiology Newsletter, 2004, 40(6): 741- 748. (in Chinese)
[27] 李振军, 李景富. 耐热番茄Hsf24基因克隆与分析[J]. 东北农业大学学报, 2010, 41(3): 29-33, 161.
LI Z J, LI J F. Cloning and analysis of heat tolerance tomato Hsf 24 gene[J]. Journal of Northeast Agricultural University, 2010, 41(3): 29-32. (in Chinese)
[28] 李秋玲, 鞠志花, 賈祥捷, 黄金明, 李建斌, 李荣岭, 李 芳, 王长法, 仲跻峰. 中国荷斯坦牛HSF1基因microRNA SNPs与耐热性能的相关性研究[J]. 中国农业科学, 2011, 44(3): 570-578.
LI Q L, JU Z H, JIA X J, HUANG J M, LI J B, LI R L, LI F, WANG C F, ZHONG J F. Identification of MicroRNA SNPs of HSF1 gene and their association with heat tolerance in Chinese Holstein[J]. Scientia Agricultura Sinica, 2011, 44(3): 570-578. (in Chinese)
