油棕脂肪酸外运蛋白基因FAX1的克隆及表达分析
2022-02-10金龙飞李睿曹红星颜彦
金龙飞 李睿 曹红星 颜彦




摘 要:油棕(Elaeis guineensis Jacq.)原產非洲,是重要的热带木本油料作物,产油效率极高。目前油棕广泛种植在东南亚、非洲、中南美洲和我国的海南、云南、广东、广西等省(区),油棕果实压榨的棕榈油是重要的食用油和工业原料。脂肪酸在植物质体中合成,然后转运到内质网上进行加工和修饰。为了研究油棕脂肪酸的转运机制,以‘热油4号’油棕为研究对象,采用生物信息学和荧光定量PCR挖掘控制油棕脂肪酸转运的关键基因。脂肪酸外运蛋白1(fatty acid export 1, FAX1)是植物脂肪酸转运蛋白,介导细胞内脂肪酸从质体向外运输,在脂质合成中起着重要的调控作用。本研究从油棕中克隆了3个EgFAX1基因(EgFAX1-1,EgFAX1-2,EgFAX1-3),对其氨基酸长度、分子量、等电点、蛋白不稳定指数、脂肪族系数、总平均亲水性、染色体定位、基因结构、保守功能域、进化关系和表达特征进行分析。结果表明:3个EgFAX1基因编码的肽链氨基酸长度分别为189、231和232,分子量分别为20.43、24.85、24.92 kDa,等电点为分别9.82、9.82和9.93,蛋白不稳定指数分别为48.01、49.71和50.09,脂肪族系数分别为81.06、84.07和83.28,总平均亲水性分别为为0.071、0.121和0.106,分别含有2、5、7个外显子,都含有FAX1的特征结构Tmemb_14蛋白结构域。将油棕与拟南芥、水稻、大豆、油菜、番茄、绿藻、红藻、盘藻、团藻、长囊水云、细小微胞藻和小球藻的FAX1氨基酸序列做进化分析,发现EgFAX1与大豆和番茄的亲缘关系较近。采用荧光定量PCR分析3个EgFAX1基因EgFAX1在油棕根、茎、叶、花和果中的表达特征,发现EgFAX1在花和果实中的表达量较高;同时分析3个EgFAX1基因油棕花后15周、17周、21周和23周果实中的表达特征,发现3个EgFAX1基因均在油棕果实发育过程中先升高,到达峰值后逐渐降低,其中EgFAX1-1在花后17周的果实达到峰值,EgFAX1-2和EgFAX1-3在花后21周的果实中达到峰值。本研究为进一步探索EgFAX1调控油棕脂肪酸运输的机制奠定基础。
关键词:脂肪酸;FAX1;油棕;生物信息学;基因表达
中图分类号:Q949.748.5 文献标识码:A
Identification and Expression Analysis of Fatty Acid Export Gene FAX1 in Oil Palm (Elaeis guineensis)
JIN Longfei1, LI Rui1*, CAO Hongxing1, YAN Yan2
1. Coconut Research Institute of Chinese Academy of Tropical Agricultural Science / Hainan Key Laboratory of Tropical Oil Crops Biology, Wenchang, Hainan 571339, China; 2. Institute of tropical Bioscience and Biotechnology, Chinese Academy of Tropical Agricultural Sciences / Key Laboratory of Biology and Genetic Resources of Tropical Crops, Ministry of Agriculture & Rural Affairs, Haikou, Hainan 571101, China
Abstract: Oil palm (Elaeis Guineensis Jacq.), originated in Africa, is an important tropical woody oil crop with high oil production efficiency. It is widely planted in Southeast Asia, Africa, Central and South America and Hainan, Yunnan, Guangdong, Guangxi of China. Palm oil squeezed from oil palm fruits is an important edible oil and industrial raw material. Fatty acids are synthesized in plant plastids and then transported into the endoplasmic reticulum for processing and modification. In order to study the transport mechanism of fatty acids in oil palm, the key genes controlling transportion of fatty acids were extracted by bioinformatics and fluorescence quantitative PCR using ‘Reyou 4’ oil palm. Fatty acid export 1 (FAX1) is a plant fatty acid transporter, which mediates the fatty acids export in plastids, and plays an important role in the regulation of lipid biosynthesis. In this study, three EgFAX1 genes (EgFAX1-1, EgFAX1-2, EgFAX1-3) were cloned from oil palm, and the amino acid length, protein instability index, aliphatic coefficient, the total mean hydrophilicity, chromosomal localization, gene structure, conserved functional domain, evolutionary relationship and expression characteristics were analyzed. The amino acid length of the peptide of EgFAX1 was 189, 231 and 232. The molecular weight was 20.43, 24.85 and 24.92 kDa. The isoelectric point was 9.82, 9.82 and 9.93. The protein instability index was 48.01, 49.71 and 50.09. The aliphatic coefficient was 81.06, 84.07 and 83.28. The total mean hydrophilicity was 0.071, 0.121 and 0.106, respectively. Sequence and amino acid domain characterization analysis showed that EgFAX1 contained 2, 5 and 7 exons, and contained Tmemb_14 protein domain. Phylogenetic analysis of FAX1 in oil palm, Arabidopsis, rice, soybean, rapeseed, tomato, green algae, red algae, Gonium pectorale, Volvox carteri, Ectocarpus siliculosus, Micromonas pusilla and Chlorella variabilis showed that oil palm was closely related to soybean and tomato. The gene expression characteristics analysis in root, shoot, leaf, flower and fruit showed that EgFAX1 was highly expressed in flowers and fruits. The gene expression characteristics analysis in different fruit development stage including 15 weeks, 17 weeks, 21 weeks and 23 weeks after anthesis (WAA) showed that the expression level of three EgFAX1 increased during fruit development and then decreased gradually after reaching the peak value. The expression level of EgFAX1-1 peaked at 17 WAA and the expression level of EgFAX1-2 and EgFAX1-3 peaked at 21 WAA. The results would provide useful information for further investigation mechanism of EgFAX1 regulating fatty acid transportation in oil palm.
Keywords: fatty acid; FAX1; oil palm; bioinformatics; gene expression
DOI: 10.3969/j.issn.1000-2561.2022.01.004
脂肪酸是植物重要的贮能物质,也是生物膜的重要组分以及一些信号分子的前体,在植物生长发育过程中发挥着重要的功能;同时脂肪酸是植物表面蜡质和角质合成的前体,参与调控植物表皮渗透、水分散失和抵御病虫害等生理过程[1]。植物细胞中的脂肪酸首先在质体中合成,运输到内质网中进行加工和修饰,再运输到质体中合成脂质[2]。脂肪酸的运输在植物脂质合成过程中起着重要的作用[3-4],参与脂肪酸运输的蛋白主要有脂肪酸外运蛋白(fatty acid export 1,FAX1)[5]、长链脂肪酸辅酶A合成酶(long chain long-chain acyl-CoA synthetase LACS)[6]、腺苷三磷酸结合盒转运蛋白(ATP-binding cassette transporter,ABC transporters)[7]、半乳糖基二甘油酯(trigalactosy-ldiacylglycerol,TGD)蛋白[8]等。
在质体中合成的脂肪酸约60%将被运出质体用于磷脂和三酰甘油的合成[1, 9]。FAXl能够调控脂肪酸在叶绿体和内质网间的运输。拟南芥的研究中发现,AtFAX1编码一种Tmemb-14家族转运蛋白,定位在叶绿体的内膜上,该基因突变后内质网的脂质含量降低,叶绿体中脂质含量增加;超量表达该基因后内质网和叶绿体脂质含量的变化则呈现相反的趋势[5, 10]。在绿藻中也鉴定了AtFAX1的同源基因CrFAX1和CrFAX2,超量表达这2个基因显著提高细胞中的脂质积累量[11];在红藻中也研究发现超量表达CmFAX1显著提高细胞内三酰甘油的含量[12]。这些结果均表明,促进脂肪酸的跨膜运输可能是提高植物细胞产油效率的一种有效策略。油棕是产油效率最高的热带木本油量作物,每公顷产油量高达4.17 t,其果实压榨的棕榈油广泛应用于食品加工、化工和生物能源上[13-14]。果肉是油棕脂肪酸主要的贮藏器官,但其脂肪酸转运的机制还不明晰,陈红[15]在油棕果肉中克隆了EgLACS1和EgLACS9,发现这2个基因均具有吸收外源脂肪酸的功能,而关于油棕脂肪酸外运的研究尚未见报道。本研究从油棕中克隆了3个AtFAX1的同源基因EgFAX1-1、EgFAX1-2和EgFAX1-3,对其理化性质、基因结构、染色体定位、序列特征和进化关系进行分析,同时采用荧光定量PCR对其在油棕果实发育中的表达特征进行分析,为后续研究EgFAX1的生物学功能和油棕遗传改良奠定基础。
1 材料与方法
1.1 材料
实验材料采自中国热带农业科学院椰子研究所基地(19°33′ N,110°47′ E)。采集8年生的‘热油4号’油棕(Elaeis guineensis)的根、茎尖、叶、花(开花期的雄花和雌花)和花后15周、17周、21周和23周的果肉。样品采集后液氮速冻,储存在–80 ℃冰箱中以备RNA提取。
主要试剂:植物总RNA提取试剂盒(北京天根)、HiScript II 1st Strand cDNA Synthesis试剂盒(北京全式金)、Taq PCR预混液(上海生工)、PMD18-T载体(大连宝生物)、DH5α感受态细胞(北京全式金)、SYBR® Select Master Mix(赛默飞世尔科技)。主要仪器设备:移液器(Eppendorf,德国)、NanoDrop分光光度计(Thermo,美国)、高速冷冻离心机(Thermo,美国)、Labcycler PCR仪(SensoQuest,德国)、水平电泳槽(DYCP-32B,北京六一仪器厂)、电泳仪(DYY-6C,北京六一仪器厂),QuantStudio 6 Flex荧光定量PCR仪(ABI,美国)。
1.2 方法
1.2.1 基因挖掘及生物信息学分析 从拟南芥基因组数据库(https://www.arabidopsis.org/)中下载拟南芥AtFAX1(At3g57280)的氨基酸序列。在油棕基因组数据库中采用BLASTP进行比对分析获得与AtFAX1高度同源的候选基因,利用Batch Web CD-search Tool进行保守结构域分析[16]。候选基因的全长及荧光定量PCR的引物设计均采用NCBI的Primer-Blast在线工具(https://www. ncbi.nlm.nih.gov/tools/primer-blast/)進行,以油棕果肉cDNA为模板,利用全长克隆引物进行PCR扩增,反应体系参照Taq PCR预混液的操作说明进行。PCR产物纯化后,连接PMD18-T载体,热激法转化DH5α感受态细胞,进行测序。油棕FAX1基因的蛋白质分子量、等电点、蛋白不稳定指数、脂肪族指数和总平均亲水性等理化性质采用在线工具ExPASy(http://www.expasy.org)分析。染色体定位和基因结构均采用Tbtool[17]进行分析。采用ClustalW软件[18]对油棕、拟南芥、绿藻和红藻的AtFAX1蛋白质序列进行多重比对,采用MEGA 6.0软件的Neighbor-joining法构建系统发生树[19],分析进化关系,校验值bootstrap设置为1000。
1.2.2 RNA提取及基因表达分析 油棕不同组织样品总RNA采用植物总RNA提取试剂盒进行提取,cDNA采用HiScript II 1st Strand cDNA Synthesis试剂盒进行合成,实时荧光定量PCR采用SYBR® Select Master Mix进行分析,以β-actin作为内参基因,反应体系及操作步骤参照试剂盒的操作说明进行,引物见表1,采用2-ΔΔCT法计算目标基因的相对表达量。
1.3 数据处理
采用SPSS 13.0软件进行数据分析,用Ducan’s检测法进行基因表达的差异显著性分析。
2 结果与分析
2.1 EgFAX1的克隆及基本信息分析
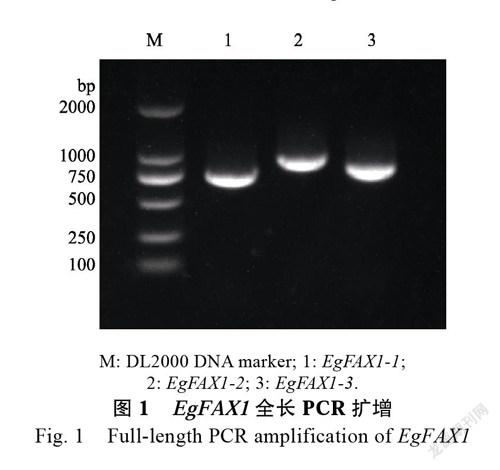
以AtFAX1的氨基酸序列在油棕基因组进行BLASTP比对获得3条高度同源的序列,对获得的候选氨基酸序列进行保守域分析,发现都含Tmemb_14保守结构(Pfam|PF03647)。以油棕果实cDNA为模板,进行油棕FAX1全长克隆,获得3条单一条带(图1),长度在750 bp左右,分别命名为EgFAX1-1、EgFAX1-2和EgFAX1-3。测序结果表明EgFAX1-1全长为656 bp,其中开放阅读框长度为570 bp,编码189个氨基酸;EgFAX1-2全长为823 bp,其中开放阅读框长度为696 bp,編码231个氨基酸;EgFAX1-3全长为715 bp,其中开放阅读框长度为699 bp,编码232个氨基酸(表2)。染色体定位发现EgFAX1-1和EgFAX1-2未能定位在染色体上,EgFAX1-3定位在Chr13上。基因结构分析发现EgFAX1-1有2个外显子,EgFAX1-2有5个外显子,EgFAX1-3有7个外显子。蛋白不稳定指数分别为48.01、49.71和50.09,均为不稳定蛋白;脂肪族系数分别为81.06、84.07和83.28;总平均亲水性为0.071、0.121和0.106,均为正值,呈疏水性。
2.2 EgFAX1的序列比对及进化分析
将拟南芥、绿藻、红藻和油棕的FAX1氨基酸序列进行比对分析发现,4个物种完全相同的
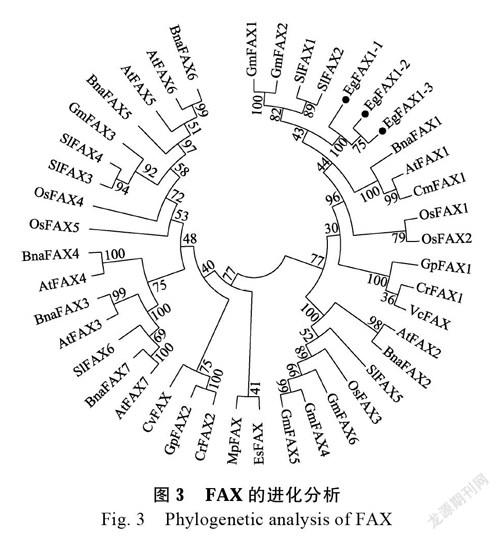
氨基酸序列占26.7%,都含有4个疏水α-螺旋组成的Tmemb_14蛋白结构域(图2),这是FAX1的典型结构域。将油棕FAX1序列与拟南芥、水稻、大豆、油菜、番茄、绿藻、红藻、盘藻、团藻、长囊水云、细小微胞藻和小球藻的FAX序列进行比对,并采用MEGA 6.0软件进行进化关系分析。结果发现,物种内3个EgFAX1聚在一起,在物种间与大豆的GmFAX1和GmFAX2、番茄的SlFAX1和SlFAX2聚在一个枝上,同时与功能明确的AtFAX1、CmAFX1和CrFAX1聚在一起(图3)。
2.3 EgFAX1的表达特征分析
采用实时荧光定量PCR对3个EgFAX1基因在油棕根、茎、叶、花、花后15、17、21、23周的果中的表达特征进行分析。EgFAX1-1在果实和花中的表达量显著高于根、茎和叶;在果实发育过程中EgFAX1-1的表达量随着果实的成熟逐渐升高,在花后17周达到最大值,然后逐渐降低。EgFAX1-2在花中的表达量最高,在果实发育过程中EgFAX1-2的表达量随着果实的成熟逐渐升高,在花后21周达到最大值,然后逐渐降低。EgFAX1- 2在果实和花中的表达量显著高于根、茎和叶;在果实发育过程中EgFAX1-3的表达量随着果实的成熟逐渐升高,在花后21周达到最大值,然后逐渐降低(图4)。
3 讨论
植物脂肪酸的合成主要在质体中进行,以糖酵解产生的丙酮酸为底物进行从头合成,然后运输到内质网进行折叠和加工[1]。及时将合成的脂肪酸转运出质体是保证脂肪酸高效合成的前提,参与植物脂肪酸转运的蛋白主要有FAX1、ABC转运蛋白、TGD、LACS[3]。定位在叶绿体内膜上的FAX1和定位在叶绿体外膜上LACS能够调控脂质在叶绿体和内质网间的运输,将合成的脂肪酸外运出叶绿体[5-6];定位在内质网膜上的ABC转运蛋白介导脂肪酸转运进入内质网[6],定位在质体膜上的TGD则介导脂肪酸从细胞质转运进入叶绿体[7]。在拟南芥基因组中FAX家族有7个成员,其中AtFAX1的功能已经明确,其他成员的功能还不明晰。AtFAX2和AtFAX3在fax1突变体中显著上调表达,可能与AtFAX1具有相似的功能[5]。FAX1在脂肪酸合成的前期调控质体中的脂肪酸向外运输,对植物脂质积累起着关键性的作用。在拟南芥的研究中发现AtFAX1突变后,内质网合成的脂质含量显著降低,进而导致植物体内脂肪酸代谢紊乱、生物量减少、育性降低[5]。本研究从油棕中克隆了3个编码FAX1的基因,分别命名为EgFAX1-1、EgFAX1-2和EgFAX1-3(图1)。序列分析发现3个EgFAX1基因都含有典型的4个疏水α-螺旋组成的Tmemb_14蛋白结构域(图2),总平均亲水性均为正值(表2),呈疏水性,表明克隆的基因均为编码FAX1外运蛋白的基因。进化分析发现3个EgFAX1与拟南芥、绿藻和红藻的FAX1聚在一起(图3),表明其可能具有相似的功能。AtFAX1和CmFAX1在酵母实验中证明具有脂肪酸转运的功能[5, 12],进而推测EgFAX1可能也具有脂肪酸转运的功能。
基因表达分析发现3个EgFAX1在根、茎、叶、花、果中都有表达,但在花和果实中的表达量显著高于根、茎和叶(图4),表明EgFAX1在油棕的花和果实发育中起重要调控作用。在拟南芥的研究中发现AtFAX1参与花粉的细胞壁形态建成,该基因突变后植物缺少用于合成花粉外壁和花粉外被的脂质,花粉细胞壁不完整,育性降低[5, 20-21]。3个EgFAX1在花中高表达,表明FAX1可能通过控制脂肪酸的转运调控油棕的花发育。油棕果肉是重要的贮油器官,成熟油棕果肉脂质含量高达50%;油棕果肉脂质含量与成熟度密切相关,果肉脂质含量从花后17周开始迅速积累,在花后23周达到峰值[22]。在本研究中EgFAX1-1在花后17周的果肉中表达量最高,EgFAX1-2和EgFAX1-3在花后21周的果肉中表达量最高(图4),FAX1的表达量的峰值略早于脂质积累量的峰值,这可能是因为转运出质体的脂肪酸还要在内质网中进行折叠和加工,最后以油体的形式贮藏在细胞质中[23]。FAX1的表达量与植物的产油量密切相关,在拟南芥、绿藻和红藻中的研究发现超量表达FAX1能够显著提高产油量[10-12]。在本研究中克隆了3个编码油棕FAX1外运蛋白的基因,而且都在果实发育中高表达,该基因在果实中的高表达可能是油棕产油效率高的主要原因。综上,本研究从油棕中克隆了3个编码脂肪酸外运蛋白基因,表达分析发现EgFAX1在花和成熟过程的果实中高表达,表明其在油棕花发和果实发育过程中的脂肪酸积累中起重要调控作用。EgFAX1的脂肪酸外运功能和调控脂肪酸积累的分子机制还有待进一步的研究。
參考文献
[1] LI-BEISSON Y, SHORROSH B, BEISSON F, ANDER-SSON M X, ARONDEL V, BATES P D, BAUD S, BIRD D, DEBONO A, DURRETT T P, FRANKE R B, GRAHAM I A, KATAYAMA K, KELLY A A, LARSON T, MARKHAM J E, MIQUEL M, MOLINA I, NISHIDA I, ROWLAND O, SAMUELS L, SCHMID K M, WADA H, WELTI R, XU C C, ZALLOT R, OHLROGGE J. Acyl-lipid metabolism[J]. The Arabidopsis Book, 2010, 8: e133.
[2] OHLROGGE J, BROWSE J. Lipid biosynthesis[J]. The Plant Cell, 1995, 7(7): 957-970.
[3] LI N N, XU C C, LI-BEISSON Y, PHILIPPAR K. Fatty acid and lipid transport in plant cells[J]. Trends in Plant Science, 2016, 21(2): 145-158.
[4] 韩二琴, 李健春, 李英双, 韩 丽, 王晓珠, 孙丽萍, 孙万梅, 马义峰, 曾 柳, 邹锡玲, 王邦俊. 转运蛋白调控植物脂质运输研究进展[J]. 中国油料作物学报, 2017, 39: 260-268.
HAN E Q, LI J C, LI Y S, HAN L, WANG X Z, SUN L P, SUN W M, MA Y F, ZENG L, ZOU X L, WANG B J. Research advance in the regulation of plant lipid trafficking by transporters[J]. Chinese Journal of Oil Crop Sciences, 2017, 39: 260-268. (in Chinese)
[5] LI N, GÜGEL I L, GIAVALISCO P, ZEISLER V, SCHREIBER L, SOLL J, PHILIPPAR K. FAX1, a novel membrane protein mediating plastid fatty acid export[J]. PLoS Biology, 2015, 13(2): e1002053.
[6] JESSEN D, ROTH C, WIERMER M, FULDA M. Two activities of long-chain acyl-coenzyme A synthetase are involved in lipid trafficking between the endoplasmic reticulum and the plastid in Arabidopsis[J]. Plant Physiology, 2015, 167(2): 351-366.
[7] KIM S, YAMAOKA Y, ONO H, KIM H, SHIM D, MAESHIMA M, MARTINOIA E, CAHOON E B, NISHIDA I, LEE Y. AtABCA9 transporter supplies fatty acids for lipid synthesis to the endoplasmic reticulum[J]. Proceedings of the National Academy of Sciences, 2013, 110(2): 773-778.
[8] FAN J L, ZHAI Z Y, YAN C S, XU C C. Arabidopsis TRIGALACTOSYLDIACYLGLYCEROL5 interacts with TGD1, TGD2, and TGD4 to facilitate lipid transfer from the endoplasmic reticulum to plastids[J]. The Plant Cell, 2015, 27(10): 2941-2955.
[9] BOUDIÈRE L, MICHAUD M, PETROUTSOS D, RÉBEILLÉ F, FALCONET D, BASTIEN O, ROY S, FINAZZI G, ROLLAND N, JOUHET J, BLOCK M A, MARÉCHAL E. Glycerolipids in photosynthesis: Composition, synthesis and trafficking[J]. Biochimica et Biophysica Acta, 2014, 1837(4): 470-480.
[10] TIAN Y S, LV X Y, XIE G L, ZHANG J, XU Y, CHEN F. Seed-specific overexpression of AtFAX1 increases seed oil content in Arabidopsis[J]. Biochemical and Biophysical Research Communications, 2018, 500(2): 370-375.
[11] LI N N, ZHANG Y, MENG H J, LI S T, WANG S F, XIAO Z C, CHANG P, ZHANG X H, LI Q, GUO L, IGARASHI Y, LUO F. Characterization of Fatty Acid Exporters involved in fatty acid transport for oil accumulation in the green alga Chlamydomonas reinhardtii[J]. Biotechnol Biofuels, 2019, 12: 14.
[12] TAKEMURA T, IMAMURA S, TANAKA K. Identification of a chloroplast fatty acid exporter protein, CmFAX1, and riacylglycerol accumulation by its overexpression in the unicellular red alga Cyanidioschyzon merolae[J]. Algal Research, 2019, 38: 101396.
[13] MAHLIA T M I, ISMAIL N, HOSSAIN N, SILITONGA A S, SHAMSUDDIN A H. Palm oil and its wastes as bioenergy sources: a comprehensive review[J]. Environmental Science and Pollution Research International, 2019, 26(15): 14849-14866.
[14] MBA O I, DUMONT M, NGADI M. Palm oil: Processing, characterization and utilization in the food industry - A review[J]. Food Bioscience, 2015, 10: 26-41.
[15] 陈 红. 油棕长链脂肪酰基CoA合成酶(LACS)基因克隆及功能分析[D]. 海口: 海南大学, 2018.
CHEN H. Cloning and functional characterization of long-chain acyl-CoA synthetase 1 and long-chain acyl-CoA synthetase 9 from the mesocarp of African oil pam (Elaeis guineensis Jacq.) [D]. Haikou: Hainan University. (in Chinese)
[16] LU S L, WANG J Y, CHITSAZ F, DERBYSHIRE M K, GEER R C, GONZALES N R, GWADZ M, HURWITZ D I, MARCHLER G H, SONG J S, THANKI N, YAMASHITA R A, YANG M Z, ZHANG D C, ZHENG C J, LANCZYCKI C J, MARCHLER-BAUER A. CDD/ SPAR¬CLE: the conserved domain database in 2020[J]. Nucleic Acids Research, 2020, 48(1): 265-268.
[17] CHEN C J, CHEN H, ZHANG Y, THOMAS H R, FRANK M H, HE Y H, XIA R. TBtools: an integrative toolkit developed for interactive analyses of big biological data[J]. Molecular Plant, 2020, 13(8): 1194-1202.
[18] EDGAR R C, BATZOGLOU S. Multiple sequence alignment[J]. Current Opinion in Structural Biology, 2006, 16(3): 368-373.
[19] KUMAR S, STECHER G, LI M, KNYAZ C, TAMURA K. MEGA X: molecular evolutionary genetics analysis across computing platforms[J]. Molecular Biology and Evolution, 2018, 35(6): 1547-1549.
[20] 劉艳艳, 陈雨沁, 石 垒, 石建新. 拟南芥脂肪酸外运蛋白FAX1影响雄性生殖发育的机制[J]. 植物生理学报, 2018, 54: 145-156.
LIU Y Y, CHEN Y Q, SHI L, SHI J X. Investigations into the mechanisms underlying the effects of Arabidopsis thaliana fatty acid export 1 (FAX1) in male reproductive development[J]. Plant Physiology Communications, 2018, 54: 145-156. (in Chinese)
[21] ZHU L, HE S Y, LIU Y Y, SHI J X, XU J. Arabidopsis FAX1 mediated fatty acid export is required for the transcriptional regulation of anther development and pollen wall formation[J]. Plant Molecular Biology, 2020, 104(1/2): 187- 201.
[22] TRANBARGER T J, DUSSERT S, JOËT T, ARGOUT X, SUMMO M, CHAMPION A, CROS D, OMORE A, NOUY B, MORCILLO F. Regulatory mechanisms underlying oil palm fruit mesocarp maturation, ripening, and functional specialization in lipid and carotenoid metabolism[J]. Plant Physiology, 2011, 156(2): 564-584.
[23] MORCILLO F, CROS D, BILLOTTE N, NGANDO- EBONGUE G F, DOMONHÉDO H, PIZOT M, CUÉLLAR T, ESPÉOUT S, DHOUIB R, BOURGIS F. Improving palm oil quality through identification and mapping of the lipase gene causing oil deterioration[J]. Nature Communications, 2013, 4: 2160.
