桑色素对ALI大鼠免疫功能、肺组织病理及IKKα蛋白水平的影响
2022-02-10徐双丽韩文杰史有奎山东省潍坊市潍坊医学院附属医院潍坊261000
徐双丽 孙 伟 韩文杰 史有奎 殷 亮 (山东省潍坊市潍坊医学院附属医院,潍坊 261000)
急性肺损伤(acute lung injury,ALI)是一种急性、弥漫性肺损伤危重疾病,严重威胁人类生命健康,其主要由内、外致病因素所致,临床上病死率超过40%[1]。ALI的主要临床特点为呼吸窘迫、非心源性肺水肿及难治性低氧血症[2]。ALI的发病机制较为复杂,目前尚无明确的临床研究报道。即便近年关于ALI的治疗研究较多(一般在糖皮质激素、氧自由基清除剂和肺泡表明活性等方面),但其病死率并未得到显著改善[3]。有研究发现,炎症反应失控是ALI发生发展的主要原因[4]。核转录因子-κB(nuclear factor kappa B,NF-κB)可调节肺损伤时肺组织内的细胞核转录因子等炎症因子[5]。IKKα是IKK复合体的一个催化亚基,IKK复合体又是NF-κB信号上游的主要成分[6]。外界信号经复杂的信号转导刺激下,会激活IKK复合体,活化NF-κB,活化的NF-κB进入细胞核内,进而调节各种基因表达,介导炎症反应、免疫反应、细胞活性等生物过程[7]。桑色素是一种天然的生物活性物质,其化学名称为(3,5,7,2′,4′-五羟黄酮),属黄体酮类化合物,其结构特点是含氧的杂环连接两个芳香环[8]。桑色素的主要化学成分黄体酮类化合物可抑制酶活性,具有抗癌、抗菌、抗炎、降低血糖和抗氧化应激等作用,但桑色素对ALI的作用及机制尚不明确,因此本文建立ALI大鼠模型,探究桑色素对ALI大鼠免疫功能、肺组织病理及IKKα蛋白水平的影响。
1 材料与方法
1.1 材料
1.1.1 实验动物 8周龄清洁级SD雄性大鼠30只,体质量180~200 g,购自河南省实验动物中心[SCXK(豫)2005-0001]。适应性喂养大鼠1周,饲养期间使饲养环境保持在25 ℃、12 h光暗交替循环。30只大鼠均为普通饲料喂养,自由进食摄水。
1.1.2 主要试剂与仪器 桑色素药物溶液(美国Sigma公司);NF-κB抗体、IKKα抗体(美国Santa Cruz公司);DG Spin离心机(美国Thermo公司);FYL-YS-150烤箱(中国宏展仪器工业股份有限公司)。
1.2 方法
1.2.1 动物分组及ALI模型制备 30只大鼠分为正常组(NC组)、ALI大鼠模型组(ALI组)、ALI大鼠模型给予桑色素干预组(Morin组),每组10只。采用脂多糖气管滴注法将ALI组和Morin组大鼠制备成ALI大鼠模型。脂多糖以生理盐水配制成1 mg/ml的溶液,腹腔注射戊巴比妥钠麻醉两组大鼠,沿大鼠颈部中线将颈部切开一小口,使气管充分暴露在外,将1 ml注射器缓慢插入气管,缓慢滴入脂多糖溶液,以每千克大鼠5 ml计量,NC组大鼠缓慢滴入等量生理盐水。马上将3组大鼠垂直并轻轻旋转1 min,使脂多糖在大鼠体内均匀分散。
1.2.2 药物干预 造模后30 min,Morin组大鼠经腹腔注射桑色素干预治疗,每千克大鼠给予40 mg桑色素;NC组和ALI组大鼠均腹腔注射等量生理盐水干预治疗,三组大鼠各干预7 d,然后处死大鼠,收集相关标本。
1.2.3 肺组织湿/干重比(W/D)和含水量测定 处死三组大鼠,分别分离三组大鼠肺组织,取出左肺,用干净滤纸将表面水分吸干,称取左肺湿重;用锡纸包裹左肺,60 ℃恒温箱烘烤48 h,至质量不再减少时,再次称量干重,计算W/D和肺含水量。
1.2.4 抗氧化指标检测 分别取三组大鼠动脉血,以3 000 r/min离心10 min。取上层血清,测定血清中氧化应激指标丙二醛(malondialdehyde,MDA)含量及超氧化物歧化酶(superoxide dismutase,SOD)活性。
1.2.5 血清中IL-1β和IL-18测定 麻醉各组大鼠后,取大鼠动脉血,在25 ℃环境中将血清静置2 h。以3 000 r/min离心30 min。取上层血清,ELISA法测定血清中炎症因子IL-1β和IL-18水平。
1.2.6 动脉血T淋巴细胞亚群CD4+、CD8+、CD4+/CD8+的检测 麻醉大鼠后,分别取三组大鼠腹主动脉血2 ml,将血液用EDTA抗凝后,各组取出60 µl血液至流式细胞仪,检测血液中T细胞亚群中的免疫因子 CD4+、CD8+细胞百分比和 CD4+/CD8+。
1.2.7 肺组织形态学变化 分别麻醉并处死三组大鼠,取各组大鼠肺组织,再将左肺上叶组织取出一小块置于甲醛中固定,48 h后取出组织,石蜡包埋,用切片机将石蜡组织切成5 µm薄片,每组任选3张薄片进行HE染色,最后用显微镜观察组织形态学改变。
对三组大鼠肺组织损伤情况进行评分,0分为肺组织未发生病变;1分为肺组织发生轻微病变;2分为中度病变;3分为重度病变;4分为极重度病变。
1.2.8 Westren blot检测肺组织中IKKα和NF-κB p65蛋白表达 分别取三组大鼠肺组织50 µg,提取肺组织中的总蛋白,蛋白浓度以BCA法检测。各组取等量蛋白进行电泳。将电泳后的蛋白转移至PVDF膜,以脱脂奶粉封闭1 h后加入IKKα和NF-κB一抗,将组织在4 ℃环境中孵育过夜;加入二抗后继续孵育1 h后ECL显色。
1.3 统计学方法 采用SPSS15.0软件分析统计数据,以±s比较三组间数据;三组间比较选用三因素方差进行分析;两组间比较选用t检验;以P<0.05表示差异有统计学意义。
2 结果
2.1 各组大鼠肺组织W/D和含水量比较 与NC组大鼠相比,ALI组大鼠肺组织W/D及含水量均显著升高(P<0.05);干预后的Morin组较ALI组肺组织W/D和肺含水量明显降低(P<0.05,表1、图1)。
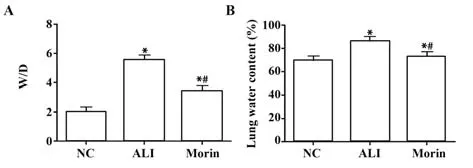
图1 各组大鼠W/D和含水量比较Fig.1 Comparison of W/D and water content of rats in each group
表1 各组大鼠W/D和含水量比较(±s)Tab.1 Comparison of W/D and water content of rats in each group (±s)
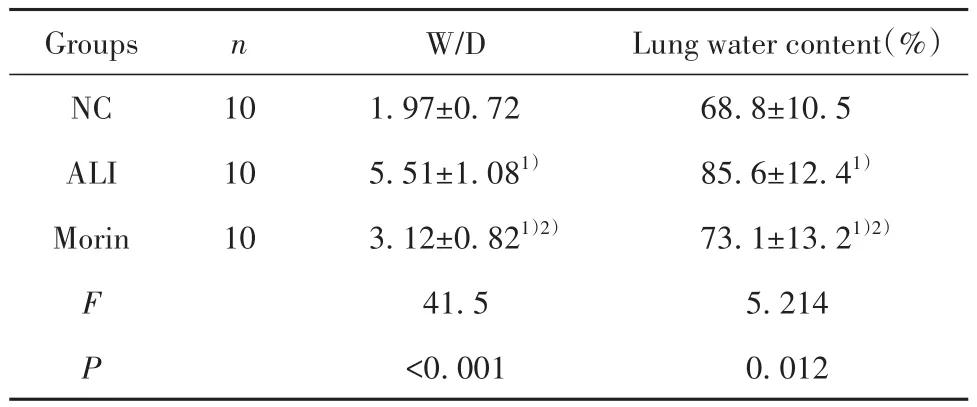
表1 各组大鼠W/D和含水量比较(±s)Tab.1 Comparison of W/D and water content of rats in each group (±s)
Note:Compared with NC group, 1)P<0.05; compared with ALI group,2)P<0.05.
Groups NC ALI Morin F P n 10 10 10 W/D 1.97±0.72 5.51±1.081)3.12±0.821)2)41.5<0.001 Lung water content(%)68.8±10.5 85.6±12.41)73.1±13.21)2)5.214 0.012
2.2 各组大鼠SOD活性和MDA含量比较 ALI组SOD活性较NC组明显降低,MDA含量较NC组明显升高(P<0.05);干预后Morin组大鼠氧化指标明显改善,SOD活性升高,MDA含量降低(P<0.05),见表2、图2。
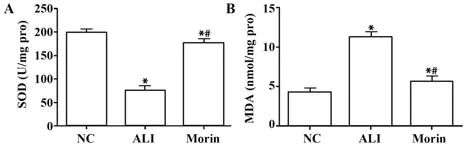
图2 各组大鼠血清中SOD活性和MDA含量比较Fig.2 Comparison of SOD activity and MDA content in serum of rats in each group
表2 各组大鼠血清中SOD活性和MDA含量比较(±s)Tab.2 Comparison of SOD activity and MDA content in serum of rats in each group (±s)

表2 各组大鼠血清中SOD活性和MDA含量比较(±s)Tab.2 Comparison of SOD activity and MDA content in serum of rats in each group (±s)
Note:Compared with NC group,1)P<0.05; compared with ALI group,2)P<0.05.
Groups NC ALI Morin F P n 10 10 10 SOD/(U·mg-1)198.13±40.11 74.52±24.411)175.76±38.181)2)35.54<0.000 1 MDA/(nmol·mg-1)4.25±1.65 11.28±2.141)5.70±1.111)2)48.55<0.000 1
2.3 各组大鼠血清中IL-1β和IL-18水平比较 与NC组相比,ALI组血清中炎症因子IL-1β和IL-18水平均显著升高(P<0.05);干预后的Morin组大鼠较ALI组大鼠血清中IL-1β和IL-18水平明显降低,见表3、图3。
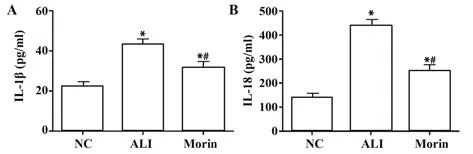
图3 各组大鼠血清中IL-1β和IL-18水平比较Fig.3 Comparison of IL-1β and IL-18 levels in serum of rats in each group
表3 各组大鼠血清中IL-1β和IL-18水平比较(±s,pg/ml)Tab.3 Comparison of IL-1β and IL-18 levels in serum of rats in each group (±s,pg/ml)

表3 各组大鼠血清中IL-1β和IL-18水平比较(±s,pg/ml)Tab.3 Comparison of IL-1β and IL-18 levels in serum of rats in each group (±s,pg/ml)
Note:Compared with NC group, 1)P<0.05; compared with ALI group,2)P<0.05.
Groups NC ALI Morin F P n 10 10 10 IL-1β 22.41±6.56 42.88±9.641)31.36±9.031)2)14.76<0.000 1 IL-18 137.50±59.71 436.25±136.171)250.12±73.481)2)24.83<0.000 1
2.4 动脉血T淋巴细胞亚群CD4+、CD8+、CD4+/CD8+比较 与NC组相比,ALI组CD4+、CD4+/CD8+明显降低,CD8+明显升高(P<0.05);和ALI组相比,Morin组CD4+、CD4+/CD8+明显升高,CD8+明显降低(P<0.05),见表4、图4。
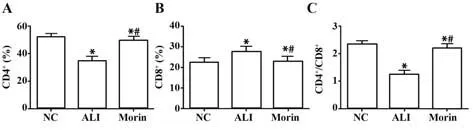
图4 各组大鼠动脉血T淋巴细胞亚群CD4+、CD8+、CD4+/CD8+比较Fig.4 Comparison of CD4+, CD8+, CD4+/CD8+T lymphocyte subsets in arterial blood of rats in each group
表4 各组大鼠动脉血T淋巴细胞亚群CD4+、CD8+、CD4+/CD8+比较(±s)Tab.4 Comparison of CD4+, CD8+, CD4+/CD8+T lymphocyte subsets in arterial blood of rats in each group(±s)
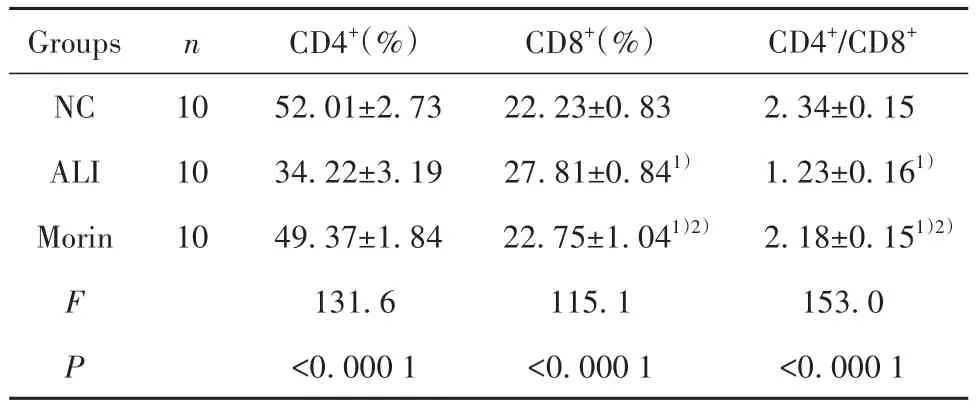
表4 各组大鼠动脉血T淋巴细胞亚群CD4+、CD8+、CD4+/CD8+比较(±s)Tab.4 Comparison of CD4+, CD8+, CD4+/CD8+T lymphocyte subsets in arterial blood of rats in each group(±s)
Note:Compared with NC group, 1)P<0.05; compared with ALI group,2)P<0.05.
Groups NC ALI Morin F P n 10 10 10 CD4+(%)52.01±2.73 34.22±3.19 49.37±1.84 131.6<0.000 1 CD8+(%)22.23±0.83 27.81±0.841)22.75±1.041)2)115.1<0.000 1 CD4+/CD8+2.34±0.15 1.23±0.161)2.18±0.151)2)153.0<0.000 1
2.5 各组大鼠肺组织形态学变化 NC组肺泡组织完整,肺损伤评分为0分;与NC组相比,ALI组大鼠肺组织结构紊乱且被破坏,肺泡腔被压缩、变窄,大量肺泡萎陷,泡壁增厚、断裂,有大量炎症细胞、液体的渗出及红细胞漏出,间质可见出血、水肿,肺损伤评分为10.38±1.31,较NC组明显升高;与ALI组相比,Morin组肺组织得到明显改善,其肺损伤评分(3.75±0.71)也明显降低,见图5。

图5 各组大鼠肺组织形态学变化(HE染色,×200)Fig.5 Morphological changes of lung tissue in rats of each group (HE staining, ×200)
2.6 各组大鼠肺组织中IKKα和NF-κB p65蛋白表达比较 与NC组相比,ALI组IKKα和NF-κB p65蛋白表达均显著升高(P<0.05);与 ALI组相比,Morin组大鼠肺组织中IKKα和NF-κB p65蛋白明显降低(P<0.05),见表5、图6。
表5 各组大鼠肺组织中IKKα和NF-κB p65蛋白表达比较(±s)Tab.5 Comparison of IKKα and NF-κB p65 protein expressions in lung tissue of rats in each group (±s)
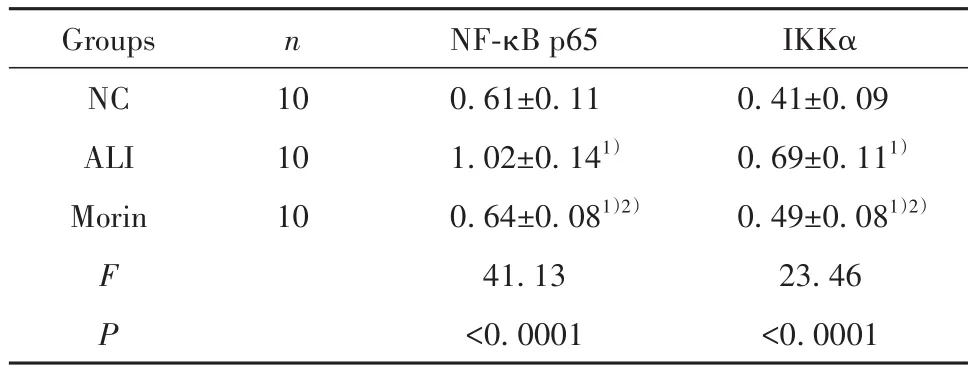
表5 各组大鼠肺组织中IKKα和NF-κB p65蛋白表达比较(±s)Tab.5 Comparison of IKKα and NF-κB p65 protein expressions in lung tissue of rats in each group (±s)
Note:Compared with NC group, 1)P<0.05; compared with ALI group,2)P<0.05.
Groups NC ALI Morin F P n 10 10 10 NF-κB p65 0.61±0.11 1.02±0.141)0.64±0.081)2)41.13<0.0001 IKKα 0.41±0.09 0.69±0.111)0.49±0.081)2)23.46<0.0001
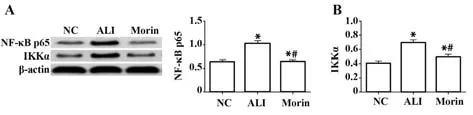
图6 各组大鼠肺组织中IKKα和NF-κB p65蛋白表达Fig.6 IKKα and NF-κB p65 protein expressions in lung tissue of rats in each group
3 讨论
ALI是以肺内大量炎症细胞浸润和渗出、肺泡毛细血管通透性增加为主要特征的肺部炎症综合反应,严重的ALI可导致进行性缺氧性呼吸衰竭,病死率逐年增加[9]。虽然目前临床上针对ALI治疗的研究很多,但能有效治疗肺损伤的药物仍然较少。桑色素是一种天然化合物,普遍存在于中草药和膳食中,如桑椹、绿茶、橙子和菠萝蜜等均可食用。LEE等[10]研究表明,桑色素可减弱IL-1β表达,抑制炎症介质和促炎细胞因子释放。NIE等[11]研究表明,桑色素可通过抑制miR-188-5p表达抑制cml细胞增殖,同时促进cml细胞凋亡。目前,桑色素对ALI大鼠的作用鲜有报道。
脂多糖是革兰氏阴性菌细胞壁最重要的成分之一,当大鼠肺内滴入脂多糖时,大鼠炎症增多,肺组织通透性随之改变,通常采用脂多糖制备ALI大鼠动物模型[12]。肺毛细血管的通透性会随肺损伤的发生而增加,同时使炎症递质和炎症蛋白均进入肺泡和肺间质;肺泡上皮细胞会被炎症因子损伤,进而减少肺泡表面的活性物质,增加其表面张力,使肺泡毛细血管中的液体向肺泡内滤出,进而加重肺水肿[13]。本研究显示,ALI组大鼠肺泡腔内有大量炎症细胞浸润,渗出大量红细胞,肺泡间质增生严重,肺损伤较NC组明显加重,提示ALI大鼠模型制备成功。实验结果显示,ALI组大鼠肺组织W/D和肺含水量较NC组显著增加;经桑色素干预后的Morin组大鼠肺组织W/D和肺含水量明显降低,提示桑色素对肺水肿具有明显的治疗效果。WANG等[14]通过脂多糖诱导小鼠肺损伤的研究发现,灯盏花素可有效改善肺损伤,其可能通过抑制小鼠体内COX-2/NLRP3/NF-κB信号通路实现。
本研究发现给予桑色素干预后Morin组大鼠氧化指标明显改善,SOD活性升高,MDA含量降低。表明桑色素具有抗氧化能力,可降低氧化应激造成的损伤[15]。SOD活性和MDA含量可间接反应机体氧化应激损伤程度,肺损伤后机体活性氧表达上调,加快MDA表达,SOD活性降低,打破氧化抗氧平衡。肺脏本身有抗氧化系统,SOD具有抗氧化能力,当肺部受到损伤后,SOD表达下调,MDA表达上调,细胞毒性增加,肺部生物膜及肺功能损伤加重。杨玲等[16]研究表明,桑色素可提高斑马鱼胚SOD活性,降低自由基表达,从而对受损的斑马鱼胚胎发挥保护作用,提示桑色素具有较强的抗氧化能力。
T淋巴细胞在机体内的分布情况可反映机体细胞的免疫功能,T淋巴细胞表面的共同标志物为CD3+,CD3+代表T淋巴细胞的总数;CD4+可将T细胞诱导为效应细胞,其是Ti/Th表面的标志物;抑制性T细胞通常以CD8+表示,可溶解病原体感染的自身细胞[17]。机体内的免疫功能是否稳定可用CD4+/CD8+反映,CD4+/CD8+在正常哺乳动物中为2,当比值<2时说明免疫功能被破坏。本研究结果显示,ALI组大鼠免疫指标较NC组明显降低;干预后的Morin 组和 ALI组相比,CD4+、CD4+/CD8+明显升高,CD8+明显降低,提示使用桑色素治疗后能进一步加强机体细胞的免疫功能。郑红丽等[18]研究发现,ALI患者治疗后血清中T细胞分化亚群指标明显优于治疗前,可见治疗后患者体内免疫功能得到改善,进而减轻了炎症所致的脏器损伤。桑色素中的生物类黄酮抗炎机制在于其抑制了前列腺素生物合成过程中的脂氧化酶、蛋白激酶C等,进而调节炎症反应过程中内皮细胞和炎症细胞活性,其可通过影响细胞的分泌过程、有丝分裂及细胞间的相互作用发挥抗炎作用,抑制大鼠肥大细胞和嗜碱性细胞对多种刺激引起的组胺及慢反应物质的释放,抑制PGE2、白三烯的合成和释放及透明质酸酶活性,降低大鼠中性粒细胞溶酶体酶的释放及脱颗粒。有文献提出,桑色素可介导机体中Th17/Treg平衡,对固有免疫有一定的调节作用[19]。
ALI的病理特征为进行性炎症失控,可导致肺巨噬细胞焦亡,进而释放促炎因子IL-1β和IL-18,在ALI中,炎症的过度反应占据主导作用[20]。本研究结果显示,ALI组血清中炎症因子水平均高于NC组;桑色素干预后的Morin组炎症因子水平受到明显抑制。众多炎症递质通过不同信号通路作用于巨噬细胞等不同的效应细胞,严重影响ALI的炎症反应,如NF-κB/IKKα表达等。目前研究发现,NF-κB信号通路主要由转录因子、7个抑制蛋白和IκB激酶复合物组成,其中转录因子包括p50、p56等,IκB激酶复合物包括IKKα、IKKβ等[21]。细胞在经典通路中受到刺激后,会激活NF-κB诱导性激酶,活化IKK复合体,激活IKKα、IKKβ组成的信号小体,导致p65蛋白磷酸化,胞浆内的NF-κB游离后进入细胞核,启动下游炎症因子等基因的转录翻译,而这些炎症因子又成为促进NF-κB重新激活的刺激因素,从而导致级联性弥漫性炎症反应[22]。本研究结果显示,ALI组大鼠肺组织中IKKα和NF-κB p65蛋白表达较NC组明显增多,Morin组肺组织中蛋白表达明显受到抑制,提示NF-κB转录因子的活化可通过桑色素抑制,同时机体免疫反应的放大程度降低,在一定程度减轻了肺损伤的发生。赵瑜等[23]通过建立幼儿ALI大鼠模型研究发现,miR-24低表达可通过抑制肺组织中p-IKK、NF-κB p65表达减轻ALI幼龄大鼠的炎症反应。
综上所述,桑色素可改善ALI大鼠的免疫功能和肺组织病理改变,同时抑制IKKα蛋白表达,进而抑制肺组织中的炎症反应,减轻肺损伤。