滑膜间充质干细胞外泌体源性miR-376b-3p靶向MYC抑制骨关节炎进展①
2022-02-10牛学刚刘朝旭刘一帆聊城市中医医院骨创伤科聊城252000
牛学刚 刘朝旭 刘一帆 (聊城市中医医院骨创伤科,聊城 252000)
骨关节炎(osteoarthritis,OA)是一种以关节软骨退化、骨结构改变、滑膜炎症和疼痛为特征的常见退行性关节病[1]。非甾体抗炎药是目前OA治疗的常用手段,能够有效缓解关节疼痛,晚期OA患者治疗则采用常规关节置换手术,但均有一定局限性[2]。
miRNAs已成为骨骼病理生理学中有前途的治疗靶点,能够调节OA进展[3-5]。最新研究显示,miR-376-3p在OA软骨组织中异常低表达,高水平的miR-376b-3p能够减轻OA细胞炎症损伤,发挥保护作用[6]。另外,人滑膜间充质干细胞(synovial mesenchymal stem cells,SMSCs)可分泌携带 miRNAs的外泌体(exosome,exo),对OA起保护作用[7]。MYC是作用广泛的转录因子,通过多种机制调节细胞分化和增殖,包括靶基因转录扩增,MYC能够激活MAPK通路进而促进OA进展[8]。本研究以miR-376b-3p为切入点探索exo源性miR-376b-3p调控MYC参与OA进程的具体机制,为OA治疗提供新的依据。
1 材料与方法
1.1 材料 HC-A细胞购于美国典型菌株保藏中心;LipofectamineTM3000购于美国Invitrogen公司;载体及PCR引物购于南京金斯瑞生物科技有限公司;TRIzol试剂、RIPA裂解液、CCK-8试剂盒、Annexin V-FITC/PI细胞凋亡检测试剂盒、BCA试剂盒购于北京索莱宝生物科技公司;ELISA试剂盒购于武汉华美生物工程有限公司;相关抗体均为英国Abcam公司产品;转染序列由上海吉玛基因公司设计合成;双荧光素酶报告基因试剂盒购于上海翊圣;Superscript Ⅲ cDNA synthesis kit、SYBR Premix Ex Taq 购于美国Thermo Fisher;GW 4869外泌体抑制剂购于翌圣生物。
1.2 方法
1.2.1 生物信息学分析 从NCBI数据库的GEO数据库获取miRNAs差异表达芯片数据集GSE79258,包括2个腰椎间盘突出(lumbar disc herniation,LDH)患者关节软骨样本和2个OA患者关节软骨样本miRNA测序信息。Starbase(http://starbase.sysu.edu.cn/)和 Targetscan(http://www.targetscan.org/vert_72/)查询miR-376b-3p下游靶基因,在线工具Venny 2.1.0(https://bioinfogp.cnb.csic.es/tools/venny/index.html)绘制韦恩图。借助KOBAS在线预测网站(http://kobas.cbi.pku.edu.cn/)进行KEGG功能富集分析,DisGeNET数据库(https://www.disgenet.org/)查询OA疾病风险基因(C0409959)。String数据库(https://string-db.org)分析蛋白互作关系。
1.2.2 组织样本采集 人滑膜样本取自2019年12月至2020年12月于聊城市中医医院进行全膝关节置换术的59例OA患者膝关节软骨,术中无菌提取和分离患者滑膜组织,男性23例,女性36例,平均年龄(62.15±3.12)岁。选取同期在聊城市中医医院因外部创伤行膝关节截肢手术的15例患者作为对照组(Non-OA)。Non-OA组患者过往无膝关节创伤及手术史,临床资料完整且未合并器质性疾病或自身免疫病。OA组患者根据Kellgren和Lawrence分级系统(Kellgrenand Lawrence grading,KLG)分为Early OA组(KLG<2,n=16)、Middle OA组(KLG=2,n=29)和Late OA组(KLG>2,n=14)。OA患者纳入标准:①符合美国风湿病协会推荐的OA诊断标准;②临床病历资料完整;③未患有其他反应性关节炎等关节疾病;④近期未使用过糖皮质激素或甾体类抗炎药。排除标准:①接受过膝关节相关手术;②合并有器质性疾病、自身免疫系统疾病及其他可能影响本研究结果的疾病患者。本研究方案经聊城市中医医院院伦理委员会批准,受试者及家属知情同意。
1.2.3 SMSCs分离与鉴定 OA滑膜标本用PBS冲洗,剪为1 mm3组织碎块,加入约10倍体积的Ⅱ型胶原酶消化3 h,过100目筛,1 500 r/min离心5 min,含10%胎牛血清的高糖培养基重悬后继续培养,细胞贴壁后传代。取第五代细胞,采用含EDTA的0.25%胰蛋白酶消化,含3%BSA的PBS孵育30 min,添加APC荧光Anti-CD34抗体、PE荧光Anti-CD44抗体、APC荧光Anti-CD73抗体及FITC荧光Anti-CD45抗体,流式细胞仪对处理后的细胞进行表型分析。CD34、CD45低表达,CD44和CD73高表达提示SMSCs分离成功。
1.2.4 SMSCs源性exo分离与鉴定 取细胞培养上清,加入0.2 ml分离纯化溶液充分混匀,4 ℃孵育过夜,离心,去除残余溶液,沉淀即为exo。透射电镜观察exo形态并拍照,Western blot检测exo标志蛋白表达。
1.2.5 细胞培养及鉴定 HC-A细胞复苏后采用DMEM培养基培养,补充10%胎牛血清和100 U/ml青链霉素,培养条件为37 ℃、5%CO2,每24 h更换1次新鲜培养基。细胞达到80%融合后0.25%胰蛋白酶消化传代,将第三代细胞分别用10 ng/ml IL-1β培养0 h、3 h、6 h、12 h,建立OA体外细胞模型。
1.2.6 转染与分组 将inhibitor-NC、miR-376b-3p inhibitor质粒转染至对数生长期SMSCs,按1.2.4分离exo,将pc-DNA3.1、pc-MYC质粒转染至对数生长期HC-A细胞。转染步骤依据LipofectamineTM3000转染试剂说明书进行。收集不同转染组SMSCs-Exo与不同组转染H-CA细胞共培养72 h,配制GW6849工作液至1.43 mmol/L,加入细胞培养基处理30 min。
1.2.7 qRT-PCR检测目标基因表达 TRIzol法提取总RNA,Nanodrop紫外分光光度计检测浓度、纯度,采用Superscript Ⅲ cDNA synthesis kit合成cDNA,qRT-PCR检测试剂盒为SYBR Premix Ex Taq,以cDNA为模板,以特异性引物为正向引物进行qRTPCR反应。miR-376b-3p以U6为内参,MYC以GAPDH为内参。Real-Time PCR 仪进行相应PCR反应,条件为:95 ℃ 3 min;95 ℃ 5 s,60 ℃ 30 s,72 ℃ 30 s,40个循环。2-ΔΔCt计算相对表达。引物序列见表1。

表1 引物序列Tab.1 Primer sequences
1.2.8 Western blot检测目标蛋白表达 收集细胞离心,沉淀中加入预冷RIPA细胞裂解液冰上振荡裂解30 min,转移上清,按BCA试剂盒说明对蛋白浓度进行定量分析。取蛋白样本10%SDS-PAGE凝胶电泳分离,转至PVDF膜,TBST溶液阻断,洗膜,加入稀释的一抗GAPDH(1∶1 000)、CD9(1∶2 000)、CD63(1∶1 000)、Calnexin(1∶1 000) 4 ℃孵育,次日取出,室温复苏1 h,TBST冲洗10 min,添加过氧化物酶标记的山羊抗兔二抗IgG(1∶1 000)孵育2 h,TBST冲洗,ECL化学发光液滴加至PVDF膜,自动凝胶成像仪拍照,Image J量化分析目标条带蛋白表达强度,根据GADPH进行归一化处理。
1.2.9 双荧光素酶报告实验检测靶向关系 根据在线生物预测网站预测的特异性结合位点扩增MYC 3'UTR片段,克隆至荧光素酶报告载体,即MYC-WT。再对原结合位点进行定点突变,扩增并克隆至载体,即MYC-MUT。将以上质粒分别与mimic-NC、miR-376b-3p mimic共转染至细胞,按LipofectamineTM3000试剂盒说明进行,转染48 h后按双荧光素酶基因报告试剂盒说明检测,以海肾荧光素酶为对照荧光素酶报告基因进行归一化。
1.2.10 CCK-8检测细胞增殖 共培养后将细胞接种于96孔板,37 ℃、5%CO2培养,0 h、24 h、48 h、72 h时每孔加入10 µl CCK-8溶液继续孵育1 h,检测490 nm处吸光度。各样品检测3次。
1.2.11 流式细胞术检测细胞凋亡 将各组共培养的HC-A细胞接种至96孔板,当细胞达到60%~80%融合时加入PBS缓冲液调整浓度,制成细胞悬液,加入 Annexin V-FITC/PI各 5 µl,混匀,避光孵育15 min,流式细胞仪下检测并计算细胞凋亡。
1.2.12 ELISA检测免疫相关因子分泌水平 取细胞上清,常规梯度密度离心去除悬浮颗粒物,ELISA试剂盒检测上清中TNF-α、IL-6水平,按试剂盒说明操作,多功能酶标仪检测490 nm处各孔吸光度(OD)。
1.3 统计学分析 采用SPSS23.0软件处理数据,符合正态分布与方差齐性的计量资料采用±s表示,采用t检验与单因素方差分析结合Tukey's检验。计数资料以n表示,采用卡方检验或Fisher确切概率检验。P<0.05为差异有统计学意义。
2 结果
2.1 OA组织与细胞系中miR-376b-3p表达下调筛选GSE79258数据集中差异表达的miRNAs,发现miR-376b-3p在OA组织中表达显著低于LDH组织(图1A)。相对于Non-OA组,OA组织中miR-376b-3p表达显著降低(P<0.05,图1B)。进一步根据KLG分级检测不同阶段OA患者miR-376b-3p表达,结果发现miR-376b-3p水平随病程延长而下降(均P<0.05,图1C)。IL-1β处理后发现,与0 h相比,IL-1β处理的HC-A细胞miR-376b-3p表达呈时间依赖性下调(均P<0.05,图1D)。提示miR-376b-3p低表达可能与OA发生发展相关。
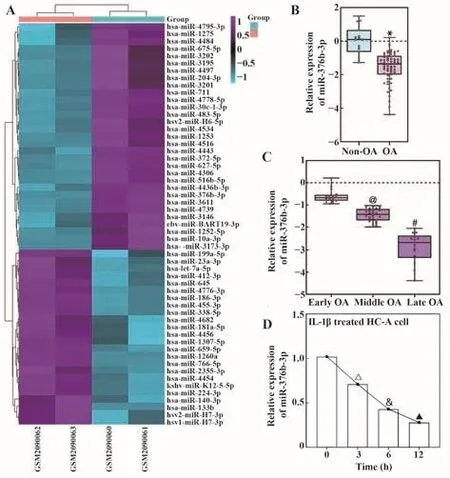
图1 OA组织与细胞系中miR-376b-3p表达下调Fig.1 miR-376b-3p expression was down-regulated in both OA tissue and cells
2.2 SMSCs源性exo中miR-376b-3p表达增加 流式细胞术结果显示,间充质干细胞标志物CD73和SMSCs标志物CD44阳性表达率分别为98.59%、99.54%,而CD34和CD45阳性表达率仅为1.59%、0.38%,提示SMSCs分离成功。透射电镜下可见exo具有双层膜结构的圆盘状颗粒(图2A)。Western blot结果显示,相对于对照组,CD9与CD63在exo中高表达,而Calnexin在SMSCs-Exo组不表达(均P<0.05,图2B),SMSCs-Exo鉴定成功。将HC-A细胞与SMSCs-Exo共培养,结果显示,相对于HC-A组,HC-A+SMSCs-Exo组miR-376b-3p表达增加(均P<0.05),加入exo抑制剂GW4869后miR-376b-3p表达被抑制(均P<0.05,图2C),提示SMSCs-Exo能够携带miR-376b-3p进入HC-A细胞。
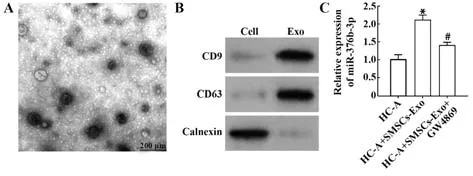
图2 SMSCs源性exo分离及miR-376b-3p表达Fig.2 Exo separated from SMSCs and expression of miR-376b-3p
2.3 SMSCs源性exo能抑制软骨细胞凋亡和炎症反应,并促进其增殖 IL-1β可显著抑制HC-A细胞增殖,诱导细胞凋亡,该效应可被SMSCs-Exo部分逆转(均P<0.05,图3A、B)。ELISA结果显示,IL-1β可提高TNF-α、IL-6水平,这些变化可被SMSCs-Exo部分逆转(均P<0.05,图3C)。提示SMSCs-Exo可促进HC-A细胞增殖,抑制其凋亡和炎症反应,改善OA软骨细胞炎症损伤。
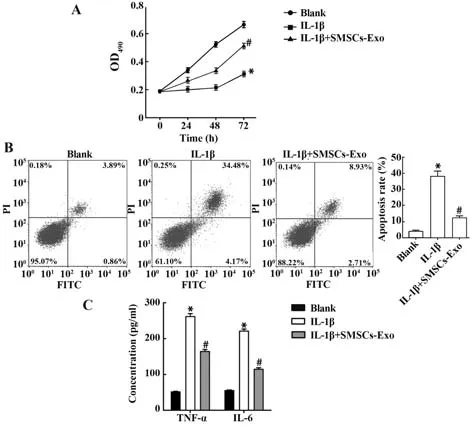
图3 SMSCs源性exo抑制软骨细胞凋亡和炎症反应并促进其增殖Fig.3 Apoptosis and inflammatory response of chondrocyte were inhibited and proliferation was promoted by SMSCs-derived exo
2.4 SMSCs通过调控miR-376b-3p减轻OA损伤qRT-PCR显示,SMSCs-miR-inhibitor-Exo组miR-376b-3p表达较阴性转染SMSCs-inhibitor-NC-Exo组显著降低(均P<0.05,图4A)。与阴性对照组相比,与SMSCs-miR-inhibitor-Exo共培养的HC-A细胞miR-376b-3p表达显著降低(均P<0.05,图4B)。SMSCs-miR-inhibitor-Exo组较SMSCs-inhibitor-NC-Exo组细胞增殖活力降低、凋亡率升高,炎症因子TNF-α和IL-6水平上调(均P<0.05,图4C~E)。提示SMSCs-Exo通过分泌miR-376b-3p有效抑制OA进展。
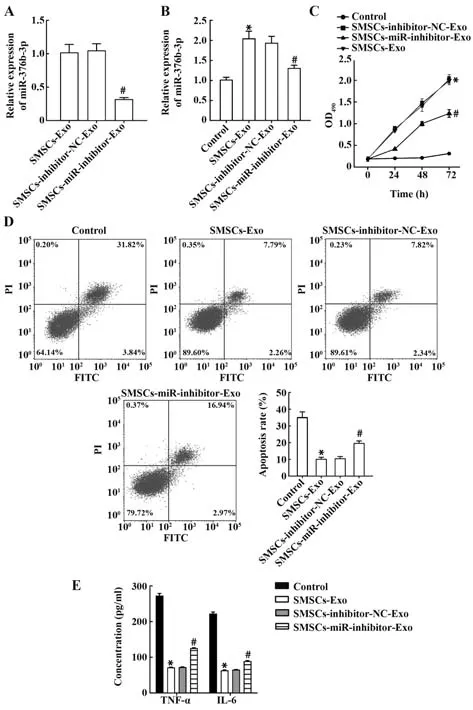
图4 SMSCs通过调控miR-376b-3p抑制OA进展Fig.4 SMSCs inhibits progression of OA by regulating miR-376b-3p
2.5 MYC是miR-376b-3p的下游靶点 TargetScan和StarBase获取miR-376b-3p的下游靶基因并取交集,结果显示,共有528个交集基因(图5A);KEGG功能富集分析结果显示,miR-376b-3p的靶基因显著富集于干细胞多能性信号通路(图5B);将该通路的16个基因与DisGeNET获取的OA疾病风险基因(C0409959:GDF5、SBNO1、LTBP1和WWP2)进行蛋白互作分析,结果显示,MYC与OA风险基因及干细胞多能性通路相关基因具有较强的相关性(图5C)。miR-376b-3p可直接靶向作用于MYC(均P<0.05,图5D、E)。OA组MYC表达较Non-OA组上调(均P<0.05,图5F),且与OA中miR-376b-3p表达呈负相关(r=-0.287 2,P=0.027 4,图5G),提示MYC可能作为miR-376b-3p的下游靶点在OA中损伤软骨细胞。
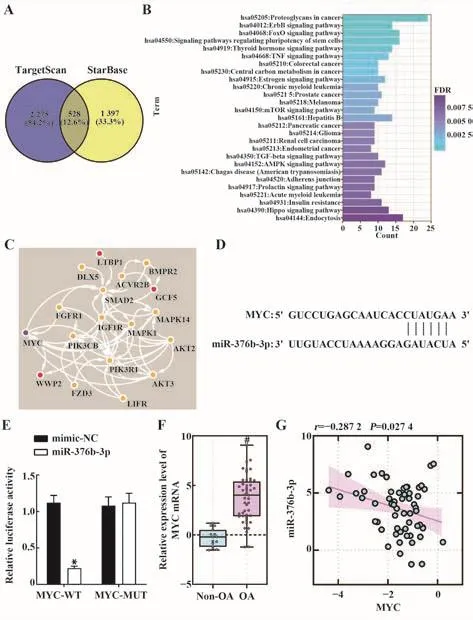
图5 MYC是miR-376b-3p的下游靶点Fig.5 MYC is downstream target of miR-376b-3p
2.6 MYC促进软骨细胞凋亡和炎症反应并抑制其增殖,exo源性miR-376b-3p可部分逆转该作用 qRTPCR结果显示,MYC能稳定高表达于转染pc-MYC的细胞(P<0.05,图6A)。共培养后发现,与pc-MYC组相比,pc-MYC+SMSCs-Exo组MYC表达下调(P<0.05,图6B)。功能试验结果显示,与pc-DNA3.1组相比,pc-MYC组细胞增殖活力降低、凋亡数增加、TNF-α及IL-6水平升高(均P<0.05),而与pc-MYC组相比,pc-MYC+SMSCs-Exo组细胞增殖活力升高、凋亡率、TNF-α 及 IL-6水平降低(均P<0.05,图6C~E)。提示exo中高水平的miR-376b-3p通过负调控MYC表达抑制OA进展。

图6 SMSCs-Exo源性miR-376b-3p/MYC对软骨细胞增殖、凋亡及炎症反应的影响Fig.6 Effects of SMSCs-Exo derived miR-376b-3p/MYC on proliferation,apoptosis and inflammatory response of chondrocytes
3 讨论
研究显示,exo是一类双层膜结构囊泡,直径约100 nm,由不同类型活细胞分泌,与其源性细胞具有类似生物功能,但不产生明显免疫原性或致瘤性等不良反应,通过携带蛋白和遗传物质等作为载体将信息稳定传递至受体细胞,与受体细胞融合并调控基因表达[9]。SMSCs源性exo在OA治疗中的作用不可或缺,如SMSCs源性exo可显著改善OA关节内衰老细胞积累的微环境[10]。SMSCs源性exo能将miR-140-5p传递至软骨细胞,促进软骨细胞增殖[11]。miR-31经SMSCs源性exo包装、携带,传递至软骨细胞,通过调控KDM2A基因促进软骨细胞增殖、迁移及软骨形成,有效改善了OA导致的软骨损伤和炎症[12]。因此认为SMSCs源性exo可有效治疗并预防OA。
为寻找更有效的生物靶向分子,本研究通过GEO数据库分析发现,miR-376b-3p在OA组织中表达下调。已有研究发现,一些miRNAs对OA发挥抗凋亡和抗炎作用,其中包含miR-376b-3p[6]。本研究通过qRT-PCR发现,miR-376b-3p在OA中异常低表达,且随着OA病程延长表达逐渐下调。软骨退化、软骨细胞衰老是OA的主要特征,而IL-1β是一种促炎症细胞因子,可导致软骨组织及细胞损伤[13]。因此本研究在体外采用促炎因子IL-1β诱导并模拟OA损伤建立细胞模型,发现miR-376b-3p水平呈时间依赖性下调。随后从滑膜组织中分离SMSCs,并进一步从SMSCs中分离exo,将exo与软骨细胞共培养后发现,SMSCs源性exo可减轻IL-1β诱导的HC-A细胞凋亡,同时抑制炎症反应,提高细胞增殖活力。而抑制SMSCs源性exo中miR-376b-3p表达,该效果减弱,提示SMSCs源性exo抑制OA进程的作用可能通过携带高水平miR-376b-3p实现。
为探索SMSCs源性exo携带的miR-376b-3p对OA的具体作用机制,本研究借助一系列在线生物预测网站,结合文献筛选并确定miR-376b-3p的下游靶基因MYC。MYC被证明可影响破骨细胞分化,且与OA发病机制紧密相关[14]。在大鼠早期OA踝突软骨细胞中表达上调,下调其表达可促进踝突软骨细胞增殖、肥大和迁移[15]。本研究证明MYC具有促OA炎症损伤作用,而该作用能被携带高水平miR-376b-3p的exo部分逆转,表明SMSCs源性exo中miR-376b-3p可影响OA进展,该作用可能通过调节MYC基因实现。
综上,SMSCs源性exo能够携带miR-376b-3p通过调控MYC表达参与OA进展,首次提出SMSCs源性exo中的miR-376b-3p可被用作OA的治疗性生物标志物,为OA治疗策略研究提供了新的视角。本研究未针对性开展体内实验,且样本量有限,因此仍存在一定局限性。