脓毒症对新生小鼠远期认知功能障碍的机制研究①
2022-02-10王海川唐彬秩李茂军
王海川 阳 倩 唐彬秩 李茂军 石 伟 吴 青
(四川省医学科学院·四川省人民医院儿科,成都 610072)
脓毒症是新生儿常见危急重症,病死率高,预后差,脓毒症相关性脑病是常见并发症,对小儿脑损伤严重,影响其远期生活质量,临床症状主要以谵妄、意识水平改变为主要特征,轻者表现为烦躁不安、注意力缺陷,严重者可导致远期认知功能障碍,智力低下、学习能力减弱、执行功能障碍,部分患儿甚至可遗留痫性发作,导致患儿死亡风险上升[1-3]。
目前有关新生儿脓毒症相关性脑病导致远期认知功能障碍的研究较少,发病机制尚不明确,主要集中在信号传导学说、炎症反应学说、谷氨酸导致的兴奋性毒性学说等[4]。现研究主要聚焦于脑线粒体氧化呼吸链功能障碍后,导致神经元凋亡,大脑病理切片及影像学表现为囊性改变及局灶性液化坏死,中枢神经系统出现不可逆损伤,进一步导致患者发生远期认知功能障碍[5]。但在临床工作中也发现,有部分患儿虽经过治疗后观察到神经系统影像学无明显的囊性改变或局灶坏死,但仍出现抑郁、焦虑及社交障碍,甚至在该类患儿中有14%严重病例需要进入特殊学校学习及心身医学科的治疗[6-7]。目前的研究未能全面解释该病的发病原因,因此对其机制仍需进一步探讨。
Tau蛋白是脑内含量最为丰富的微管相关蛋白,在学习记忆过程中发挥了重要作用,如参与神经元的营养及轴突的运输、维持神经系统内部的正常生物学信号传导[8]。在疾病状态下,Tau蛋白出现过度磷酸化,导致神经元出现神经纤维缠结,损伤神经元,并进一步诱发患者出现认知功能障碍[9]。截至目前,国内外在新生儿脓毒症介导的相关性脑病的研究中,关于中枢神经系统中的Tau蛋白是否出现异常磷酸化的研究较少,且Tau蛋白在其中的作用也尚不清楚。因此,本研究通过构建新生小鼠脓毒症模型,探讨新生儿脓毒症导致患者远期认知功能出现障碍,是否与Tau蛋白过度磷酸化存在关联。
1 材料与方法
1.1 材料
1.1.1 实验动物 C57BL/6J孕鼠购于北京维通利华实验动物技术有限公司,体质量30 g左右。动物饲养在四川省人民医院动物实验中心,温度20 ~25 ℃,相对湿度55%~65%,整个实验过程和实验操作符合国际实验动物认可和评估委员会认证的要求。
1.1.2 药品与试剂 脂多糖(lipopolysaccharide,LPS,L2880)、anti-pS396 抗体(ab109390,1∶5 000,Sigma公司);戊巴比妥钠(T8590,索莱宝公司);PVDF膜(IPVH00010,Millipore公司);脱脂奶粉(232100,BD公司);anti-IL-1β抗体(ab9787,1∶1 000)、anti-TNF-α抗体(ab66579,1∶1 000)、anti-pS404抗体(2691-1,1∶5 000,Abcam公司);anti-Tau抗体(MA-12808,1∶1 000,ThermoScientific公司);anti-GAPDH抗体(ZSGB-BIO,1:2 000,中杉金桥公司);anti-MouseIgG-HRP 抗体(M210015,1∶1 000)、anti-RabbitIgG-HRP抗体(M210025,1∶1 000,Abmart公司);Donkey anti-Mouse(AlxaFluor594)抗 体(A-21203,1∶400,Invitrogen公司);TNF-α ELISA试剂盒(MB-2868B)、IL-1β ELISA试剂盒(MB-2776B,江苏酶标生物科技有限公司)。
1.1.3 主要仪器 BIO-RAD MiniPROTEAN Tetra电泳仪、BIO-RAD Trans-Blot半干转膜仪(BIO-RAD,美国);低温离心机(Heal Force Neofuge 13R,中国);全波长酶标仪(MD Spectra Max 190,美国);BIORAD Chemical XRS+显影系统(Bio-Rad,美国)。
1.2 方法
1.2.1 动物模型的建立 选取出生后第5天C57BL/6J小鼠腹腔注射LPS(100 µg/kg),诱导全身炎症反应,构造脓毒症小鼠模型。选取经LPS干预下且存活至8周的小鼠12只设为模型组,正常小鼠12只设为对照组。
1.2.2 行为学实验评估 采用旷场实验、新奇实验、新物体位置识别实验分别评估C57BL/6J小鼠记忆和焦虑行为。旷场实验:将小鼠放置在正方形的场地(长48 cm×宽48 cm ×高30 cm)中央,通过顶部的摄像机观察实验小鼠在5 min内的活动总距离和在角落区域内的时间,结果通过EthoVision8.5软件来进行数据分析。新奇实验:在一正方形的箱内(长48 cm×宽48 cm×高30 cm)让小鼠自由活动10 min,以熟悉周围环境。然后将实验小鼠放回原居住鼠笼。把A、B两个相同物体放入箱内,并且固定好位置,再次放入实验小鼠,让其自由探索10 min,探索完成后再将小鼠放回鼠笼。第2天将试验用物A替换为物C,物B位保持原位置,再将实验小鼠放入箱中,让其活动10 min,记录小鼠在B、C两个物体周围活动的时间。新物体位置识别实验是在原实验环境及原实验步骤的基础上,将物A由原来位置换到新标记位置,物B保持原位置,记录小鼠在A、B两物体的活动时间,结果均通过EthoVision 8.5软件进行数据分析处理。
1.2.3 Western blot蛋白水平测定 各组小鼠海马组织,通过蛋白裂解试剂盒提取蛋白原液,采用Bandford法检测蛋白浓度,每组取蛋白样品20 µg进行SDS-PAGE电泳,跑胶完成后,将胶移至PVDF膜,转膜完成后将膜放置5%脱脂牛奶封闭1 h,再添加Ⅰ抗4 ℃过夜。第2天给予含有辣根过氧化物酶的Ⅱ抗室温下孵育2 h。BIO-RAD Chemical XRS+显影系统对条带显影,采用Imege J 3.0软件系统分别测定各组小鼠蛋白的灰度值。
1.2.4 ELISA检测外周血清中IL-1β、TNF-α 称量模型组及对照组小鼠体质量;取1%戊巴比妥钠(60 mg/kg)腹腔注射麻醉;取模型组及对照组C57BL/6J小鼠外周血,置于室温后1 h,4 ℃,2 000 r/min离心20 min后吸取血清备用,按照小鼠IL-1β、TNF-α试剂盒的检测方法检测小鼠血清中IL-1β、TNF-α的含量。
1.2.5 免疫荧光检测海马齿状回脑区Tau蛋白称量模型组及对照组小鼠体质量,取1%戊巴比妥钠(60 mg/kg)腹腔注射麻醉。经心脏用4%多聚甲醛灌注后取出脑组织,用冷冻包埋剂包埋组织后,利用冷冻切片机切片(40 µm),切片完成后放置-20 ℃冰箱中保存。将切片用PBS液冲洗3次,每次5 min。加入5%的驴血清进行封闭,室温2 h。加入Ⅰ抗Tau(1∶150),在4 ℃下孵育过夜。次日用PBS液冲洗3次,每次5 min。加入荧光Ⅱ抗,在室温下孵育2 h,用PBS液冲洗3次,每次3 min。最后加入含有Dapi的荧光淬灭液封片。采用荧光显微镜对海马组织中齿状回脑区Tau蛋白的表达进行观察,Image J 3.0软件系统对拍摄的图片进行统计分析。
1.3 统计学分析 数据以±s表示。使用SPSS21.0统计软件对实验数据进行统计检验处理。对各组数据进行正态性和方差齐性检验,数据呈正态分布,采用独立样本t检验进行统计学分析。P<0.05时认为差异具有统计学意义。
2 结果
2.1 行为学测试结果 在行为学实验中发现,模型组小鼠与对照组小鼠相比,在测定运动距离及角落时间方面明显滞后于对照组,差异有统计学意义(P<0.05,图1A、B);测定模型组小鼠与对照组小鼠对新物体识别及物体位置探索后发现,模型组小鼠对新物体和物体位置没有明显的偏好,两组比较差异有统计学意义(P<0.01,图1C、D)。

图1 旷场试验、新奇试验和新物体位置识别试验Fig.1 Open field test,novel object recognition test and new object position recognition test
2.2 外周血清IL-1β、TNF-α水平检测 与对照组水平相比,在出生后8周时模型组小鼠外周血清IL-1β、TNF-α 水平差异无统计学意义(P>0.05,图2)。
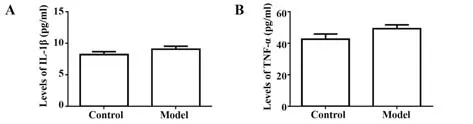
图2 外周血清IL-1β和TNF-α的水平检测Fig.2 Levels of IL-1β and TNF-α in peripheral serum
2.3 脑组织中IL-1β、TNF-α、Tau蛋白和磷酸化Tau蛋白的表达 在出生后8周时模型组小鼠脑组织中IL-1β和TNF-α的表达高于对照组,差异有统计学意义(P<0.05,图3A);此外,与对照组相比,模型组小鼠Tau蛋白表达显著上调,第396和第404苏氨酸位点的磷酸化水平显著上升,差异有统计学意义(P<0.05,图3B)。
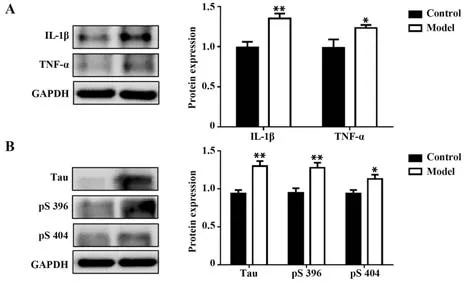
图3 脑组织内IL-1β和TNF-α、Tau蛋白和磷酸化Tau蛋白的表达Fig.3 Expression of IL-1β and TNF-α,Tau protein and phosphorylated Tau protein in brain tissue
2.4 免疫荧光观察海马齿状回脑区中Tau蛋白表达 在病理切片上,模型组小鼠海马齿状回脑区Tau蛋白的表达相较于对照组小鼠明显升高,差异有统计学意义(P<0.05,图4)。
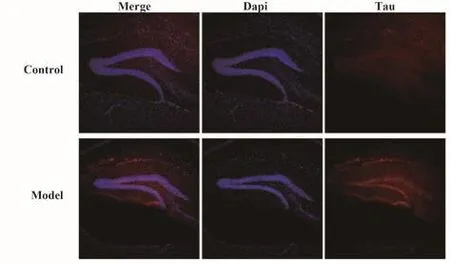
图4 小鼠海马齿状回脑区Tau蛋白表达(免疫荧光染色,×100)Fig.4 Expression of Tau protein in dentate gyrus of mouse hippocampus (immunofluorescence staining,×100)
3 讨论
研究表明,线粒体功能障碍、谷氨酸兴奋性毒性作用、中枢神经系统中神经元自噬现象均与新生儿脓毒症相关性脑病的远期认知功能障碍存在关联[10]。本研究发现脓毒症小鼠在出生后8周时行为学出现异常,考虑可能与炎症反应作用于机体后导致大脑功能受损,行为学出现异常存在关联。全身炎症反应早期机体炎症因子大量释放,内皮细胞遭到破坏后,血脑屏障通透性增加,炎症因子IL-1β、TNF-α、IL-10进一步作用于免疫细胞, CD4+T淋巴细胞的循环转移,导致大脑内CD4+T淋巴细胞数量增加,外周血中CD4+T细胞减少,促进Th1淋巴细胞向Th2淋巴细胞的转化增加,加速免疫失衡进程[11-12]。本次实验测定模型组脑内IL-1β和 TNF-α的含量明显高于对照组,该实验结果同国内外文献报道一致,表明脓毒症小鼠脑内存在炎症反应[13]。
国内有学者研究报道脓毒症后期脑组织出现了局部囊性改变或液化坏死病灶,主要发生在海马、枕叶部位,海马组织参与学习、记忆及情感调控,海马组织病变与行为学异常密切相关[14]。目前国内外较多的脓毒症模型多采用出生后1个月或成熟期小鼠作为动物模型,本次实验与以往研究有所不同,采用出生5 d幼鼠造模,观察了海马区Tau蛋白的变化。生命早期免疫功能尚不成熟,机体对炎症因子的打击反应程度不同,机体的应激反应也存在差异性,导致器官损伤部位及程度也不尽相同[15-16]。本实验从模型构造的差异性及诱发全身炎症反应的不同状态出发,来探讨其远期认知功能障碍的可能发病机制。
本次实验同时测定外周血清中IL-1β、TNF-α的浓度,对照组与模型组无明显差异,目前研究报道疾病早期外周及颅内炎症因子均升高二者存在一致性,而后期二者相关性的研究目前暂无文献报道,考虑与机体外周免疫调节与中枢神经系统免疫调节机制可能存在不同的信号通路存在关联[17-18]。颅内神经系统小胶质细胞活化后,导致炎症瀑布反应持续存在,慢性炎症因子浸润,神经元出现不可逆损伤[19-20]。而外周大部分组织器官代偿增生能力较强,通过免疫自稳促进机体的自身修复来降低炎症因子损伤,使颅内炎症因子明显升高,而外周炎症因子无明显变化[21-22]。
Tau蛋白是脑内含量最为丰富的微管相关蛋白,可分泌神经营养因子,参与维持大脑正常发育[23]。Tau蛋白是否参与了新生儿脓毒症相关性脑病远期认知功能障碍的发病机制,目前国内外相关报道较少。通过本次研究发现,颅内炎症因子含量明显升高时,Tau蛋白也呈现出过度磷酸化状态,考虑二者之间可能存在关联性。炎症状态下,Ca2+可出现明显的浓度差异,而钙激酶活性受Ca2+浓度调节,钙激酶可通过影响糖原合成酶激酶3 (glycogen synthase kinase 3,GSK3)来参与调节Tau蛋白磷酸化[24-25]。目前已有研究发现GSK3主要通过促进Tau蛋白 Thr205、Thr212、Ser214、Thr217和 Ser396/404多个位点发生过度磷酸化参与认知功能障碍[26-28]。GSK3磷酸化位点的不同,发挥的生物活性也存在差异,如ser9位点的磷酸化可抑制钙激酶对GSK3的剪切及抑制作用[29-30]。目前已有文献报道Tau蛋白磷酸化位点多以Ser202/205位点为主[31]。本实验发现Tau蛋白主要以Ser396/404磷酸化位点表达上调,与既往报道磷酸化位点有所不同,有研究报道小鼠脑损伤后检测3个月时颅内Tau蛋白磷酸化水平无明显变化,而在16个月时才出现明显异常,考虑Tau蛋白磷酸化位点的不同及时间差异性,可能与脑损伤的年龄段、原发疾病及试验对象品系基因易感性相关[32-33]。
综上所述,在本次实验中发现脓毒症小鼠出现了远期行为学异常,外周血清中炎症因子无明显变化,但海马组织中炎症因子浓度升高,且出现Tau蛋白过度磷酸化,考虑到炎症因子作用于中枢神经系统后,导致免疫失衡及Tau蛋白异常,这可能是脓毒症相关性脑病发生远期行为学异常的重要原因。因此对中枢神经系统免疫功能的研究,将有助于更好地探讨新生儿脓毒症及其远期认知功能障碍可能的发病机制。