维生素D通过调控Traf6/TAK1通路抑制2型糖尿病肾病大鼠肾小管上皮细胞间充质转分化
2022-02-10南通市中医院南通226001
薛 莉 瞿 伟 (南通市中医院,南通 226001)
随着人们生活方式的改变和老龄化社会的加剧,2型糖尿病(type 2 diabetes mellitus,T2DM)患病率逐年上升,成为继心脑血管疾病及肿瘤后威胁人类健康的又一严重疾病[1]。糖尿病肾病(diabetic kidney disease,DKD)是T2DM的常见并发症,临床特征为肾小管上皮细胞肥大、肾小管基底膜增厚,进而出现微量白蛋白尿、大量蛋白尿、肾小管间质纤维化(renal interstitial fibrosis,RIF)及肾小球硬化等,最终导致终末期肾病[2]。其中RIF是终末期肾病最典型的病变,也是多种肾病发展为终末期肾功能衰竭的共同环节,而上皮细胞间充质转分化(epithelial mesenchymal transition,EMT)是形成RIF的主要病变途径。因此抑制EMT对预防慢性肾病具有重要价值[3]。肿瘤坏死因子受体相关分子6(tumor necrosis factor receptor associated factor 6,Traf6)是Toll样受体家族成员,参与介导Toll样受体与肿瘤坏死因子受体的信号传导,Traf6可以使转化生长因子β活化激酶1(transforming growth factor β activated kinase 1,TAK1)磷酸化,进而诱导炎症、凋亡及氧化应激的发生[4-5]。另外Traf6还参与肾小管上皮细胞转分化过程[6-7]。维生素D(vitamin D,Vit D)是脂溶性维生素,活性形式为25-羟维生素D3[25-(OH)D3],其主要来源于食物或由暴露在紫外光下的皮肤合成。近年来研究发现Vit D对胰岛细胞具有一定的保护作用,Vit D是否影响DKD患者肾小管EMT鲜有报道。
本研究通过观察Vit D对链脲佐菌素(streptozotocin,STZ)诱导的DKD大鼠Traf6/TAK1信号通路的调控作用、炎症反应及肾小管EMT的影响,进一步探究Vit D在DKD发生、发展中的作用,为Vit D临床防治RIF提供依据。
1 材料与方法
1.1 材料
1.1.1 实验动物 48只8周龄、体质量为(250±10) g的SPF级SD雄性大鼠购自北京生物制品研究所有限责任公司,生产许可证号为SYXK(京)2020-0031。饲养环境为室温23 ℃、标准湿度60%、12 h/12 h昼夜交替、正常供给饲料和饮用水、分笼饲养。饲养1周后用于实验。本研究实验经医院伦理委员会批准。
1.1.2 主要试剂和仪器 STZ(美国Sigma公司);骨化三醇胶丸(上海罗氏制药有限公司);E-cadherin抗体(美国Protein-tech公司);α-SMA抗体(美国Selleck公司);Traf6、p-TAK1抗体(美国CST公司);辣根过氧化物酶标记的二抗(北京博尔西科技有限公司);RIPA裂解液、BCA蛋白浓度测定试剂盒(北京中杉金桥生物技术有限公司);TGF-β1抗体、ELISA试剂盒(武汉博士德生物工程有限公司);Thermo酶标仪(上海热电仪器有限公司);组织包埋机(德国Leica公司);台式冰冻离心机(美国Beckman公司);蛋白电泳仪(美国Bio-Rad公司);光学显微镜(日本Olympus公司);便携式血糖监测仪(德国ACCU-Chek公司)。
1.2 方法
1.2.1 造模、分组和留样 将48只大鼠随机分为对照组(Control组)、模型组(Vehicle组)、治疗组(Vit D组)。模型制作:Control组喂普通饲料,Vehicle组及Vit D组喂高脂高糖饲料(饲料配方:10%炼猪油,20%蔗糖,2%胆固醇,8%蛋黄粉,60%普通饲料),6周后Vehicle组及Vit D组大鼠空腹12 h后腹腔注射小剂量STZ(30 mg/kg)。注射3 d后,随机检测血糖,连续3次非同日尾静脉注射≥16.7 mmol/L STZ为T2DM大鼠。T2DM成模大鼠在STZ注射后6周和7周时检测晨尿中微量蛋白含量,若连续3次以上为阳性,则为DKD大鼠。DKD大鼠建模成功后,Vit D组给予0.03 µg/(kg·d)骨化三醇(溶于0.05 ml花生油)灌胃8周,Vehicle组给予等量花生油灌胃,Control组不做任何处理。8周后收集大鼠24 h尿液,测定24 h尿蛋白含量及尿量。腹腔注射0.3%戊巴比妥钠(3 ml/kg)麻醉大鼠,心脏穿刺取血,分离血清,保存于-20 ℃备用,测定FBG、血肌酸酐、血尿素氮含量。处死大鼠后,分离两侧肾,取皮质部分,切成1 mm×1 mm×1 mm的小块,部分用4%多聚甲醛固定,部分浸入RNA later液中,置于-80 ℃保存待测。
1.2.2 生化指标检测 采用德国ACCU-Chek血糖仪测定FBG,Olympus全自动生化分析仪检测尿蛋白、血肌酸酐、血尿素氮。采用ELISA法检测血清中IL-6、IL-1β及TNF-α含量。
1.2.3 HE染色观察肾脏组织形态学改变 取出用4%多聚甲醛固定的肾脏组织,进行脱水透明、石蜡包埋、脱蜡等操作,苏木素染色5~6 min,伊红染液染30 s,之后乙醇梯度脱水、透明、中性树胶封片,显微镜(×400)下观察大鼠肾脏组织病理学改变。
1.2.4 Masson染色观察肾脏组织纤维化改变 切片进行常规脱蜡,苏木素染色10 min,丽春红酸性复红液染色5 min,磷钼酸溶液分化5~10 s,亮绿染色6~8 min,乙醇梯度脱水,中性树胶封片,显微镜(×400)下观察大鼠肾脏组织纤维化程度。
1.2.5 免疫组化观察肾脏 E-cadherin、TGF-β1、α-SMA表达 石蜡切片经60 ℃熔蜡、二甲苯脱蜡、乙醇梯度脱水后,进行高压抗原修复,分别滴加一抗E-cadherin、TGF-β1、α-SMA(1∶200)孵育过夜,二抗(辣根过氧化物酶标记)孵育20 min,DAB显色液显色,苏木精复染,乙醇梯度脱水、透明、封片,显微镜(×200)下镜检。阳性染色为棕黄色,随机选取5个视野,利用Image J软件进行阳性面积统计。
1.2.6 Western blot法检测Traf6、p-TAK1蛋白的表达 取冻存的肾脏组织,加入RIPA裂解液,超声匀浆提取总蛋白,BCA蛋白检测试剂盒测定蛋白浓度。将蛋白沸水浴变性,取等量变性后的蛋白进行SDS-PAGE电泳,湿转至PVDF膜,用含5%脱脂牛奶死亡 TBST封闭 2 h,加入一抗 Traf6、p-TAK1(1∶2 000)4 ℃孵育过夜,TBST漂洗3次,加入二抗(1∶10 000)室温孵育2 h,用ECL化学发光剂进行显影,以GAPDH作为内参校正,Image J软件进行发光结果的灰度分析。
1.3 统计学分析 数据统计采用SPSS16.0软件,作图工具采用Graphpad5.0,计数资料采用n(%)表示,两组间比较采用χ2检验,多组间比较采用单因素方差分析,P<0.05表示差异具有统计学意义。
2 结果
2.1 各组大鼠一般情况及血糖、肾脏指标比较Control组大鼠毛色顺滑有光泽,饮食、饮水、尿量正常,体质量稳定增长,活动正常。给予高脂高糖喂养,腹腔注射STZ后,Vehicle组大鼠毛发暗淡无光泽,逐渐出现多饮、多食、多尿情况,逐渐消瘦,反应迟钝,活动减少。给予骨化三醇灌胃后,Vit D组大鼠情况有所改善,毛发逐渐润泽,饮食、饮水、尿量正常,精神逐渐恢复,体质量稳定增长。
与Control组相比,Vehicle组大鼠FBG、肌酐、尿素氮、24 h尿蛋白水平显著升高(P<0.05);与Vehicle组相比,Vit D组大鼠FBG、肌酐、尿素氮、24 h尿蛋白水平明显下降,差异具有统计学意义(P<0.05,表1)。
表1 各组大鼠FBG、肌酐、尿素氮、24 h尿蛋白、尿量的比较(±s)Tab.1 Comparison of FBG, creatinine, urea nitrogen, 24 h urine protein and urine volume of rats in each group (±s)

表1 各组大鼠FBG、肌酐、尿素氮、24 h尿蛋白、尿量的比较(±s)Tab.1 Comparison of FBG, creatinine, urea nitrogen, 24 h urine protein and urine volume of rats in each group (±s)
Note:Compared with control group, 1)P<0.01; compared with vehicle group, 2)P<0.05.
Groups Control Vehicle Vit D FBG/(mmol·L-1)5.7±0.35 17.6±2.131)12.4±1.852)Creatinine/(µmol·L-1)97.85±7.32 146.36±8.441)121.75±6.242)Urea nitrogen/(mmol·L-1)5.23±0.45 9.16±0.761)7.56±0.682)24 h urine protein/mg 12.54±4.65 46.23±8.411)28.14±6.522)24 h urine volume/mg 23.56±6.32 126.85±9.341)76.24±8.462)
2.2 各组大鼠炎症因子IL-6、IL-1β及TNF-α含量比较 ELISA结果显示(图1),与Control组相比,Vehicle组大鼠血清TNF-α、IL-1β和IL-6表达水平明显升高(P<0.05);与Vehicle组相比,Vit D组大鼠TNF-α、IL-1β和IL-6表达水平明显下降,差异具有统计学意义(P<0.05,图1)。

图1 各组大鼠炎症因子IL-6、IL-1β及TNF-α含量Fig.1 Levels of inflammatory factors IL-6, IL-1β and TNF-α in each group of rats
2.3 各组大鼠肾脏组织形态学改变比较 HE染色结果显示(图2),Control组大鼠肾小球、肾小管形态规则,囊壁结构完整;Vehicle组肾小球形态不规则,出现黏连、硬化,部分肾小管扩张,发生坏死,无囊壁结构,有明显的炎症细胞浸润;Vit D组大鼠肾小球形态较规则,细胞数增多,肾小管水肿,有轻度扩张和炎症细胞浸润,囊壁结构完整。
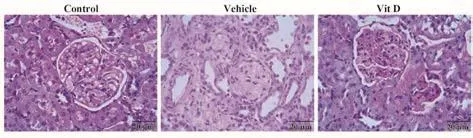
图2 各组大鼠肾脏组织形态学改变(×400)Fig.2 Morphological changes of rat kidney tissue in each group (×400)
2.4 各组大鼠肾脏组织纤维化改变比较 Masson染色结果显示(图3),Control组大鼠肾脏为大量红染的正常肾脏组织,Vehicle组大鼠出现部分蓝染的胶原纤维;Vit D组大鼠呈现散在蓝染的胶原纤维。

图3 各组大鼠肾脏组织形态学改变(×400)Fig.3 Morphological changes of rat kidney tissue in each group (×400)
2.5 各组大鼠肾脏组织E-cadherin、TGF-β1、α-SMA表达比较 免疫组化染色结果显示(图4),E-cadherin、TGF-β1、α-SMA蛋白阳性表达均呈棕黄色,Control组大鼠E-cadherin蛋白在肾小管上皮细胞呈强阳性表达,TGF-β1在肾小球和肾小管上皮细胞少量阳性表达,α-SMA在肾小管周围和间质散在表达;与Control组相比,Vehicle组大鼠E-cadherin蛋白表达显著减少,TGF-β1、α-SMA蛋白表达显著增加;与Vehicle组相比,Vit D组E-cadherin蛋白表达显著增加,TGF-β1、α-SMA蛋白表达显著减少,差异具有统计学意义(P<0.05)。
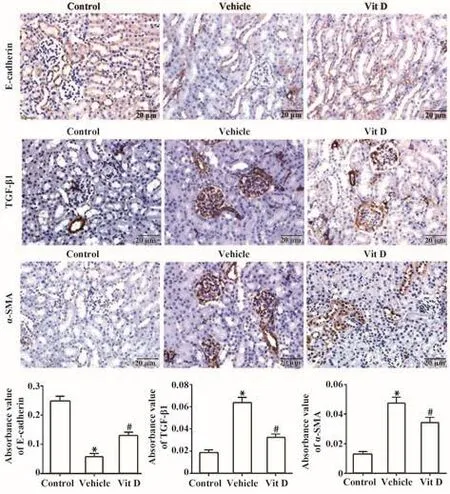
图4 各组大鼠肾脏组织E-cadherin、TGF-β1、α-SMA表达Fig.4 Expression of E-cadherin, TGF-β1 and α-SMA in kidney tissues of rats in each group
2.6 各组大鼠肾脏组织Traf6、p-TAK1蛋白表达比较 Western blot结果显示(图5),与Control组相比,Vehicle组大鼠血清Traf6、p-TAK1蛋白表达水平显著升高(P<0.05);与Vehicle组相比,Vit D组大鼠Traf6、p-TAK1蛋白表达水平明显下降,差异具有统计学意义(P<0.05)。
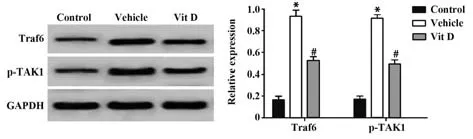
图5 各组大鼠肾脏组织Traf6、p-TAK1蛋白表达Fig.5 Expressions of Traf6 and p-TAK1 protein in kidney tissues of rats in each group
3 讨论
DKD是由糖尿病引起的微血管病变进而导致的肾小球硬化症,是慢性肾病和肾衰竭的常见病因。其中RIF是进展为终末期肾病的必经途径,而EMT是促进RIF的重要途径。因此探索缓解肾小管EMT及纤维化的药物,对于改善肾脏疾病具有重要意义。近年来Vit D对DKD的保护作用备受关注。研究表明Vit D能够减少肾脏足细胞肥大,减轻蛋白尿及肾小球硬化,抑制炎症因子的表达及巨噬细胞浸润等,能有效缓解DKD大鼠肾脏损伤[8]。张晓玲等[9]发现缺乏Vit D与DKD的发生、发展有关,补充Vit D有助于DKD的治疗。本研究中Vehicle组大鼠与Control组相比,毛发暗淡无光泽,出现多饮、多食、多尿情况,逐渐消瘦,反应迟钝,活动减少,FBG、肌酐、尿素氮、24 h尿蛋白等指标水平显著升高,肾小球出现黏连、硬化,部分肾小管扩张、坏死,说明制作DKD大鼠模型成功。给予Vit D干预后,Vit D组大鼠情况有所改善,毛发逐渐润泽,饮食、饮水、尿量正常,精神逐渐恢复,体质量稳定增长,FBG、肌酐、尿素氮、24 h尿蛋白水平明显下降,肾小球形态较规则,肾小管有轻度扩张。说明Vit D能有效改善DKD损伤,与以往研究结果一致。
肾脏组织长期浸润在高血糖环境中,能够引起炎症细胞过量分泌,从而激活核因子、丝裂元活化蛋白激酶家族(MAPKs)等多种炎症信号通路,诱发TNF-α、IL-1β和IL-6等炎症因子的分泌[10]。TNF-α能够损伤肾小管内皮细胞,造成细胞外基质沉积,导致 RIF[11]。IL-1、IL-6 可促进肾小球系膜细胞增殖,导致细胞外基质分泌增多和沉积[12]。Vit D能够改善DKD炎症状态,通过上调IL-10等抗炎因子及抑制TNF-α、IL-1β和IL-6等促炎因子的表达调节炎症的平衡[13]。赵耀等[14]发现高血糖能引起肾脏组织炎症反应,DKD大鼠较正常组TNF-α和IL-6含量显著上升。本研究中Vehicle组大鼠TNF-α、IL-6水平明显升高,经过Vit D干预后,TNF-α、IL-6水平明显降低,说明Vit D能够减轻DKD大鼠炎症反应,改善肾脏病理损害。
EMT发生后会迁移至间质区域,分泌大量细胞外基质,促进RIF的发生[15]。其中E-cadherin是肾小管上皮细胞的标志物,能够维持肾脏上皮结构及功能,其表达减少是发生EMT的早期事件。TGF-β1是公认的EMT发生诱导剂,能够单独引起并参与整个EMT过程,从而诱导纤维化的发生。α-SMA是间充质细胞的标志物,会随着肾脏成纤维细胞的激活而增多。赵宇等[16]研究发现高盐能通过增加TGF-β1、α-SMA的表达诱导EMT的发生,从而促进大鼠肾脏纤维化。韦建辉等[17]发现高糖通过下调E-cadherin的表达,上调α-SMA的表达,成功诱导HK-2细胞发生EMT。白雪峰等[18]发现低氧诱导因子-1α通过上调TGF-β1、α-SMA的表达,降低E-cadherin的表达,促进牦牛肾小管EMT的发生。本研究中Vehicle组大鼠TGF-β1、α-SMA的表达升高,E-cadherin的表达降低,且大鼠肾脏组织出现部分蓝染的胶原纤维;经过Vit D干预后,TGF-β1、α-SMA的表达水平明显降低,E-cadherin的表达明显增加,且呈现散在蓝染的胶原纤维,说明Vit D能够降低DKD大鼠EMT发生,从而抑制RIF。
TRAF6是一种衔接蛋白,在胞外信号刺激下TRAF6被激活,进而使下游TAK1发生磷酸化,将胞外信号传至胞内诱导炎症反应。研究发现,小鼠体内过表达TRAF6基因,会增加TAK1磷酸化水平,进而激活NF-κB信号通路,诱导细胞氧化损伤、炎症反应及细胞凋亡的发生[19]。沈先敏等[20]发现槲皮素通过抑制TRAF6/TAK1信号通路的活化,抑制TNF-α、IL-1β和IL-6炎症因子的表达,从而改善脂多糖诱导的BV-2细胞炎症损伤。李霖等[21]发现萝卜硫素通过抑制Traf6/TAK1通路,抑制脂多糖诱导的HK-2细胞炎症因子的产生,以及抑制肾小管EMT。本研究中Vehicle组较Control组TRAF6、TAK1的表达增加,Vit D干预后,TRAF6、TAK1的表达较Vehicle组降低,推断Vit D对DKD的保护作用可能是通过抑制TRAF6/TAK1信号通路实现的。
综上所述,Vit D能够有效改善DKD损伤,抑制机体炎症反应及肾小管EMT的发生,从而抑制RIF,可能通过抑制TRAF6/TAK1信号通路发挥对DKD大鼠的保护作用。