细胞遗传学检测方法对MLL基因异常儿童急性白血病的诊断意义
2022-02-10孙恒娟杜成坎
孙恒娟, 杜成坎, 李 红, 柳 敏, 张 泓
(1.上海市儿童医院 上海交通大学医学院附属儿童医院检验科,上海 200040;2.上海市儿童医院 上海交通大学医学院附属儿童医院血液科,上海 200040)
急性白血病(acute leukemia,AL)是儿童常见恶性疾病,约占15岁以下儿童恶性肿瘤的25~30%。AL患儿各种基因重排较普遍,混合谱系白血病(mixed linage leukemia,MLL)基因重排是其中之一,MLL基因又称KMT2A、ALL1或HRX基因,位于11号染色体长臂2区3带(11q23),可见于15.0%~20.0%的急性髓系白血病(acute myeloid leukemia,AML)和2.5%~5.0%的急性淋巴细胞白血病(acute lymphoblastic leukemia,ALL)患儿,在婴幼儿AL中占75%[1]。伴MLL基因重排的AL大多恶性程度高,缓解率低,对化疗不敏感,患儿预后不佳,是AL的一种独特亚型。本研究对MLL基因异常的AL患儿进行细胞遗传学分析,比较常规细胞遗传学(conventional cytogenetics,CC)检测方法(染色体G显带)和荧光原位杂交( fluorescence in situ hybridization,FISH)技术诊断MLL基因异常、MLL基因重排、染色体11q23异常AL患儿的临床价值。
1 材料和方法
1.1 研究对象
选取2016年6月—2021年6月上海市儿童医院收治的初发AL患儿404例,其中男228例、女176例,年龄2个月~15岁。根据《血液病诊断及疗效标准》[2],确诊ALL患儿308例、急性髓系白血病(acute myeloid leukemia,AML)患儿96例。
1.2 仪器和试剂
Chang Medium MF/BMC细胞培养试剂(美国Irvine Scientific公司)、Sigma-AlorichGs500染液(美国Sigma-Alorich公司)、VysisFISH探针(美国Abbot公司)、BX51和BX61显微镜(日本Olympus公司)、CDS5细胞生成干燥箱(美国Thermotron公司)、Thermobrite杂交仪(美国Leica公司)。
1.3 CC法染色体核型分析
采用24 h和48 h培养法制备染色体样本,根据人类细胞基因组学国际命名体系(2016)描述染色体核型。严格按照试剂盒和仪器说明书要求进行检测。
1.4 FISH技术分析
采用直接法获取细胞,采用双色分离探针变性、杂交过夜后,用6-二脒基-2-苯基吲哚(4',6-diamidino-2-phenylindole,4',DAPI)复染细胞核。使用荧光显微镜在DAPI/FITC/Texas Red三色滤光镜下观察间期荧光杂交信号,以红绿黄色(1R1G1F)荧光信号为MLL基因重排阳性。每例至少分析300个间期细胞,不计重叠细胞,计算阳性细胞比例。严格按照试剂盒和仪器说明书要求操作。
1.5 统计学方法
采用SPSS 23.0软件进行统计分析,计数资料以例或率表示,比较采用χ2检验。以P<0.001为差异有统计学意义。
2 结果
2.1 患儿一般资料
采用FISH技术检出MLL基因异常(重排阳性)患儿57例(14.1%),其中男34例、女23例,年龄2个月~14岁;57例患儿中, ALL患儿40例,其中≤12个月患儿5例( 12.5%);AML患儿17例,其中≤12个月患儿4例( 23.5%);有10例患儿初发时白细胞计数≥ 50×109/L ,其中ALL患儿7例( 17.5%)、 AML患儿3例( 17.6%)。CC法检出MLL基因异常患儿27例(6.7%)。2种方法MLL基因异常检出率差异有统计学意义(P<0.001)。
2.2 CC法染色体核型分析结果
40例ALL患儿中,染色体核型正常16例,因培养细胞生长不良不能分析1例,非染色体11q23异常8例,染色体11q23异常15例。15例染色体11q23异常患儿中,单纯数目异常(-11)1例,add(11)(q23)1例,明确MLL基因重排伙伴基因13例[t(4;11)(q21;q23)结构和数目异常7例、t(9;11)(p22;q23)4例、t(1;11)(p32;q23)1例、t(10;11)(p12;q23)1例]。见图1。
17例AML患儿中,染色体核型正常3例,因培养细胞生长不良不能分析1例,非染色体11q23异常1例,染色体11q23异常12例。12例染色体11q23异常患儿中,add(11)(q23)1例,明确MLL基因重排伙伴基因11例[t(9;11)(p22;q23)3例(其中1例增加了1条8号染色体)、t(11;19)(q23;p13)3例(其中1例增加了1条8号染色体)、t(1;11)(q21;q23)3例、t(11;17)(p23;q25)1例、ins(11;11)1例]。见图1。
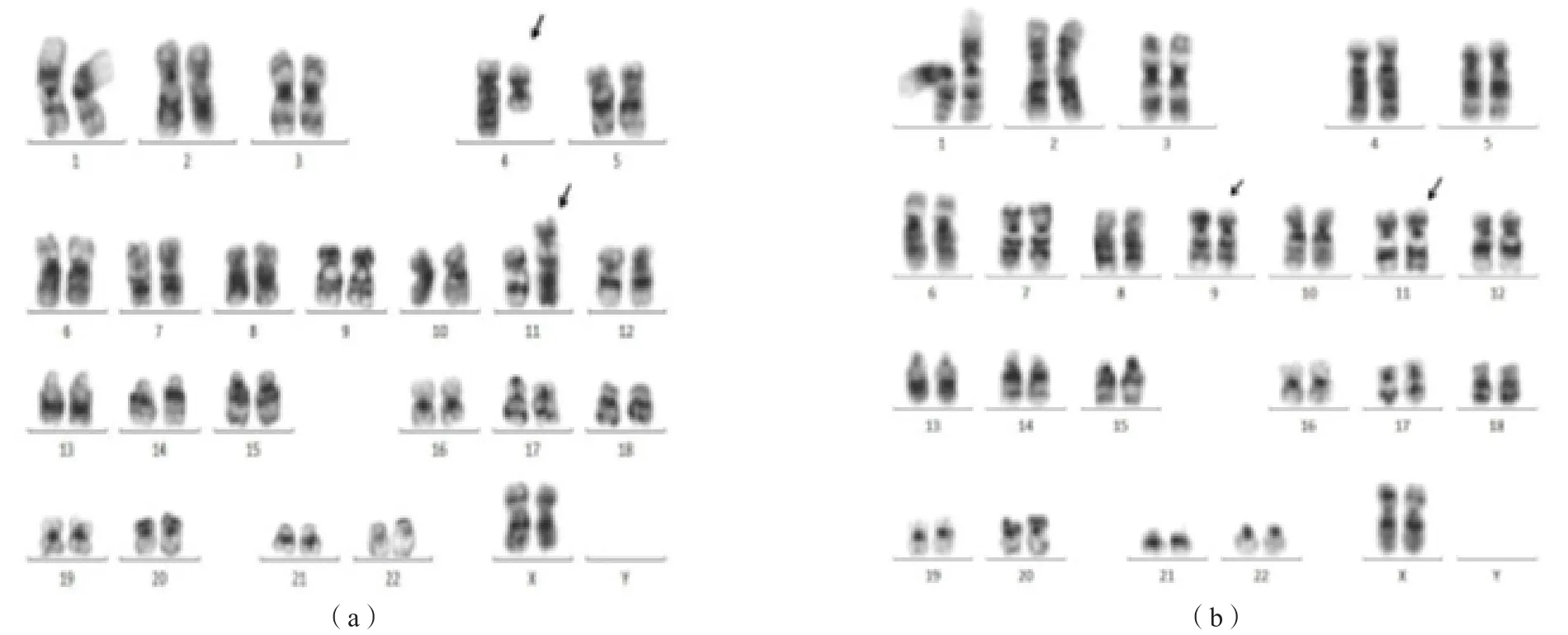
图1 异常染色体核型
2.3 FISH技术检测结果
57例MLL基因重排阳性患儿均发现MLL基因探针信号异常。40例ALL患儿中,探针信号分离(1F1R1G)MLL基因重排17例,探针信号缺失(1F)8例,探针信号增加15例(13例3F,2例4F);17例AML患儿中,探针信号分离(1F1R1G)MLL基因重排15例,探针信号增加(3F)2例。见图2。

图2 AL患儿MLL基因FISH技术检测结果
3 讨论
1979年,VAN DEN BERGHE等[3]首先报道了AML中存在11q23染色体异常,此后相关研究在多种血液系统恶肿瘤中发现存在11q23/MLL异常。MLL基因重排是造血系统恶性肿瘤常见的遗传学改变,其易位形成的MLL融合蛋白可引起转录调控异常,诱导HOX、EPHA7、MEIS、PBX等下游目的基因异常表达,影响造血分化,导致白血病的发生[4]。MLL的伙伴基因有80多个,可以导致130余种不同的重排[5],是此类白血病诊断和预后判断的重要因素。
本研究404例AL患儿中,采用FISH技术检出MLL基因异常57例,其中ALL患儿40例、AML患儿17例。40例ALL患儿中,MLL基因信号拷贝数异常23例,包括信号缺失8例、3拷贝13例、4拷贝2例;探针信号分离MLL基因重排17例,信号模式均为1R1G1F。17例AML患儿中,探针MLL基因信号3拷贝2例;探针信号分离MLL基因重排15例,其中典型异常信号(1R1G1F)10例,1G1F伴MLL基因3'端丢失、1G1F伴额外获得1拷贝MLL基因3'端、2R1G1F伴额外获得1拷贝MLL基因3'端、1R2F伴额外获得1拷贝MLL基因、1G3F伴额外获得1拷贝MLL基因5'端各1例,且这5例患儿探针均有MLL基因重排的现象,这种异常信号的复杂多样化也可能是AML的不良预后因素之一。
本研究结果显示,404例AL患儿中,FISH技术检出MLL基因重排32例(7.9%)、CC法检出24例(5.9%),与相关文献MLL基因重排见于5%~10%的AL患儿结果一致[6]。染色体核型分析检出的染色体11q23畸变包括易位、缺失、重复、插入,本研究明确11q23易位伙伴24例,以t(4;11)、t(9;11)、t(1;11)、t(11;19)染色体易位为主;t(4;11)、t(1;11)(p32;q23)、t(10;11) 均在ALL患儿中被检出;t(1;11)(q21;q23)、t(11;19)、t(11;17)、ins(11;11)均在AML患儿中被检出;t(9;11)、add(11)在ALL和AML患儿中均有检出。非11q23克隆性染色体异常9例、正常核型19例、因培养细胞生长不良不能分析2例。ALL患儿共检出染色体11q23异常15例,其中14例可以明确易位伙伴;1例数目异常,非11q23异常8例,1例因培养细胞生长不良不能分析,核型正常16例。AML检出染色体11q23异常12例,均为结构异常,非11q23其他克隆性染色体异常1例,1例因培养细胞生长不良不能分析,染色体核型正常3例。15例ALL异常中,明确MLL基因重排和伙伴基因13例,其中t(4;11)7例、t(9;11)4例、t(10;11)1例、t(1;11)(p32;q23)1例。AML患儿共检出染色体异常12例,明确MLL基因重排和伙伴基因11例,t(9;11)3例、t(1;11)(q21;q23)3例、t(11;19)3例,t(11;17)1例、ins(11;11)1例,在11q23/MLL基因重排患儿中有2例合并+8,与文献报道的数目异常以三体8多见一致[7]。
综上所述,FISH技术对MLL基因异常检出率高于CC法,且检测周期短、准确性高、敏感性强,但只能针对怀疑片段进行检测,有一定的局限性;CC法是最基本的检测方法,可以直观地呈现MLL基因重排异常类型,并明确其伙伴基因,但不易发现MLL基因隐匿易位,有漏检的可能。2种方法可优势互补,在MLL基因异常AL的诊断中均有较大的价值。
