氧化应激标志物与前列腺增生和前列腺癌的相关性
2022-02-10王琳琳许丽丽
王琳琳, 许丽丽, 范 君, 钱 余
(1. 上海市杨浦区控江医院检验科,上海 200093;2. 上海市杨浦区控江医院泌尿科,上海 200093)
前列腺增生和前列腺癌是老年男性泌尿系统常见的疾病[1]。随着我国人口老龄化的逐年加重,前列腺增生和前列腺癌的发病率和患病率逐年升高。前列腺增生和前列腺癌的发病机制极其复杂,激素、肥胖、饮食和代谢等均是其发病的高危因素[2-3],但具体机制仍未被阐明。有较多研究发现氧化应激参与了肿瘤的发生、发展过程,在肿瘤的进展、转移中发挥了至关重要的作用[4-6]。班晨等[5]的研究结果显示,口腔鳞状细胞癌患者超氧化物歧化酶(superoxide dismutase,SOD)水平显著下降,且SOD低表达患者的死亡率更高(P<0.05)。孙昕等[6]的研究结果显示,肺癌患者SOD活性显著降低(P<0.05),丙二醛(malondialdehyde,MDA)则显著升高(P<0.05)。氧化应激在前列腺增生和前列腺癌中的作用受到了越来越多的关注,氧化应激紊乱可能通过多种途径参与前列腺增生和前列腺癌的发生和进展[7-8]。因此,本研究拟通过评估氧化应激标志物[谷胱甘肽过氧化物酶(glutathione peroxidase,GPX)、SOD、总抗氧化状态(total antioxidant status,TAS)、MDA、谷胱甘肽还原酶(glutathione reductase,GR)]与前列腺增生和前列腺癌的相关性,为前列腺增生和前列腺癌患者提供可能的治疗靶点和临床干预方案。
1 材料和方法
1.1 研究对象
选取2020年1月—2022年1月上海市杨浦区控江医院前列腺增生患者222例(前列腺增生组),年龄50~85岁。纳入标准:(1)经前列腺手术或穿刺活检术后病理检查证实为前列腺增生;(2)年龄≥18岁。选取同期上海市杨浦区控江医院前列腺癌患者136例(前列腺癌组),年龄51~86岁。纳入标准:(1)经前列腺手术或穿刺活检术后病理检查证实为前列腺癌;(2)年龄≥18岁;(3)首诊患者。前列腺增生组和前列腺癌组的排除标准:(1)非增生性前列腺肥大患者;(2)正在接受放化疗的患者;(3)前列腺炎症患者;(4)前列腺癌出现转移的患者;(5)全身系统性疾病或严重感染患者;(6)临床资料和病理资料不完整者;(7)器官衰竭患者;(8)合并其他恶性肿瘤患者;(9)服用抗氧化制剂者。采用Gleason评分系统对前列腺癌组织进行分级,癌组织分化程度分值为1~5分,按其主要和次要分化程度分别评分[9]。根据Gleason评分将前列腺癌患者分为6~7分组、8分组、9~10分组。另选取同期上海市杨浦区控江医院男性健康体检者194名作为正常对照组,年龄49~83岁。纳入标准:(1)经影像学检查未发现前列腺异常;(2)无前列腺增生或前列腺癌的临床症状;(3)年龄≥18岁;(4)签署知情同意书。排除标准:(1)恶性肿瘤患者;(2)服用可能影响氧化应激标志物检测结果的药物;(3)患心、肝、肾等重要脏器疾病;(4)临床资料和病理资料不完整。本研究经上海市杨浦区控江医院伦理委员会批准,研究对象均签署知情同意书。
1.2 方法
对所有对象进行详细的体格检查和临床检查,收集相关临床资料,包括年龄、身高、体质量、糖尿病史、高血压史、吸烟史和饮酒史等。计算体质量指数。
采用促凝管采集所有患者手术或穿刺病理活检前、健康体检者体检当日的清晨空腹静脉血4 mL,2 014×g离心10 min,分离血清,分装0.5 mL,-80 ℃冻存,统一检测MDA。剩余血清在分离后的3 h内分别采用谷胱甘肽底物法、酶法、比色法和邻苯三酚底物法检测GR、GPX、SOD、TAS。GR和GPX试剂购自临沂中拓生物有限公司,SOD和TAS试剂购自北京九强公司,检测仪器为cobas c 702全自动生化分析仪(瑞士罗氏公司)。采用酶联免疫吸附试验检测MDA,试剂盒购自江苏碧云天公司,检测仪器为Multiskan SkyHigh全波长酶标仪(美国ThermoFisher Scientific公司)。
1.3 统计学方法
采用SPSS 22.0软件进行统计分析。采用Kolmogorov-Smirnov检验对数据进行正态性分析。呈正态分布的计量资料以±s表示,多组间比较采用单因素方差分析,组间两两比较采用LSD-t检验。采用单因素二元Logistic回归分析评估氧化应激标志物与前列腺增生和前列腺癌的关系。将氧化应激标志物作为连续性变量进行分析。在单因素分析基础上,以是否发生前列腺增生或前列腺癌为自变量,以氧化应激标志物为因变量,校正年龄、体质量指数、吸烟史(有=1,无=0)、饮酒史(有=1,无=0)、高血压史(有=1,无=0)和糖尿病史(有=1,无=0),进行多因素二元Logistic回归分析。以P<0.05为差异有统计学意义。
2 结果
2.1 前列腺增生组、前列腺癌组和正常对照组一般资料比较
前列腺增生组、前列腺癌组、正常对照组之间年龄、体质量指数、糖尿病史、高血压史、吸烟史和饮酒史差异均无统计学意义(P>0.05)。见表1。
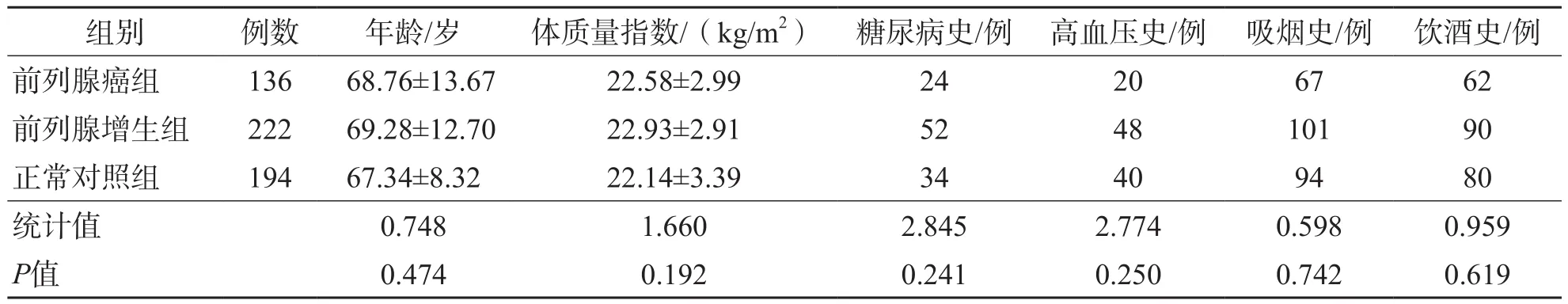
表1 前列腺增生组、前列腺癌组和正常对照组一般资料比较
2.2 正常对照组、前列腺增生组、前列腺癌组氧化应激标志物水平比较
正常对照组、前列腺增生组、前列腺癌组SOD和TAS水平依次降低(P<0.001),MDA水平依次升高(P<0.001)。GPX和GR水平3组之间差异无统计学意义(P>0.05)。见表2。

表2 前列腺癌组、前列腺增生组、正常对照组氧化应激标志物水平比较
2.3 不同Gleason评分各组氧化应激标志物水平比较
Gleason评分6~7分组、8分组、9~10分组SOD和TAS水平依次降低(P<0.001)。GPX、GR和MDA水平3组之间差异均无统计学意义(P>0.05)。见表3。
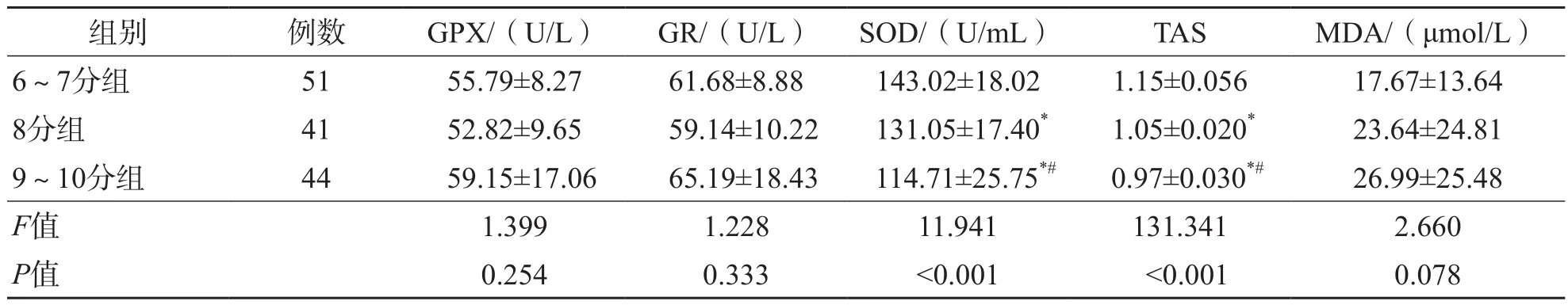
表3 不同Gleason评分各组氧化应激标志物水平比较
2.4 以正常对照组为参考时前列腺增生发生的危险因素分析
以正常对照组作为参考,单因素二元Logistic回归分析结果显示,SOD、TAS水平降低和MDA水平升高是前列腺增生发生的危险因素(P<0.05)。以是否发生前列腺增生为自变量,以SOD、TAS和MDA为因变量,多因素二元Logistic回归分析结果显示,校正年龄、体质量指数、吸烟史、饮酒史、高血压史和糖尿病史后,SOD降低、TAS降低、MDA升高均是前列腺增生发生的独立危险因素[比值比(odds ratio,OR)值分别为1.014、8.117、1.020,95%可信区间(confidence interval,CI)分别为1.005~1.024、1.956~23.693、1.007~1.052]。见表4。

表4 以正常对照组为参考时前列腺增生危险因素的Logistic回归分析
2.5 以正常对照组为参考时前列腺癌发生的危险因素分析
以正常对照组作为参考,单因素二元Logistic回归分析结果显示,SOD、TAS水平降低和MDA水平升高是前列腺癌发生的危险因素(P<0.001)。以是否发生前列腺癌为自变量,分别以SOD、TAS和MDA为因变量,多因素二元Logistic回归分析结果显示,校正年龄、体质量指数、吸烟史、饮酒史、高血压史和糖尿病后,SOD降低、TAS降低、MDA升高均是前列腺癌发生的独立危险因素(OR值分别为1.054、22.894、1.256,95%CI分别为1.034~1.075、9.196~60.560、1.025~1.664)。见表5。

表5 以正常对照组为参考时前列腺癌危险因素的Logistic回归分析
2.6 以前列腺增生组为参考时前列腺癌发生的危险因素分析
以前列腺增生组作为参考,单因素二元Logistic回归分析结果显示,SOD降低、TAS降低、MDA升高是前列腺癌发生的危险因素(P<0.001)。以是否发生前列腺癌为自变量,分别以SOD、TAS和MDA为因变量,多因素二元Logistic回归分析结果显示,校正年龄、体质量指数、吸烟史、饮酒史、高血压史和糖尿病史后,SOD降低、TAS降低、MDA升高均是前列腺癌发生的独立危险因素(OR值分别为1.040、15.577、1.012,95%CI分别为1.028~1.052、3.401~71.354、1.002~1.023)。见表6。
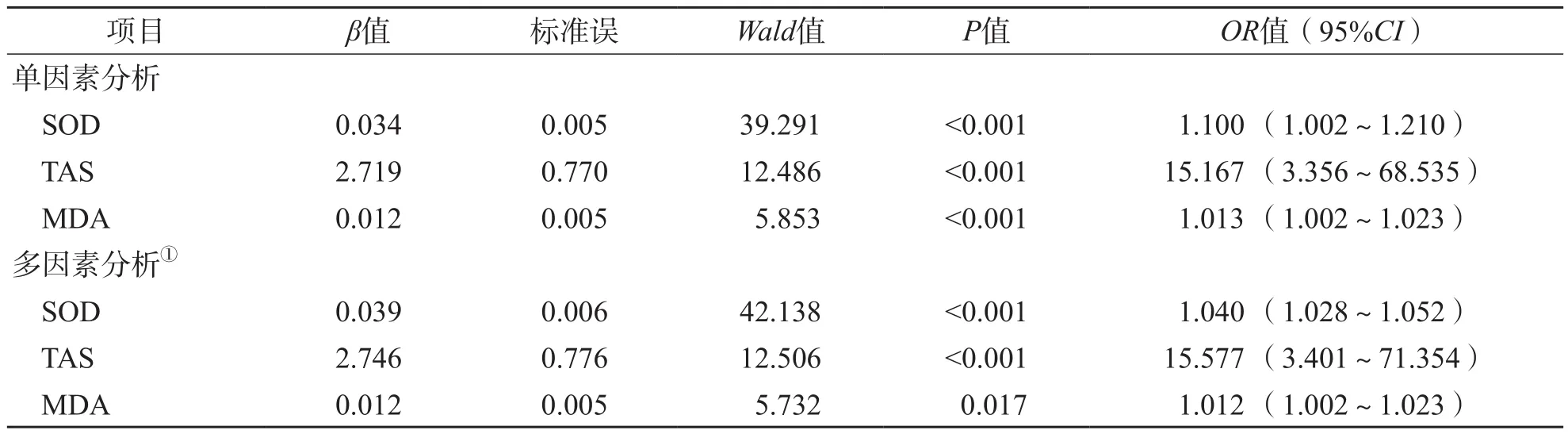
表6 以前列腺增生组为参考时前列腺癌危险因素的Logistic回归分析
3 讨论
前列腺癌和前列腺增生的发病机制目前尚不完全清楚。有研究发现,肿瘤患者处于高氧化还原状态,体内通常含有较高水平的促氧化应激物质(活性氧、氮自由基)和较低水平的抗氧化物质[10]。本研究通过病例对照研究探讨了氧化应激标志物水平变化与前列腺增生和前列腺癌的关系,分析氧化应激紊乱在前列腺增生和前列腺癌中的作用,结果显示,前列腺增生和前列腺癌患者体内抗氧化标志物(TAS、SOD)水平显著降低,且前列腺癌患者降低更明显;氧化应激损伤标志物(MDA)水平显著升高,且前列腺癌患者升高更明显;多因素二元Logistic回归分析结果显示,SOD、TAS水平降低和MDA水平升高是前列腺增生和前列腺癌发生的独立危险因素(P<0.05)。
SOD是一种抗氧化物质,可以催化超氧化物自由基转化为过氧化氢,从而消除氧自由基,发挥抗氧化能力,其活性可反映机体抗氧化能力[11]。王钟华等[12]的研究结果显示,舌鳞状细胞癌患者SOD阳性率高于对照组(P<0.05),SOD阳性患者的组织分化程度、瘤体直径、淋巴结转移、TNM分期、浸润深度均高于阴性患者(P<0.05),提示SOD可促进舌鳞状细胞癌的进展。曹修娥等[13]的研究结果显示,卵巢癌患者血清SOD水平显著低于卵巢良性疾病组和健康对照组(P<0.05);卵巢癌Ⅲ期、Ⅳ期患者血清SOD水平显著低于Ⅰ期患者(P值分别为0.001、0.002),且分期越高,SOD水平越低。本研究结果显示,正常对照者、前列腺增生患者、前列腺癌患者SOD水平依次降低(P<0.05),且SOD水平随Gleason评分的升高而逐渐降低(P<0.001)。因此,SOD水平的在一定程度上反映了前列腺增生到前列腺癌的进展情况。
目前,关于TAS、MDA与肿瘤相关性的研究较少。TAS可反映机体总的抗氧化能力,有助于抵御感染等引起的氧化应激反应和炎症反应。MDA是膜脂过氧化指标,其水平可反映机体氧自由基水平和氧化应激损伤程度。本研究未发现前列腺癌患者GPX、GR水平与前列腺增生患者、正常对照者有差异(P>0.05),且不同Gleason评分的前列腺癌患者之间GPX和GR水平差异亦无统计学意义(P>0.05),提示GPX和GR可能与前列腺癌的发生、发展无关。人体内氧化应激系统的稳态主要依靠非酶促和酶促抗氧化系统来维持。GPX和GR是重要的抗氧化酶,同属于酶促抗氧化系统。MDA是氧化应激损伤标志物,属于氧化应激系统的产物,与GPX和GR相比属于不同的分类。TAS可反映非酶促和酶促抗氧化系统整体的抗氧化能力,其中包括了GPX和GR。因此,可能会出现前列腺癌患者外周血GPX和GR水平无显著变化,而TAS和MDA水平出现显著变化的情况。SOD、GPX和GR均为抗氧化酶,前列腺癌患者GPX和GR无显著变化,但SOD显著降低的原因可能为:(1)SOD相关通路是前列腺癌氧化应激的靶点,而GPX和GR相关通路未参与前列腺癌的发生、发展;(2)SOD可能在前列腺癌的发生、发展中发挥主要作用,而GPX和GR可能发挥次要作用,所以会出现先大量消耗SOD的情况,但具体原因仍有待进一步阐明。
氧化应激紊乱可能通过多种途径促进前列腺癌的发生、发展。氧化应激紊乱导致肿瘤细胞内较高的活性氧水平,有利于进行增殖、自我更新和转移,通过上皮-间质转化促进肿瘤的发生发展[14]。抗氧化能力降低可增强肿瘤细胞的耐药性,同时减弱药物诱导的DNA损伤,从而提高肿瘤细胞的存活率[15]。番茄红素是一种重要的具有抗氧化特性的类胡萝卜素[16],有研究结果显示,对前列腺癌患者行睾丸切除术+口服番茄红素疗法,通过发挥番茄红素的抗氧化能力,可有效缩小前列腺肿瘤的体积,提高患者生存率[17]。核因子E2相关因子2(nuclear factor erythroid 2-related factor 2,Nrf-2)是调节抗氧化反应元件的重要转录因子,激活Nrf-2不仅能调节氧化应激水平,而且还可以通过诱导p120-核因子E2相关因子1的核积累来降低雄激素受体的反式激活,同时抑制双氢睾酮诱导的雄激素受体活性,从而改善前列腺癌患者的预后[18]。
综上所述,前列腺增生和前列腺癌患者SOD、TAS和MDA水平发生显著变化,提示患者体内氧化应激紊乱。SOD、TAS降低和MDA升高是前列腺增生和前列腺癌发生的危险因素。氧化应激紊乱在前列腺增生和前列腺癌的发生、发展中有重要作用。
