凝胶电泳与蛋白质印迹技术实验方法的改进和探索
2022-02-09廖志银霍朝霞翁登坡赵鲁杭于晓虹
廖志银,霍朝霞,翁登坡,赵鲁杭,于晓虹
(浙江大学 医学院 基础医学实验教学中心,浙江 杭州 310058)
凝胶电泳与蛋白质印迹技术是生命科学及基础医学实验室中常见的实验技术。鉴于凝胶电泳与蛋白质印迹技术的重要性和实用性,2012年起,浙江大学基础医学实验教学中心已在“生物化学与分子生物学”“分子医学实验”等课程中增加了这一实验。以往的实验中使用的凝胶配方因为凝胶各成分配比和交联剂的比例没有达到最优,导致学生在制胶过程中频频出现问题,部分学生的胶聚合时间较长,需45~60 min;部分学生制的胶不能聚合,需要反复重新配制,浪费了大量时间,导致每组学生的实验进度不一致;因为实验课时间有限,部分学生只能做前半部分实验,后半部分实验无法继续进行。此外,每批学生的实验结果都不稳定,重复性差。为了使学生能顺利体验整个实验项目,使实验结果具有更好的重复性,本研究对交联剂的浓度、交联剂与丙烯酰胺的比例、催化剂的浓度、胶聚合时间以及制备时的温度等影响制胶的因素进行了改进,使学生的实验结果趋于稳定,大大提高了实验效率。同时,本研究通过不断调整和改进蛋白质印迹技术实验中所用试剂的浓度和比例,使学生获取实验结果更加容易,也使学生较好地理解和掌握了该实验技术,激发了学生的学习兴趣,培养了学生的科学思维和探究能力[1]。
1 实验原理
聚丙烯酰胺凝胶电泳(Polyacrylamide Gel Electrophoresis,PAGE)是以聚丙烯酰胺凝胶为支持物的电泳方法,基本原理:丙烯酰胺(Acrylamide,Acr)与交联剂亚甲基双丙烯酰胺(N,N’-Methylene Bis Acrylamide,MBA)在催化剂的作用下,经过聚合交联形成含有亲水性酰胺基侧链的脂肪族长链,相邻的两个链通过亚甲基桥交联形成三维网状结构凝胶[2]。聚合的孔径大小主要由凝胶的质量分数决定[3],例如7.5%的凝胶孔径平均为5 nm,30.0%的凝胶孔径为2 nm左右。但交联剂对电泳泳动率也有影响,交联剂质量占总质量的比例越大,电泳泳动率越小[4-6]。
蛋白质印迹技术是分子生物学、生物化学、免疫学和遗传学等学科研究领域中常用的实验方法[7-9],基本原理:用特异性抗体对凝胶电泳处理过的细胞或生物组织样品进行着色,通过分析着色位置和着色深度获得特定蛋白质在所分析的细胞或组织中表达情况的信息[10]。经过十二烷基硫酸钠-聚丙烯酰胺凝胶电泳(Sodium Dodecyl Sulfate-Polyacrylamide Gel Electrophoresis,SDS-PAGE)分离的蛋白质样品转移到固相载体聚偏二氟乙烯(Polyvinylidene Difluoride,PVDF)膜上,以固相载体上的蛋白质或多肽作为抗原,与对应的未标记的一抗发生免疫反应,再与酶或同位素标记的二抗反应,经过底物显色、化学发光或放射自显影,检测电泳分离的某种特定蛋白成分的存在和含量。
2 实验步骤
2.1 总蛋白的提取
从20.0~30.0 g小鼠中取肝组织0.5 g,在滤纸上剪碎,放入玻璃匀浆管中,按1∶15的比例加入匀浆缓冲液,取2.00 mL离心管,各加入1.20 mL匀浆液,于4 ℃下13 000转离心20 min后,取上清液于﹣20 ℃条件下保存,用于SDS-PAGE分离检测。
2.2 凝胶的制备
2.2.1 分离胶的制备
改进前后SDS-PAGE分离胶各成分用量如表1所示。
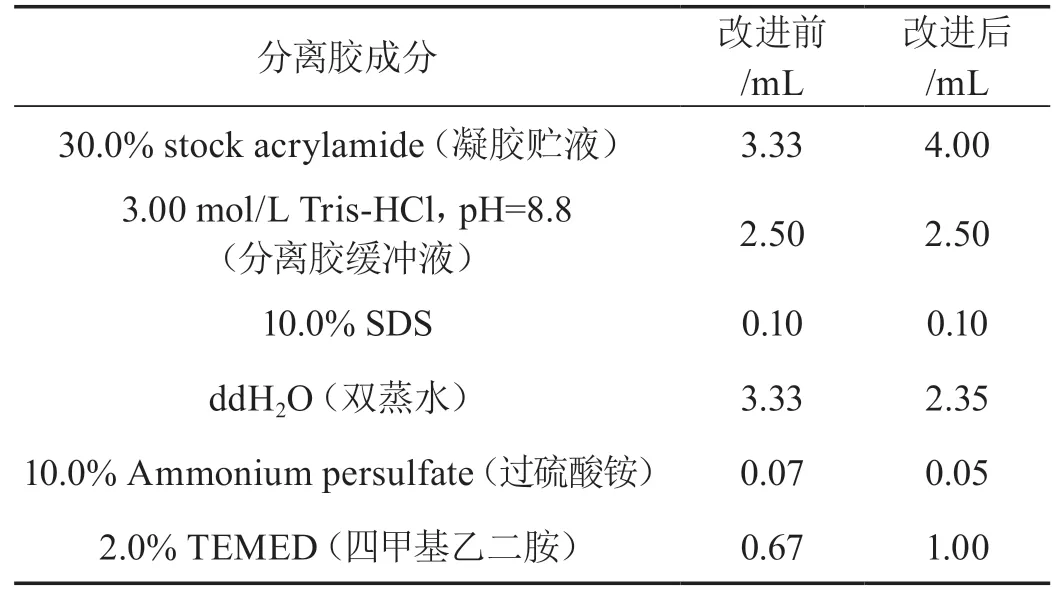
表1 改进前后SDS-PAGE分离胶配制用量(10.00 mL)
2.2.2 浓缩胶的制备
改进前后SDS-PAGE浓缩胶各成分用量如表2所示。
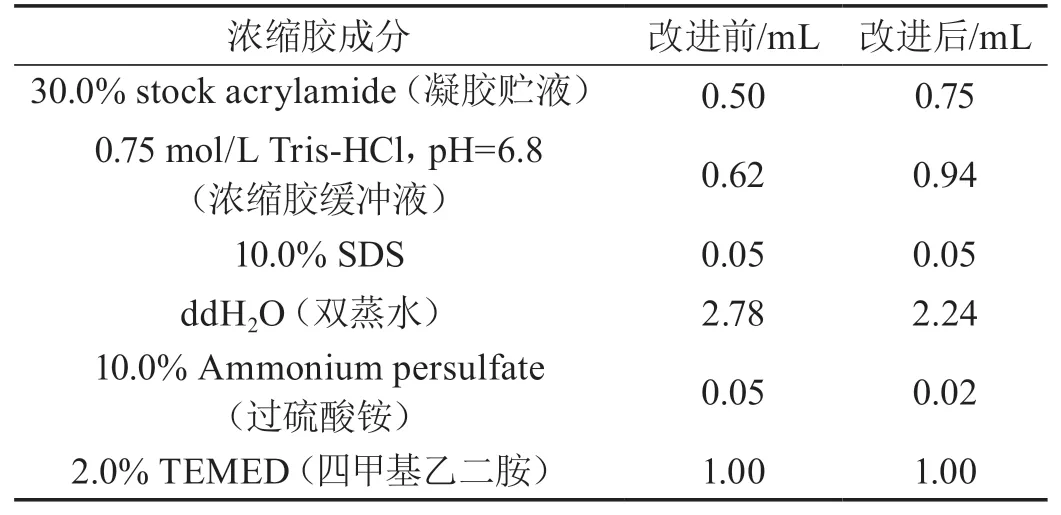
表2 改进前后SDS-PAGE浓缩胶配制用量(5.00 mL)
2.3 待测液配制
将上一实验中取得的蛋白质样品液与5X蛋白质样品溶解液按4∶1混合均匀,制作成待测液,另外取出混合后的待测液一份,再用5X蛋白质样品溶解液稀释一倍,制成浓度减半的待测液一份。
2.4 电泳与转膜
在沸水浴中加热标准蛋白质样品、Marker、待测样品液3~5 min;待制胶完成后,用加样枪头或微量注射器,在样品槽内各加入标准蛋白质样品10 μL和待测样品液10~15 μL、Marker 5~10 μL,稳压90 V电泳至含溴酚蓝指示剂的样品液泳动到浓缩胶与分离胶结合处,调整电压至110 V,电泳至指示剂泳动到分离胶下端边缘1.0~1.5 cm时再停止泳动,时间控制在50~60 min。每个电泳槽内双面安放两块长短玻璃板,其中一面玻璃板中的凝胶在结束本次凝胶电泳后,用考马斯亮蓝R-250染色液染色30 min,之后将凝胶放入150 mm培养皿内,在脱色摇床上摇1~2 h进行脱色;另一面长短玻璃板中的凝胶立即进行转膜。将电泳好的凝胶放在去离子水中漂洗,按(负极)3层滤纸、凝胶、膜、3层滤纸(正极)的顺序进行,90 V恒压1 h。取下膜后用TBST(用NaCl、KCl、Tris base和吐温、纯净水及浓盐酸配制的溶液)淋洗,待PVDF膜晾干后保存备用。
2.5 封闭、一抗反应
取上述保存好的PVDF膜,甲醇激活,用TBST淋洗后,放入封闭液中,室温摇床轻摇1 h;取出PVDF膜,用TBST淋洗3遍,加入一抗[甘油醛-3-磷酸脱氢酶(Glyceraldehyde-3-Phosphate Dehydrogenase,GAPDH),1∶2 000],改进前一抗使用浓度比为1∶5 000。取出PVDF膜后,用TBST漂洗3次,每次10 min。
2.6 二抗反应
将PVDF膜放入用辣根过氧化物酶(Horseradish Peroxidase,HRP)标记的二抗体溶液中,室温摇动1 h,仍用TBST洗涤3次,每次10 min。改进前二抗浓度比为1∶3 000,改进后按1∶2 000进行稀释。
2.7 观察、记录
打开化学发光图像分析仪,预冷20 min以上,使其电荷耦合元件(Charge Coupled Device,CCD)温度在﹣30 ℃以下,用发光条进行测试,图像清晰完整方可用于拍摄。
将增强型化学发光液(Enhanced Chemiluminescence,ECL)A、B按1∶1等量混合。将PVDF膜从器皿中取出,放到化学发光图像分析仪上,在膜上加ECL,使其完全覆盖膜表面,反应1~3 min后进行测定,读取数据并保存。
3 结果与讨论
3.1 制胶与考马斯亮蓝染色结果分析
用改进前的凝胶配制方案,80.0%以上的学生配制的SDS-PAGE容易出现各种问题,如凝胶内部极易产生气泡(见图1),凹槽“梳条”高低不平、不直、易弯曲,凹槽大小不均匀,凝胶聚合时间较长;部分学生的凝胶不能良好地聚合,导致后续实验无法进行。

图1 改进前的制胶结果
凝胶配制质量直接影响后续实验。使用改进前的凝胶电泳,用考马斯亮蓝R-250染色后,分离条带较粗,容易呈弯曲状,拖尾,清晰度与分辨率均较差。
改进凝胶配方后,将加样梳从浓缩胶中拔出后,凹槽“梳条”具有良好的韧性,不易弯曲,不易断裂,凹槽形状完整(见图2);凝胶聚合时间缩短,同时受温度影响较小,制备成功率高。分离胶与浓缩胶制备均可控制在20~30 min完成。改进后,几乎所有学生制胶都能成功,学生都能进行后续相关实验。

图2 改进后的制胶结果
用预染Marker观察电泳的进程和Marker条带的分离情况[11],牛血清白蛋白(Bovine Albumin,BSA)67 kD纯品作为标准蛋白质,和提取的总蛋白质样品同时用改进后的凝胶进行电泳。考马斯亮蓝R-250染色30 min,经2~3次脱色后,分离条带清晰度与分辨率均极高,稀释一倍后,虽然颜色变淡,分离条带仍具有很好的清晰度与分辨率,同时条带拖尾和弯曲现象明显减少(见图3)。改进后,学生可清晰地观察到蛋白质样品条带,根据Marker推算出标准蛋白质(BSA)的相对分子质量。改进前,由于多数学生配制的凝胶质量差,只有少数学生可以清晰地观察到实验结果。完成第一步的SDS-PAGE,意味着蛋白质印迹技术能顺利应用,是该实验项目的关键步骤。

图3 改进后的考马斯亮蓝染色结果
3.2 CCD成像检测结果分析
凝胶配制质量会直接影响后续实验,改进前,学生的实验结果大多不理想,由于跑胶后有些电泳条带变成斜线或曲线,印记杂交显影后有的条带弯曲,有些条带不清晰或不完整(见图4A、B)。
此外,抗体浓度对显影也有很大影响。根据实验不断调整和改进抗体的浓度,选择最合适的浓度很有必要。在实验中不断调整和改进抗体浓度,一抗(GAPDH)浓度比由原来的1∶5 000调整为1∶2 000;二抗浓度比由1∶3 000调整为1∶2 000。调整前,CCD成像直观性不理想,背景条带多而杂,发光条带有的亮度过曝,有的显示不足(见图4C、D)。调整后,CCD成像合成结果Marker条带与发光条带相当清晰,背景干净,没有亮度过曝情况(见图5)。

图4 改进前的Western blotting CCD成像结果

图5 改进后的Western blotting CCD成像合成结果
SDS-PAGE是蛋白印迹杂交技术的关键步骤[12-13],学生如果在这一步出现问题,后续实验将无法进行。该实验自开设以来,因技术步骤较多和操作复杂等,学生在操作过程中出现的问题较多,多数学生在制胶环节就失败,导致实验不能继续进行,或者每批学生的结果都不稳定、重复性差,每次实验结果都不理想。为使学生熟练且稳定地掌握该技术,本研究经过长期的摸索和实践,反复改变实验条件,最后通过改进凝胶各成分配比方案,有效增强了凝胶配制的时效性,大大提高了凝胶电泳后续实验的稳定性和成功率[14-15]。通过优化蛋白质印迹过程中关键试剂的使用浓度、控制ECL加样时间,确保目标蛋白质条带清晰、结果理想。改进后的实验反应时间控制合理,制胶成功率高,印记杂交显影后非特异性条带少,可操作性强,学生满意度较高。
改进后,学生能熟练操作、完整体验实验过程,经过蛋白质提取、凝胶电泳、蛋白质印迹技术分段式练习,学生的动手操作能力、实验结果分析能力和综合思考能力都得到了有效锻炼和提高。
4 结语
项目从蛋白质的提取到SDS-PAGE分离检测,再到蛋白印迹技术,3个部分具有良好的系统性和连贯性,对培养学生的创新思维和创新意识、提高学生的综合实践能力和创新能力具有很好的引导作用。因此,不断改进实验方法、提高实验的成功率极其重要。该实验使学生,特别是本科生得到了较强的实践锻炼和较好的操作体验,得到了系统性的培养,提高了学生对分子医学和分子生物学实验技术的兴趣。掌握该实验的研究方法不仅能更好地为今后所涉及的前沿科学研究项目(如蛋白质组学等研究)服务,也能促进思考与判断,拓宽学生的科研和创新思路,凸显教学成效。
