基于分子印迹聚合物的多菌灵电化学传感器研究
2022-02-09吴宇森李莹莹廉文静
程 鑫,王 鑫,吴宇森,张 雨,李莹莹,廉文静
(天津农学院 基础科学学院,天津 300384)
多菌灵作为一种广谱性杀菌农药,被普遍用作谷类作物和蔬菜水果等植物的杀菌剂。然而,多菌灵在食品中的残留威胁人类健康,导致人体肝肾功能受损、出现恶心呕吐等不良反应[1]。因此,国内外研究者探索构建了多种多菌灵分析检测方法。目前,测定多菌灵残留的方法主要有气相色谱-质谱联用法、紫外-可见分光光度法、高效液相色谱法、酶联免疫吸附测定法等[2]。然而,这些常规方法存在仪器检测过程烦琐、样品前处理过程复杂、对设备和人员的要求较高等缺点[3]。因此,亟待找到快速、灵敏、简单的方法来检测多菌灵农药残留量。
本研究将具有特异识别性、预定性的分子印迹技术与电化学方法相结合,建立多菌灵分子印迹电化学传感器,选择简单、可控的电化学聚合方法,在玻碳电极(Glassy Carbon Electrode,GCE)表面合成多菌灵分子印迹聚合物(Molecular Imprinted Polymer,MIP),以铁氰化钾为探针,利用循环伏安法对影响多菌灵测定的各个实验条件进行优化,得到最佳实验参数。在优化后的实验条件下,通过测定多菌灵标准溶液绘制标准曲线,得到分析性能参数,并将构建的多菌灵电化学传感器应用于实际样品中多菌灵的测定,为多菌灵的检测和分析提供了快捷、灵敏、准确的方法。
1 实验
1.1 仪器与试剂
仪器:电化学工作站(CHI 660E型);电子天平(BSA223S型);三电极系统(以GCE电极为工作电极,分别以铂丝电极和饱和甘汞电极为对电极和参比电极);超声波清洗仪(KH5200B型)。
试剂:多菌灵、吡咯、铁氰化钾、磷酸二氢钠、磷酸氢二钠、氯化钠、氯化钾、氢氧化钠等,均为分析纯。实验用水为二次蒸馏水。
1.2 GCE电极预处理
分别用粒径为1.0 μm、0.3 μm、50 nm的氧化铝粉抛光GCE电极,用蒸馏水冲洗电极后,分别在乙醇、蒸馏水中超声洗涤20 s,最后用蒸馏水冲洗后晾干。
1.3 电聚合多菌灵MIP
以预处理后的GCE电极为工作电极构建三电极系统,置于含有15 mmol/L吡咯和5 mmol/L多菌灵、pH为6.8的0.1 mol/L磷酸缓冲液中进行循环伏安扫描,扫描电位为0~1.4 V,扫速为0.05 V/s,电聚合5圈,室温晾干后得到多菌灵MIP/GCE电极。
1.4 洗脱与重结合
1.4.1 洗脱
将电聚合后的多菌灵MIP/GCE电极置于10 mmol/L NaOH溶液中,磁力搅拌15 min洗脱多菌灵,用蒸馏水冲洗后室温晾干,得到洗脱后的MIP/GCE电极。该电极对多菌灵具有特异识别作用。
1.4.2 重结合
将洗脱后的MIP/GCE电极浸入不同浓度的多菌灵溶液中15 min,室温干燥得到重结合后的MIP/GCE电极。
1.5 测试与表征
传感器构建条件优化及性能研究均采用循环伏安法,以5 mmol/L K3Fe(CN)6溶液(含0.1 mol/L KCl)为探针,扫描电位为﹣0.2~0.6 V,扫描速度为0.10 V/s。
2 结果与讨论
2.1 吡咯与多菌灵比例优化
参照以吡咯为功能单体电聚合制备MIP的文献报道常用参数[4],以GCE电极为工作电极构建三电极系统,分别置于含有5 mmol/L多菌灵和5、10、15、20 mmol/L吡咯以及pH为6.8的0.1 mol/L磷酸缓冲液中进行循环伏安扫描,在0~1.4 V以0.05 V/s扫描,电聚合5圈后,在GCE电极表面得到多菌灵MIP膜,即MIP/GCE电极,用10 mmol/L NaOH溶液洗脱MIP/GCE电极15 min后,以洗脱后的MIP/GCE电极为工作电极构建三电极体系,在5 mmol/L铁氰化钾探针溶液中进行循环伏安测定,记录铁氰化钾的氧化峰电流值。如图1所示,吡咯与多菌灵浓度比值为3,即多菌灵浓度为5 mmol/L、吡咯浓度为15 mmol/L时,得到的吡咯特异性识别位点最多。
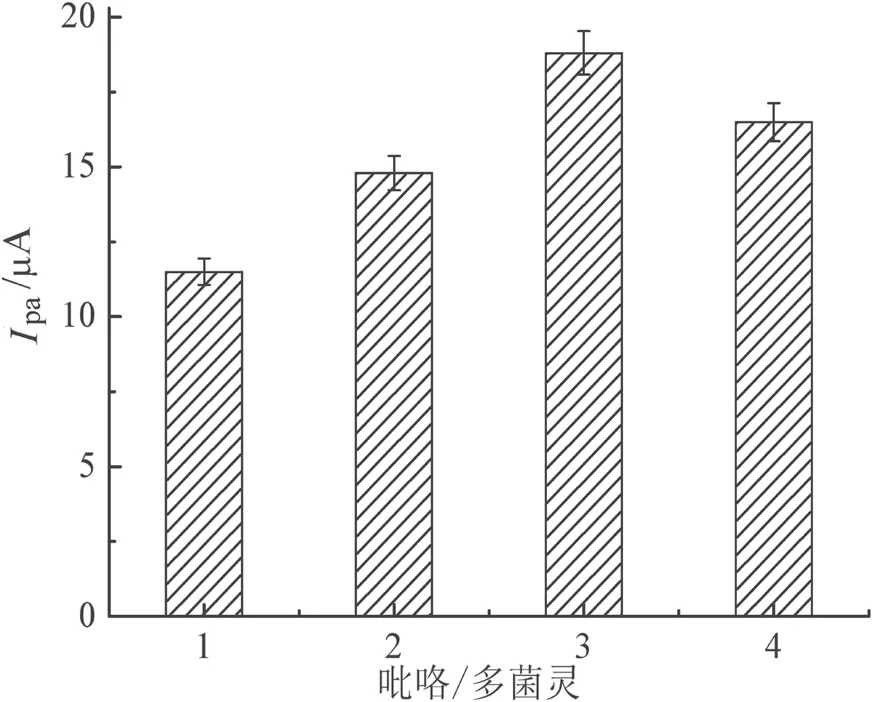
图1 吡咯与多菌灵比例优化
2.2 电聚合圈数优化
以含有5 mmol/L多菌灵和15 mmol/L吡咯、pH为5.2的0.1 mol/L磷酸缓冲液为电聚合溶液,电聚合方法和参数同2.1,分别在GCE电极表面电聚合3、4、5、6圈,得到多菌灵MIP膜,并研究铁氰化钾探针溶液在洗脱后的MIP/GCE电极表面的电化学响应。如图2所示,当电聚合圈数为5圈时,铁氰化钾的氧化峰电流最大,多菌灵的特异性识别位点数量最多。

图2 电聚合圈数优化
2.3 洗脱及重结合时间优化
以常用的NaOH溶液作为洗脱剂,将电聚合后的多菌灵MIP/GCE电极置于10 mmol/L NaOH溶液中,分别磁力搅拌洗脱5~20 min,用蒸馏水冲洗后室温晾干,得到洗脱不同时间后的MIP/GCE电极。测定铁氰化钾探针溶液在洗脱不同时间后的MIP/GCE电极表面的电化学响应,结果如图3A所示,15 min为最佳洗脱时间。
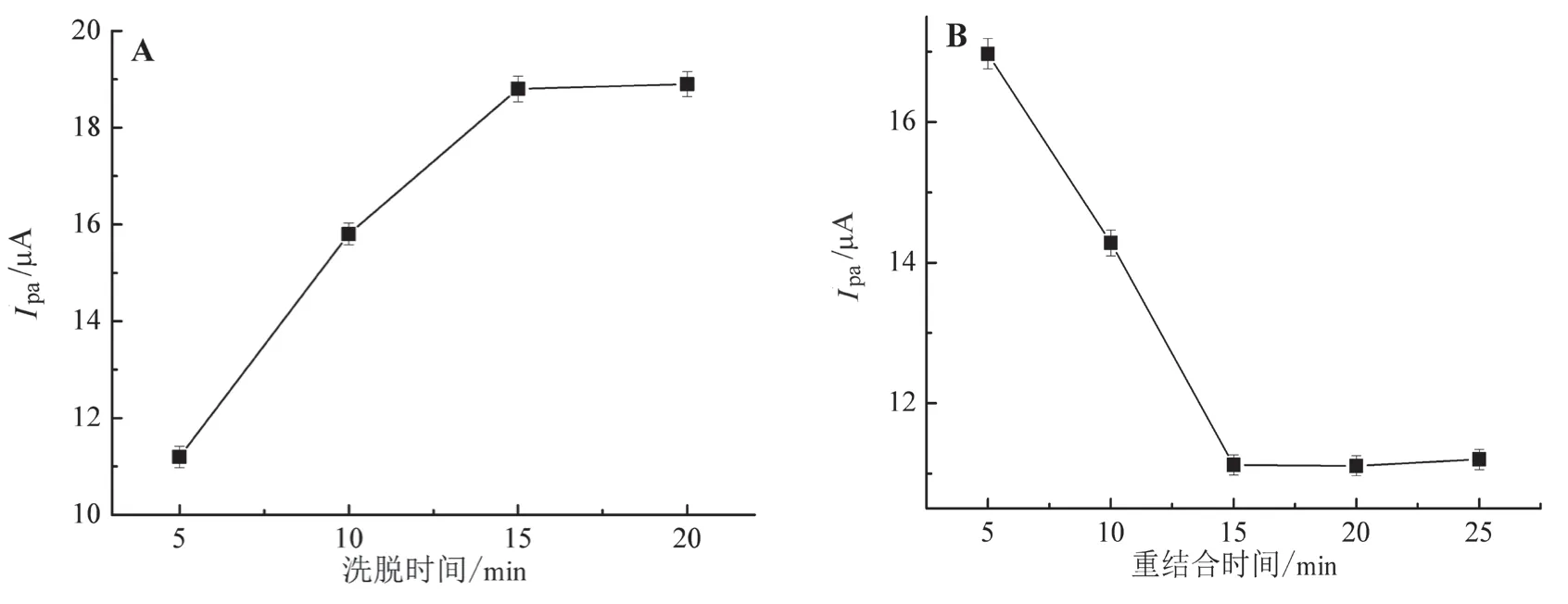
图3 洗脱(A)和重结合(B)时间优化
将洗脱后的多菌灵MIP/GCE电极置于4×10-5mol/L多菌灵溶液中,分别孵化5~25 min。在探针溶液中测得如图3B所示的循环伏安曲线。由测定结果可知:当重结合时间为5~15 min时,随着时间的延长,氧化峰电流逐渐降低,这是因为电极表面的部分分子印迹膜特异性识别结合位点被多菌灵重新占据,阻碍了探针的电子传递;当重结合时间为20~25 min时,氧化峰电流与重结合15 min基本相同。因此,15 min为最佳重结合时间。
2.4 传感器构建过程表征
利用循环伏安法测定铁氰化钾探针在传感器构建过程中不同电极上的电化学响应,以研究传感器对多菌灵的识别作用。如图4所示,多菌灵MIP/GCE电极(曲线b)的氧化峰电流值明显小于GCE电极(曲线a),这是因为电聚合后的电极表面被致密的MIP膜占据,影响了铁氰化钾在电极表面的氧化还原反应。重结合4×10-5mol/L多菌灵后电极(曲线d)的氧化峰电流值小于洗脱后的MIP/GCE电极(曲线c),因为洗脱后电极呈现多孔结构,有利于铁氰化钾探针分子穿过、到达电极表面发生氧化还原反应。重结合时,电极表面的立体空穴又会再次被多菌灵分子占据。基于以上分析,本研究所构建的分子印迹电化学传感器对多菌灵具有识别作用。
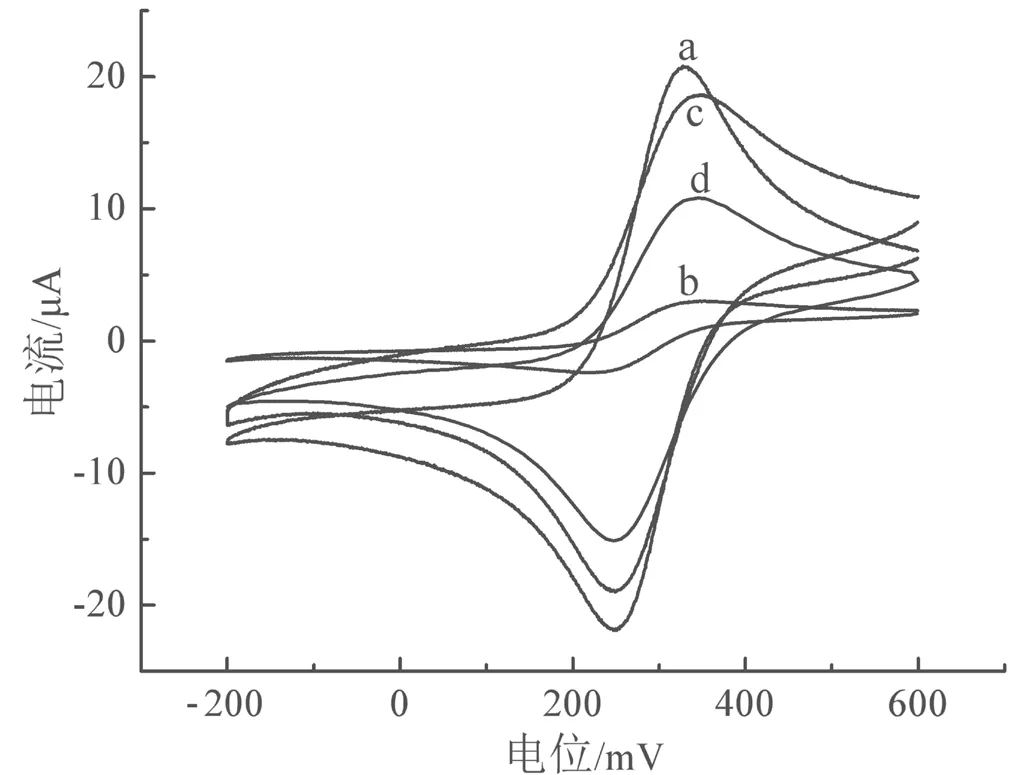
图4 铁氰化钾探针在GCE电极(a)、MIP/GCE电极(b)、洗脱后的MIP/GCE电极(c)、重结合多菌灵后电极(d)上的循环伏安曲线
2.5 标准曲线的绘制
用建好的传感器测定1×10-3~1×10-9mol/L多菌灵溶液,先测定洗脱后多菌灵MIP/GCE电极在铁氰化钾探针溶液中的循环伏安氧化峰电流值I0,再将洗脱后的电极在不同浓度多菌灵溶液中孵化15 min,测得氧化峰电流值Ipa。记录多菌灵标准溶液浓度c与ΔIpa(I0-Ipa)的关系,绘制如图5所示的标准曲线,得到传感器的线性方程:ΔIpa(μA)=1.621 7(μA)+0.154 9c(μmol/L),线性范围为3×10-8~7×10-5mol/L,最低检出限为2.13×10-8mol/L(S/N=3)。

图5 传感器的标准曲线
3 结语
将分子印迹技术与电化学检测方法结合,构建多菌灵分子印迹电化学传感器,采用电化学聚合法,以多菌灵为模板分子、吡咯为功能单体,在电极表面合成多菌灵MIP。通过对传感器构建过程实验条件的优化,在最佳实验条件下,将构建的多菌灵分子印迹传感器应用于不同浓度多菌灵溶液的测定。该多菌灵分子印迹电化学传感器具有稳定性强、特异识别性强及测定高效等优点,具有较大的实际应用潜力。
