猪瘟疫苗面临的机遇与挑战
2022-02-08李少丽尹忠良胡晓凤王家福
李少丽 , 尹忠良 , 胡晓凤 , 康 斌 , 王家福
(杭州佑本动物疫苗有限公司 , 浙江 杭州 310018)
猪瘟(Classical swine fever,CSF)是由黄病毒科瘟病毒属的猪瘟病毒(Classical swine fever virus,CSFV)引起的猪的一种急性、热性、高度接触性传染病,为我国一类动物疫病之一。尽管世界动物卫生组织(World Organization for Animal Health,OIE)宣布目前已有38个无猪瘟的国家或地区,但猪瘟仍然在亚洲、南美、东欧及非洲部分地区流行[1]。尤其近2年,猪瘟在巴西、日本和韩国等曾宣布无猪瘟的国家重新出现,引发人们对猪瘟再度暴发的警惕[2-4]。
CSFV为有囊膜的单股正链RNA病毒,基因组长约12.3 kb,含1个大的开放阅读框,编码1个独立的由3 898个氨基酸组成的多聚蛋白,这个多聚蛋白被宿主蛋白酶裂解为4个结构蛋白(C、E0、E1、E2)和8个非结构蛋白。囊膜糖蛋白E0和E2介导病毒感染细胞,是重要的免疫保护性抗原,其中的E2蛋白由约373个氨基酸构成,是CSFV的主要中和性抗原蛋白,在靠近E2基因氨基端上游有一段用于调控蛋白表达的信号肽序列,羧基端疏水的跨膜区常会抑制蛋白的表达,因此,常需要将E2基因的跨膜域去掉,再进行猪瘟E2蛋白的高效表达。
猪瘟病毒只有1个血清群,可分为3个基因型和11个基因亚型。基因1型(1.1、1.2、1.3和1.4)主要包含从世界各地分离的包括所有猪瘟弱毒活疫苗在内的毒株;基因2型(2.1、2.2和2.3)包含自1980年至今导致猪瘟流行率上升的大多数流行毒株;基因3型(3.1、3.2、3.3和3.4)毒株主要分布于韩国、日本、泰国和中国台湾等国家或地区[5]。虽然目前没有明确的证据表明基因型和毒力之间存在相关性,但一般来说,强毒力毒株一般为基因1型,而大多数为中等毒力毒株属基因2型。
1 猪瘟疫苗面临的机遇
1.1 猪瘟疫苗的良好典范——猪瘟“C株”活疫苗 中国不仅是世界上最大的养猪大国,同时也是世界上猪肉消耗量最多的国家。猪瘟疫苗是我国养猪业必须接种的基础疫苗。1950年,我国的方时杰、周泰冲等学者将猪瘟强毒在兔体内连续传480多代培育成猪瘟兔化弱毒“C株”,它集高度安全性与不可比拟的免疫原性于一体,可同时激发机体的细胞免疫和体液免疫,并可使免疫猪抵抗不同基因型猪瘟强毒的攻击,对我国甚至全球的猪瘟防控做出了巨大贡献,是优良猪瘟疫苗的典范[6-7]。我国猪场使用的兔源的猪瘟脾淋苗、乳兔苗以及细胞源的犊牛睾丸细胞苗和ST传代细胞苗,都是用猪瘟兔化弱毒“C株”制备抗原。作为猪瘟活疫苗黄金标准的“C株”疫苗,一直具有以下几项优秀的免疫指标:首先,“C株”疫苗可阻断CSFV的水平传播和垂直传播,疫苗免疫4 d的接种猪攻毒后不表现任何猪瘟相关临床症状,且检测不到攻击毒株,妊娠母猪免疫后7 d即能阻止病毒经母体胎盘传播给胎儿,“C株”疫苗的免疫保护期可长达1年甚至终身[8];其次,“C株”疫苗生产成本低,适宜口服接种,可用于野猪的口服免疫。
1.2 猪瘟“C株”活疫苗缺乏DIVA特性 按照农业农村部发布的《2021年国家动物疫病强制免疫计划》的要求[9],各省级畜牧兽医主管部门根据本辖区内猪瘟流行情况,继续实施猪瘟的强制免疫。目前我国猪群感染猪瘟主要表现为非典型性症状,种猪的持续性感染和仔猪的先天性感染比较普遍,均以隐性感染为主。近2年猪瘟样品阳性率均在5%以下,以2.1型为主要流行基因型[10],猪瘟“C株”活疫苗仍可对其进行有效的交叉免疫保护。然而,猪瘟“C株”黄金活疫苗却不能采用血清学方法区分疫苗免疫动物与野毒感染动物(Differentiating infected from vaccinated animals,DIVA),导致野毒感染动物潜伏在疫苗接种动物中,不能进行鉴别诊断,不能满足未来猪瘟疫苗的市场需求和国家重大动物疫病净化的需要,猪瘟疫苗面临新的机遇。
2 猪瘟疫苗面临的挑战
学者们利用猪瘟E2蛋白良好免疫原性的特点,陆续开发了基于E2蛋白的猪瘟亚单位疫苗和嵌合病毒DIVA活疫苗,如德国拜耳和默沙东的BAYOVAC®CSF E2和Porcilis®Pesti E2,中国的猪瘟E2蛋白亚单位疫苗Rb-03株和WH09株,以及韩国和欧盟的嵌合病毒活疫苗Flc-LOM-BErns和CP_E2alf[11-12]。这些商品化的猪瘟DIVA疫苗均可诱导机体产生高水平的E2抗体和中和抗体,保护猪抵抗猪瘟强毒的攻击。国外很多学者采用植物表达系统表达猪瘟E2蛋白或者构建重组疫苗进行DIVA疫苗的开发。在我国,近几年处在新兽药注册阶段的猪瘟疫苗依然是以“C株”为基础的猪瘟E2蛋白亚单位疫苗、基因工程活疫苗或联苗(表1),病毒载体疫苗研究也较多,但还未见有申请注册的报道。随着猪瘟DIVA疫苗研究和应用的增加,问题日益显现,猪瘟疫苗的应用面临新的挑战。
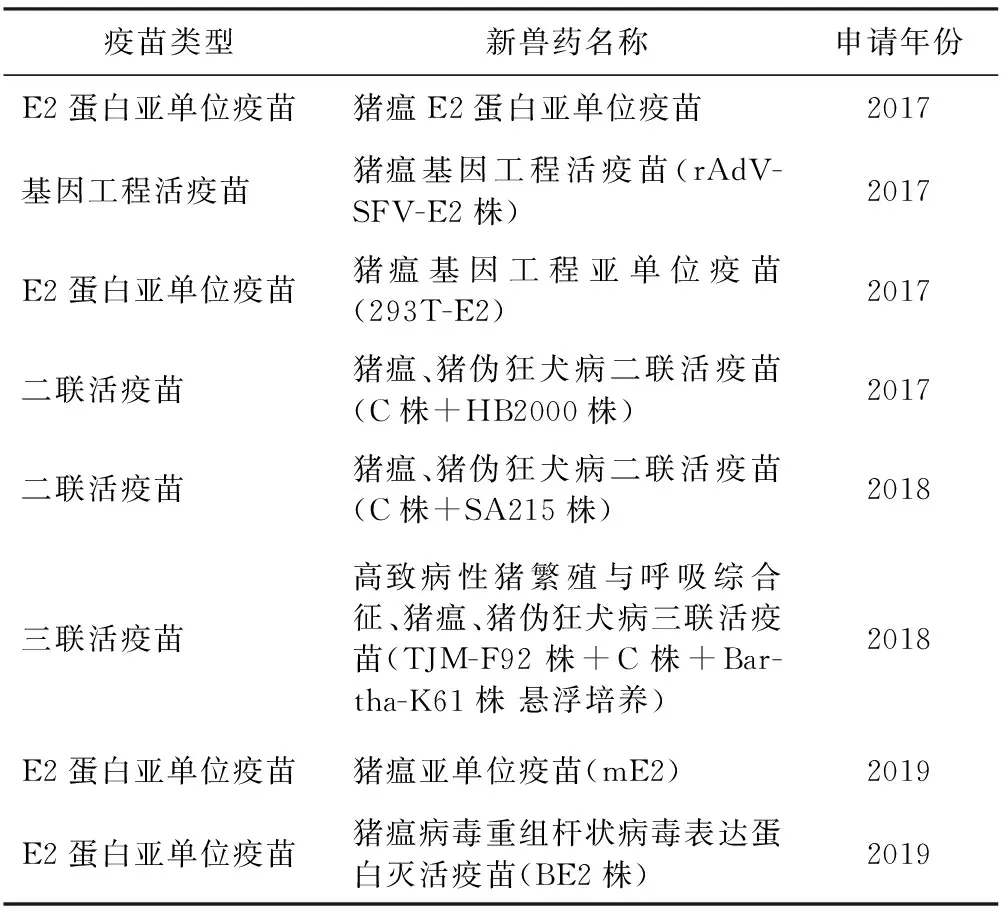
表1 近5年处于新兽药申请阶段的猪瘟疫苗汇总
2.1 猪瘟E2蛋白亚单位疫苗表达量低 理想的疫苗不仅应该是安全有效的,而且还应是终端用户能够负担得起的,成功表达大量具有强免疫原性的E2蛋白是成本效益的关键。就当前上市的猪瘟E2蛋白亚单位疫苗而言,大多采用杆状病毒表达系统进行E2蛋白的表达,该系统表达的蛋白能进行翻译后修饰并能正确折叠,但蛋白表达量低导致生产成本增加。针对这个问题,学者们尝试了多种方法解决:(1)在表达载体中加入强启动子,Feng等[13]在表达载体中加入内源性Txnip启动子转染CHO细胞进行表达,E2蛋白表达量高于使用CMV启动子;(2)在E2基因启动子之前加入最优的信号肽序列可提高E2蛋白的分泌表达,Xu等[14]选择了一种新的信号肽序列SPZJ (SP23),其诱导表达的E2蛋白量可达65 μg/mL,表达量比其他信号肽序列(SP13、SP18等)至少增加50%;(3)与分子佐剂融合表达,以促进蛋白表达并提高融合蛋白的免疫原性,鉴于CD154可作为分子佐剂增强免疫应答的特性,可将猪瘟E2基因和CD154分子构建重组表达载体,转染HEK293细胞,细胞上清中E2蛋白表达量可达50 mg/L,单次免疫攻毒后未在血液、扁桃体、脾脏、淋巴结等组织检测到CSFV,表明融合蛋白激发了机体坚强的免疫保护[15-17]。
植物生长成本低,不需要特殊的设备且易于规模化表达外源蛋白。近2年,采用植物表达系统进行猪瘟E2蛋白的表达成为研究热点。Park等[18]用植物表达系统融合表达猪瘟E2蛋白和可提高蛋白溶解度及表达水平的IgG的Fc段,融合蛋白表达量可达1.135 μg/μL,1 kg植物叶片可表达302 mg融合蛋白,并且150 μg融合蛋白乳化后间隔20 d免疫2次试验猪,直到二免后170 d猪瘟特异性中和抗体仍大于6log2。植物表达系统不但表达量高,表达蛋白也具有很好的免疫原性。Park等[19]还用烟草组织培养系统表达的猪瘟E2蛋白制备疫苗,免疫2次妊娠64 d的母猪后可阻止病毒由母体传染给仔猪。Laughlin等[20]用农杆菌表达猪瘟E2蛋白,试验猪免疫1次后用强毒攻击,猪只全部存活。因此,在保证免疫效果的前提下,为控制生产成本,植物表达系统将来也许会作为外源蛋白表达的工具而规模化应用。
2.2 猪瘟E2蛋白亚单位疫苗建立免疫保护的时间长 与屠宰政策相比,迅速采取紧急疫苗接种策略以防止病毒传播至关重要。“C株”疫苗免疫后1 d,攻毒动物即可得到一定程度的攻毒保护,免疫后3 d,大多数动物免于临床疾病和病毒血症,鼻分泌物中的病毒数量显著减少[21]。相比之下,猪瘟E2蛋白亚单位疫苗不能在体内复制且不能引起细胞免疫反应,一般于首免后21 d或二免后7~14 d即可激发机体产生有效的保护性免疫[22-24],因此,猪瘟E2蛋白亚单位疫苗不能用于紧急免疫,而更适用于感染背景明确种群的免疫。
2.3 猪瘟E2蛋白亚单位疫苗不能阻断病毒的垂直传播 猪瘟E2蛋白亚单位疫苗能阻止病毒的水平传播,也能对不同基因型的病毒产生良好的免疫保护。Chen等[25]间隔3周免疫2次猪瘟E2亚单位疫苗,第2次免疫3周后用105TCID50/mL的猪瘟强毒攻击猪只,并于攻毒4 d后引入哨兵猪同居。结果显示,CSF E2蛋白亚单位疫苗免疫组猪只在CSFV攻毒后具有较高的中和抗体滴度,无临床症状和明显的病理变化,且同居期间未发现哨兵猪感染,表明CSF E2蛋白亚单位疫苗能阻止病毒的水平传播。此外,该类疫苗是否能防止病毒经母体胎盘垂直传播给胎儿也很重要。我国的TWJ-E2蛋白亚单位疫苗能对2.1型和2.2型猪瘟的攻击产生完全的攻毒免疫保护,不出现病毒血症,血液和组织中也未检测到CSFV核酸[25]。但对其能否阻断病毒垂直传播的研究报道很少。然而,大多研究资料表明,猪瘟E2蛋白亚单位疫苗不能阻断CSFV的垂直传播[26-29],也就是说如果猪瘟E2蛋白亚单位疫苗用于免疫母猪,则有可能使仔猪先天感染,导致胎儿出生后出现体弱、死亡或震颤等临床症状,有的呈免疫耐受而无临床症状,对之后免疫的疫苗不产生免疫应答,持续向外界排毒成为传染源,甚至与猪肺疫、猪繁殖与呼吸综合征、猪链球菌病和仔猪副伤寒等疫病并发或混合感染。针对这个问题,目前主要通过尝试开发嵌合病毒活疫苗解决。
2.4 猪瘟DIVA嵌合病毒活疫苗的免疫效力问题 针对E2蛋白亚单位疫苗建立有效免疫时间长,很难阻止病毒垂直传播的问题,猪瘟DIVA嵌合病毒活疫苗应运而生。2014年,猪瘟DIVA嵌合病毒活疫苗CP7_E2alf在欧盟获批上市,它是以BVDV毒株CP7为骨架,将其E2基因用CSFV毒株Alfort/187的E2基因替代,安全性和有效性可与传统的猪瘟活疫苗相媲美[16],可阻断病毒的水平传播[30]。然而,当进行早期CSFV强毒攻击试验以评估CP7_E2alf是否可作为紧急免疫疫苗时,有些案例中CP7_E2alf并不能阻止病毒的胎盘传播[31]。但若CP7_E2alf紧急免疫时攻击CSFV中等毒力毒株,则可有效阻断母猪传染给仔猪[32],也就是说CP7_E2alf疫苗更适于感染中等毒力CSFV时的紧急免疫。不过在复杂的CSFV流行背景下,为尽量避免可能造成的仔猪先天性感染,母猪应谨慎接种CP7_E2alf疫苗。
另一个成功注册的猪瘟DIVA嵌合病毒活疫苗是2017年韩国上市的Flc-LOM-BErns,该疫苗是以CSFV LOM毒株为骨架,将其C蛋白的3′端基因及E0基因用BVDV的相应基因替代。与CP7_E2alf相比,Flc-LOM-BErns阻止病毒垂直传播的能力更强。据报道,该疫苗免疫妊娠母猪2周后,猪只鼻拭子和粪便拭子中均未检测到疫苗毒株[33]。而在猪瘟“C株”中引入标记基因制备DIVA疫苗,是否能保持“C株”的有效性和安全性还在研究中。
2.5 猪瘟DIVA疫苗配套ELISA检测方法存在的问题
2.5.1 E0抗体的交叉反应 E2蛋白亚单位疫苗中只含纯化的E2蛋白,免疫后机体仅产生针对E2蛋白的抗体,若采用ELISA方法能在血液中检测到非疫苗蛋白(如E0、NS3)的抗体,则表明猪群感染猪瘟野毒或接种了全病毒猪瘟疫苗。由于NS3蛋白在除CSFV之外的其他瘟病毒中也存在,不适合作为CSFV的特异性检测标记[34],因此,猪瘟DIVA疫苗配套的鉴别检测试剂盒均是针对E2和E0蛋白设计的。对于CP7_E2alf和Flc-LOM-BErns这2种猪瘟DIVA嵌合病毒活疫苗配套的ELISA方法,均存在E0抗体交叉免疫反应的弊端[33,35]。为解决这个问题,有研究尝试用与猪瘟同属但亲缘关系较远的病毒的同源基因代替。Postel等[36]采用挪威鼠瘟病毒和/或叉角羚瘟病毒的E0基因代替CSFV Alfortp447的E0基因构建感染性cDNA克隆,血清学检测未出现交叉反应,为猪瘟DIVA嵌合病毒活疫苗配套检测的建立提供了借鉴。
2.5.2 敏感性和特异性有待提高 当前所建立的猪瘟DIVA配套检测方法敏感性和特异性不高。Pannhorst等[37]采集CSFV感染早期(感染<21 d)的57份血清和感染后期(感染>21 d)的127份血清,采用PrioCHECK CSFV ErnsELISA试剂盒进行敏感性和特异性检测。结果显示,该方法对感染早期血清敏感性范围为82%~95%,对感染后期血清的敏感性范围为90%~98%,而对CP7_E2alf疫苗免疫攻毒后血清的检测敏感性只有78%~89%。同时,用该试剂盒对CP7_E2alf疫苗接种猪血清检测的特异性为89%~96%,多次免疫血清的特异性只有79%~85%。表明猪瘟感染阶段以及是否进行多次免疫均对该试剂盒的检测结果有很大影响,因此,该试剂盒只能测定部分群体动物,不适于全群检测。相比之下,Meyer等[35]建立的Pigtype ErnsELISA方法敏感性和特异性更高些,其对感染不同基因型CSFV血清的敏感性和特异性分别为93.5%和99.7%,对猪瘟CP7_E2alf免疫血清的敏感性和特异性分别为90.2%和93.8%。暂未发现其他关于猪瘟DIVA嵌合病毒活疫苗检测方法的详细报道。不过,从这2种试剂盒检测结果看,猪瘟DIVA检测方法的敏感性和特异性还有很大的提升空间。
3 展望
近年来猪瘟区域频发,全球范围内重新暴发猪瘟的风险提高。2014年,宣布无猪瘟的韩国Jeju岛,因意外接种猪瘟LOM疫苗暴发猪瘟,其分离株与LOM疫苗毒株核苷酸同源性高达98.7%~99.0%[38]。同样在2018年,曾宣布无猪瘟的日本Gifu,26年来首次暴发猪瘟疫情,而且在野猪不太可能传染到的猪场也暴发了猪瘟[39-40]。这些案例引起了人们对传统猪瘟活疫苗毒株毒力返强风险意识的警惕,也督促我们重新审视猪场的生物安全措施及疫病控制策略。尽管我国的猪瘟“C株”活疫苗非常安全,在猪体传30代后毒力仍不返强,而且,其对最近流行的3种基因型的CSFV均可产生较好的免疫保护,但毕竟其已普免多年,需要对其安全性重新评估,提前防范,防止像非洲猪瘟一样,对我国猪场再次造成毁灭性打击。
据中国兽药信息网统计,2020年,国内猪瘟疫苗生产企业共申请了14个批次的猪瘟E2蛋白亚单位疫苗和1 698个批次的猪瘟活疫苗。而截止2021年11月,相应疫苗分别为39个批次和1 475个批次,这反映出国内猪场使用猪瘟疫苗的动向,也进一步表明猪瘟DIVA疫苗取代猪瘟“C株”活疫苗还有很长的路要走。因此,开发集猪瘟“C株”活疫苗的安全性、有效性和DIVA特点于一体的猪瘟DIVA疫苗,符合未来猪瘟疫苗市场的必然需求和猪瘟净化的需要。在畜牧兽医相关部门大力倡导支持下,采用优秀的猪瘟DIVA疫苗及配套的血清检测方法,淘汰无抗体反应或抗体水平低的种猪,同时逐步改善养猪场的生态环境并提高生物安全水平,才能逐步建立起猪瘟阴性猪群,加快我国猪瘟净化的进程,早日实现猪瘟净化的目标。
