花生果腐病致病真菌的分离及抗性种质资源鉴定
2022-02-08朱立飞张初署唐月异韦潇王冕于强宋福荣张建成
朱立飞,张初署,唐月异,韦潇,王冕,于强,宋福荣,张建成
(1.山东省花生研究所/农业农村部花生生物学与遗传育种重点实验室,山东 青岛 266100;2.辽宁工程技术大学,辽宁 阜新 123000;3.青岛天祥食品集团有限公司,山东 青岛 266100)
花生(Arachis hypogaeaL.)是一种地上开花、地下结果的喜温豆科作物,富含蛋白和油脂,是世界范围内广泛种植的油料和经济作物。我国是花生生产和消费大国,花生总产量和出口量均占世界第一[1]。花生适宜种植在疏松的沙土地上,适应性较强,但其生长过程中土传病害种类较多。已报道的花生土壤侵染性病害有多种,包括真菌性病害、细菌性病害和线虫病害等。其中真菌病害主要有茎腐病、根腐病、果腐病等。
花生果腐病又称“烂果病”。发病时,花生荚果果皮先出现深褐色的病斑,随后病斑逐渐扩展到整个荚果,最终变黑、腐烂,不同发育阶段的荚果均可受害。此外,果柄与荚果的结合部容易染病,发病后果柄与荚果结合不牢固,收获时极易落果[2],花生籽仁也会发黑霉烂,严重影响花生的产量和品质。该病2009年在河北新乐、定州、行唐和河南濮阳及山东部分地区造成大幅减产[3]。近年来此病在我国北方产区呈连年加重之势,已成为花生生产上的主要病害,对花生产量和品质构成严重威胁。
花生果腐病的病原是复合病原(peanut pod rot complex),包括病原真菌、植物寄生线虫和土壤螨类等[4]。Frank[5]在1968年首次鉴定了花生烂果病的病原菌是群结腐霉(Pythium myriotylum),而后分离出多种病原真菌。Garcia[6]在1975年证实,花生果荚埋在含有腐霉菌、镰刀菌和根结线虫的土壤中烂果更为严重。Shew等[7]在1979年证实,超过50%的花生荚果与伯氏嗜木螨属(Caloglyphus)螨虫有关,土传螨显著增加花生果腐病的发病率。Hollowell等[8]通过田间调查分离出丝核菌(Rhizoctonia)、腐霉菌(Pythium)和花生黑腐病菌(Cylindrocladium paraasiticum)等5种真菌。Cilliers[9]发现,南非花生果腐病病原是Chalara elegans。利比亚果腐病病原为腐皮镰刀菌(Fusarium solani)及该属其它种[10]。此外,Crous等[11]发现枝双孢霉属(Cylindrocladium)是导致花生果腐病的病原菌,Lombard等[12]在2009年分离得到该病菌,并于2010年对由Cylindrocladium引起的植物各种病害进行了统计分析[13]。
花生果腐病的病原复杂致使防控困难[14]。杀菌剂是农业防控果腐病的手段之一,但是这些杀菌剂都是针对腐霉菌和丝核菌等引起的花生果腐病,而对于其他真菌,例如镰孢菌、粪壳菌等的防效未见报道。抗病育种是最经济、安全有效的花生果腐病防控手段。已有研究表明,普通型花生更易感染花生果腐病,而珍珠豆型花生品种“Toalson”对于腐霉菌(Pythium)和立枯丝核菌(Rhizoctonia solani)具有显著抗性,花生品系Georgia Browne对立枯丝核菌也有一定抗性[15],但是这种抗性花生种质资源较少。因此花生果腐病病原真菌的筛选、培养和致病性研究尤为重要。
本研究以花育917为试验材料,从发生花生果腐病的籽仁中分离和鉴定出一株真菌(PPRF-05),结合形态学观察及ITS序列分析对菌种进行鉴定,并对本课题组保存的花生资源和突变体材料进行抗病鉴定,以期为开展花生果腐病抗病机理研究和育种提供理论基础和种质材料。
1 材料与方法
1.1 试验材料
供试花生品种均为本实验室育成并保存。花生离体组织取自花育917。
1.2 供试菌株的分离
将发生花生果腐病的荚果去掉外壳,发黄发黑籽仁浸泡于50 mL PDA液体培养基中,25℃过夜培养后倒掉籽仁,用脱脂棉过滤培养基。将过滤后的培养基3 000×g离心10 min后弃液体培养基,2 mL PDA培养基重悬菌体,后用涂抹法纯化菌体至单菌落。
1.3 菌种鉴定
使用通用引物ITS5:5′-ACCCGCTGAACTTAAGC-3′,ITS4:5′-BTCCTGAGGGAAACTTCG-3′进行ITS序列扩增[16],选择单一明亮的条带送生工生物工程(上海)股份有限公司进行测序,利用BLAST进行序列比对。
1.4 花生各离体组织接菌
种子消毒:75%乙醇浸泡5 min,5%次氯酸钠浸泡10 min,无菌水冲洗5~6遍,清水浸泡8 h,后置于水培培养箱中,25℃培养至四叶期。
离体组织的获得:在超净工作台中,无菌水冲洗幼苗,灭菌剪刀剪下叶片、茎和根备用。子叶取自二叶期幼苗。将各种离体组织置于培养皿中浸湿的棉花上培养2 d备用。
接种:将花生不同组织置于超净工作台中,先用接种针轻轻划伤花生组织表面,然后将直径0.5 cm的菌饼置于伤口处,培养20 d,以不接种致病菌作为对照组。每组2个重复,每个试验重复3次。
1.5 花生果腐病感-抗模型的建立
参考王冕等[17]的方法。不同品种均取饱满、健康、无霉变的鲜种子,平分为两份,一份直接接种果腐病病原菌,另一份进行培育并在幼苗子叶上接种病原菌。每天记录鲜种子和幼苗子叶的发病率、病害严重程度以及病斑大小,对种子进行抗病分级。
鲜种子接种5 d出现病斑,发病率90%以上,接种点腐烂,病斑直径0.5 cm以上为易感病(HS)品种;接种5 d出现病斑,发病率在70%~90%,接种点发黑,病斑直径0.2~0.5 cm为感病(S)品种;接种7 d无病斑,发病率在10%~20%,接种发黄为抗病(R)品种;接种7 d无病斑,发病率在10%以下,接种点无变化,种子可以正常萌发为高抗病(HR)品种。
统计不同感抗病品种鲜种子对应的花生幼苗子叶发病情况,将对应的幼苗子叶发病情况作为花生果腐病感-抗模型。
易感病(HS):接种5 d出现病斑,发病率90%及以上,子叶整体发黑,接种点腐烂,病斑直径1.0 cm以上;感病(S):接种5 d出现病斑,发病率在70%~90%,子叶整体发黄,接种点发黑,病斑直径0.3~1.0 cm;抗病(R):发病率在10%~20%,接种点发黄;高抗病(HR):发病率在10%以下,接种点无变化,茎部正常生长。
1.6 花生抗病种质资源的筛选
将花生种子放在无菌水中浸泡8 h后铺于平皿上培养至露白,水培至4片真叶,幼苗全长10~15 cm。将幼苗用无菌水洗净,取花生子叶置于湿棉花上,25℃光照培养箱中光照16 h、黑暗8 h培养2 d待用。接菌后培养20 d,以不接种致病菌作为对照组,每天记录子叶的发病率、病害严重程度以及病斑大小。导入花生果腐病感-抗模型中,筛选抗病品种。
2 结果与分析
2.1 菌株PPRF-05的分子生物学鉴定
从发生花生果腐病籽仁中分离出一株菌株PPRF-05,对其ITS区域进行测序(图1),根据Blastn结果进行序列注释,并提交到GenBank上注册,序列号:MH368499。其ITS序列经比对与Fusarium oxysporum相似度为100%,确定该菌为尖孢镰刀菌,现保藏于中国微生物菌种保藏管理委员会普通微生物中心,保藏编号为CGMCC No.18130。

图1 菌株PPRF-05的ITS序列
2.2 菌株PPRF-05的形态特征
PPRF-05接种在PDA培养基上,气生菌丝为白色絮状,随着培养时间增加,培养基质由红色转为紫红色(图2A);老熟菌丝上产生许多直径为1.5 mm的疏松絮状菌核,及大型镰刀形分生孢子和小型椭圆形分生孢子(图2B)。

图2 菌株PPRF-05的形态特征
2.3 花生各离体组织接种PPRF-05后的症状
接种3 d后,花生各组织表现出发黄、发黑等果腐病症状。接种7 d后,花生茎略有发黄、发紫,与对照相比没有明显变化(图3A);子叶接种位置明显腐烂,并向未接种位置扩散(图3B);根系主根明显发黑,并向未接种位置扩散,对照根系发黄(图3C);叶片在接种7 d后出现病斑、发黄并向未接种位置扩散(图3D);此外,PPRF-05菌株可以侵染花生种子的任一发育阶段(图3E)。

图3 花生各离体组织接种PPRF-05后的症状
2.4 花生果腐病感-抗模型的建立
接种5 d后,种子发病情况如图4所示。种子抗病分级情况及对应幼苗子叶发病情况如表1、表2所示,以此作为花生果腐病感-抗模型。
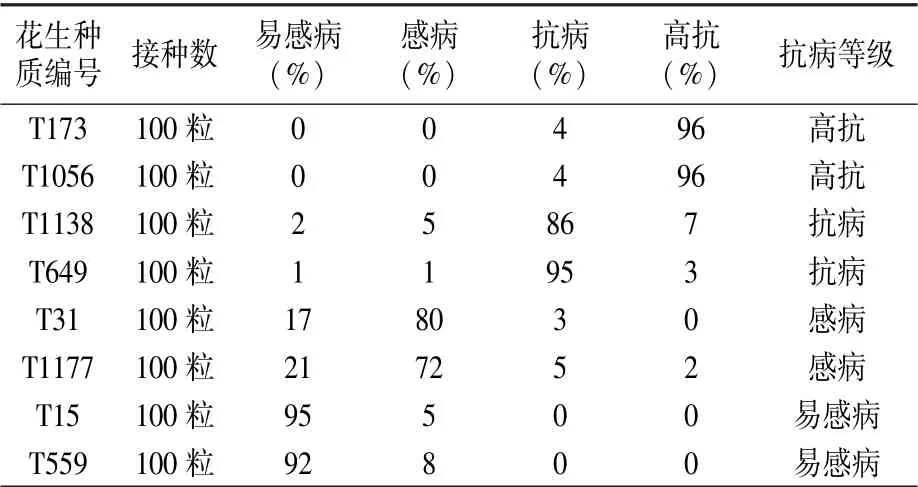
表1 鲜种子抗病性分级

表2 幼苗子叶感病统计
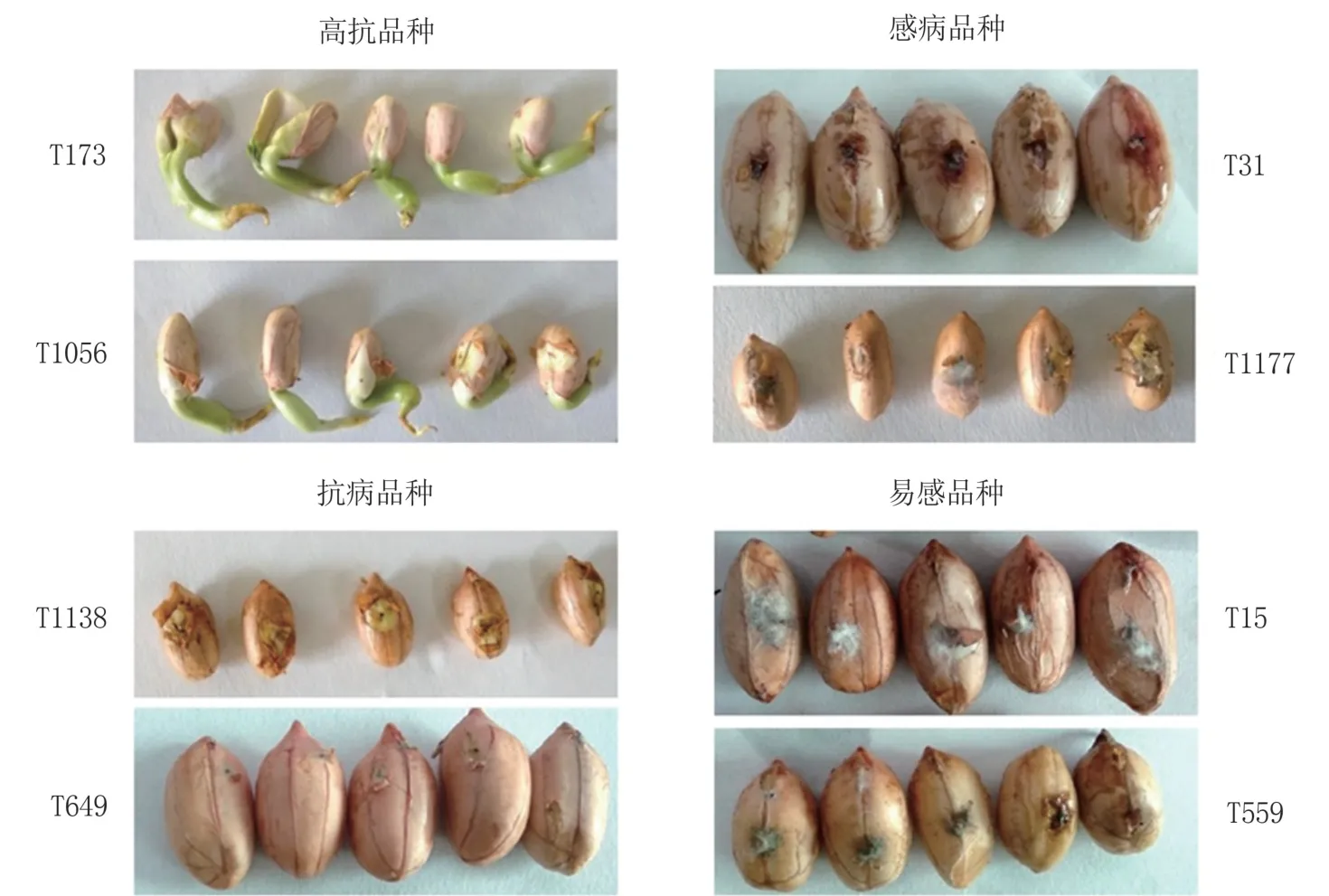
图4 鲜种子发病情况

表2(续)
2.5 花生种质资源鉴定
用上述感-抗模型对种质资源进行抗果腐病筛选鉴定,结果显示:花育36和花育915为易感品种;花育20和花育24为感病品种;花育916和花育50为抗病品种;T1611和R18-4为高抗品系(表3)。

表3 种质资源抗病分级

表3(续)
3 讨论与结论
花生果腐病的病原复杂多样,Csinos[18]在1986年分离出Rhizoctonia、Pythium和Cylindrocladium等6种真菌,同时明确不同地域或同一地域不同年份的病原微生物组成存在差异;另外土壤环境因素的改变也可能加重果腐病的发生,甚至某些营养元素的改变会导致果腐病的发生。王传堂等[3]利用分子克隆技术,发现莱西农场的果腐病与真菌感染有关,并且镰刀菌可能是主要病原。李术臣等[19]研究发现,在中国台湾地区花生果腐病的主要病原有Fusarium solani、Rhizoctionia solani和Pythium myriotylum及寄生性线虫等;河北省病原种类与其基本一致,都是多真菌病害共同作用的结果。本研究分离得到的PPRF-05菌株,ITS区测序表明其属于镰刀菌属。
感染果腐病的花生植株地上部与正常植株无差异,但荚果发黑腐烂,不易发现[20]。病害严重的植株茎叶浓绿,收获期无明显落叶现象,秧苗不死,根系繁茂但表皮发黑,但荚果几乎全部腐烂[21]。本研究将PPRF-05菌株接种花生各离体组织,根、子叶出现明显的发黑腐烂现象,茎和叶片出现病斑,但症状较轻。与果腐病的发病症状一致,进一步证实PPRF-05菌株是果腐病的主要致病菌。
目前,关于花生果腐病的研究主要集中在病原菌的分离鉴定及其致病性,在抗果腐病花生种质资源筛选鉴定方面相对较少。2018年何美敬等[22]通过田间自然发病对引进的77份美国资源和39份国内资源进行连续2年的鉴定;于静等[23]采用自然病圃鉴定法,对莱西试验站76个花生品种(系)进行了花生果腐病抗性评价。我国对花生果腐病的抗性种质资源筛选采用的是Wheeler等[24]的果腐病等级划分法以及何美敬等[22]建立的田间抗性评价体系。本研究建立的离体接种快速筛选方法,能够在实验室内简洁、高效地筛选抗病品种。下一步将对筛选所得花生品种进行田间试验,结合何美敬等[22]引入的田间抗性评价体系,进一步验证离体接种快速筛选方法的可行性,为抗果腐病花生品种快速选育提供新路径。
