格瓦斯对脾胃虚寒型胃溃疡大鼠保护作用的研究
2022-02-07邵占梅仲继冬房玉明马永强
邵占梅,仲继冬,房玉明,马永强*
(1.东北林业大学 林学院,黑龙江 哈尔滨 150040;2.哈尔滨秋林饮料科技股份有限公司,黑龙江 哈尔滨 150040;3.黑龙江省谷物食品与谷物资源综合加工重点实验室,黑龙江 哈尔滨 150076)
胃是重要的消化器官,承担着人体消化、储存和吸收各类营养物质的功能[1]。长期情绪波动、不规律的生活作息以及不当的饮食习惯都会破坏胃粘膜的结构,从而导致胃部病变,诱发胃溃疡(gastric ulcer,GU)、胃部炎症、急性胃炎等多种疾病[2],严重者甚至会转变为胃癌,威胁人体生命安全,因此保护胃粘膜结构状态对预防人体胃部疾病有着十分重要的意义。自由基的化学性质十分活泼,有很强的氧化性,对人体细胞的细胞膜、线粒体膜造成伤害,并与膜上的不饱和脂肪酸反应,造成脂质过氧化增强,使机体内产生更多自由基,这样膜结构完整性受到破坏,进而使局部细胞死亡[3]。此外,自由基还会攻击人体细胞的细胞核,破坏脱氧核糖核酸(deoxyribo nucleic acid,DNA),导致人体内酵素无法修补,产生细胞癌变。在产生众多的脂质过氧化物中,丙二醛(maleic dialdehyde,MDA)的毒性最大,它可以有效的反映机体过氧化的速率,间接反映局部组织和细胞受损伤程度[4]。超氧化物歧化酶(superoxide dismutase,SOD)是一类人体必需的天然抗氧化剂,可以平衡机体的脂质过氧化反应,有效保护胃粘膜结构,调节血管因子,保护胃部平缓消化刺激性食物,起到预防胃部疾病的作用[5]。
胃溃疡是一种人体常见的消化类疾病,常伴随着腹部胀痛、食欲不振、恶心、头晕、呕吐等症状,发病周期较长,是一种常见的慢性疾病[6]。随着现代社会年轻人生活节奏的加快,胃溃疡患病率也不断上升,严重影响了人们的身体健康和生活工作,中医学机理认为,脾胃虚寒是引起胃溃疡的病理基础,肝胃燥热、胃郁内热、肝胃不和、胃部瘀血等临床表征都是胃溃疡的常见症状[7],因此建立脾胃虚寒的模型对研究胃溃疡机理有着十分重要的意义。
格瓦斯是一种以面包发酵为主要手段的日常饮品,口感甘甜、爽口,富含钙元素、维生素、多种氨基酸和酵母菌群、乳酸菌群等有益菌群,其作用是在发酵过程中可以有效延长产品保质期,抑制其他有害微生物细菌的生长[8],长期饮用对人体有健脾、开胃,促进肠道消化的功能,另外格瓦斯中酒精含量低,市售格瓦斯每瓶酒精含量只有0.2%~0.4%[9],适应各类人群的日常需求,适当的配料应用还可调制出不同口味的格瓦斯饮品,适宜的酸涩甜味,少量的二氧化碳中和形成了格瓦斯饮料独有的风味口感。本研究通过冰食醋法和醋酸涂抹法建立脾胃虚寒型胃溃疡大鼠模型,经过格瓦斯灌胃实验,观察给药前后体质量变化、摄食量变化、胃溃疡指数、胃溃疡大小、胃液pH值、胃部超氧化物歧化酶、丙二醛、血清一氧化氮的含量,研究格瓦斯饮料对于脾胃虚寒型胃溃疡的缓解作用,为后续探讨其作用机制提供科学依据。
1 材料与方法
1.1 材料与试剂
1.1.1 动物
Wistar雄性大鼠60只:体质量为(190±200)g,购于长春亿斯实验动物中心,质量合格证序号202000034165,许可证号码为SCXK(吉)-2018-0007。实验前先适应性饲养7 d,饲养于哈尔滨商业大学药学院无特定病原体(specific pathogen free,SPF)级动物房,饲养条件为温度22~25 ℃,相对湿度(65±5)%,12 h昼夜循环,正常喂予普通饲料和纯净水。
1.1.2 试剂
格瓦斯、食醋、安胃疡胶囊:市售;一氧化氮(NO)、超氧化物岐化酶(SOD)、丙二醛(MDA)、胃泌素(gastrin,GAS)检测盒:南京建成生物工程研究所;10%甲醛溶液:上海国药集团化学试剂有限公司。
1.2 仪器与设备
TDL80-2台式离心机:上海安亭科技仪器厂;SpectraMax 190全波长酶标仪:美国Molecular Devices公司;TU-1900紫外可见分光光度计:上海元析仪器有限公司;PHSJ-4FpH计:上海雷磁仪器厂;HHS-ZK4恒温水浴锅:天津市泰斯特仪器有限公司。
1.3 方法
1.3.1 脾胃虚寒大鼠模型的建立
采取冰食醋法[10]建立模型,取SPF级雄性Wistar大鼠50只,每日早上灌胃1次约4 ℃的食醋,灌胃量为10 mL/kg,下午灌胃猪油脂(脂肪含量≥98%,温度30~33 ℃),连续灌胃10 d,正常喂食,造模期间监测大鼠的摄食量和体质量状况,待大鼠出现进食减少、疲倦少动、四肢温度降低,体质量明显减轻、大便变稀的症状后即说明造模成功。
1.3.2 脾胃虚寒型胃溃疡大鼠模型的建立
在成功建立脾胃虚寒大鼠模型的基础上,采用醋酸涂抹[11]的方法建立胃溃疡的模型,脾胃虚寒症大鼠造模成功后禁食不禁水24 h,注入1.5 mL 2%的水合氯醛溶液麻醉大鼠,将大鼠的四肢固定于手术台上,于腹部切开1~2 cm的切口,打开大鼠腹腔后,轻拉出胃部器官,用长度约为1.8 cm的小塑料管按在在胃部的前部的浆膜面上[12],力度不宜过重,防止胃部损伤出现出血现象,向小塑料管内注入0.1~0.2 mL 4 ℃的冰醋酸约30 s,结束后用生理盐水冲洗牵拉出的局部器官,包覆此过程出现的损伤部位,将胃部器官轻放回腹腔相应部位,用消毒针线逐层缝合腹部切口,然后再向腹部切口损伤处注射0.1~0.2 mL的青霉素钠注射液[13],用来防止大鼠的伤口术后感染,待大鼠麻醉状态结束完全清醒后放回饲养箱中,正常给予饮食和水,术后当日时时观察大鼠活动状态,防止大鼠剧烈活动造成伤口破裂感染。次日开始恢复自由饮食饮水,手术恢复24 h后进行分组及给药灌胃。
1.3.3 大鼠分组及给药方案
60只Wistar大鼠随机分成6组,每组10只,空白组和模型组大鼠正常给予普通饲料和水,参照人体的等效剂量进行各组给药,安胃疡阳性组大鼠每日灌胃一次,灌胃量为0.15 g/kg,高剂量格瓦斯组大鼠每日灌胃一次,灌胃剂量为16 g/kg(此剂量为人体正常等效剂量的2倍),格瓦斯中剂量组大鼠每日灌胃一次,灌胃剂量为8 g/kg(此剂量为人体正常的等效剂量),格瓦斯低剂量组大鼠每日灌胃一次,灌胃剂量为4 g/kg(此剂量为人体正常等效剂量的1/2),3 mL/d持续灌胃7 d,末次给药后禁食8 h采用颈椎脱臼法处死大鼠。
1.3.4 摄食量测定
适应性饲养期间每只大鼠禁食不禁水12 h后,按照分组转移到单独的鼠笼内单独饲养,适应30 min后,在特殊的容器中放入称过质量的鼠粮喂养鼠笼中的大鼠,2 h后拿出鼠粮再次称质量,两次数据之差即为大鼠的摄食量(期间注意拿取鼠粮时残渣的掉落)。同时,在脾胃虚寒型胃溃疡大鼠造模成功后和灌胃相应药物后测量大鼠的摄食量,方法同上。
1.3.5 大鼠血清及部分器官样本采集
末次给药后,禁食不禁水8 h,注射5%水合氯醛麻醉大鼠,固定大鼠四肢于手术台上,采用腹腔主动脉取血[14]的方法,打开大鼠腹腔,用采血针倾斜45°扎进主动脉,取2~3 mL血液,3 000 r/min离心15 min,取上层血清备用,结扎贲门和幽门,沿胃部器官大弯处切开,用注射器吸出全部胃液,使用生理盐水快速冲洗胃部残留成分和血污,将取下的胃放置在白色滤纸上,观察测量溃疡的面积状况。称取约0.2 g的胃溃疡组织部分,加4 ℃冰生理盐水混合匀浆形成10%的胃溃疡组织匀浆液,置于10 mL规格的EP管中,3 500 r/min离心15 min,取上清液[15],余下的溃疡组织在手术后立即放入10%的甲醛组织固定液中,结束后将它们均放于-80 ℃的冰箱保存。
1.3.6 大鼠胃溃疡面积、指数和胃液pH值测定
用游标卡尺测量大鼠胃溃疡部分的纵径(Z1)和横径(D1),按公式(1)计算胃溃疡面积。

式中:S为胃溃疡面积,mm2;Z1为胃溃疡纵向直径,mm;D1为胃溃疡横向直径,mm。
参照GUTH P H等[16]的标准,以局限于胃部胃上皮的溃疡、糜烂和出血灶等长度测量进行积分累积,正常组织的记为0分,有部分斑点糜烂的记为1分,糜烂最大横径小于1 mm的记为2分,在1~2 mm之间的记为3分,在3~4 mm之间的记为4分,>4 mm的记为5分,各项分值相加总和为大鼠胃溃疡面积指数结果,并用精密pH试纸测试抽出胃液的pH。
1.3.7 大鼠胃部组织SOD、MDA含量测定
根据试剂盒中说明书提供的方法操作,测定各组大鼠胃部组织超氧化物歧化酶活力值和丙二醛含量。
1.3.8 大鼠血清NO、GAS含量测定
根据试剂盒中说明书提供的方法操作,测定各组大鼠血清的一氧化氮和胃泌素含量
1.3.9 统计方法
数据采用SPSS 23.0软件处理,所有指标数据均使用“平均值±标准差”的形式表示,对数据进行单因素方差分析进行数据的差异性分析,当P<0.05时数据具有显著性差异,P<0.01时数据具有极显著差异,并使用Origin 2018软件作图。
2 结果与分析
2.1 造模前后状态变化及对体质量、摄食量的影响
2.1.1 状态变化
适应性饲养期间大鼠活动迅速,体质量增长较快,脾胃虚寒造模期间,除空白组外其余各组大鼠均有疲倦感,活动频率降低,进食量开始呈现下降趋势,在造模第4天开始出现大便稀溏[17]的状况,毛色暗淡无光泽。
脾胃虚寒型胃溃疡造模手术结束后,各组大鼠恢复意识后,活动频率和强度明显降低,意识恢复缓慢,饮水量和进食量逐渐降低,大便情况更加稀溏,恢复24 h后进行给药,给药期间大鼠活动频率和速度有明显的加强,食欲在给药第2天有所恢复,体质量逐渐增加,中剂量和低剂量组大鼠的体质量,食欲和大便情况均有改善,但没有安胃疡阳性给药组和高剂量组大鼠情况改善明显,模型组大鼠状况持续走低,大鼠无明显活动能力,腹部肿大,体质量持续降低,身体时常呈现蜷缩状[18],喜扎堆。
2.1.2 体质量变化
造模前后及给药后各组大鼠体质量变化结果见图1。由图1可知,有的大鼠出现体质量下降的趋势,而空白组大鼠整体状态良好,体质量平缓上升,行动迅速,无疲倦感,大便呈现明显的颗粒状。造模成功后和空白组对比,各组大鼠体质量增长呈现减缓趋势,模型组大鼠体质量呈现明显下降趋势,给药后高、中、低剂量组大鼠体质量均有增加,与空白组相比,模型组大鼠体质量呈现明显的下降趋势(P<0.05);与模型组相比,高剂量组和安胃疡阳性给药组大鼠体质量均有显著增加,且差异具有一定的统计学意义(P<0.05)。结果表明,安胃疡药物和格瓦斯饮料能有效改善脾胃虚寒型胃溃疡所导致的体质量下降的趋势,且格瓦斯饮料缓解这一表征效果趋近于安胃疡阳性药物。

图1 各组大鼠体质量变化状况Fig.1 Changes in body mass of rats in each group
2.2 各组大鼠摄食量变化
各组大鼠不同时期摄食量变化结果见表1。由表1可知,造模后阳性组、模型组、中剂量组和低剂量组大鼠的摄食量均显著低于空白组(P<0.05),模型组大鼠摄食量显著低于阳性组(P<0.05),说明整体大鼠造模手术比较成功,除空白组外各组大鼠的摄食量均有所减少,灌胃后结果显示,阳性组、高剂量、中剂量和低剂量组大鼠摄食量均显著高于模型组(P<0.05),而模型组显著低于阳性组大鼠(P<0.05),说明格瓦斯饮料和阳性药物安胃疡对于脾胃虚寒型胃溃疡大鼠有一定的缓解作用,可以在一定程度上增加胃部组织已受损大鼠的进食量。

表1 各组大鼠不同时期摄食量变化Table 1 Changes in food intake of rats in different periods in each group
2.3 对大鼠胃溃疡面积、指数的影响
各组大鼠胃溃疡面积及指数变化结果见表2。由表2可知,溃疡面积方面,与模型组相比,安胃疡阳性组、高剂量组、中剂量组和低剂量组大鼠均有显著性减小(P<0.05),溃疡指数方面,与模型组相比,安胃疡阳性组和格瓦斯高剂量组大鼠的溃疡面积极显著减少(P<0.01),中剂量组和低剂量组大鼠有显著性差异(P<0.05),这可能是由于格瓦斯饮料和安胃疡刺激了大鼠的胃黏膜,使黏膜中的脂蛋白发挥保护作用,防止H+和Na+扩散至胃内部,保护了胃黏膜屏障不被破坏[19],由此说明阳性药物安胃疡和格瓦斯饮料能够有效改善大鼠胃溃疡状况,且高剂量的格瓦斯对于缓解脾胃虚寒型胃溃疡出血糜有着更好的效果。

表2 各组大鼠胃溃疡面积及指数变化Table 2 Changes in gastric ulcer area and index of rats in each group
2.4 对大鼠胃液pH值的影响
各组大鼠胃液pH值变化结果见表3。由表3可知,空白组、安胃疡阳性组、高剂量组、中剂量组和低剂量组大鼠胃液pH均与模型组呈现显著性差异(P<0.05),与空白组相比,模型组大鼠胃液pH值有明显上升,说明大鼠胃上皮胃粘膜处有较大损伤,胃腺壁细胞破环严重,导致胃部不能正常分泌大量胃酸,和模型组相比,安胃疡阳性组和格瓦斯给药组大鼠胃液pH值均有所下降,说明胃粘膜结构和胃腺壁细胞受到的损伤较小,实验结果表明,阳性药物和格瓦斯饮料对脾胃虚寒型胃溃疡有较为明显的改善作用,这可能是由于格瓦斯在一定程度上消解了胃部的蛋白酶,促进了胃酸的分泌,可以在一定程度上有效修复胃粘膜结构和胃腺细胞,促使大鼠胃部分泌大量胃酸[20]。
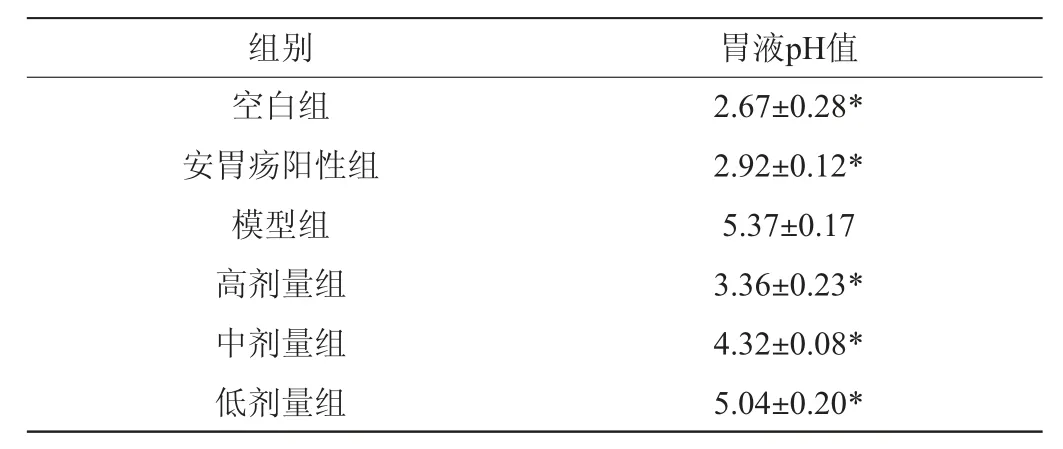
表3 各组大鼠胃液pH值Table 3 pH of gastric juice of rats in each group
2.5 大鼠胃部组织中超氧化物歧化酶和丙二醛含量测定
各组大鼠胃部组织SOD含量及MDA含量见图2。由图2可知,与空白组相比,模型组和阳性给药组大鼠胃组织SOD含量明显降低(P<0.05),MDA含量显著升高(P<0.05),与模型组相比,格瓦斯高剂量组大鼠胃部组织SOD含量有明显的升高,MDA含量有明显降低(P<0.05),与阳性组相比,高剂量组大鼠胃组织的SOD含量有显著性差异(P<0.05),模型组大鼠胃组织SOD含量显著降低(P<0.05),由结果可知,阳性药物安胃疡和格瓦斯饮料能有效增强大鼠胃部器官的超氧化物歧化酶活力,提升大鼠机体自主清除自由基的能力,提高抗氧化能力,丙二醛含量明显下降可能是由于格瓦斯阻断了机体中蛋白质、多种酶等大分子的聚合,使体内的脂肪发生一定程度的氧化反应[21],说明安胃疡和格瓦斯饮料能有效改善脾胃虚寒型胃溃疡的症状。

图2 各组大鼠胃部组织超氧化物歧化酶含量(A)及丙二醛含量(B)Fig.2 Superoxide dismutase content (A) and malondialdehyde content (B) in stomach tissue of rats in each group
2.6 大鼠血清中一氧化氮(NO)含量的测定
各组大鼠血清NO含量测定结果见图3。一氧化氮是一种底物为左旋精氨酸的神经传导递质,在机体的催化作用下生成,能有效保护胃粘膜细胞结构,促进胃壁细胞生长因子快速生长。由图3可知,与空白组相比,模型组大鼠血清中的NO含量显著降低(P<0.05),与模型组相比,高、中、低剂量组大鼠血清NO含量均有显著性差异(P<0.05),与阳性给药组相比,高剂量组大鼠血清NO含量也呈现显著性差异(P<0.05),整体结果表明,三组格瓦斯饮料给药组能有效提高大鼠机体内NO含量,使NO发挥其保护生长因子的作用,舒展胃部血管,增加胃粘膜周围的血流量,从而有效抑制脾胃虚寒型胃溃疡、胃上皮糜烂和出血的现象[22],降低有害物质对胃器官的损伤,保证胃粘膜的完整性。

图3 各组大鼠血清一氧化氮含量Fig.3 Nitric oxide content in serum of rats in each group
2.7 大鼠血清中胃泌素(GAS)含量的测定
各组大鼠血清中GAS含量见表4。由表4可知,模型组大鼠血清GAS含量显著低于空白组大鼠(P<0.05),阳性组、高剂量、中剂量、低剂量大鼠血清GAS含量显著高于模型组大鼠(P<0.05),说明阳性药物安胃疡和格瓦斯饮料能在一定程度上提高大鼠体内GAS这种胃肠激素,这可能是与反馈作用有关,安胃疡和格瓦斯内的功效成分刺激了大鼠的神经系统,刺激了胃平滑肌细胞的收缩反映,增加了胃部的消化运动,有效修复胃部损伤的黏膜组织[23]。

表4 各组大鼠血清中胃泌素含量Table 4 Gastrin content in serum of rats in each group
3 讨论
格瓦斯是一种经过多种复合菌共同发酵之后形成的低酒精饮品,日常饮用能有效促进人体消化,保护脾胃,消除疲劳感,还可以很好的促进脾胃消化,有利于人体吸收各类营养物质[24]。胃溃疡作为21世纪以来人类慢性病的一大杀手,对人体的危害不言而喻,其发生的原因一般多是外部细菌大面积侵害,胃酸过少等原因,当机体内消化系统平衡被打破时,会极大程度的破坏体内黏膜-黏液的保护屏障,造成胃部的病变[25],例如胃酸过多过少,胃腺壁细胞损伤,从而导致急性胃炎、胃溃疡,甚至是胃癌等疾病的发生。此外,有关研究发现,一些非甾体抗炎药[26]对人体胃肠道有着严重的不良反应,具体表现为淤血、斑点、胃上皮糜烂出血等症状[27],目前临床治疗中一般以抑制胃酸胆汁过多分泌,清除体内幽门螺旋杆菌[28]和保护胃部黏膜结构为主,杨希良等[29]通过利用提取出的蛋黄油对大鼠胃溃疡模型灌胃研究发现高浓度的蛋黄油对溃疡面积有明显的的减少,且大鼠肠胃便稀的情况也有逐渐改善。本研究参考人体等效剂量对各组脾胃虚寒型胃溃疡大鼠进行灌胃治疗,结果存在一定的指导作用,但由于人体和动物体的差异性,格瓦斯饮料对人体胃溃疡疾病的修复效果和机理仍有待进一步探讨。
4 结论
本研究通过对Wistar大鼠进行灌胃实验,证明了格瓦斯对脾胃虚寒型胃溃疡病症的拮抗作用,实验结果显示,针对SOD、MDA和NO指标来说,格瓦斯高剂量组与模型组相比有着显著性差异(P<0.05),从胃溃疡面积指数和胃液pH值两个指标来看,安胃疡给药组和格瓦斯给药组与模型组大鼠相比有极显著性差异(P<0.01),说明格瓦斯饮料可以在一定程度上修复被破坏的胃部组织,减少胃溃疡的面积,抑制胃酸分泌过剩造成的恶心呕吐等症状,此外,在给药期间大鼠活动状态较为良好,活动频率增加,造模期间的蜷缩状疲倦感逐渐消失,毛色由暗淡无光泽逐渐变为柔顺光亮,这一表征也可以说明长期饮用格瓦斯能有效缓解机体疲劳感,清除体内过剩的自由基,从而有效改善脾胃虚寒型的胃溃疡疾病,但其对机体胃部病变部分的作用机理仍有待进一步的研究探讨。
