全自动烷基汞测定仪分析鱼及鱼饲料中的甲基汞
2022-02-06易华娟苏雍伦何洁玲张树权陈锦杭
易华娟,苏雍伦,何洁玲,张树权,陈锦杭
(1.东莞市食品药品检验所,广东 东莞 523808;2.广东医科大学,广东 东莞 523808;3.中山海关技术中心,广东 中山 528403)
汞(Hg)是一种常见的高毒性元素,具有持久性、全球性和生物累积性[1],主要分为无机态(Hg,Hg2+,Hg+)和有机态(MeHg、乙基汞(EtHg)等)[2],有机汞的毒性较无机汞更强,其中MeHg的毒性最强[3]。Hg主要以气态形式存在于大气中,其中的无机汞因重力、雨水等原因进入地表[4],同时水体因各种生产活动而被Hg污染,水中的无机汞经过微生物作用转换为MeHg[5-6]。MeHg因其碳链短、分子量小、脂溶性大而极易被鱼类吸收,而MeHg排除的速率却很低,并因生物累积效应在生物体内富集,富集因子高达1×104~1×107[2]。所以,即使在低浓度MeHg的水里,还是能够引起鱼类的高水平污染,这最终都会反馈给食用者[7]。鱼饲料在生产及储存过程中会因复杂的环境、原材料及生产器械等而被甲基汞污染[8]。
研究指出,人类暴露于MeHg的主要途径为食用水产品[7-9],甲基汞沿着食物链中的细菌、浮游生物等富集到鱼类中,被人类食用后,会被人体吸收并随血液输送到全身组织器官中[10]。中毒表现主要为末梢感觉紊乱、精神失常、丧失意识、震颤、共济失调和向心性失调等[11]。上世纪50年代,日本“水俣事件”的成因就是食物链被MeHg污染[12]。因此,研究食物链中MeHg的累积效应对保护人类健康具有重要意义。
我国是世界水产养殖第一大国,同时也是汞污染较为严重的国家[13-14],随着养殖业的商业化,鱼饲料在投料中所占比例也越来越高,鱼饲料的污染水平将是控制水产品品质的关键[15]。目前,国内外对水生食物链中甲基汞的放大作用主要集中在不同营养层间的捕食关系上[16],鲜有研究鱼饲料在食物链中的累积效应。通过对不同鱼体、饲料的深入分析,能够使人们对甲基汞在不同鱼体中的分布状况有一定的认识,同时也为后续对于鱼饲料中甲基汞的研究提供借鉴。
目前,液相和气相色谱等分离方法与原子荧光光谱[17-18]、原子吸收光谱、原子发射光谱[19]和电感耦合等离子质谱[20-22]等高灵敏度的检测仪器联用被广泛应用于甲基汞的检测研究中[23]。但这些方法因成本高、前处理繁杂、耗时长、分析效果不理想等原因,限制了其在日常批量检验中的使用。研究采用了吹扫捕集-气相色谱-冷原子荧光光谱仪法,该方法具有操作简便、检出限低、分离效果佳、时间短和成本低等优势[24-25]。随着检测行业的发展和国家标准的完善,GC-CVAFS法在日常检测中的推广必定更具发展前景。
1 材料与方法
1.1 材料与试剂
鲩鱼、草鱼、乌鳢、鲤鱼、鳙鱼、多春鱼、带鱼、鲅鱼、黄花鱼、鮸鱼和鱼饲料,购自市场。
氢氧化钾、三水合乙酸钠(优级纯)、冰乙酸(色谱纯),中国天津市科密欧化学试剂有限公司提供;盐酸(优级纯)、硝酸(分析纯),广州试剂厂提供;甲醇(色谱纯),德国默克公司提供;四乙基硼化钠(≥98%);鱼肉中总汞与甲基汞成分分析标准物质(标准值5.5±0.17 mg/kg),欧盟联合研究中心提供;甲基汞标准溶液(1.0 mg/L),中国计量科学研究院提供。
1.2 仪器与设备
全自动甲基汞测定分析仪,美国Brooks Rand Labs公司产品;涡旋振荡仪,德国IKA公司产品;烘箱,德国Memment公司产品;电子分析天平,北京Satorious科学仪器公司产品;微量移液器,德国艾本德有限公司产品;超纯水处理系统,美国密理博产品。
1.3 试剂及标准溶液配制
1.3.1 20%(W/V)氢氧化钾(KOH)甲醇溶液
称取10.0 g KOH置于50 mL离心管中,分4次加入40 mL甲醇溶解,混匀,装聚四氟乙烯试剂瓶内保存。
1.3.2 乙酸钠(NaAc-HAc)缓冲溶液(2 mol/L)
称取54.4 g三水合乙酸钠,加入到23.6 mL冰乙酸中,用水定容至200 mL。
1.3.3 30%硝酸溶液
量取30 mL硝酸,加入至70 mL水中;2%(W/V)KOH水溶液:称取1.0 g KOH置于50 mL塑料容量瓶中,加水溶解并定容至50 mL。
1.3.4 乙基化试剂
将质量分数为2%的KOH溶液置于-20℃冰箱中冻至水溶液出现晶体后,加入0.5 g四乙基硼化钠粉末,混匀后分装到液相小瓶中,置于-20℃下保存。
1.3.5 0.5%乙酸+0.2%盐酸混合溶液
量取0.5 mL乙酸溶液和0.2 mL盐酸溶液,缓缓倒入100 mL水中。
甲基汞标准使用液(200 pg/mL):吸取相应量的甲基汞标准溶液,用0.5%乙酸+0.2%盐酸混合溶液逐级稀释至质量浓度为200 pg/mL,置于4℃以下冰箱储存使用。
1.4 样品前处理
1.4.1 提取前准备
将鱼样用水洗净,取可食部分放入搅拌器中绞碎、混匀,装入样品罐中,放入-20℃冰箱中保存备用;取颗粒状鱼饲料放入搅拌器中绞碎至粉末状、混匀,装入样品罐中保存备用。
1.4.2 碱法提取
称取0.1 g(精确到0.000 1 g)样品到50 mL离心管中,加入预先配制的质量分数为20%的KOH甲醇溶液5 mL,摇匀后置于60℃的烘箱中消解4 h。消解过程中,每隔1 h涡旋1次,使消解液与样品充分接触。在进样瓶中加水至瓶颈处,加入样品消解液50 μL,用10% HCl试剂调节pH值至6~8,加入NaAc-HAc缓 冲溶液300 μL,将pH值调节至4.5~5.0,加入乙基化试剂50 μL,加水至出现凸液面,迅速盖上瓶盖,摇匀,使其乙基化反应充分进行。
1.4.3 酸法提取
称取0.1 g(精确到0.000 1 g)样品到50 mL离心管中,加入质量分数为30%的硝酸溶液10 mL,盖紧,置于60℃烘箱中消解12 h。取出消解完的样品,加水定容至20 mL。在进样瓶中加水至瓶颈处,准确移取0.2 mL样品消解液至瓶内,再加入质量分数为20%的KOH甲醇溶液0.16 mL,用质量分数为10%的HCl溶液试剂调节pH值至6~8,加入NaAc-HAc缓冲溶液将pH值调节至4.5~5.0,加入50 μL的乙基化试剂,加水至出现凸液面,迅速盖上瓶盖,摇匀,使其乙基化反应充分进行。
1.5 标准曲线的配制
将40 mL棕色进样瓶加水至瓶颈处,分别移取0.2 ng/mL甲基汞标准溶液0.05,0.25,0.50,1.25,2.50,5.00 mL,加入NaAc-HAc缓冲溶液300 μL,再加入乙基化试剂50 μL,加水至呈凸液面,盖紧混匀,配成甲基汞质量分别为10,50,100,250,500,1 000 pg的标准溶液系列。
1.6 仪器条件及原理
1.6.1 仪器条件
冷原子荧光检测器光电倍增管(PMT)电压670 V;基线信号值36 μV;吹扫捕集气:氮气,流速50 mL/min,时间5 min;干燥气:氮气,流速40 mL/min,时间3 min;Tenax管解析加热时间9.9 s;GC温度35℃;GC载气为氩气,流速30 mL/min。
1.6.2 仪器工作原理
全自动烷基汞测定分析仪的仪器检出限(IDL)为0.002 ng/L,其工作原理为:将样品经前处理消解提取出甲基汞,取定量样液进行乙基化反应后,在加压状态下被氮气自动输送至气液分离器中,经氮气吹脱至Tenax捕集管并被干燥,加热Tenax捕集管使Hg解析,而后被氩气输送至气相柱使不同形态的Hg分离,热解还原为单质Hg,经冷原子荧光检测器(CVAFS)进行测定[26]。
阳性样品出峰色谱图见图1。

图1 阳性样品出峰色谱图
色谱图中包含3个峰,从左到右依次为Hg0,MeHg,Hg2+和CH3-CH2-Hg+。
2 结果与分析
2.1 GC柱分离温度的优化
取衍生好的甲基汞标准溶液作为样品,设定GC温度为30,35,40,45℃,比较不同温度下Hg0,MeHg,Hg2+和CH3-CH2-Hg+乙基化产物的分离效果。由图1可知,温度为45℃时,3个峰勉强分离;当温度为30,35,40℃时,3个峰可以完全分离开;但温度为30℃时,MeHg的峰拖尾时间较长,不利于快速检测;所以,当温度为35℃和40℃时,3个峰的分离效果最好,考虑到经济效益及环保节能,选取35℃作为GC柱的分离温度最为合适。
2.2 乙基化反应条件的优化
2.2.1 乙基化反应的pH值
用标准参考物质作为质控样品,按照1.4.2中碱法消解的步骤对样品进行前处理,用质量分数为10%的HCl溶液试剂调节pH值至6~8后,加入浓度为2 mol/L的NaAc-HAc缓冲溶液调节pH值至3,4,5,6,8,9,10,每个pH值条件做6组平行。
乙基化反应pH值对回收率的影响(n=6)见图2。
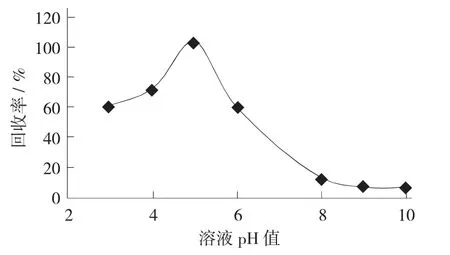
图2 乙基化反应pH值对回收率的影响(n=6)
回收率在pH值5时最高,此时添加的2 mol/L NaAc-HAc缓冲溶液为300 μL,回收率为99.927%。研究所得的最佳乙基化反应pH值与王雪婷等人[27]的研究结果相符。
2.2.2 乙基化试剂的使用量
乙基化试剂的使用量对乙基化反应有直接影响,乙基化试剂使用量过少时甲基汞的乙基化反应不充分,但使用量过大时又会使得乙基化反应剧烈造成甲基汞挥发而损失,回收率下降,同时也会提高试验成本[28]。因此,确定最佳的乙基化试剂使用量尤为重要。
用标准参考物质作为质控样品,按照1.4.2中碱法消解的步骤对样品进行前处理,分别加入乙基化试剂20,40,50,70 μL,测定其含量。
不同乙基化试剂使用量时标样中MeHg的测定值(n=6)见表1。
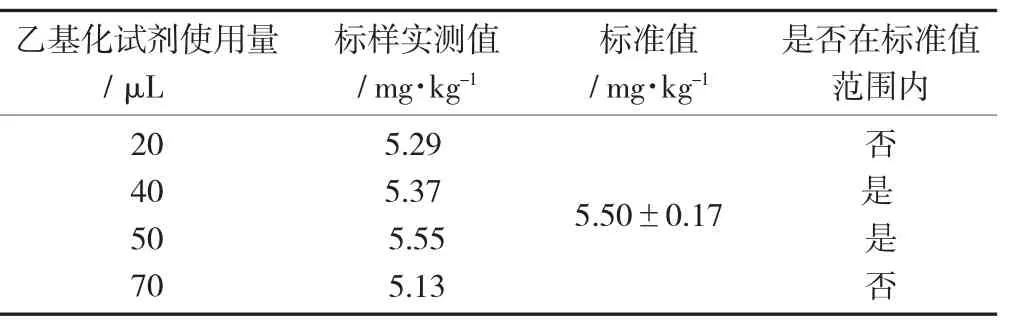
表1 不同乙基化试剂使用量时标样中MeHg的测定值(n=6)
由表1可知,乙基化试剂的投加量为40 μL和50 μL时,标样的测定值都在标准值范围内,为确保样品中的乙基化反应充分进行,试验选取的乙基化试剂投加量为50 μL。
2.3 消解方法的比较
在生物组织中,有机汞的含量占总汞的70%~90%,有机汞化合物与硫基高度亲和[29],必须通过化学试剂破坏硫化合物,从而释放有机汞。不同的提取方式对MeHg的回收率和不同形态Hg之间的转换会产生不同的效果。因此,样品的前处理方法对于检测结果中的质量控制至关重要。
2.3.1 鱼肉消解方法的选择
称取鱼肉中甲基汞成分分析标准物质作进行试验,分别按照1.4中的酸法和碱法对样品进行消解。
2种消解方法处理鱼肉标准物质的结果对比(n=3)见表2。

表2 2种消解方法处理鱼肉标准物质的结果对比(n=3)
由表2可知,2种方法的回收率相差不大,测定值均在标准值范围内,因此2种前处理方法均适用于鱼类中甲基汞的测定。考虑到碱法消解的前处理时间相较于酸法消解短,接下来鱼类中甲基汞的测定均采用碱法消解。
2.3.2 鱼饲料消解方法的选择
分别按照1.4中的碱法和酸法对样品进行前处理。
2种消解方法处理鱼饲料的结果对比(n=6)见表3。

表3 2种消解方法处理鱼饲料的结果对比(n=6)
鱼饲料的基质较为复杂,富含蛋白质原料,如鱼粉、虾粉、豆粕和米糠等。鱼饲料消解完成后,发现酸法的消解液沉淀少、呈澄清状态,而碱法处理鱼饲料样品的消解液中出现乳浊、颗粒性沉淀现象及少量泡沫。酸法消解的RSD%为2.92%,具有良好的平行性;碱法消解的RSD%为9.81%,且提取效率显著低于酸法消解(p<0.05)。
由消解现象及测定结果可知,相比于碱法消解,酸法消解能较完全地消解鱼饲料样品并提取甲基汞,因此接下来的试验中鱼饲料采取酸法消解。
2.4 线性关系
质量分别为10,50,100,250,500,1 000 pg的一系列标准溶液,在上述优化条件下测定,以MeHg的出峰高度为纵坐标(Y),MeHg质量为横坐标(X),作线性回归曲线,标准曲线方程为Y=365.68X-1 900.2,相关系数R2=0.999 8。
2.5 方法检出限与定量限
以11个空白样品考查该方法的灵敏度,计算11个空白样品测量值的标准偏差,以3倍标准偏差为检出限,10倍标准偏差为定量限。根据样品前处理方法中的称样量和稀释倍数,可计算出方法的检出限和定量限。
不同消解方法的检出限和定量限见表4。

表4 不同消解方法的检出限和定量限
2.6 方法精密度与准确度
分别选取草鱼和鱼饲料作为试验材料,以1倍,2倍及10倍定量限作为加标水平。分别按照1.4中的碱法和酸法对样品进行消解及测定。每个加标水平做6个平行试验。
鱼肉中甲基汞加标回收率和精密度测定结果(n=6)见表5,鱼饲料甲基汞加标回收率和精密度(n=6)见表6。
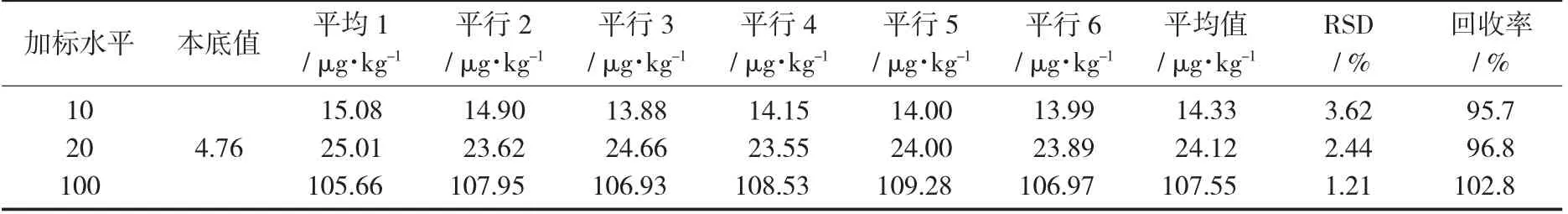
表5 鱼肉中甲基汞加标回收率和精密度测定结果(n=6)
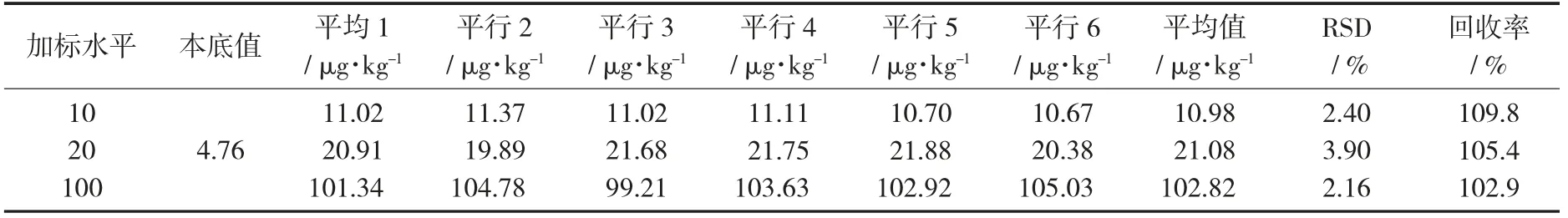
表6 鱼饲料甲基汞加标回收率和精密度(n=6)
在低、中、高3个加标水平下的回收率和RSD均符合GB/T 27404—2008《实验室质量控制规范 食品理化检测》中附录F的要求,定量限适用性良好。
2.7 实际样品的测定
应用研究建立的分析方法对10种鱼类和10批鱼饲料进行测定。
鱼及鱼饲料中甲基汞含量的测定结果(n=6)见表7。
由表7可知,淡水鱼测定含量为3.79~16.74 μg/kg,海水鱼测定含量为26.45~142.19 μg/kg。鱼饲料中2批检出甲基汞的含量范围为3.68 μg/kg和5.51 μg/kg。GB 2762—2017《食品中污染物限量》中MeHg限量规定:肉食性水产动物及其制品1.0 mg/kg,非肉食性鱼类及其制品0.5 mg/kg,在此次测定中所有水产品的MeHg含量均符合该限量要求。

表7 鱼及鱼饲料中甲基汞含量的测定结果(n=6)
从结果大致可知,海水鱼的甲基汞含量普遍高于淡水鱼中的甲基汞含量,造成这种差异的原因可能是生活环境和食物中甲基汞浓度的不同。海水鱼多数是野生的且生长周期长,在海水中有较长且稳定的食物链,对于甲基汞的富集作用强。而淡水鱼一般是养殖鱼,淡水中的甲基汞污染没有海水中的污染严重,且能够人为控制,并且主要以甲基汞含量极低的鱼饲料作为主要食物来源,生长周期短,食物链短,富集MeHg的程度低[30]。
3 结论
建立了气相色谱-冷蒸气原子荧光光谱法测定鱼及鱼饲料中甲基汞的方法,该方法灵敏度高,操作步骤简便快速、准确、高效、经济可行,分析测定得到的数据具有良好的精密度,准确性高,在日常检测中具有很大的推广空间和发展前景。
