肝脏血管认知更新与研究新思路
2022-02-03刘志敏董梦琦周伟杰
林 媛,刘志敏,董梦琦,周伟杰
南方医科大学南方医院普通外科,广东 广州 510515
肝脏是哺乳动物身体最大的器官,具有高度多样复杂的功能。肝脏组织的一个基本特征是其独特的血管模式。两条传入血管向肝脏供血:门静脉和肝动脉。门静脉血来自胃、肠、胰腺和脾脏,低氧低压力,富含从消化道吸收的营养物质和有毒物质以及内脏产生的激素和生长因子。动脉血具有系统水平的氧气、压力和成分。肝脏血液传出系统为肝静脉或“中央”静脉,通过下腔静脉到达全身循环。肝血窦形成一个非常特殊的血管系统,介于传入和传出血管之间,其由有孔的内皮细胞单层排列组成,缺乏结构化的基底膜,提供了血液和肝细胞之间特别有效的沟通[1-3]。最广泛研究和分析的肝脏形态和功能单位是肝小叶(经典的基尔南氏),在二维组织切片上呈多边形(通常为六边形)。如图1所示,肝小叶多边形角部被小叶间胆管、门静脉和肝动脉的终支组成的“门脉三联体”占据,肝静脉的终支(中央静脉)位于小叶的中心,血液沿向心方向从门脉经肝血窦流向中央静脉。窦状细胞与相邻肝板中的肝细胞之间存在一个狭窄的裂缝,称为Disse间隙。肝细胞产生的胆汁在相邻肝细胞形成的胆管中以离心方向流动,并由门三联体的小叶间胆管收集。
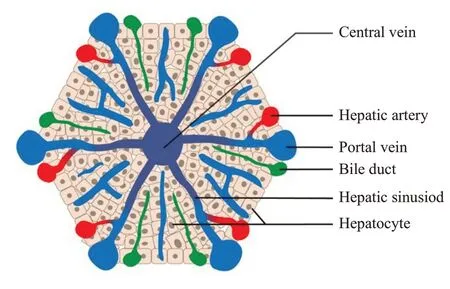
图1 肝小叶微血管分布示意图Fig.1 Distribution of microvessels in the hepatic lobule.The liver consists of numerous anatomical units called lobules.In each hepatic lobule,blood flows from the portal vein and the hepatic artery through the liver sinusoid toward the central vein.
尽管对门脉、肝血窦、中央静脉的血管分布认识已经非常清楚,但在肝脏病理变化中,除了肝血窦毛细血管化被特别关注,很少研究关注门脉与中央静脉的变化与功能。本综述将总结肝血管系统在慢性肝病中的研究进展,重点关注并讨论门脉、肝血窦、中央静脉三者的不同变化与功能。未来对这三种血管功能与调控机制的清晰解析将可能带来肝脏发育、再生及疾病调控领域的重大突破。
1 肝血窦毛细血管化与肝纤维化
肝纤维化是肝脏损伤修复过程中的瘢痕形成过程,表现为细胞外基质过度沉积,逐步发展为肝硬化乃至肝癌,导致机体死亡[4]。无论何种病因引起的慢性肝病,均以炎症和进行性纤维化为特征。肝脏特殊的微血管系统肝血窦缺乏基膜,由单层肝血窦内皮细胞(LSECs)围成管腔。LSECs上分布孔径大小为100~150 nm约占其表面积20%的穿孔,在血液和实质组织之间提供大分子和微颗粒的开放通道[5]。研究者很早就注意到,肝纤维化进展中伴随着LSECs开窗减少并在肝血窦管腔外侧出现有组织的基底层,这一过程称为肝血窦毛细血管化。大部分观念认为肝血窦毛细血管化是肝纤维化进展的继发效应和表型特征之一,即肝纤维化会促进肝血窦毛细血管化现象发生,同时肝血窦毛细血管化又会加重肝纤维化进程[6]。也有研究认为肝血窦毛细血管化先于肝纤维化的发生,是肝纤维化进展的看门人事件[7]。肝星状细胞激活一直被认为肝纤维化进展的关键调节者,其可通过细胞外基质、炎性细胞因子和氧化应激的变化而促进肝血窦毛细血管化[8]。反过来,LSECs也可调控肝星状细胞的活化,正常分化的LSECs可阻止肝星状细胞激活并促进其恢复静止状态,而毛细血管化的LSECs则会促进肝星状细胞活化[9]。在实验模型中,肝血窦去毛细血管化促进了轻度纤维化的消退[9,10]。
2 血管新生与肝纤维化
血管新生指从现有血管系统生成新血管,在各组织器官发育和损伤修复中均有发生,主要依赖多种生长因子和缺氧诱导[11]。血管结构紊乱是肝纤维化/肝硬化的重要病理特征,病理性血管新生在慢性肝病中被广泛描述,新血管的形成与不同慢性肝病典型的纤维化发展模式密切相关,最终导致肝硬化特有的异常血管结构[12-15]。研究发现,在肝纤维化进展中,血小板衍生生长因子、转化生长因子1、成纤维细胞生长因子、血管内皮生长因子(VEGF)、缺氧诱导因子、血管生成素I、肝特异性血管生成因子ANGPTL3、VEGF受体I型(Flt-1)和II型(Flk-1)以及血管生成素I受体Tie-2、整合素、Ephrin和其他多种参与细胞外基质重塑和血管生成的粘附分子的基因表达增加[16,17]。这表明血管新生在肝纤维化进程中被多维度调控,并且可能是促进纤维化发生的必要步骤。一些实验室证据表明,抑制血管生成可以抑制肝纤维化进展[18-22],然而也有证据表明,抑制血管生成会加重纤维化,促进血管生成反而会促进纤维化消融[23-25]。这些矛盾的报道很难得到合理解释,使得血管新生在肝纤维化中的作用变得扑朔迷离,靶向血管治疗肝纤维化因此陷入困境。究其原因,是因为肝纤维化中血管新生的相关研究比较粗糙,仅仅从整体组织观察血管的染色深浅和数量多少,缺少对血管新生的具体位置特征和来源的深入研究,无法区分这些“新生”血管哪些来源于门脉和中央静脉,哪些来源于肝血窦毛细血管化,哪些来源于骨髓前体血管内皮细胞。这些不同位置和来源的血管是否扮演不同的角色完全不清楚。
3 肝纤维化进程中的门脉与中央静脉的变化
一直以来,在慢性肝病进程中门脉血管和中央静脉血管的变化与功能缺乏关注。我们最近的研究发现,在肝纤维化进程中,除了已被广泛报道的肝血窦发生毛细血管化,一直被忽略的汇管区血管和中央静脉区血管也发生了不同变化,其中汇管区血管变少,中央静脉区血管增多(图2)[26]。这些变化发生在病变的非常早期,并持续加强。利用谷氨酰胺合成酶(GS)来标记肝小叶中央区可发现,在CCl4诱导肝纤维化模型中,GS阳性区在第1天即开始扩张,第4天出现相邻GS区连接在一起现象,提示此时便已发生了中央区桥接。相应的,中央区血管增多和肝血窦毛细血管化发生在第1天,汇管区血管减少则发生在第4天。胶原天狼星红染色显示胶原累积发生在第4天。在胆碱缺乏的高脂饮食诱导的非酒精性脂肪肝模型中也发现了类似现象。在第3周肝纤维化非常轻微的时候,汇管区血管减少、血窦毛细血管化和中央区血管增多均已发生。这表明,肝脏不同位置的血管均在肝纤维化中发挥非常重要的作用。从肝脏功能和结构恢复正常化的角度可以推导出直接而朴素的观点:汇管区血管增多抑制肝纤维化,肝血窦毛细血管化增多促进肝纤维化,中央静脉区血管增多促进肝纤维化。当然,目前支持这个推论的证据尚不充分。需要合适的谱系示踪小鼠能够分别特异性标记门脉血管、肝血窦、中央静脉血管,给出三者在肝纤维化进程中准确的数量和位置变化。这在目前难以做到,因为缺乏能够直接区分3种血管的标志物。更重要的是要明确汇管区和中央静脉区血管调控的不同机制,二者结构相似,变化却相反,其内在的调控机制解析将可能给出特异性调控其中一种血管的方法,为阐明二者的功能阐明提供直接证据。
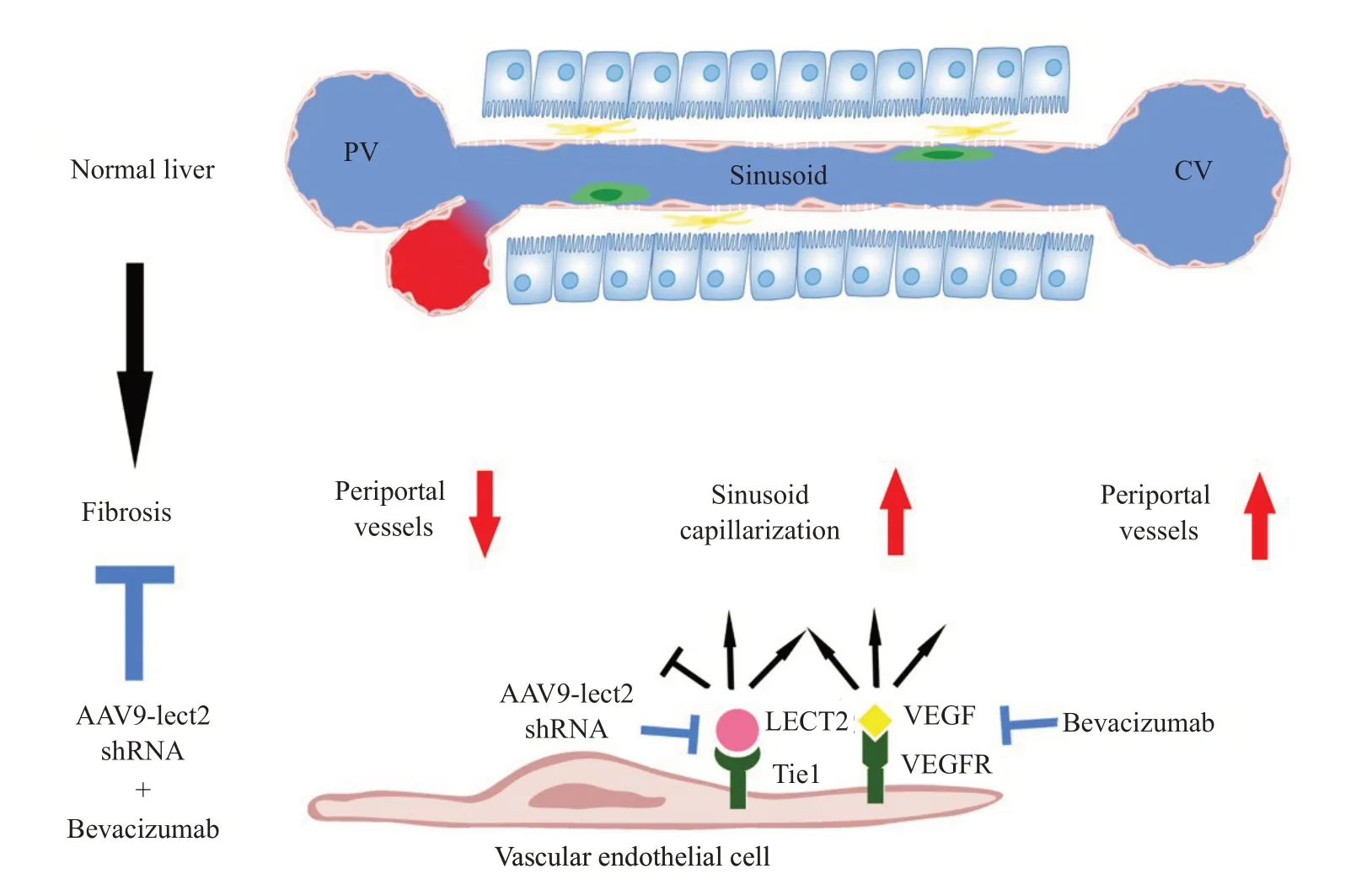
图2 肝纤维化不同血管发生不同变化示意图Fig.2 Schematic illustration of different changes in different blood vessels during fibrogenesis.During liver fibrogenesis,the portal vessels decrease,sinusoid capillarization increases,and the central vessels increase.The increase of portal vessels alleviates liver fibrosis;the increase of central vessels and the increase of sinusoid capillarization aggravates liver fibrosis.LECT2/Tie1 signaling decreases portal vessels,increases sinusoid capillarization,and increase central vessels.VEGF/VEGFR signaling increases portal vessels,increases sinusoid capillarization,and increases central vessels.The combination treatment of AAV9-LECT2-shRNA and bevacizumab significantly improves the therapeutic effects on liver fibrosis.CV:Central vein;PV:Portal vein.
4 一条新的血管调控通路:LECT2/Tie1信号
Tie(tyrosine kinase with immunoglobulin-like and epidermal growth factor homology)家族酪氨酸激酶受体Tie1与Tie2是血管内皮细胞特异表达的一次跨膜受体,二者可形成异源二聚体,在血管新生和稳态维持中发挥重要作用[27,28]。其中Tie2的功能和机制研究的比较成熟,血管生成素蛋白家族成员Ang1、Ang2、Ang4等都可与Tie2结合调控血管新生和稳态维持,在发育和多种疾病中扮演重要角色[29-31]。Tie1被报道与Tie2结合参与Ang-Tie2信号通路调控,它本身则不与任何血管生成素蛋白家族成员直接结合[32,33]。Tie1的功能非常重要,其基因敲除小鼠会导致中晚期胚胎发育因严重的出血和微血管异常而致死,但它的配体一直未被找到,二十多年来一直作为孤儿受体(orphan receptor)存在,其下游调控机制也不清楚[34-36]。我们最新研究发现,肝脏受损时,分泌型蛋白LECT2在血管周围肝细胞表达上调,与血管内皮细胞孤儿受体Tie1直接结合,促进Tie1/Tie2异源二聚体解离,诱导Tie2/Tie2同源二聚体增多,磷酸化增强,激活下游MAPK/PPAR信号通路,抑制蛋白酶MMPs表达,促进胞外基质蛋白分泌,上调血管内皮细胞粘连蛋白VE-cadherin,抑制汇管区新生,促进肝血窦毛细血管化,促进汇管区血管新生,促进肝纤维化进程[37]。令人吃惊的是,与VEGF/VEGFR信号同时促进汇管区和中央区血管新生增多不同,LECT2/Tie1信号抑制汇管区血管新生,促进中央区血管新生(图2)[26]。运用腺相关病毒携带Lect2-shRNA(AAV-Lect2-shRNA)阻断LECT2/Tie1信号可显著抑制小鼠肝纤维化,表明LECT2/Tie1信号是治疗肝纤维化的重要靶点[26,37]。此外,作为新的血管调控通路,LECT2/Tie1信号在其他组织器官损伤修复中是否发挥重要调控作用值得广泛和深入研究。
5 靶向血管治疗肝纤维化策略准则
既然肝小叶汇管区、肝血窦、中央区的血管在肝纤维化中发生了不同变化,那么简单地抑制或促进血管新生显然不能提供理想的血管修正。这可以解释上文提到的血管抑制剂或激活剂既可以抑制肝纤维化又可以促进肝纤维化的矛盾报道。比如,血管抑制剂抑制了肝血窦毛细血管化和中央静脉对抑制肝纤维化是有利的,然而它抑制了汇管区血管新生则促进肝纤维化进展;反过来血管激活剂促进了汇管区血管新生和肝血窦去毛细血管化对抑制肝纤维化是有利的,但它促进中央区血管新生则促进肝纤维化进展。药物最终的表现取决于因给药时机和剂量差异引起的三种血管不同的平衡偏向而不同。因此,针对靶向血管调控治疗肝纤维化,我们可以提出这样的准则:需同时满足促进汇管区血管新生,抑制肝血窦毛细血管化和抑制中央区血管新生,使血管正常化。很显然,单一的血管调节通路不足以同时满足血管新生的促进、抑制及血管重构的综合调控,需要多条血管调控通路在时间和空间上进行合理搭配才能达到理想要求。我们初步联合调控新发现的LECT2/Tie1信号和已广泛研究的VEGF/VEGFR信号通路来验证这个概念。发现LECT2/Tie1信号抑制剂AAV-Lect2-shRNA、VEGF/VEGFR 信号贝伐单抗(Bevacumab)、VEGF/VEGFR信号激活剂VEGF重组蛋白(rVEGF)均能一定程度抑制小鼠肝纤维化,其中AAV-Lect2-shRNA联合贝伐单抗和AAV-Lect2-shRNA联合VEGF重组蛋白大大提高了肝纤维化的治疗效果。鉴于AAV-Lect2-shRNA 联合VEGF 重组蛋白出现了较严重副作用,AAV-Lect2-shRNA联合贝伐单抗成为治疗肝纤维化的可推荐方法(图2)。在该治疗策略下,可观察到汇管区血管新生增加,肝血窦毛细血管化减少,中央区血管新生减少,符合靶向血管治疗准则,使肝脏血管正常化。进一步在时间和空间上组合多条血管调控通路以达到对3种血管进行理想调控是该治疗准则指导下的正确研究方向,而对3种血管精准调控机制的解析无疑将推进该准则的验证与实施。
6 总结与展望
肝脏病变中的血管变化是一个多年来比较沉寂的研究领域,但现在可以被重新激活。肝脏3种不同位置的3种微血管的不同变化、不同功能、不同调控机制蕴含着丰富的重要信息,很多新的问题有待解决。比如,除了慢性肝病,在肝脏发育和肝脏切除再生中,3种血管的变化规律和功能是什么?汇管区除了静脉,还有动脉和胆管,它们的变化规律和功能是什么?作为结构和功能相似的门静脉和中央静脉为什么变化不一致?其调控机制是什么?LECT2/Tie1信号对门静脉和中央静脉的调控方向相反,其原因是什么?肝纤维化/肝硬化中的血管来源(门脉、中央静脉、肝血窦、骨髓前体血管内皮细胞)的比例、位置分布规律和作用是什么?如何对它们进行分别调控?只有清楚解决这些问题,才有可能在时间和空间上精准调控这些异常的血管,使之正常化,达到最好的肝病治疗效果。从肝脏引申开来,其他组织器官,比如肺脏、肾脏、大脑等也拥有极具特色的微血管系统,从血管精准调控的角度来开展研究,而不是简单宽泛地促进或抑制血管新生,将有可能发现新的重要调控机制和干预策略。
