ALDH2 通过线粒体融合与裂变减轻脂多糖诱导的脑微血管内皮细胞屏障的损伤
2022-02-03王莎莎王丽娅田美惠刘忠义王佳慧
王莎莎,吕 恒,王丽娅,田美惠,高 洁,刘忠义,王佳慧,于 影
蚌埠医学院1生理学教研室,2心脑血管疾病基础与临床重点实验室,3流行病与卫生统计学教研室,安徽 蚌埠 233000
脓毒症相关性脑病(SAE),是脓毒症常见的一种神经系统并发症,其相关重要机制极为复杂,包括内皮屏障受损、线粒体的功能障碍、神经胶质细胞激活以及鞘磷脂代谢紊乱或异常等[1]。血脑屏障(BBB)[2]是维持中枢神经系统稳态的关键屏障系统,由周细胞、脑微血管内皮细胞(BMECs)、星形细胞末端足、基底板细胞、神经元和小胶质细胞组成。其中BMECs通过紧密连接蛋白构成内皮细胞屏障,对维持BBB的完整性尤为重要[3]。紧密连接蛋白主要由跨膜蛋白,如闭锁带状蛋白ZO、咬合蛋白Occludin、闭合蛋白Claudin以及连接黏附分子JAM等组成[4]。研究发现,脂多糖(LPS)诱导SAE产生活性氧ROS[5],引起细胞间紧密连接被破坏,ZO-1、Occludin蛋白表达下降,内皮细胞通透性增加,造成神经系统功能障碍[6]。
乙醛脱氢酶2(ALDH2)是位于线粒体基质内重要的醛类氧化酶,催化乙醛氧化为乙酸。值得注意的是,敲除ALDH2小鼠因脑内皮细胞内皮型一氧化氮合酶(eNOS)降低,导致氧化应激增加,引起内皮细胞紧密连接蛋白ZO-1和Occludin丢失,内皮屏障通透性增加[7];而在高氧诱导的人微血管内皮细胞采用ALDH2激动剂Alda-1干预,可通过抑制氧化应激的增加,恢复线粒体膜电位并改善线粒体功能[8]。
线粒体在生理状态下,处于不断地融合、分裂动态平衡中[9]。线粒体的融合蛋白家族成员包含视神经萎缩蛋白OPA1、线粒体融合蛋白Mfn2;线粒体的分裂蛋白包括动力相关蛋白Drp1、线粒体分裂蛋白Fis1等。已有研究表明,线粒体融合和分裂参与了多种细胞活动,如氧化应激[10-12]、细胞凋亡[13-15]、吞噬有丝分裂[15-17]等。抑制Drp1可以逆转线粒体形态变化,降低ROS水平,明显改善了BBB破坏和脑水肿[18]。而Mfn2通过抑制炎症反应,稳定细胞间连接,维持内皮屏障的完整性[19],这表明线粒体融合和分裂与内皮细胞屏障存在一定联系。在心肌细胞中研究显示[20],ALDH2可以通过调控线粒体分裂蛋白Drp1,抑制线粒体分裂发挥保护作用。采用线粒体分裂蛋白抑制剂可减弱LPS诱导的脓毒症时,肺脏[21]、脑组织[22]氧化应激的产生,改善线粒体的功能。然而,有关ALDH2改善LPS导致的脑微血管内皮细胞损伤,相关报道较少。特别是ALDH2能否通过调控线粒体融合和分裂,抑制氧化应激的增加,进而减轻内皮细胞通透性?具体机制还不清楚。故本实验通过给予ALDH2 激动剂Alda-1,观察ALDH2 对LPS诱导脑微血管内皮细胞损伤的影响,并探讨线粒体融合和分裂在内皮屏障中的作用。
1 材料和方法
1.1 材料
小鼠脑微血管内皮细胞(Procell);DMEM高糖培养基(Hyclone);胎牛血清(Hyclone);LPS(Sigma);Alda-1(MCE);Dihydroethidium 和DAPI(碧云天);CCK8 检测细胞增殖毒性试剂(Biosharp);丙二醛(MDA)和超氧化物歧化酶(SOD)氧化应激检测试剂盒(南京建成);FITC-Dextran(Sigma);DHE超氧化物阴离子荧光探针(碧云天);ALDH2单克隆抗体、ZO-1多克隆抗体、Occludin单克隆抗体、OPA1多克隆抗体和Drp1多克隆抗体(Abcam);Mfn2多克隆抗体和Fis1单克隆抗体(武汉三鹰);辣根过氧化物酶标记的羊抗兔二抗(Biosharp)。
1.2 方法
1.2.1 细胞培养 脑微血管内皮细胞加入浓度为25 mmol/L的DMEM培养基,其中包括10%的胎牛血清和双抗(即青霉素和链霉素),在实验操作过程中,按照约以3×104/cm2的密度,接种到25 cm2的培养瓶中,最后放置于温度为37 ℃、含5%CO2的细胞培养箱中进行培养。待细胞的密度长至约80%~90%左右时,将细胞进行传代(1传2),进行后续的实验。
实验分组:实验分为3组,即(1)对照组:将脑微血管内皮细胞培养在DMEM完全培养基;(2)LPS损伤组(LPS):LPS加入在DMEM完全培养基中,24 h后处理细胞;(3)LPS+ALDH2激动剂Alda-1组(LPS+Alda-1):Alda-1药物预先处理1 h,随之将药物LPS加入DMEM完全培养基中干预24 h。
1.2.2 CCK-8 检测细胞活性 将bEnd.3 细胞密度以6000/孔,接种于96 孔板,分别加入LPS(0.1、0.5、1、5 μg/mL)和Alda-1(10、20、40、80、100 μmol/mL)药物处理24 h后,每个孔加入含有110 μL 的CCK-8稀释液,放置摇床上匀速混匀5 min,在培养箱中避光孵育1 h,最后测定各组的A值(波长450 nm处)。
1.2.3 TEER电阻值的测定 每孔接种细胞2×105/mL,细胞贴壁生长48 h至单层融合后,利用ESR-电阻仪测量细胞TEER电阻值;在测量时,将电极插入小室中(上短下长),均取每孔细胞不同方向的3个点进行检测。TEER=(内皮细胞电阻值-基础电阻值)×Transwell上室滤膜的底面积。
1.2.4 FITC-Dextran细胞通透性检测 将脑微血管内皮细胞按2×105/cm2接种于小室的滤膜上,待bEnd.3细胞待汇合成单层后,LPS和Alda-1药物干预细胞24 h后,弃去小室中的培养基,下室加入无FITC 标记的葡聚糖的无血清DMEM 600 μL,上室中加入无血清DMEM配制的0.5 mg/mL FITC-Dextran 100 μL,孵育1 h后,在暗室下分别吸取各组上室和下室的溶液,各100 μL/孔,用多功能酶标仪检测其荧光的A值(即激发的波长为485 nm、发射的波长为520 nm)。FITC-Dextran通透性的大小,用通透系数(Pa)表示,计算公式为:Pa=[A]/t×1/A×V/[L],其中[A]表示下室的荧光值,t为FITC-Dextran的孵育时间(以秒计算为单位),A为FITC-Dextran滤过的面积(以cm2计算),V为下室无血清培养基体积,[L]代表上室荧光的A值。实验结果均以Pa%表示,即Pa%=(检测组Pa值/对照组Pa值)×100%。
1.2.5 SOD活性和MDA含量的测定 取药物干预后的细胞上清液于新的1.5 mL于EP管中,接下来进行离心(3000 r/min 10 min),取适量于新的EP管中,按照试剂盒的说明书操作步骤,检测脑内皮细胞MDA的含量和SOD活性。
1.2.6 细胞免疫荧光ROS测定 将细胞接种于6孔板,按以1×105/孔的细胞密度接种培养,细胞生长至合适的密度后,LPS、Alda-1单独或联合药物干预24 h后,弃去原有的培养基并用PBS清洗,随后用4%的多聚甲醛固定细胞(30 min),清洗细胞3遍,5 min/遍;应用DHE(超氧化物阴离子荧光探针)试剂按5 μmol/L 的浓度在37 ℃水浴锅中孵育40 min,之后清洗细胞;接下来,DAPI染胞核5 min(5 μg/mL,37 ℃)左右并清洗细胞3遍,放置避光的盒子中,利用蔡司荧光倒置显微镜观察细胞内荧光强度的表达变化,并及时拍照保存。
1.2.7 Western blot实验检测各蛋白表达 细胞药物干预24 h后,使用PBS清洗细胞,随后加入提前配制好的裂解液和蛋白酶抑制剂(比例为100∶1)的混合液,上下左右摇晃培养皿,在冰上裂解5 min后,用手持型细胞刮刀刮取脑内皮细胞,然后用1 mL量程的移液枪,收集细胞悬浮液至新的EP管中,振荡离心,结束后吸取各组的蛋白上清液(200 μL EP管)。蛋白浓度检测后,经计算得出各组蛋白的上样体积。取各组适量的蛋白上样、电泳、转膜,最后用牛奶封闭PVDF膜2 h。封闭结束后将条带用TBST洗膜3遍,10 min/遍,随后将PVDF膜分别与ALDH2(1∶2000)、ZO-1(1∶1000)、Occludin(1∶1000)、OPA1(1∶1500)、Mfn2(1∶8000)、Drp1(1∶1000)、Fis1(1∶3000)、GAPDH(1∶10 000)等一抗,4 ℃冰箱的摇床过夜;隔天上午用配制好的TBST洗膜3遍,10 min/遍,洗膜结束后,孵育蛋白二抗(1∶10 000),在室温条件下,孵育1.5 h,最后洗膜并曝光。将显影液与各条带进行充分的接触,即在盒子中静置1 min后,使用Tanon-5200 Multi 化学发光成像系统进行图像采集,并用Image J软件对目的和内参条带,进行灰度值分析。
1.2.8 统计学分析 将所有的数据以均数±标准差表示,利用GraphPad Prism 8.0统计软件,多组间比较采用单因素方差分析。P<0.05时表明差异有统计学意义。
2 结果
2.1 细胞活性变化
2.1.1 药物浓度确定 CCK8结果显示,LPS药物干预24 h后,与Con组相比,随着LPS药物浓度的不断增高,各药物浓度的细胞活性逐渐下降(P<0.001),其中LPS浓度为1 μg/mL时,细胞活性最低(P<0.001),细胞损伤较强,故选取LPS药物浓度为1 μg/mL进行实验(图1A)。加入Alda-1干预24 h后,与Con组相比,随着Alda-1药物浓度的不断增高,细胞活性均明显升高(P<0.001);结合我们实验室前期研究基础,选取20 μmol/mL 的Alda-1进行后续实验(图1B)。
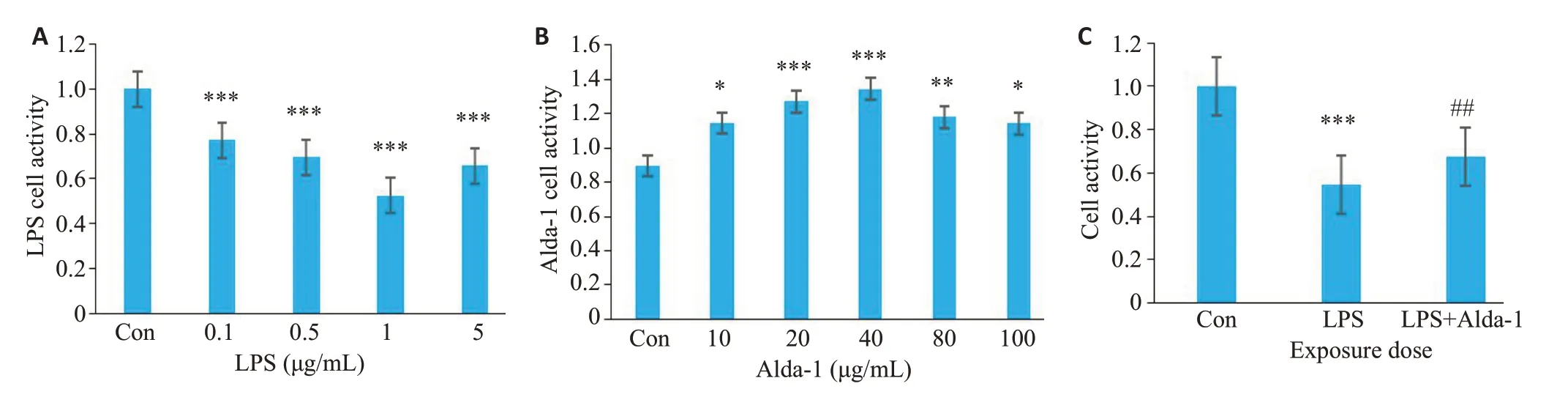
图1 各组脑微血管内皮细胞细胞活性Fig.1 Viability of brain microvascular endothelial cells treated with different concentrations of LPS (A),Alda-1 (B) and both (C).Data are presented as Mean±SD(n=6).*P<0.05,**P<0.01,***P<0.001 vs Con;##P<0.01 vs LPS.
2.1.2 各组内皮细胞活性的变化 CCK-8的结果显示(图1C),与对照组相比,LPS 组细胞活性下降(P<0.001)。与LPS组相比,LPS+Alda-1组细胞活性增高(P<0.01)。
2.2 ALDH2对LPS诱导脑微血管内皮细胞通透性的影响
采用TEER法检测细胞电阻值,结果如图2A所示,与Con组相比,LPS组电阻值显著降低(P<0.05);而使用ALDH2激动剂Alda-1预处理后,LPS+Alda-1组电阻值升高(P<0.001)。进一步采用FITC-Dextran法观察荧光渗漏A值变化,结果如图2B所示,与Con组相比,荧光渗漏A值明显增高(P<0.05);而使用ALDH2激动剂Alda-1 预处理后,LPS+Alda-1 组荧光值降低(P<0.001)。
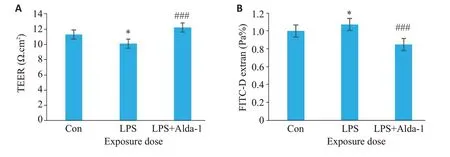
图2 ALDH2对LPS诱导脑微血管内皮细胞通透性的影响Fig.2 Effects of ALDH2 on LPS-induced increase of permeability of brain microvascular endothelial cells.TEER (A) and FITC-dextran permeability (B) of the cells.Data are presented as Mean±SD(n=6).*P<0.05 vs Con;###P<0.001 vs LPS.
2.3 ALDH2对LPS诱导脑微血管内皮细胞氧化应激的影响
采用MDA和SOD试剂盒检测氧化应激变化,如图3所示,与Con相比,LPS组MDA含量的表达明显升高(P<0.01),然而SOD 的活性表达降低(P<0.001);与LPS组相比,LPS+Alda-1组结果反之,即MDA含量的表达明显下降(P<0.001),而SOD活性表达显著升高(P<0.01)。

图3 各组细胞MDA、SOD水平比较Fig.3 Comparison of MDA(A)and SOD(B)levels in the cells.Data are presented as Mean±SD(n=6).**P<0.01,***P<0.001 vs Con,##P<0.01,###P<0.001 vs LPS.
2.4 ALDH2对LPS诱导脑微血管内皮细胞内活性氧ROS的影响
免疫荧光结果如图4A所示,与Con相比,LPS组胞浆ROS的平均荧光强度增强(红色,图4B)(P<0.01);与LPS组相比,LPS+Alda-1组胞浆ROS的平均荧光强度弱(红色,图4B)(P<0.05)。
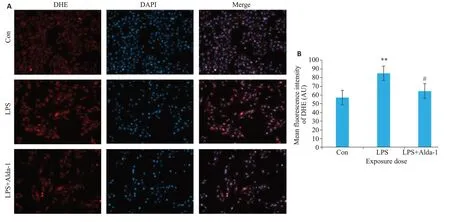
图4 各组脑微血管内皮细胞ROS免疫荧光染色Fig.4 Immunofluorescence staining of ROS in the cells.A:Immunofluorescence staining of ROS(red)and DAPI(blue).B:Quantitative analysis of ROS fluorescence intensity(Mean±SD,n=5).**P<0.01 vs Con;#P<0.05 vs LPS.
2.5 ALDH2 对LPS 诱导脑微血管内皮细胞中OPA1、Mfn2、Drp1和Fis1蛋白表达的影响
采用免疫印迹实验检测线粒体融合蛋白和线粒体分裂蛋白表达的变化,结果如图5所示:与Con组相比,LPS 组OPA1 蛋白(P<0.01)和Mfn2 蛋白(P<0.001)表达明显降低,Drp1(P<0.001)和Fis1蛋白表达均显著增高(P<0.01);而与LPS组相比,LPS+Alda-1组OPA1蛋白(P<0.05)和Mfn2蛋白(P<0.001)表达升高,Drp1蛋白(P<0.001)和Fis1蛋白(P<0.05)表达降低。
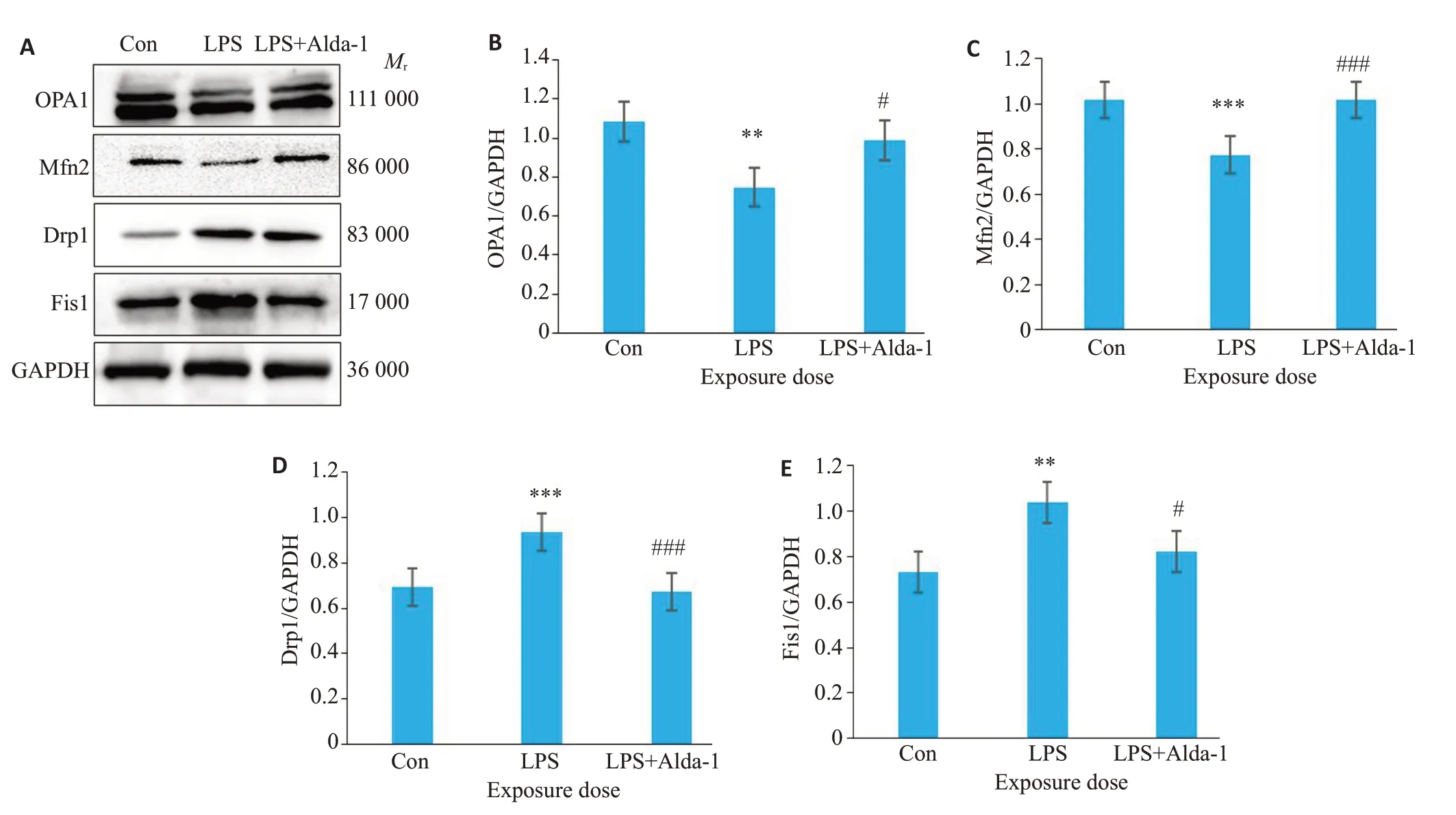
图5 各组bEnd.3脑微血管内皮细胞OPA1、Mfn2、Drp1和Fis1蛋白水平变化Fig.5 Expression of OPA1,Mfn2,Drp1 and Fis1 proteins in bEnd.3 cells in each group.Western blots of OPA1,Mfn2,Drp1,Fis1 and GAPDH(A).OPA1(B),Mfn2(C),Drp1(D),and Fis1 (E) protein levels are normalized by GAPDH levels (Mean±SD, n=5).**P<0.01,***P<0.001 vs Con;#P<0.05,###P<0.001 vs LPS.
2.6 ALDH2对LPS诱导脑微血管内皮细胞ALDH2和紧密连接蛋白ZO-1、Occludin蛋白表达的影响
免疫印迹实验检测ALDH2、紧密连接蛋白ZO-1和Occludin表达的变化,结果如图6所示:与Con组相比,LPS组ALDH2蛋白表达降低明显(P<0.001),与此同时,ZO-1蛋白(P<0.001)和Occludin蛋白(P<0.001)表达均降低显著;使用ALDH2激动剂Alda-1预处理后,LPS+Alda-1组ALDH2(P<0.01)、ZO-1(P<0.01)和Occludin(P<0.05)蛋白表达均明显升高。
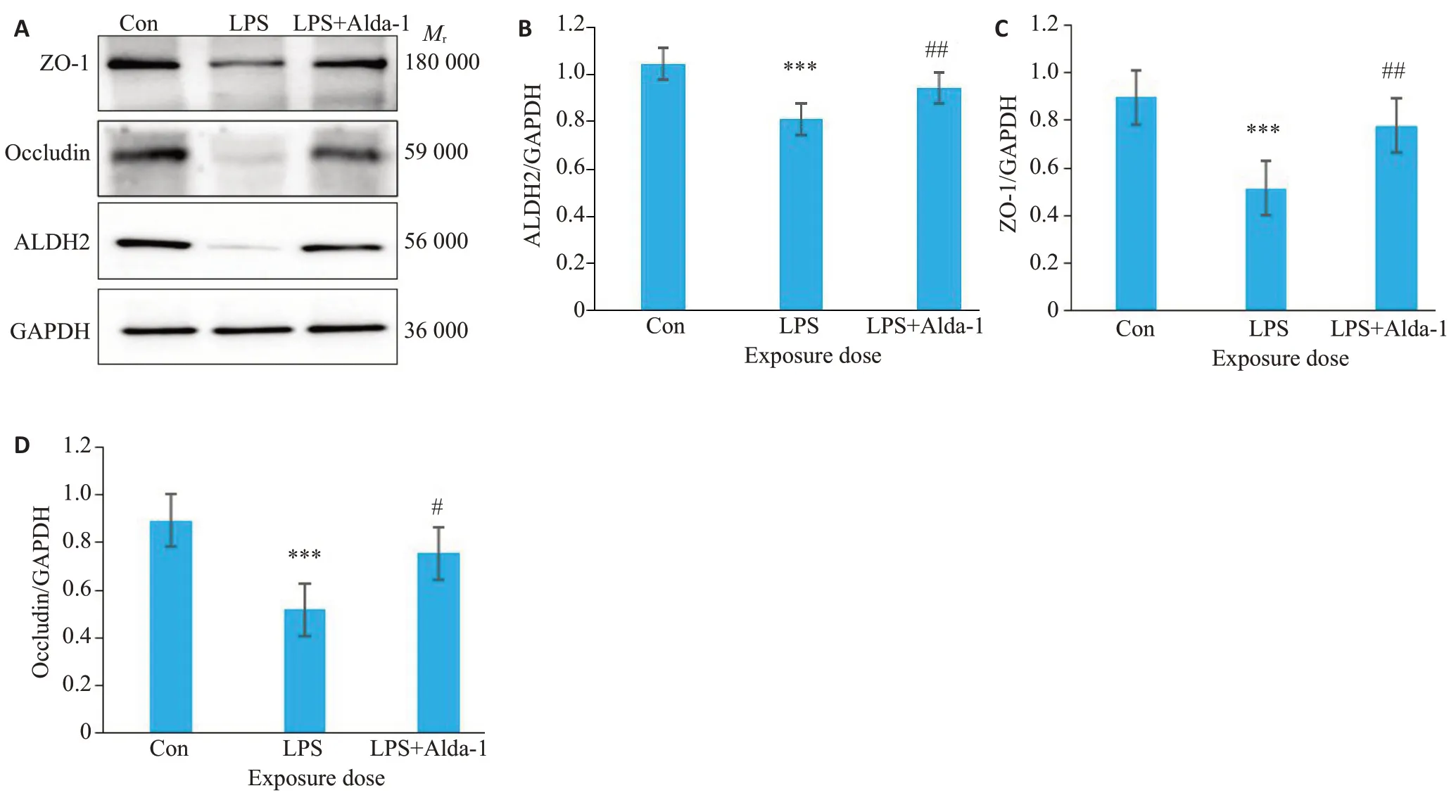
图6 各组ALDH2、ZO-1、Occludin蛋白表达情况Fig.6 Expression of ALDH2,ZO-1,and occludin protein in each group.A:Western blots of ZO-1,occludin and GAPDH.B-D:ALDH2(B),ZO-1 (C),Occludin(D)protein levels normalized by GAPDH levels(Mean±SD,n=5).***P<0.001 vs Con,#P<0.05,##P<0.01 vs LPS.
3 讨论
脑微血管内皮细胞之间的紧密连接是血脑屏障的基本结构,是维持脑微环境内稳态的第一道屏障[23]。而紧密连接破坏和内皮损伤是LPS诱导血脑屏障破坏的主要机制[24,25]。当ROS分泌和清除之间的平衡被打破时,ROS过度积累就会诱导氧化应激增加[26],进而破坏内皮屏障的完整性。本研究采用LPS诱导脑微血管内皮细胞损伤模型,结果显示:与Con组相比,TEER电阻值降低而FITC-Dextran荧光渗漏值升高;氧化应激因子MDA含量增高而SOD活性下降;ROS荧光强度表达增强;ZO-1和Occludin内皮屏障紧密连接蛋白表达明显降低,提示LPS可引起脑微血管内皮细胞损伤显著,促进氧化应激产生,导致细胞通透性增加。
线粒体是细胞的“动力工厂”,也是真核动物细胞生物氧化、能量转换的主要场所。生理状态下,细胞内线粒体处于不断地融合与分裂平衡中,对维持细胞功能起到重要作用[27,28]。已有研究表明线粒体融合和分裂是影响内皮屏障的关键因素之一[22]。抑制线粒体融合或线粒体过度分裂会造成线粒体功能紊乱,导致细胞内ROS产生,破坏线粒体膜电位[29],进一步增加血管内皮细胞膜通透性,使血管内皮屏障功能遭到损害[30]。过表达OPA1能够促进线粒体的融合,抑制氧化应激,减少细胞凋亡,减弱内皮细胞的损伤程度[31]。而体内缺失线粒体融合蛋白Mfn2,会导致线粒体稳态破坏,血管内皮细胞通透性增加,影响内皮屏障的完整性[19]。此外,还有研究发现,在脑微血管内皮细胞和星形胶质细胞共同培养的体外血脑屏障细胞模型中[22],给予线粒体分裂蛋白Drp1抑制剂,可明显降低线粒体ROS水平,改善线粒体的膜电位,降低LPS诱导的细胞通透性;同时体内实验[22]也表明分裂蛋白Drp1抑制剂可以上调脑组织中ZO-1和Occludin蛋白的表达。随后Haileselassie等[22]研究发现,抑制Drp1-Fis1相互作用,可以减轻LPS诱导的原代脑微血管内皮细胞通透性,促进紧密连接蛋白表达,进而保持血脑屏障的完整性。与此结果相似的是,我们采用LPS刺激脑微血管内皮细胞损伤后,线粒体融合蛋白OPA1、Mfn2表达下降,分裂蛋白Drp1、Fis1表达升高,紧密连接蛋白ZO-1和Occludin表达降低,说明LPS抑制线粒体融合、促进线粒体分裂并且破坏内皮屏障。
已有研究表明,ALDH2可以通过代谢4-羟基壬稀醛(4-HNE)和MDA等毒性醛类物质,发挥间接抗氧化的作用,拮抗ROS生成,减轻乙醛及代谢产物对细胞的损伤[32]。作为ALDH2的激动剂Alda-1,可通过上调内皮细胞紧密连接蛋白及粘附连接蛋白的表达,改善内皮屏障损伤[33]。Alda-1通过抗氧化作用清除机体内ROS,抑制脂质过氧化的产生,促进细胞氧化还原平衡[34]。此外,线粒体ALDH2在防止4-HNE的积累、氧化应激、细胞凋亡和线粒体膜损伤等方面发挥着重要作用。激动ALDH2可以明显抑制肺微血管内皮细胞免受氧化应激,改善线粒体形态结构与功能,在急性肺损伤中发挥保护作用[8]。为进一步分析ALDH2是否通过调控线粒体融合和分裂减轻LPS诱导脑微血管内皮屏障损伤,本研究使用Alda-1进行干预,结果显示:与LPS组相比,LPS+Alda-1组TEER电阻值升高,FITC-Dextran荧光渗漏值下降,MDA含量降低,SOD活性升高,ROS释放减少,内皮紧密连接蛋白ZO-1和Occludin表达增高,提示激动ALDH2可以减轻脑微血管内皮屏障损伤和氧化应激反应的发生。同时,我们通过Western blot实验还测定线粒体融合和分裂蛋白的表达情况,结果显示:ALDH2蛋白表达增高时,线粒体融合蛋白Mfn2、OPA1升高,分裂蛋白Fis1、Drp1表达减少。说明ALDH2可能通过促进线粒体的融合和抑制线粒体的分裂,减少氧化应激的产生,减轻对脑内皮屏障的破坏。
综上所述,本研究发现ALDH2 预处理可以抑制ROS的释放,减轻LPS诱导脑微血管内皮细胞屏障的损伤,其机制可能与维持线粒体融合和分裂平衡有关,二者之间相关机制还有待进一步探讨。
