我国不同产地党参药材中糖类成分比较分析
2022-02-02黄延盛张欣刘耀军胡流云王长虹王峥涛黄晓君
黄延盛,张欣,刘耀军,胡流云,王长虹,王峥涛,黄晓君
(1.无限极(中国)有限公司,广东 广州 510623;2.上海中药标准化研究中心,上海 2012033.南昌大学a.食品科学与技术国家重点实验室;b.中国-加拿大食品科学与技术联合实验室c.江西省生物活性多糖实验室,江西 南昌 330047)
党参属(Codonopsis)隶属桔梗科(Campanulaceae),全属共40余种,我国有39种,野生党参主要分布于西南各省区,栽培党参则主产于西北、华北地区[1]。本属植物党参(Codonopsispilosula(Franch.)Nannf.)、素花党参(C.pilosulavar.modesta(Nannf.)L.T.Shen.)及川党参(C.tangshenOliv.)为2010版《中国药典》收载品种[2],其干燥根作为党参入药,具有补中益气,健脾益肺之功效[3]。用于脾肺虚弱、气短心悸、食少便溏、虚喘咳嗽、内热消渴等症[4-8]。党参属大多数种类的根部都具有药用价值,一些种类如管花党参(C.tubulosaKom.)、球花党参(C.subglobosaSrnith.)、灰毛党参(C.canescensNannf.)、新疆党参(C.clematidea(Schrenk)Clarke.)等在临床上也作为党参使用[9]。
党参中含有单糖、低聚糖和多糖等糖类物质,单糖有果糖,低聚糖有菊糖等[10-12]。党参多糖同其他药用植物多糖一样,具有广泛的药理作用,主要包括调节机体免疫、清除自由基和造血等作用,其中尤以党参多糖的免疫调节作用研究得较多和较深入,主要表现为增强免疫作用,与党参补中益气、健脾益肺之功效相符[13-14]。从化学组成可见,素花党参多糖由甘露糖、鼠李糖、半乳糖醛酸、葡萄糖、半乳糖和阿拉伯糖6种单糖组成,HPLC法测得其物质的量比为0.07:0.22:1.00:4.38:0.81:1.40,主要含有葡萄糖、阿拉伯糖和半乳糖醛酸[15]。GC法分析表明,党参粗多糖的单糖组成为阿拉伯糖、葡萄糖、半乳糖、半乳糖醛酸、木糖,物质的量比依次为1.0:10.5:2.0:1.4:1.0[16]。另一研究结果表明,党参中性杂多糖COP-Ⅰ的单糖组成为甘露醇、果糖、葡萄糖,物质的量比为1:0.05:1.56;党参酸性杂多糖COP-Ⅱ的单糖组成为甘露醇、果糖、葡萄糖和半乳糖,物质的量比为1:0.11:1.07:0.37。由此可以看出,不同品种的党参多糖的组成和物质的量比均存在一定的差异[17]。这些研究为党参多糖的结构分析奠定了基础。党参多糖含量高低可以初步反映党参药材质量的好坏,是鉴别党参药材的方法之一。
目前,对于党参中多糖含量测定方法已有很多,多采用苯酚-硫酸法测定其多糖含量,该方法具有操作简单、快速、重复性好、显色后稳定性较好等优点,但对有色样品结果易偏高[18]。多糖可用与其组成结构相近的多糖作标准曲线,但更多的情况下是以相应的单糖作标准。本研究通过测定党参的多糖含量、单糖组成,以及建立党参中5种糖类成分的HPLC-ELSD定量分析方法,并通过测定35批党参中5种糖类成分含量,为党参质量标准中糖类成分含量测定项的完善提供参考。
1 材料与方法
1.1 材料与试剂
党参药材,35批党参主要来源于甘肃、贵州、山西、湖北、四川等党参主产区,包括2015版《中国药典》收录的3种党参药材:党参、素花党参、川党参。由上海中药标准化研究中心吴立宏研究员鉴定,其性状与2015年版《中国药典》所规定的党参药材一致,鉴定为正品。
无水葡萄糖、苯酚、浓硫酸、三氟乙酸、冰醋酸、乙酸酐、盐酸、硼氢化钠、甲醇、甲苯、氯仿(分析纯,国药集团化学试剂有限公司);三乙胺、乙腈、甲醇、甲酸(色谱纯,美国Fisher公司);D-(+)-葡萄糖、D-果糖、蔗糖(分析纯,上海源叶生物科技有限公司);蔗果三糖、蔗果四糖(分析纯,上海西宝生物药业有限公司)。
1.2 仪器与设备
KQ-250DB数控超声波清洗仪(江苏昆山市超声仪器有限公司);高速离心机(美国BECKMAN公司);旋转蒸发仪N-1001、OSB-2000水浴锅(日本EYELA公司);BP211D电子分析天平(德国Sartourius公司);MILLI-Q超纯水制备仪(美国Millipore公司);Agilent1100高效液相色谱仪;Agilent GC-MSD7890B气质联用色谱仪(美国Agilent公司)。
色谱柱:X-Bridge Amide C18色谱柱(4.6 mm×250 mm,3.5 μm)(美国Waters公司)
1.3 方法
1.3.1 样品前处理
每个产地党参样品中挑选200 g无霉变、外观良好的党参用粉碎机粉碎,过药典标准3号筛(筛孔孔径为0.355 mm)备用。
1.3.2 党参多糖含量测定
1.3.2.1 标准液的配制
精密称取经105 ℃干燥至恒重的无水葡萄糖900 mg置100 mL容量瓶中,加水溶解并稀释至刻度,摇匀;精密量取该溶液1.0 mL置100 mL容量瓶中,加水溶解并稀释至刻度,摇匀,即得90.0 μg·mL-1的葡萄糖溶液。
1.3.2.2 葡萄糖标准曲线的绘制
精密量取对照品溶液0.2,0.4,0.6,0.8,0.9,1.0 mL,分别置于10.0 mL具塞试管中,各加水补至1.0 mL,精密加入质量分数为5%的苯酚溶液1.0 mL(临用配制),摇匀,再精密加浓硫酸5.0 mL,摇匀,至沸水浴中加热30 min后取出,迅速置于冰水浴中冷却5 min,空白对照以1.0 mL蒸馏水代替葡萄糖对照品溶液,照紫外-可见分光光度法,在482 nm下测定吸光度,以吸光度(x)为纵坐标,质量浓度(y)为横坐标,进行线性回归,得回归方程:y=0.009x-0.008 6,R2=0.998 6。结果表明,葡萄糖质量浓度在18.01~90.05 μg·mL-1范围内呈良好的线性关系。
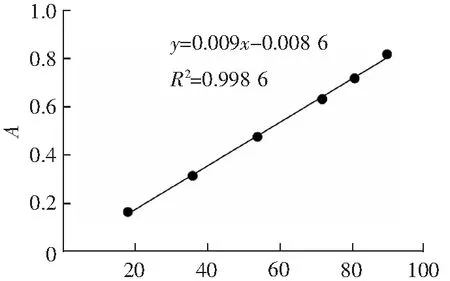
ρ/(μg·mL-1)图1 标准曲线Fig.1 Standard curve
1.3.2.3 样品前处理
取党参粉末1.0 g,精密称定,加水200 mL,加热回流2.0 h,放冷,转移至250 mL容量瓶,用少量水分次洗涤容器,洗涤液并入容量瓶中,加水至刻度,摇匀,过滤。精密量取续滤液3.0 mL至离心管中,加入无水乙醇15.0 mL,摇匀,冷藏1.0 h,取出,离心15 min(转速为4 000 r·min-1),弃去上清液,沉淀加体积分数为80%的乙醇洗涤2次,每次8.0 mL,离心,弃去上清液,沉淀加热水溶解,转移至25 mL容量瓶中,放冷,加水至刻度,摇匀,即得。
1.3.2.4 多糖含量的测定
精密量取样品溶液1.0 mL,按照“葡萄糖标准曲线的绘制”的方法测定其吸光度,计算出不同批次党参多糖含量。
1.3.3 党参多糖的单糖组成分析
1.3.3.1 党参多糖的提取与精制
分别取10.0 g党参(S7、S21、S31)药材粗粉,精密称定,置于圆底烧瓶中,加入250 mL石油醚脱脂,回流提取2.0 h过滤,药渣挥尽石油醚后,以80%乙醇500 mL浸渍过夜,85 ℃回流提取2次,每次1.5 h,过滤,药渣加蒸馏水浸渍1.0 h后,100 ℃回流提取60 min,过滤,再用500 mL蒸馏水100 ℃提取30 min,过滤,合并滤液,减压浓缩至150 mL,与等体积Sevage试剂(V(三氯甲烷):V(正丁醇)=4:1)混合,振摇,以除去蛋白质。加体积分数为95%的乙醇使含醇量达80%(V/V)冰箱静置过夜。过滤,残渣先后用95%乙醇、无水乙醇、乙醚、丙酮依次多次洗涤,冻干,即得精制党参多糖0.72 g。得率为7.2%。其中S7为纯白色疏松粉末,S21为白色粉末,S31为灰白色粉末。
1.3.3.2 多糖水解及单糖衍生化产物的制备
称取3.0 mg精制党参多糖,转入10 mL安瓿瓶中,各加入3.0 mL 2 mol·L-1三氟乙酸溶解,拉丝封口,120 ℃油浴中水解反应2.0 h,取出转移到心形瓶,减压蒸干,加甲醇蒸干3次,以完全除尽三氟乙酸;残余物加入50.0 mg NaBH4和2.0 mL水,混匀后室温还原反应过夜(还原8.0 h以上即可);加适量冰醋酸以除去过量的NaBH4,减压浓缩至黏稠液体;加入冰醋酸-甲醇(体积比1:5)3.0~5.0 mL,蒸干3次,再加乙腈蒸干2次,得到白色粉末,放入烘箱105 ℃加热5 min以除去水分,快速加入3.0 mL乙酸酐,置101 ℃烘箱中乙酰化反应1.0 h,取出,加适量水溶解静置10 min,加2.0~3.0 mL氯仿用水萃取3次,吸出上层水层,取出氯仿层,用无水硫酸钠干燥浓缩至0.5 mL进行GC-MS分析(适量棉花堵住1.0 mL枪头,用无水硫酸钠填充,让样品溶液滤过枪头流入气相小瓶)。标准品与样品同时处理,进样。
1.3.3.3 气相条件
GC-MS程序升温条件:起始温度120 ℃,以2 ℃·min-1升温至180 ℃,保温4 min,再以1 ℃·min-1升温至200 ℃,最后以3 ℃·min-1升温至250 ℃,保持5 min;进样口温度为250 ℃;氦气载气,流速为1 mL·min-1。单糖标准品与样品进行图谱对照。提取特征峰为115m/z。
1.3.4 党参中单糖及低聚果糖含量测定
1.3.4.1 对照品溶液的制备
分别称取D-果糖、D-葡萄糖、蔗糖、蔗果三糖、蔗果四糖对照品适量,精密称定,加入60%甲醇(V/V)制成每毫升含D-果糖0.607 4 mg、D-葡萄糖0.504 8 mg、蔗糖0.590 3 mg、蔗果三糖0.561 1 mg、蔗果四糖0.685 7 mg的溶液,即得。
1.3.4.2 样品前处理
取本品细粉约0.05 g,精密称定,置100 mL具塞锥形瓶中,精密加入60%甲醇10.0 mL,称定质量,超声处理(功率250 W,频率40 kHz)60 min,放冷,再称定质量,用60%甲醇补足减失的质量,摇匀,过滤,精密量取滤液2.0 mL,置10 mL容量瓶中,加甲醇至刻度,摇匀,过滤取滤液,即得。
1.3.4.3 色谱条件
Waters X-Bridge Amide C18色谱柱(4.6 mm×250 mm,3.5 μm);以乙腈(A)-甲醇(B)-0.05%三乙胺水(C)为溶剂按表2进行梯度洗脱,流速1.0 mL·min-1,柱温40 ℃,蒸发光散射检测器采用撞机器关(impactor off)的模式,漂移管温度控制在100 ℃,气体流速1.5 mL·min-1。
2 结果与分析
2.1 党参多糖含量测定
2.1.1 最优反应温度和反应时间的筛选
2.1.1.1 反应温度的考察
取供试品溶液共4份,每份3个平行样,经苯酚-浓硫酸显色后,分别在40,60,80,100 ℃保温0.5 h,考察吸光度值变化。结果表明接近沸水浴的温度,吸光度越接近,即此阶段反应温度为最佳反应温度。最终反应温度确定为100 ℃。
2.1.1.2 反应时间的考察
取供试品溶液5份,每份3个平行样,经苯酚-浓硫酸显色后,分别在不同反应时间10,20,30,45,60 min保温后,考察吸光度变化。结果表明10~60 min之间吸光度无明显变化,即反应时间对吸光度无明显影响。故最终反应时间取中间时间点为30 min。

表2 反应时间考察表(n=3)Tab.2 Reaction time(n=3)
2.1.2 方法学考察结果
2.1.2.1 精密度试验结果
精确量取样品1.0 mL,按照“葡萄糖标准曲线的绘制”的方法测定其吸光度,进行5次平行测定。结果的RSD为0.006 9%,表明仪器精密度良好。

表3 精密度试验Tab.3 Precision experiment
2.1.2.2 重复性试验结果
精确量取1.0 mL党参样品,平行5份,按照“葡萄糖标准曲线的绘制”的方法测定其吸光度,结果RSD为4.35%,表明方法重复性良好。

表4 重复性试验Tab.4 Repeatability experiment
2.1.2.3 稳定性试验结果
精确量取样品1.0 mL,然后按照“葡萄糖标准曲线的绘制”的方法测定其吸光度,分别在0,10,20,30,45,60,90,120 min时测定吸光度值。结果表明供试样品溶液在2.0 h内是稳定的。
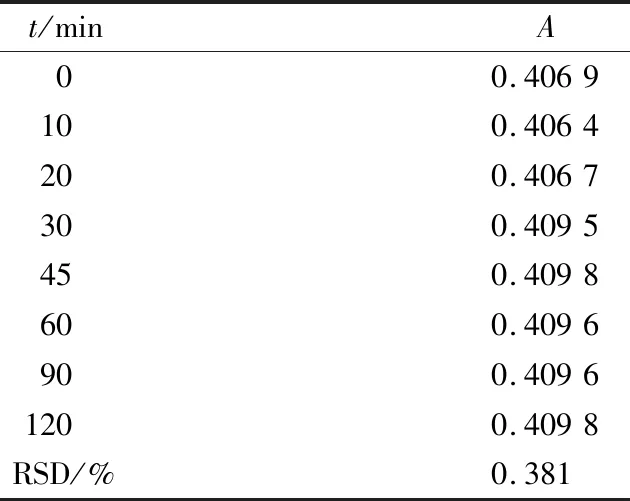
表5 稳定性试验结果Tab.5 Stability experiment
2.1.2.4 加样回收率试验结果
精密量取0.5 mL 15号党参样品液6份,分别加入质量浓度为0.066 41 mg·mL-1的葡萄糖标准液0.5 mL,按照“葡萄糖标准曲线的绘制”的方法测定其吸光度,结果见表6。
2.1.2.5 多糖含量测定结果
精密量取样品溶液1.0 mL,按照“葡萄糖标准曲线的绘制”的方法测定其吸光度,计算出不同批次党参多糖含量,结果见表7。
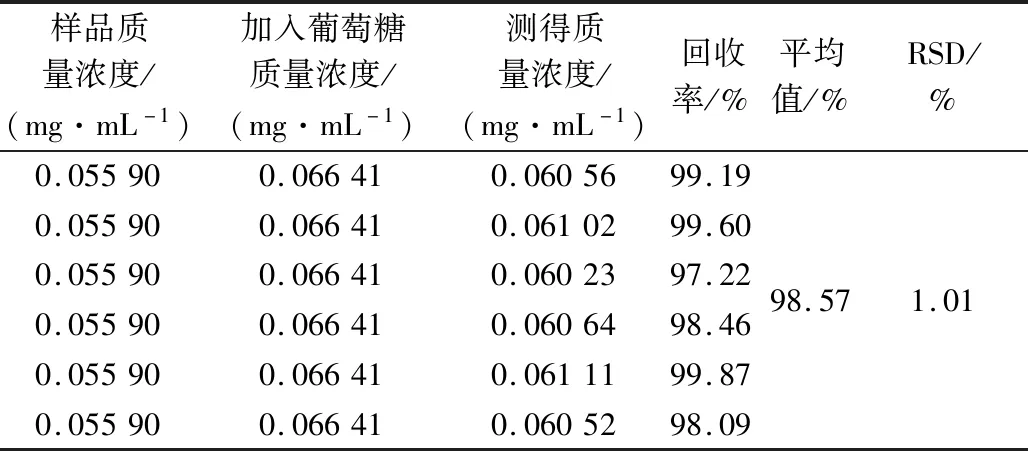
表6 加样回收率试验结果(n=6)Tab.6 Recovery experiment(n=6)

表7 党参药材多糖含量测定结果(n=2)Tab.7 Polysaccharide content of Codonopsis pilosula (n=2)
结果表明,35批党参中,多糖含量在5.3%~28.1%的范围,平均含量为16.9%±6.0%。按照下浮20%计算,可暂定含多糖不得低于13.5%。
2.2 党参单糖组成分析结果
将3批不同品种党参,分别是产于甘肃省渭源县的素花党参S7(西党)、湖北省恩施市的川党参S23(板党)以及产于山西省陵川县的党参S31(潞党),按气相条件进样,3种党参糖组成图谱见图2。
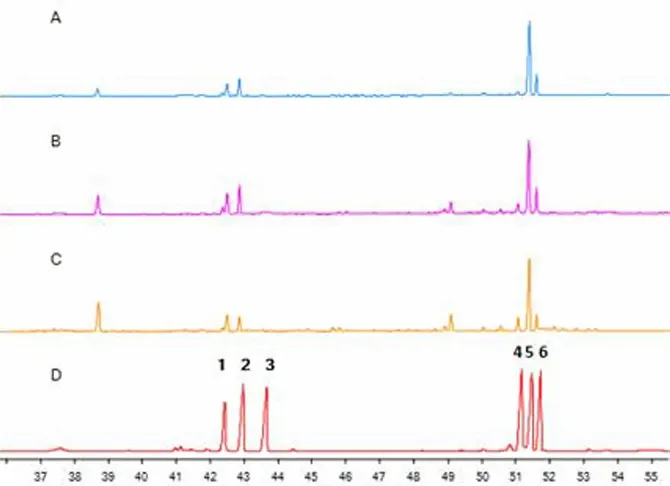
t/minA.潞党;B.板党;C.西党;D.单糖混合标准品。1.鼠李糖;2.阿拉伯糖;3.木糖;4.甘露糖;5.葡萄糖;6.半乳糖。
可知,3种基源党参的多糖组成大致相同,均含有鼠李糖、阿拉伯糖、甘露糖、葡萄糖和半乳糖。并且3种党参的物质的量比分别为:素花党参S7=0.8:1.2:0.4:19.2:6.8;川党参S23=1.4:3.2:0.8:21.2:6.8;党参S31=1.6:1.9:1.4:20.2:6.8。
2.3 党参中单糖及低聚果糖含量测定结果分析
2.3.1 对照品与样品色谱图
党参中主要单糖及低聚果糖为D-果糖、D-葡萄糖、蔗糖、蔗果三糖、蔗果四糖。HPLC-ELSD色谱图如图3。
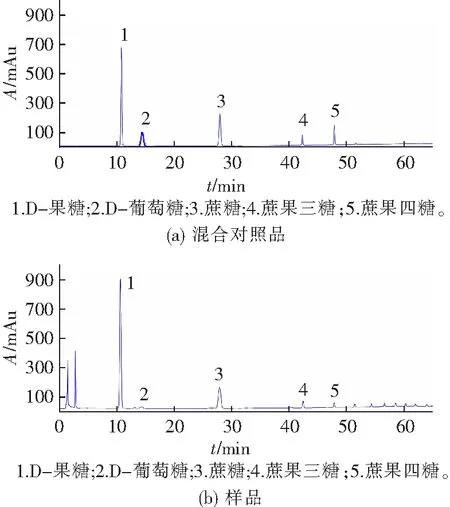
图3 混合对照品和样品的HPLC-ELSD色谱图Fig.3 HPLC-ELSD chromatograms of mixed reference and sample
2.3.2 方法学考察
2.3.2.1 线性关系及定量限、检测限的考察
精密吸取“对照品溶液的制备”项下5种糖类对照品溶液适量,制成混合标准品贮备液,并逐级稀释成一系列标准品混合溶液,进样10.0 μL,得到各标准对照品的标准曲线及线性范围,并分别按信噪比(S:N)为3:1和10:1计算各标准品的检测限和定量限,结果如表8。

表8 党参中5种糖类成分的线性方程、线性范围以及其定量限和检测限Tab.8 Linear equation,range and the limit of quantitation and detection between five kinds of carbohydrate components of Codonopsis pilosula
2.3.2.2 精密度考察
取高、中、低3种不同质量浓度混合对照品溶液各10.0 μL,连续进样6次,分别计算D-果糖、D-葡萄糖、蔗糖、蔗果三糖和蔗果四糖的日内、日间精密度。5种物质峰面积的日内、日间精密度RSD均在5%以内,表明仪器及进样精密度良好,结果见表9。
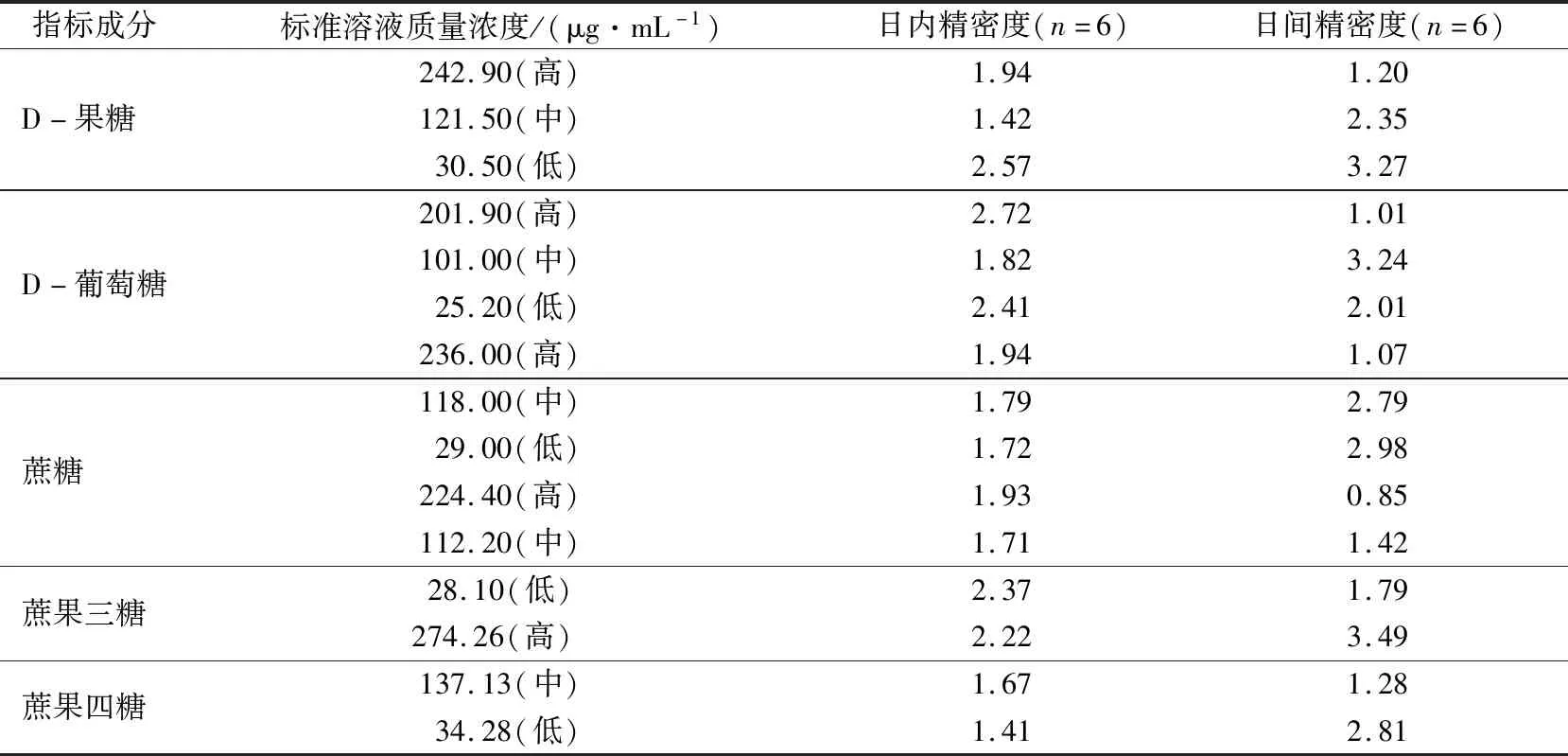
表9 D-果糖、D-葡萄糖、蔗糖、蔗果三糖和蔗果四糖的日内、日间精密度Tab.9 Intra-day and inter-day precision of D-fructose,D-glucose,Sucrose,Kestose,Nystose
2.3.2.3 重复性实验结果
取7号样品细粉0.05 g,精密称定,按供试品溶液制备方法操作,平行制备6份供试品溶液,测得D-果糖、D-葡萄糖、蔗糖、蔗果三糖和蔗果四糖的平均含量分别为6.8%、1.0%,4.0%,1.2%和0.6%,RSD分别为1.82%,1.91%,1.94%,0.93%,1.38%,表明重复性良好。
2.3.2.4 稳定性实验结果
精密吸取同一供试品溶液(S7),分别于0,1,3,5,9,12,18,24,36 h进样,测定D-果糖、D-葡萄糖、蔗糖、蔗果三糖和蔗果四糖的峰面积,其峰面积的RSD分别为3.49%,2.81%,2.76%,2.43%,2.15%,表明供试品溶液在36 h内稳定性良好。
2.3.2.5 加样回收率实验结果
取党参药材(S7)9份,分别按已知质量含量的80%,100%,120%加入D-果糖、D-葡萄糖、蔗糖、蔗果三糖和蔗果四糖对照品溶液,每一比例平行做3份;按供试品溶液制备方法操作,计算各成分的加样回收率,5种物质的加样回收率见表10。
2.3.3 样品检测结果
35批党参和饮片中D-果糖、D-葡萄糖、蔗糖、蔗果三糖和蔗果四糖的含量测定,见表11和图4。
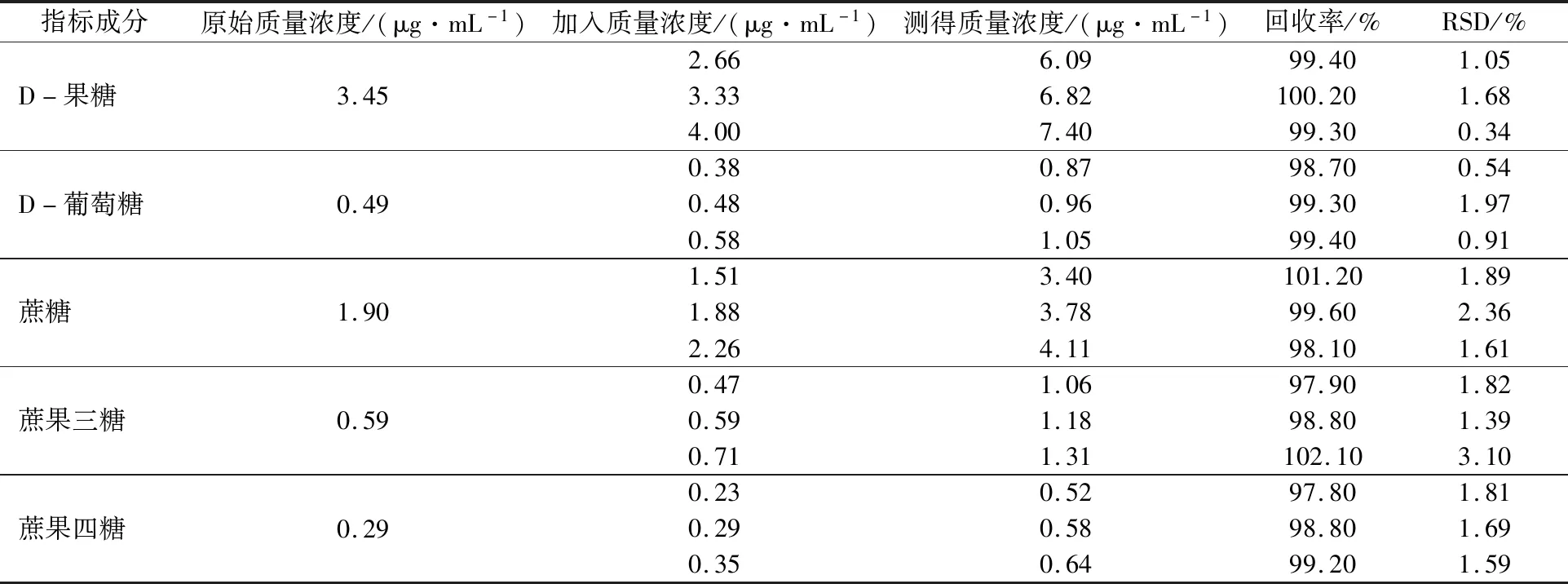
表10 D-果糖、D-葡萄糖、蔗糖、蔗果三糖和蔗果四糖的加样回收率(n=9)Tab.10 Recovery experiment of D-fructose,D-glucose,sucrose,kestose,nystose
表11 党参原药材中35批党参和饮片中D-果糖、D-葡萄糖、蔗糖、蔗果三糖和蔗果四糖的含量(n=2,以干燥品计算含量)Tab.11 The content of D-fructose,D-glucose,sucrose,kestose,nystose in sample of Codonopsis pilosula
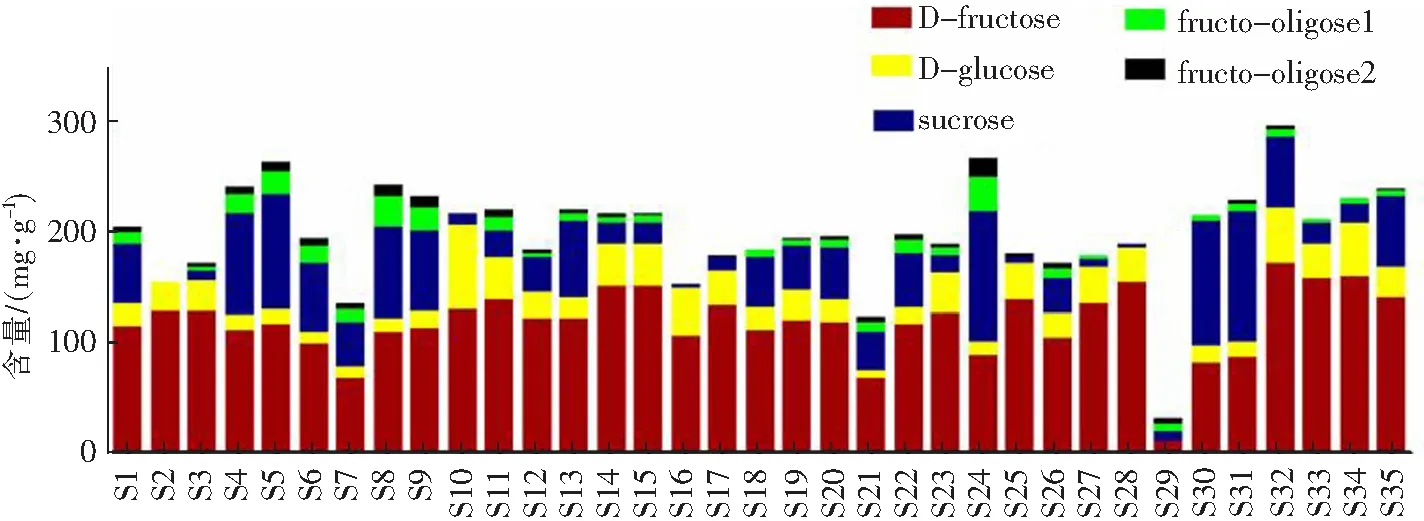
图4 党参中5种糖类物质含量比较Fig.4 Comparison of the contents of five sugars in Codonopsis pilosula
从图4看出党参中35批党参和饮片中D-果糖、D-葡萄糖、蔗糖、蔗果三糖和蔗果四糖的含量存在种内和种间差异。其中D-果糖、蔗糖和葡萄糖为党参药材中主要糖类成分,不同品种之间差异较大,质量含量范围分别为10.69~157.54,5.36~23.06和8.00~50.38 mg·g-1。其中D-果糖含量在S1~S10(素花党参)中相对较低,在S12~S19(素花党参)样品中含量相对较高。D-果糖在S20~S28(川党参)中含量与素花党参相当,并且随着生长年限的增加逐渐增加。D-葡萄糖在素花党参中的含量分布和D-果糖类似。蔗糖含量在3种党参中差异较大,总体而言素花党参>党参>川党参。
3 结论
本文通过使用HPLC-ELSD方法对我国5个主要党参产区(甘肃、贵州、山西、湖北、四川)的党参、素花党参和川党参中的多糖含量、单糖组成、D-果糖等5种单糖以及低聚糖进行定量分析,并制定党参相关的质量控制标准。其中35批党参药材中,多糖的平均质量分数为16.9%±6.0%,但不同来源的党参多糖含量差异较大,对其品质影响较大。不同品种党参多糖的单糖组成成分基本相似且含量大致相同,均含有鼠李糖、阿拉伯糖、甘露糖、葡萄糖和半乳糖,葡萄糖和半乳糖是党参中主要的单糖成分,可作为真伪鉴别指标。35批党参中,5种单糖和低聚糖(D-果糖、D-葡萄糖、蔗糖、蔗果三糖和蔗果四糖)的总平均质量分数为19.91%,其中总含量最高的党参比最低值高达8.4倍,造成党参之间的品质差异较大。根据平均含量下浮20%的标准,建议设定党参中多糖含量质量控制标准为≥13.5%;5种糖类成分总质量分数不得低于15.92%。本文通过对主要产地和品种党参糖类成分的分析及研究,并制定相应质量控制要求,可为选择适宜品种党参作为食品原料时提供一定的数据支持。
