不同肥力棕壤玉米根茬和茎叶残体碳氮的固定特征
2022-02-02李佳燕孙良杰马南王丰汪景宽
李佳燕,孙良杰,马南,王丰,汪景宽
不同肥力棕壤玉米根茬和茎叶残体碳氮的固定特征
李佳燕,孙良杰,马南,王丰,汪景宽
沈阳农业大学土地与环境学院/农业农村部东北耕地保育重点实验室,沈阳 110866
【目的】秸秆还田是增加土壤碳固定和改善土壤养分状况的重要措施之一。研究玉米不同部位残体碳、氮在土壤中的固定特征,明确秸秆还田的土壤增碳培肥机制。【方法】以沈阳农业大学棕壤长期定位试验站为平台,采集不施肥和有机肥配施化肥处理的土壤分别作为低肥力(LF)和高肥力(HF)土壤,并分别与13C和15N双标记的玉米茎叶(S)、玉米根茬(R)混合,在25℃条件下进行室内培养试验。试验于第1、30、60、180和360 天取样并测定土壤总有机碳(SOC)、全氮(TN)含量及其同位素丰度,分析玉米不同部位残体碳、氮在不同肥力水平土壤中的固定特征。【结果】添加玉米残体显著提高土壤SOC,一年后仍能提高14.0%。添加玉米残体后,土壤系统中有一小部分氮素可能以反硝化方式流失,且外源玉米残体氮和土壤原有老氮均有损失。与添加根茬相比,添加茎叶更有利于外源新碳、氮的增加,而且具有更强的激发老碳、氮分解/损失的效应,不利于土壤老碳、氮的固持;根茬残体则更趋向于被分解,使土壤老碳、氮得到相对的保护和固定。外源残体碳虽然在低肥力土壤中的固定较少,但是对低肥力土壤碳库的提升具有更大的贡献。添加残体后低肥力土壤的C/N和13C/15N(代表土壤中来自于外源残体的C/N)显著高于高肥力土壤。但本研究结果表明13C/15N并不是限制低肥力土壤中残体分解和固定的主要因素,其主要原因可能在于底物长期选择条件下的特异性土著土壤微生物群落较为稳定,对于外源有机质加入的干扰具有抵抗力造成的。【结论】土壤中添加玉米不同部位残体均可显著提高土壤碳、氮水平,但其内在的残体新碳/氮和土壤老碳/氮的固定策略相异。低肥力土壤较高肥力土壤对外源碳的固定少,其对不同部位残体的固定在本研究中并不受到来自于外源残留残体C/N的影响。
玉米残体;土壤肥力水平;土壤碳氮固定;稳定同位素标记
0 引言
【研究意义】土壤有机碳和氮含量的提高不仅有利于土壤肥力的保持与提升,还是保障农田生态系统功能正常发挥的基础[1-2]。因此,农田土壤碳和氮的固存一直都是农田土壤培肥研究的重点和热点[3-4]。植物残体还田作为一项能够提升土壤有机碳和全氮含量的环保且经济措施被广泛推广[5]。【前人研究进展】还田植物残体主要包括植物的非收获部位——根茬和茎叶,二者因其化学组成不同,可能会导致它们在土壤中的分解和固定过程相异[6]。在传统认知中,与茎叶相比,木质素含量高的根茬碳更加稳定,因此对土壤有机碳积累的贡献更显著[7]。然而,最近的研究表明,植物来源的木质素在土壤中的稳定性并不高[8],甚至有研究指出具有较高微生物利用效率的茎叶对于土壤碳固定的作用更大[9]。由此看来,关于植物不同部位残体碳、氮在土壤中的固定特征还存在一些争议。此外,不同肥力水平农田土壤因自身的有机碳和氮素养分的差异,而使其通过能量和养分有效性强烈调节着对外源碳、氮的固持[10-11],因此,在评估土壤碳、氮动态响应外源物质输入时应加以考虑。有研究指出,低肥力土壤可能比高肥力土壤更容易受到外源物质添加的影响,刺激产生更强的微生物活性,进而具有更强固碳能力。郭策等[12]通过研究秸秆添加对耕层(有机碳含量和肥力水平均高)与底层(有机碳含量和肥力水平均低)母质土壤的有机碳含量的影响,发现母质层的低肥力土壤有机碳增量高于耕层高肥力土壤,土壤固碳潜力更强。然而,也有研究指出,有机物输入引起了低肥力土壤更大的净碳损失,而在高肥力土壤中却促进了碳的固持[13-14],形成了土壤碳固持的“马太效应”[15]。由此看来,外源秸秆碳在农田土壤中的固定不仅受到植物残体特性(不同部位)的影响,而且也受到土壤肥力水平的影响。不同肥力水平土壤的碳库对外源秸秆的响应情况还存在着不确定性。【本研究切入点】目前,已有许多研究对植物残体碳、氮在土壤中的转化固定进行了研究[16-17],然而,关于植物不同部位残体碳、氮在土壤中的固定过程,以及不同肥力水平土壤固碳对外源秸秆碳的响应特征均还存在较大不确定性。此外,传统的研究不能区分秸秆来源碳、氮和土壤原有碳、氮,而利用同位素技术可以解决此问题。因此,本研究将以13C、15N双标记玉米残体为材料进行农田土壤碳、氮固定特征的研究,为弄清还田秸秆的碳、氮双元素的土壤固定特征及二者在固定过程中的耦合关系提供更加准确的技术支撑。【拟解决的关键问题】本研究以玉米连作棕壤为研究对象,分别向高肥力和低肥力土壤中添加13C、15N双标记玉米残体(根茬、茎叶),进行室内培养试验,分析不同肥力水平棕壤中的碳、氮固定及土壤C/N的动态变化,探讨玉米不同部位残体在高、低肥力棕壤中的碳氮固定特征,明确秸秆还田措施下农田土壤的固碳固氮机制,为构建合理的秸秆还田土壤培肥措施提供理论依据。
1 材料与方法
1.1 试验区概况与供试样品采集
供试土壤来源于沈阳农业大学棕壤长期定位试验站(41°49′N,123°57′E),该试验站建于1987年,属于典型的北温带大陆性季风气候,年平均降水量为730 mm,年平均气温为8.2℃,土壤类型为棕壤(简育湿润淋溶土)。试验区常年连作种植玉米(当地常用品种),于每年4月中下旬农机起垄并人工播种,9月下旬收获。
试验布置前采集试验站0—20 cm土层的土样,选取2个处理土壤作为高、低肥力土壤:不施肥土壤视为低肥力土壤(LF),高量有机肥配施氮磷肥(年施有机肥折合含纯氮270 kg·hm-2,年施用化肥中含N 135 kg·hm-2和P2O567.5 kg·hm-2,一次性施入)视为高肥力土壤(HF)。于9月底玉米收获后将鲜土采回,在室温下风干,剔除可见根系和石块,混匀后过2 mm筛备用,其中一部分过0.15 mm筛测定土壤总SOC、TN、δ13C值、δ15N值,明确土壤碳氮及其同位素的本底值(表1)。
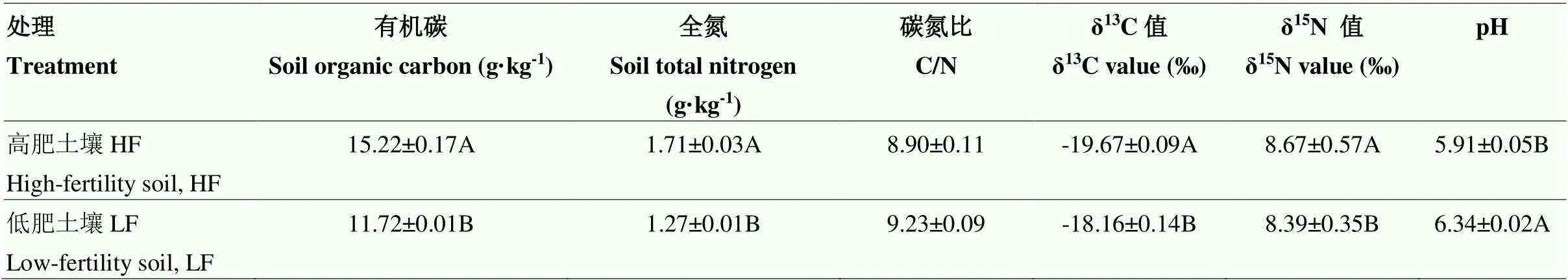
表1 试验土壤(0—20 cm土层)的基本理化性状
平均值±标准误。同一列数据后的不同大写字母表示不同肥力土壤间的差异显著(<0.05)
Means±standard error. Different uppercase letters after the same column of data indicate significant differences between soils with different fertility levels (<0.05)
供试13C和15N双标记玉米残体材料是本研究团队通过脉冲标记法获得[18],标记主要过程如下。利用NaOH 将标记室内的12CO2充分吸收之后,通过HCl与Na213CO3(99% atom%13C)反应产生的13CO2气体对玉米进行标记。同时在植株根部土壤直接注入(15NH4)2SO4(98 atom%15N)溶液进行玉米的15N标记。脉冲标记从玉米苗期进入拔节期开始至成熟期结束,总共进行4次。标记完成后,收获的植株冲洗干净,105℃下杀青后60℃下烘干。将玉米根茬和茎叶分开,剪成2 cm小段,用粉碎机粉碎,过40目筛(0.425 mm)备用。供试玉米残体基本碳氮含量和标记丰度性质见表2。

表2 供试玉米残体的基本理化性状
1.2 试验设计
将土壤与标记的玉米不同部位残体混合后进行室内培养,培养周期为2020年1月15日至2021年1月9日。培养试验的具体操作如下。称取250 g(烘干重计)风干土样于直径为11.5 cm、容积为1 L的塑料广口瓶中,加蒸馏水调节土壤含水量至田间持水量的40%,用广口瓶盖旋紧,并将瓶盖均匀扎孔以便瓶内外进行气体交换。将准备好的培养瓶置于培养箱,在25℃条件下避光培养7 d。7 d后取出立即进行混样:称取5 g已粉碎的玉米根茬和茎叶(占干土重比例2%),分别与培养土壤充分混匀,再次调节土壤含水量至田间持水量的60%,25℃下避光培养。试验共设置如下处理:低肥土壤+玉米根茬(LF+R);低肥土壤+玉米茎叶(LF+S);高肥土壤+玉米根茬(HF+R);高肥土壤+玉米茎叶(HF+S);以不添加玉米残体的2种肥力土壤作为对照(LF,HF)。试验共进行约360 d,通过称重法每周补水1次。培养期间,在第1、30、60、180和360天进行破坏性取样,每次取各处理的3个重复土壤样品进行指标测定。样品风干后用研钵研磨并过0.15 mm筛,供分析土壤总有机碳、全氮含量及其δ13C和δ15N值。
1.3 土壤样品测定
将过0.15 mm筛的土样直接包样在元素分析仪-稳定同位素比例质谱联用仪(EA-IRMS, Elementar vario PYRO cube-IsoPrime100 Isotope Ratio Mass Spectrometer,德国)上测定土壤样品总有机碳和全氮含量及其δ13C和δ15N值。δ13C值以美国南卡罗来纳州白垩纪皮狄组层位中的拟箭石化石(Pee DeeBelemnite, PDB)为标准物质,δ15N值以纯净大气氮为标准物质。
1.4 数据计算
土壤有机碳中秸秆碳占比或土壤全氮中秸秆氮占比(,%)的计算公式如下[19]:

式中,δXsample(‰)为添加秸秆处理土壤有机碳的13C值或全氮的15N值;δXcontrol(‰)为不添加秸秆处理土壤有机碳的13值或全氮的15值;δXmaize(‰)为初始添加秸秆的13值或15值。
土壤有机碳含量中秸秆来源碳和土壤全氮含量中秸秆来源氮(m,g·kg-1)的计算如下[20]:
m=sample×(2)
式中,sample(g·kg-1)为添加秸秆处理土壤总有机碳含量或全氮含量;为土壤总有机碳中来自秸秆的碳比例或全氮中来自秸秆的氮比例。
土壤中原有机碳含量或原有机氮含量(Y,g·kg-1)的计算如下:
o=sample-m(3)
采用Excel 2019进行数据整理和计算,使用SPSS 21.0一般线性模型进行方差分析,多重比较采用Duncan 法,显著水平为<0.05。用Origin 2017软件绘图。
2 结果
2.1 玉米不同部位残体碳的固定特征
2.1.1 土壤总有机碳含量变化 试验期间,高肥力土壤总有机碳(SOC)含量显著高于低肥力土壤(<0.05),分别为14.37—15.22 和10.48—11.72 g·kg-1(表3)。两种肥力土壤总SOC在添加残体处理条件下均显著提高(<0.05),低肥力土壤提高了39.0%,而高肥力土壤则提高了23.0%,这说明添加残体更有利于促进低肥土壤总SOC的提高。培养开始时(1 d),在低肥力土壤中,添加根茬处理的土壤有机碳含量较对照处理高出76.6%,而添加茎叶土壤高出66.9%;在高肥力土壤中,添加根茬土壤高出54.6%,而添加茎叶土壤高出48.2%,即低肥力和高肥力土壤中,添加根茬对土壤总SOC的提高幅度均较添加茎叶处理的高。随培养时间延长,各处理总SOC均显著下降,但是添加玉米残体总SOC仍然高于对应的不添加残体的处理,培养结束时(360 d),在低肥力土壤中,添加根茬处理土壤SOC较对照高出17.7%,而添加茎叶土壤高出22.6%;在高肥力土壤中,添加根茬土壤高出10.3%,而添加茎叶土壤高出11.7%,即在低肥力和高肥力土壤中,添加根茬对土壤总SOC的提高幅度均较添加茎叶处理低。由此看来,从试验初期到试验末期,不论高肥力和低肥力土壤中,玉米不同部位残体对土壤总有机碳较对照的提升幅度大小发生了翻转。总的来说,添加根茬土壤的SOC高出13.4%,而添加茎叶土壤高出14.6%。同时发现,根茬和茎叶添加处理土壤SOC较培养开始时分别降低了8.03和6.61 g·kg-1,这表明,在试验期内,玉米根茬残体的分解速度比茎叶残体快。
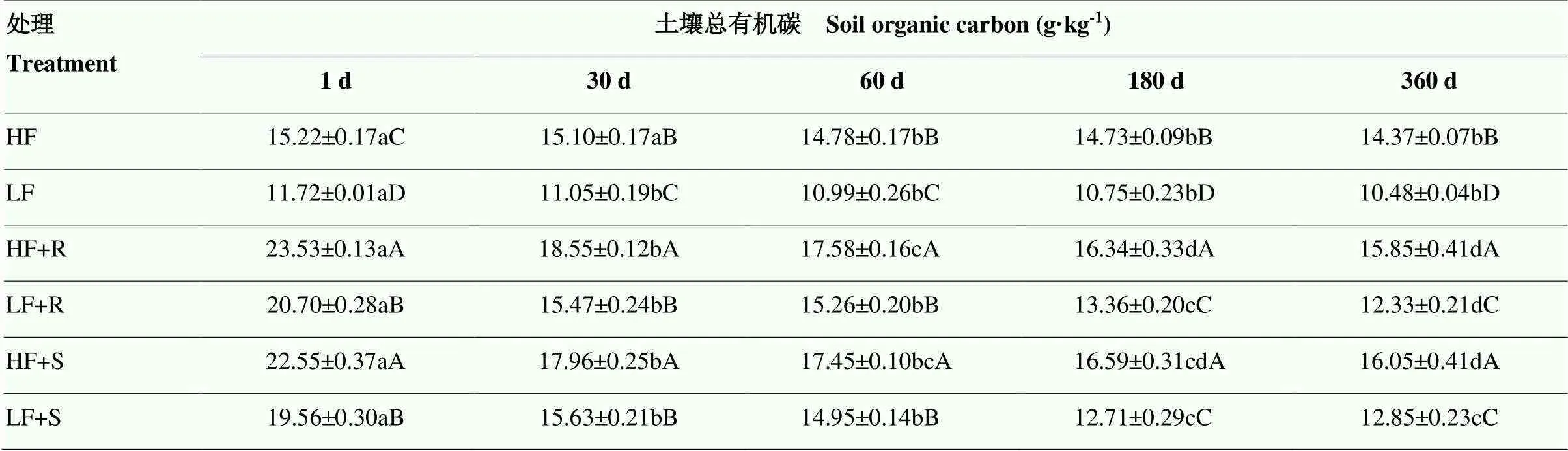
表3 不同处理土壤总有机碳含量随时间变化情况
不同小写字母表示同一处理不同培养时间差异达5%显著水平(<0.05);不同大写字母表示同一培养时间不同处理间差异达5%显著水平(<0.05)。LF 和 HF 分别代表低肥力和高肥力土壤,R 和 S 分别代表根茬和茎叶。下同
The different lowercase letters indicate that the difference between the same column and different incubation time is 5% significant (<0.05); the different uppercase letters indicate that the difference between different column at the same incubation time is 5% significant (<0.05). LF and HF represent the soils with low and high fertility, respectively. R and S represent root and stalk+leaf residues, respectively. The same as below
2.1.2 土壤中外源新碳和原有老碳的含量变化 外源新碳主要是指土壤中加入玉米残体后新固定下来的来自于玉米残体的有机碳,原有老碳则指的是新碳以外,来自于土壤中原有的有机碳。由图1可知,随培养时间延长,各处理土壤外源新碳含量显著下降(<0.05),到培养结束时,添加的秸秆分解了大半部分,低肥力和高肥力土壤的外源新碳含量分别降低了5.66和3.96 g·kg-1,降幅分别为73.9%和63.4%,低肥力土壤中外源新碳较高肥力土壤分解得更多。在低肥力土壤中,茎叶添加处理土壤外源新碳含量较根茬处理高出13.7%,主要发生在试验前期(60 d以前),但是在高肥力土壤中二者却未表现出显著性差异(>0.05)。随培养时间的延长,各处理间差异不断缩小,到180 d以后不同处理间无显著差异(>0.05)。
高肥力土壤老碳含量显著高于低肥力土壤(<0.05),高出31.2%,玉米残体添加并未使这种趋势发生改变(图 1)。然而,玉米不同部位残体添加使土壤老碳发生了显著变化。在低肥力土壤中,添加根茬处理土壤老碳在试验1、60和180 d显著高于添加茎叶处理(<0.05),而在高肥力土壤中二者之间则在30 d开始即转变为不显著(>0.05)。总的来说,添加茎叶和添加根茬之间的差异在逐渐缩小。在培养过程中,各处理土壤老碳含量变化也呈下降趋势,到培养结束时,在低肥力和高肥力土壤中添加玉米残体后老碳含量较培养开始时分别降低了1.88和3.14 g·kg-1,降幅分别为15.1%和18.5%。其中,在低肥力土壤中,添加茎叶和添加根茬处理分别降低了0.29和3.47 g·kg-1,降幅分别为2.6%和25.3%;在高肥力土壤中,添加茎叶和添加根茬处理分别降低了2.42和3.86 g·kg-1,降幅分别为14.9%和21.8%。
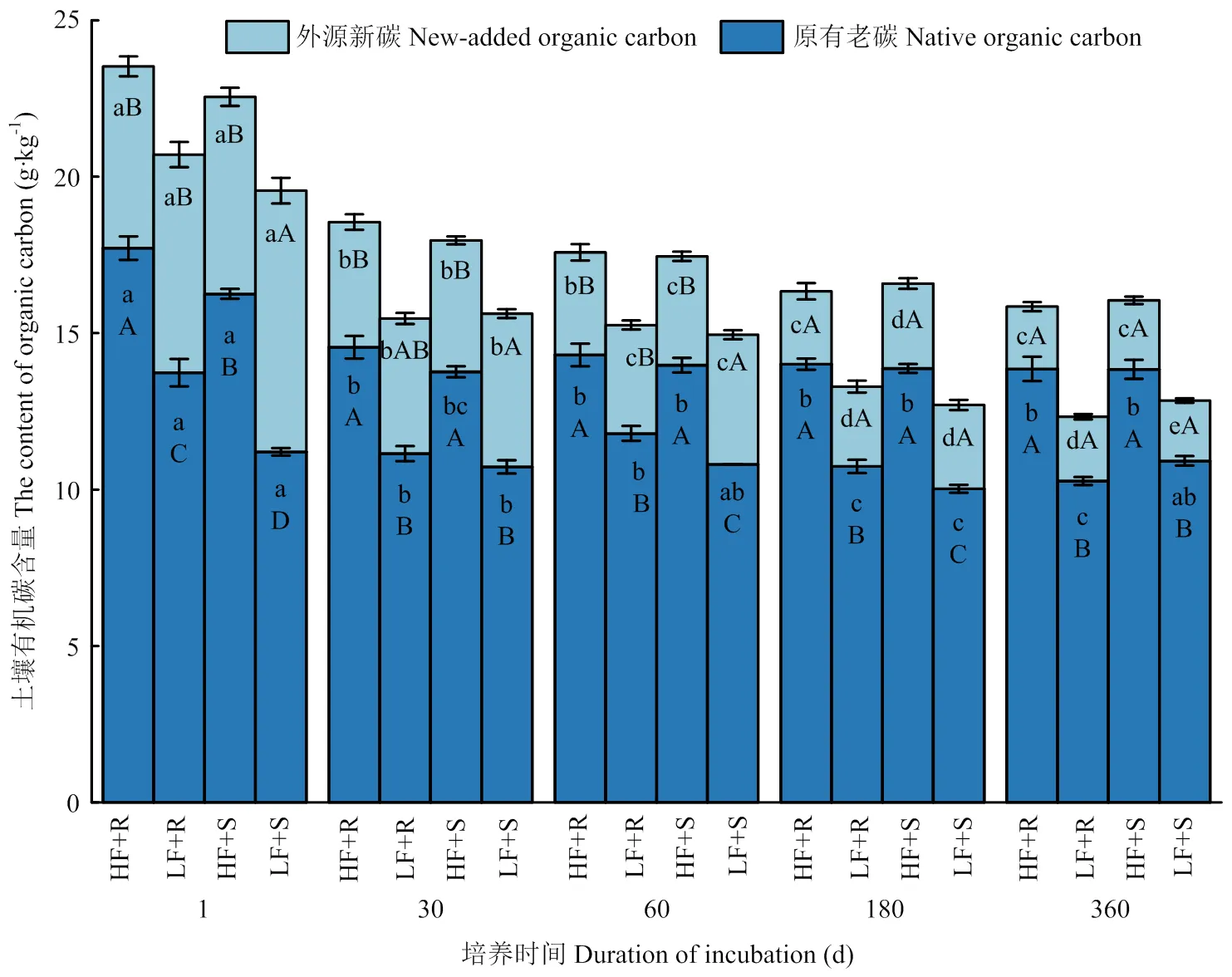
图1 不同处理条件下土壤中外源新碳和原有老碳含量随时间变化情况
2.1.3 外源新碳和原有老碳对土壤总有机碳的贡献率 结果表明(图2),土壤原有老碳对SOC的贡献(SOC-Fsoil)始终大于新碳对SOC的贡献(SOC-Fmaize)(<0.05),前者随着培养的进行逐渐上升,而后者则逐渐下降(<0.05),其中,低肥力土壤平均下降了57.7%,高肥力土壤平均下降了49.9%。在低肥力土壤中添加玉米根茬和茎叶土壤新、老碳的贡献率显著差异,在高肥力土壤中则差异不显著(>0.05),表现为培养前60 d低肥力土壤中添加茎叶处理SOC-Fmaize显著高于添加根茬处理,高出20.6%,而在60 d之后,却未表现出显著差异(>0.05)。玉米残体添加对低肥力土壤新、老有机碳比例变化的影响大于高肥力土壤,使低肥力土壤SOC-Fmaize较高肥力土壤高出33.7%(<0.05),与之相对应的高肥力土壤SOC-Fsoil较低肥力土壤高出8.9%(<0.05)。
2.2 不同部位玉米残体氮的固定特征
2.2.1 土壤全氮含量 分析比较土壤全氮(TN)变化情况(表4)发现,不同处理条件下土壤TN在培养期间整体上呈现下降趋势,但是下降幅度不大,到试验结束时(360 d)低肥力和高肥力土壤TN与培养开始时(1 d)相比分别降低了0.31和0.44 g·kg-1,降幅分别为7.7%和8.1%。各处理之间土壤TN含量有显著差异(<0.05),高肥力土壤TN显著高于低肥力土壤,高出27.3%,而添加茎叶和根茬残体后,也使土壤TN有所增加。与不添加残体的对照相比,添加残体处理使两种肥力土壤TN含量在试验1 d显著提高(<0.05),高肥力土壤中这种趋势一直持续到试验结束,而低肥处理中则在1 d后差异不显著(>0.05)。
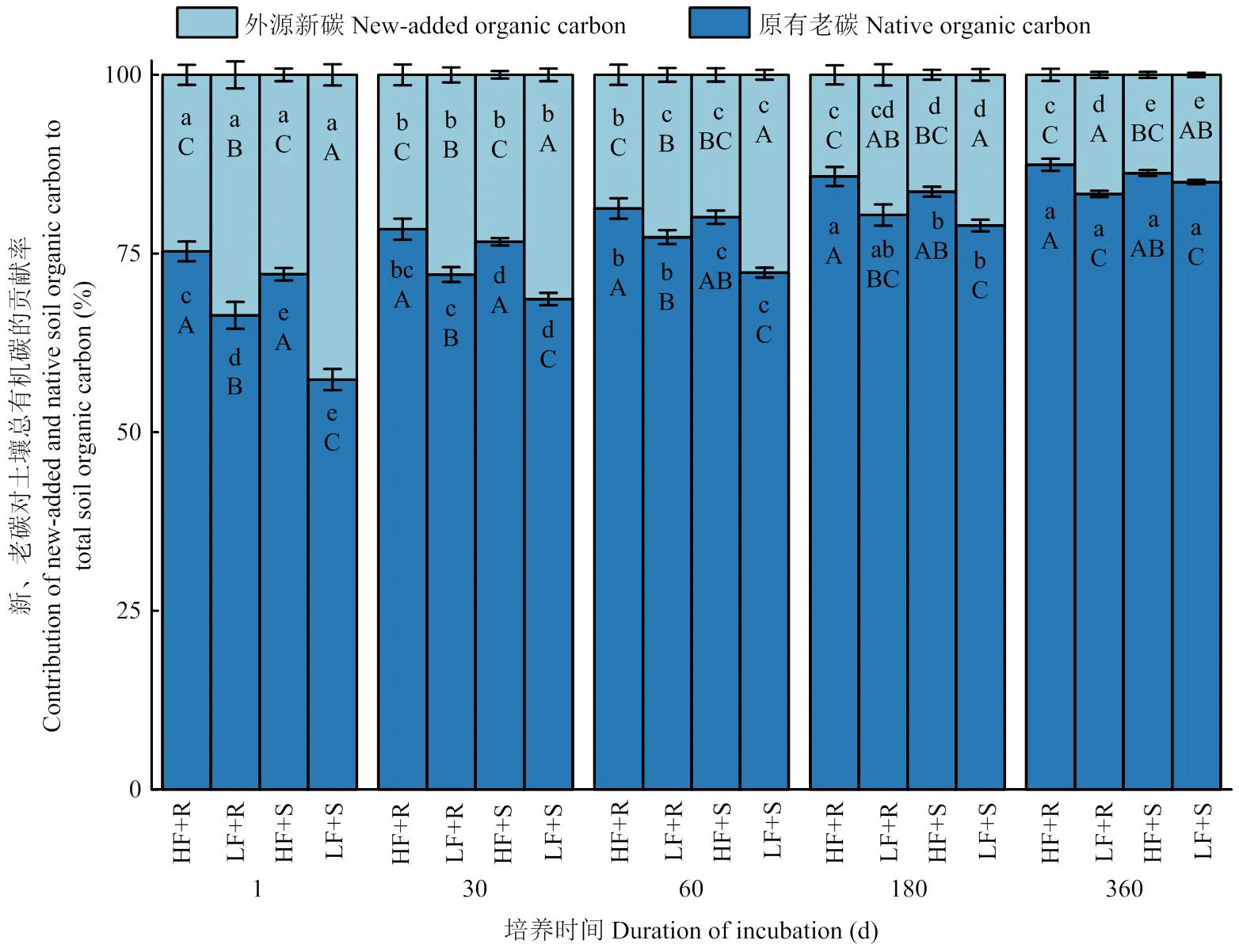
图2 不同处理下土壤外源新碳和原有老碳对总有机碳的贡献率随时间变化情况
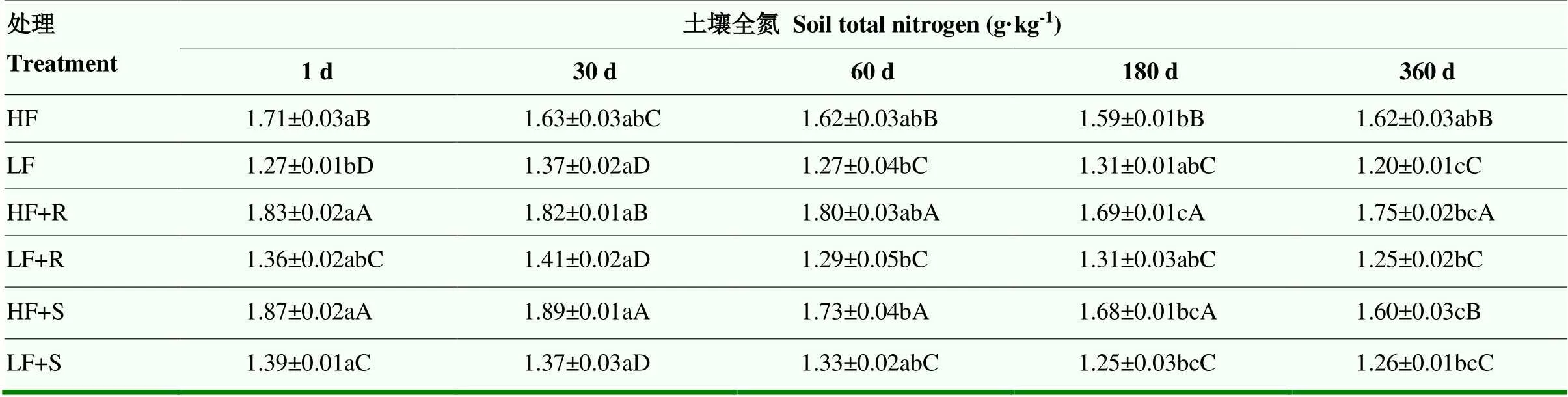
表 4 不同处理下土壤全氮含量随时间变化情况
2.2.2 土壤中外源新氮和原有老氮的含量变化 无论在高肥力还是低肥力土壤中,添加茎叶处理土壤外源新氮含量显著高于添加根茬处理(<0.05),前者比后者高出36.4%—55.6%(图3)。不同部位玉米残体添加对土壤老氮含量也有显著影响(<0.05),在低肥力土壤中,培养30、60和180 d时,添加茎叶处理土壤原有老氮含量显著低于添加根茬处理(<0.05),而在高肥力土壤中,添加根茬和添加茎叶处理间土壤老氮含量差异不显著(>0.05)。此外,土壤新氮和老氮含量在各处理条件下的时间变化趋势与土壤全氮含量相一致,到培养试验结束时(360 d),低肥力和高肥力处理土壤新碳含量与培养开始时(1 d)相比分别降低了0.04和0.02 g·kg-1,降幅分别为28.6%和14.3%,土壤老氮含量降低了0.08和0.16 g·kg-1,降幅分别为6.5%和9.4%。
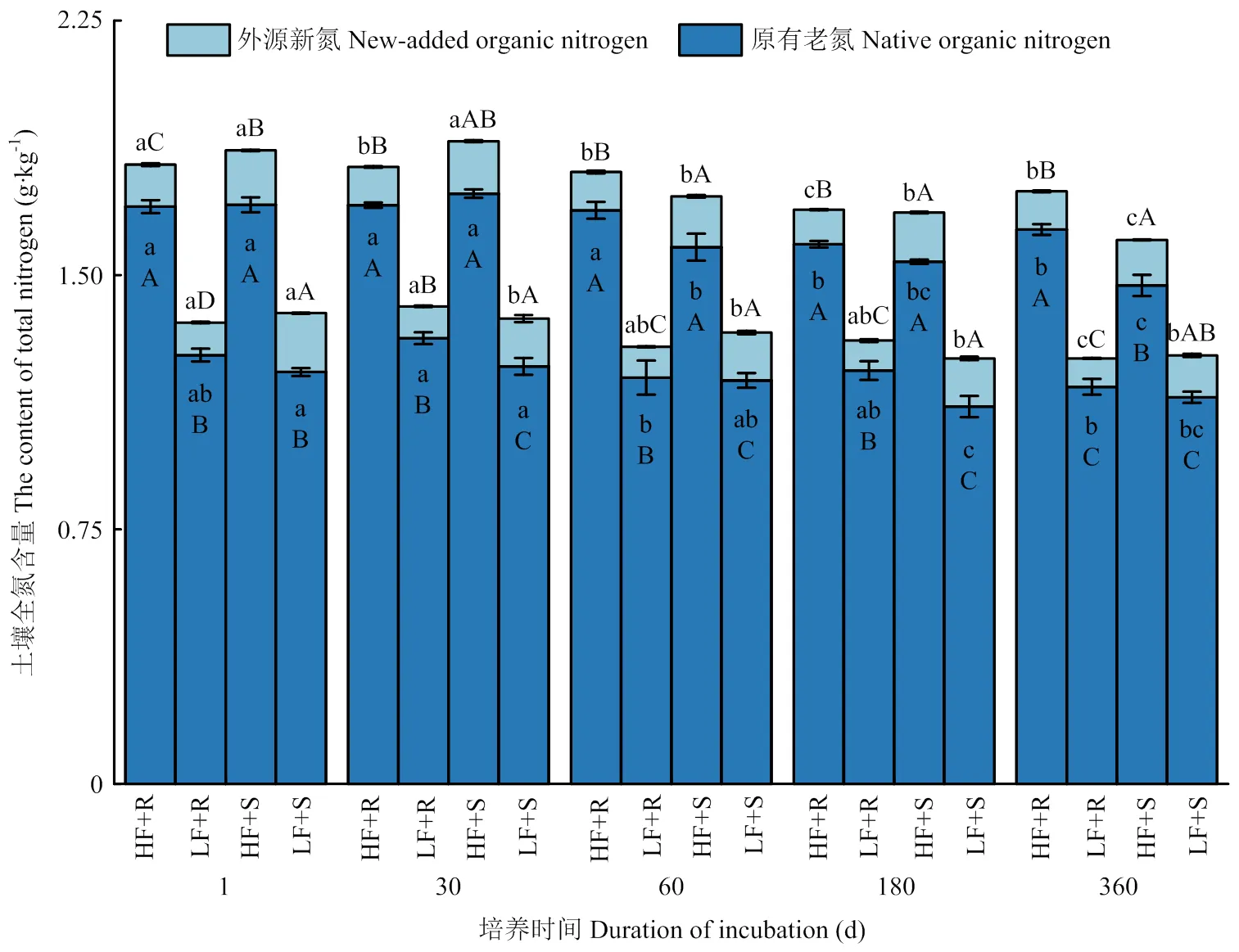
图3 不同处理下土壤外源新氮和原有老氮含量随时间变化情况
2.2.3 外源新氮和原有老氮对土壤全氮的贡献率 由图4可知,整体上看,添加残体处理使低肥力土壤外源新氮贡献率(TN-Fmaize)较高肥力土壤高出16.6%(<0.05),这种提高主要是由添加茎叶处理造成的,添加茎叶处理使低肥TN-Fmaize较高肥土壤高出22.4%(<0.05),而添加根茬条件下高肥力和低肥力土壤间TN-Fmaize没有显著差异(<0.05)。与外源新氮相对应的,添加残体处理整体上使高肥力土壤原有老氮贡献率(TN-Fsoil)较低肥力土壤高出1.6%(<0.05),添加茎叶处理使高肥力土壤TN-Fsoil较低肥力土壤显著高出2.7%(<0.05)。随时间延长,在高肥力土壤中,添加根茬处理TN-Fmaize呈现逐渐下降的趋势,但是添加茎叶处理TN-Fmaize没有显著差异(>0.05),而在低肥力土壤中,添加茎叶处理TN-Fmaize呈现逐渐下降的趋势,但是添加根茬处理TN-Fmaize没有显著差异(>0.05)。
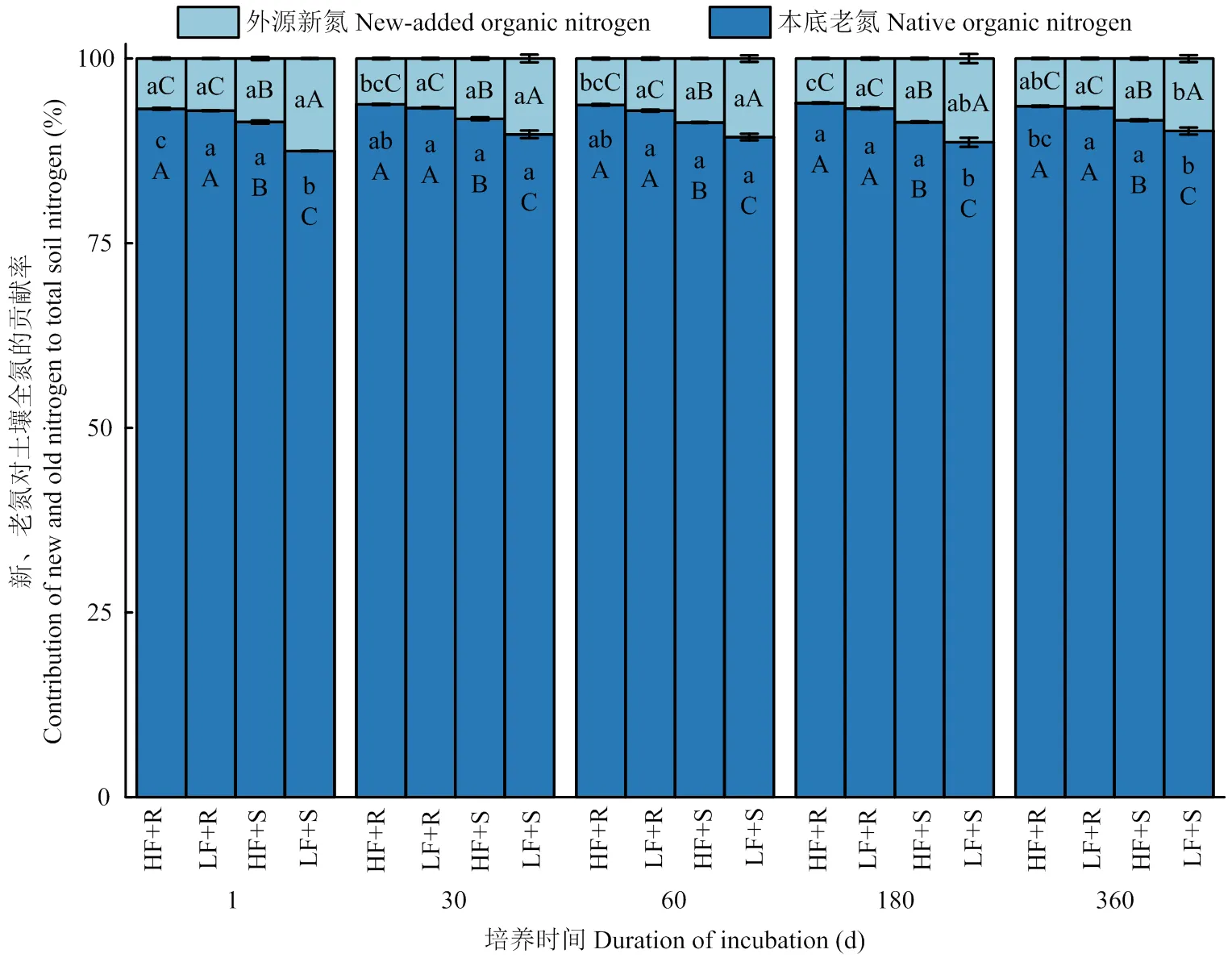
图4 不同处理下土壤外源新氮和原有老氮对全氮的贡献率随时间变化情况
2.3 添加玉米残体对不同肥力土壤碳氮比的影响
2.3.1 土壤碳氮比 高肥力和低肥力土壤碳氮比(C/N)分别为8.87—9.45和8.07—9.25(表5),高肥力土壤C/N主要在第30天和第180天显著高于低肥力土壤(<0.05)。残体添加可显著提高土壤C/N(<0.05),使高、低肥力土壤分别提高了12.1%和34.1%,可见残体添加对于低肥力土壤C/N的影响更大。随培养时间延长,各处理土壤C/N整体呈现出稳定下降的趋势。低肥力土壤中,根茬添加处理C/N高于茎叶添加处理(<0.05);在高肥力土壤中,仅培养30、60 d后C/N表现为根茬添加处理C/N高于茎叶添加处理(<0.05),180 d开始往后则表现出茎叶添加处理的C/N高于根茬添加处理。
2.3.2 土壤外源碳氮比(13C/15N) 土壤外源碳氮比(13C/15N)是指土壤中来自新添加秸秆的有机碳和全氮比值。由图 5可知,整个培养时期内,不同处理条件下的土壤13C/15N均显著下降,到180 d后则转变为平稳阶段。对玉米不同部位残体添加处理间差异比较发现,高肥力土壤中的根茬添加处理13C/15N仅在培养第30、60天时显著高于添加茎叶处理(<0.05),其余时间两者差异不显著;而在低肥力土壤中,根茬添加处理13C/15N均显著高于茎叶添加处理,在培养1 d其差异幅度可达43.6%。另外,土壤肥力水平也对13C/15N产生显著影响(<0.05),表现为添加根茬条件下高肥力土壤13C/15N在试验期间均显著小于低肥力土壤,而添加茎叶处理条件下高、低肥力土壤间13C/15N差异在60 d以前与添加根茬处理相同,而在60 d以后则表现为差异不显著(>0.05)。各处理之间的差异随试验的进行逐渐变小。
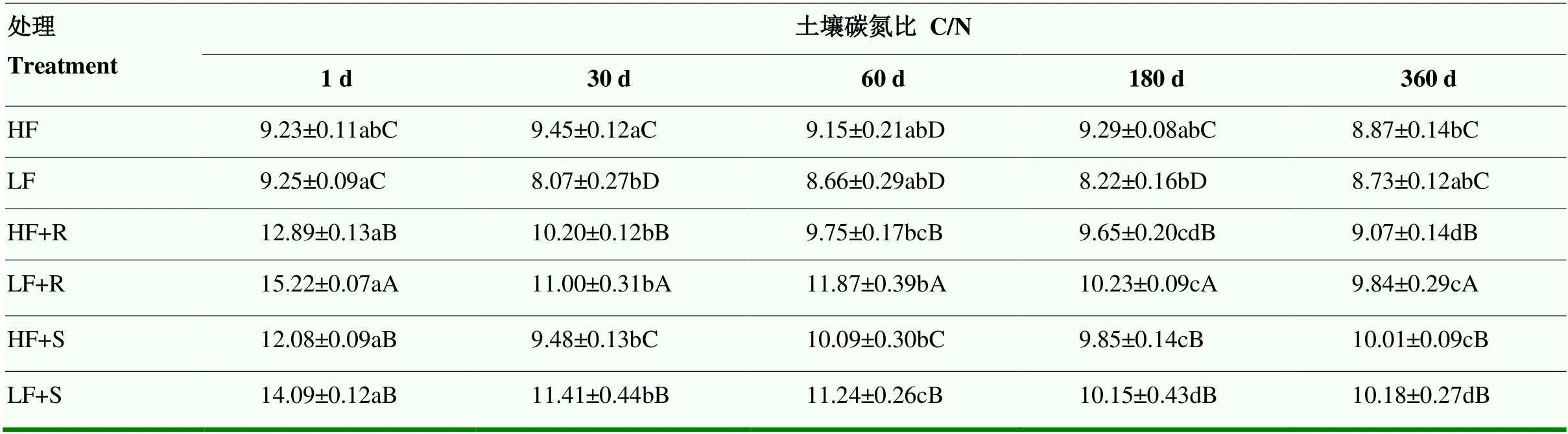
表5 不同处理下土壤C/N比随时间变化情况
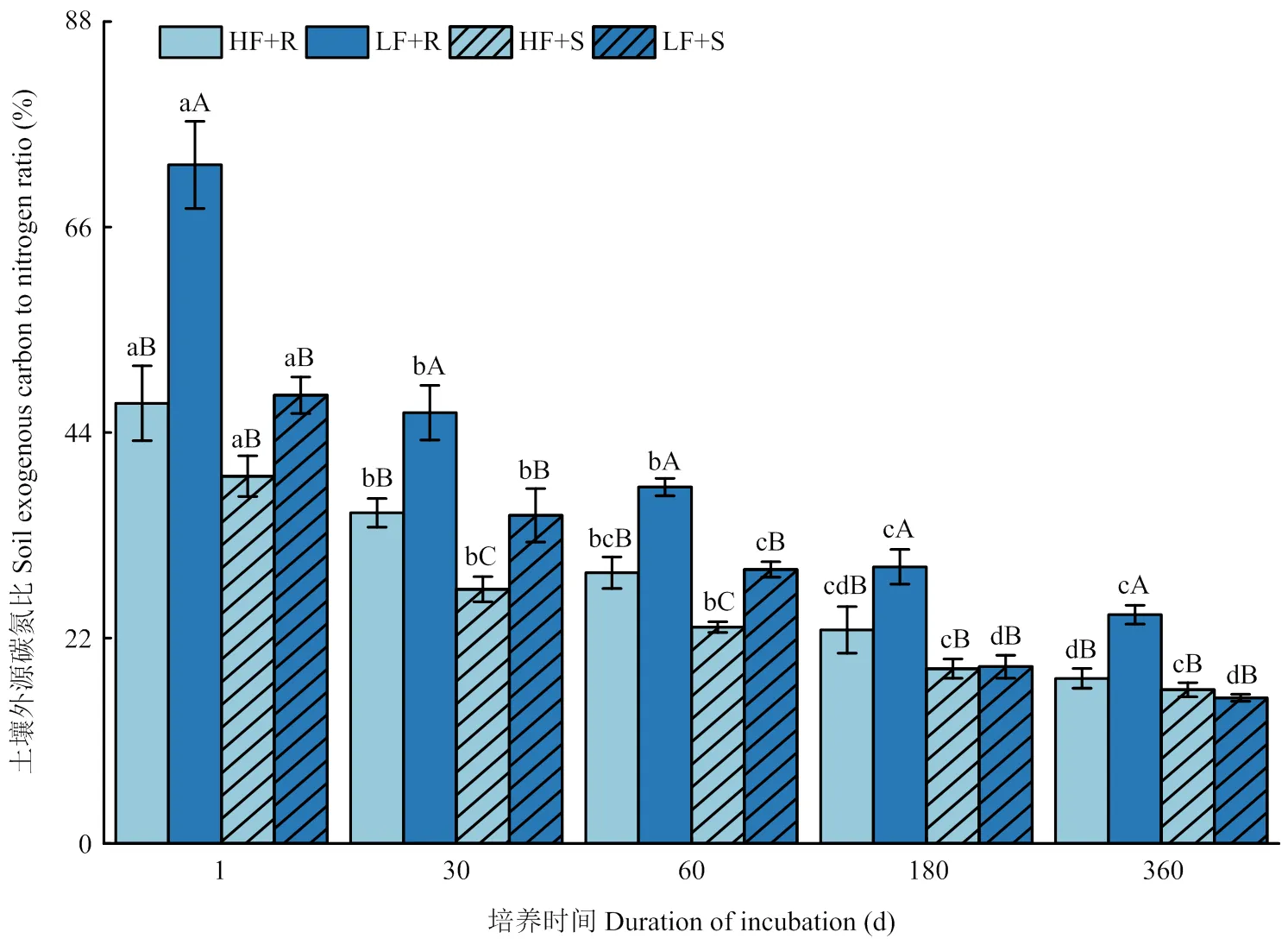
图5 不同处理下土壤13C/15N变化
3 讨论
3.1 玉米不同部位残体添加对土壤固碳的影响
植物残体是农田土壤有机碳(SOC)的主要来源,大量研究表明植物残体添加能够提高SOC含量[21-23]。本研究通过为期360 d的室内培养试验结果表明玉米残体添加显著提高了土壤总有机碳含量,进一步证明残体添加是提高土壤有机碳含量的有效途径,尤其是在有机碳含量较低的土壤上,由于其本身有机碳含量低,所以等量外源残体碳的添加对低肥力土壤总SOC的提升幅度更加显著。
添加不同类型的植物残体对土壤SOC的提升程度在整个试验期间内平均条件下相似,但在不同分解时期却表现出明显的不同:与对照相比,添加根茬处理使总SOC的提升在前期高于添加茎叶处理,而在后期则低于添加茎叶处理,表明茎叶残体碳在土壤中的固定与传统上所认为的不易分解的木质素含量高的根茬碳更易被固定下来的观点并不完全一致,甚至在残体分解的后期与传统观点相反[9],然而,近些年也有一些研究结果与我们的发现保持一致。这些研究指出植物来源的木质素在土壤中稳定性不高,反而易被土壤微生物分解,茎叶残体成为了土壤碳固定的潜在来源[24-25]。本研究的同位素标记结果发现,试验前期(60 d以前)添加茎叶残体处理的外源新碳含量高于添加根茬处理,而老碳与之相反,即添加茎叶残体处理低于添加根茬处理。而试验后期(180 d以后)则处理间外源新碳含量差异不再显著。因此,添加茎叶处理土壤总碳下降主要是由于土壤老碳分解造成的,而外源茎叶残体碳在培养初期反而相对地得到了一定的保护;反之添加根茬残体处理土壤中主要是外源新碳受到分解,原有老碳相对地受到了一定的保护。从另一个角度来讲,茎叶残体碳对土壤原有有机碳分解具有更大的激发效应。有研究指出[26-27],由于作物根系一方面在土壤中生长衰亡不断向土壤中提供根系残体,另一方面作物收获后根系往往被残留在土壤中,因此,相较于植株地上部分,土壤微生物群落更适应于分解利用土壤根茬残体有机碳,也更倾向于获取和利用作物根茬残体。这可能是本研究发现的茎叶残体碳易于固定且对土壤老碳产生更大激发效应的原因。随着试验的进行,不同残体类型之间的差异最终不再显著,这表明,残体类型造成的外源碳固定差异只发生在其固碳过程的早期,它们最终(360 d)的固碳率相一致。
不同土壤肥力状况下有63.4%—73.9%的外源残体碳在试验结束(360 d)时被分解,也就是大部分外源碳在添加一年内被分解了,只有26.1%—36.7%的外源碳还被固定在土壤中。其中,在试验结束时低肥力土壤中外源碳被分解的量较高肥力土壤更多,即其固定下来的外源碳更少,但低肥力土壤SOC中外源新碳的贡献率却显著高于高肥力土壤,达33.7%。低肥力土壤有机碳含量较低,养分长期处于缺乏状态,不利于土壤微生物的生长,然而一旦有外源碳输入,土壤微生物对于能量和养分的需求得到满足,便会对外源碳进行更加激烈地分解,导致低肥力土壤中外源碳的固定减少[28]。然而,即便如此,由于低肥力土壤初始有机碳含量较低,外源碳对于土壤有机碳的贡献还是要高于高肥力土壤。另外,研究结果还显示,在低肥力土壤中添加不同类型残体后外源新碳的含量有显著差异,而在高肥力土壤中添加则差异不显著,这可能是由于在高肥力土壤中有机碳含量高的背景下残体类型所产生的固碳差异被掩盖[21],表明土壤肥力水平的高低是影响土壤固碳的主要因素,而残体类型的影响次之。
3.2 玉米不同部位残体添加对土壤固氮的影响
土壤全氮在试验期间呈现下降趋势,但下降幅度不大,这表明土壤中有部分氮素产生了损失,可能是土壤中的反硝化作用使土壤氮转化为氮气和氮的氧化物等气体排出土壤导致的,但是这部分损失相对较少,在0.31—0.44 g·kg-1范围内。李忠徽[29]通过为期360 d的培养试验探究有机肥配施化肥对土壤氮矿化特征的影响,发现土壤全氮随培养时间延长呈现逐渐下降的趋势,并指出这是由于反硝化作用所造成的。土壤15N同位素结果表明,土壤中原有老氮和外源新氮均随培养时间逐渐下降,因此我们推测土壤全氮的下降可能是由老氮和新氮的反硝化消耗共同贡献的。但是高肥力和低肥力土壤对于不同类型残体氮的反硝化消耗程度是不一样的。有研究指出[30]高肥力土壤中来源于根茬的残体氮贡献率随时间下降,低肥力土壤中则是来源于茎叶的残体氮贡献率随时间下降,表明高肥力土壤更利于根茬氮的反硝化作用,而低肥力土壤则更利于茎叶氮的反硝化作用。研究表明高肥力土壤因其本身碳氮含量较高,尤其高碳量可直接为反硝化细菌提供能量和电子而促进反硝化,而且可以激发自养硝化和异养硝化,为反硝化提供底物。与此相反,LI等[31]研究发现提升土壤中氮素对土壤反硝化作用具有抑制作用。本研究中高肥力土壤和低肥力土壤中氮素的反硝化消耗均不大,但是对不同类型残体氮的消耗表现出一定的“偏好”,这可能是由微生物群落组成的差异所导致的[32]。
此外,研究还发现无论是在高肥力还是低肥力土壤中,添加茎叶残体处理的外源氮含量高于添加根茬残体处理,这可能是由于所添加的茎叶残体含氮量高于根茬造成的。同时,对于土壤老氮来说,低肥力土壤中添加茎叶处理土壤老氮含量小于添加根茬,但高肥力土壤中二者差异不显著。这表明相较于根茬残体来说,低肥力土壤中茎叶残体氮不易发生反硝化损失,而土壤中老氮的反硝化损失却受到了促进作用,表现出一定的激发作用现象。就根茬来看,其C/N较高,N素含量较低,在土壤中组分更稳定,不易被分解,因此土壤中的部分氮素会被微生物固持,减小其在土壤中的反硝化作用损失[33-34]。低肥力土壤中添加茎叶残体处理新氮对全氮贡献率高于高肥力土壤,而老氮贡献率低于高肥力土壤,进一步验证了这一结论。这与低肥力土壤中外源新碳的情况相类似,也佐证了低肥力土壤中的微生物群落对于氮素的利用倾向于利用更长时间接触和利用的根茬氮素,而非茎叶氮素这一推断。
3.3 玉米不同部位残体添加对土壤碳氮比的影响
土壤碳氮比(C/N)反映的是土壤中碳和氮之间的计量比情况,是土壤质量的敏感指标,该比值的变化可引起微生物活性及其对土壤碳和氮转化状况的改变,进而影响土壤碳氮固存[35]。添加玉米残体后,不论高肥力还是低肥力土壤的C/N均显著提高,且一直到试验结束时(360 d),虽然土壤C/N已经大幅下降,处理间差异也在不断缩小,但仍维持着高于不添加玉米残体处理这一趋势。这表明玉米残体的C/N对土壤C/N带来的影响较为深刻且持续时间长。多数研究[36-38]表明,秸秆还田后,部分氮素被释放并供土壤微生物利用,从而导致土壤C/N增加。但是由于低肥力土壤本身的碳氮含量较高肥力土壤低,因此外源残体碳氮对低肥力土壤C/N的提升幅度显著大于高肥力土壤,即外源残体所产生的影响对低肥力土壤更加深刻。
值得注意的是,根据同位素结果计算得到的土壤外源碳氮比(13C/15N)在添加不同类型残体条件下表现为,添加根茬处理大于添加茎叶处理,尤其是在低肥力土壤中,前者比后者高出43.6%,这种较大的差异在试验开始时最为明显,到了后期有所下降,但是仍保持较高水平。一般认为,外源残体C/N是影响其分解速度的重要因素。对于一般作物残体来说,C/N高则给微生物的生长活动带来相对的氮匮乏环境,阻碍植物残体的分解,有利于残体碳固定,反之,C/N低则氮素充分,有利于植物残体的分解[39-40],不利于残体碳固定。然而,本研究发现在低肥力土壤中添加根茬后13C/15N高的条件下,其残体碳的固定情况要低于与之相对的添加茎叶处理(图1)。这与传统的观点不一致。在本研究中,造成这种现象的可能原因再次与前文所阐述的土壤微生物群落更趋向于利用能够经常获得的根系相关有机碳、氮相关联。
4 结论
4.1 土壤中添加玉米残体可以有效提高土壤有机碳、氮含量。对于有机碳来说,虽然在培养系统内会受到土壤微生物的分解而随时间下降,但一年后试验结束时仍有这种提高效果,这表明秸秆还田对土壤有机碳固存的长效性。而对于土壤氮来说,由于培养系统内没有植物参与,因此,玉米残体添加后土壤系统中氮素损失较小,但是仍有一小部分氮素(0.31—0.44 g·kg-1)可能以反硝化变成气体的方式而流失到土壤系统之外,而外源玉米残体氮和土壤原有老氮均对这部分损失的氮素有贡献。
4.2 尽管添加玉米残体均能有利于土壤有机碳、氮库的提高,但玉米不同部位残体的影响机制不同,且外源残体碳对不同肥力水平土壤有机碳库的影响程度也不同。茎叶残体碳、氮较根茬残体碳、氮更多地被固定到土壤中,而添加茎叶残体促进了土壤原有老碳、氮的分解/损失,比根茬残体具有更强的激发效应;根茬残体则更趋向于被彻底分解为CO2释放到土壤系统之外,从而土壤老碳、氮得到一定的保护和固定。
4.3 对于不同肥力水平的土壤来说,尽管外源残体碳在低肥力土壤中分解得较多,导致其被固定下来的较少,但外源碳对低肥力土壤有机碳库提升的贡献率却十分重要。
4.4 本研究还发现外源残体的碳氮比并不是限制低肥力土壤中玉米残体分解和固定的主要因素,这主要是由于底物长期选择条件下的特异性土著土壤微生物群落较为稳定,对于外源有机质加入的干扰具有抵抗力造成的。
[1] SPRINGOB G, KIRCHMANN H. Bulk soil C to N ratio as a simple measure of net N mineralization from stabilized soil organic matter in sandy arable soils. Soil Biology and Biochemistry, 2003, 35(4): 629-632. doi:10.1016/S0038-0717(03)00052-X.
[2] ZHOU Z C, ZHANG X Y, GAN Z T. Changes in soil organic carbon and nitrogen after 26 years of farmland management on the Loess Plateau of China. Journal of Arid Land, 2015, 7(6): 806-813. doi:10. 1007/s40333-015-0051-y.
[3] 盖霞普, 刘宏斌, 翟丽梅, 杨波, 任天志, 王洪媛, 武淑霞, 雷秋良. 长期增施有机肥/秸秆还田对土壤氮素淋失风险的影响. 中国农业科学, 2018, 51(12): 2336-2347. doi:10.3864/j.issn.0578-1752.2018.12. 010.
GAI X P, LIU H B, ZHAI L M, YANG B, REN T Z, WANG H Y, WU S X, LEI Q L. Effects of long-term additional application of organic manure or straw incorporation on soil nitrogen leaching risk. Scientia Agricultura Sinica, 2018, 51(12): 2336-2347. doi:10.3864/ j.issn.0578-1752.2018.12.010. (in Chinese)
[4] 胡延斌, 肖国举, 仇正跻, 戴君丽, 李永平. 西北半干旱区农田土壤有机碳和全氮分布特征及其对地膜玉米产量的影响. 水土保持研究, 2021, 28(1): 58-64, 403. doi:10.13869/j.cnki.rswc.2021. 01.007.
HU Y B, XIAO G J, QIU Z J, DAI J L, LI Y P. Distribution characteristics of soil organic carbon and total nitrogen and its influence on film-mulched maize in farmland in northwest semiarid region. Research of Soil and Water Conservation, 2021, 28(1): 58-64, 403. doi:10.13869/j.cnki.rswc.2021.01.007. (in Chinese)
[5] WHITBREAD A, BLAIR G, KONBOON Y, LEFROY R, NAKLANG K. Managing crop residues, fertilizers and leaf litters to improve soil C, nutrient balances, and the grain yield of rice and wheat cropping systems in Thailand and Australia. Agriculture, Ecosystems & Environment, 2003, 100(2/3): 251-263. doi:10.1016/S0167-8809(03) 00189-0.
[6] ABIVEN S, RECOUS S, REYES V, OLIVER R. Mineralisation of C and N from root, stem and leaf residues in soil and role of their biochemical quality. Biology and Fertility of Soils, 2005, 42(2): 119. doi:10.1007/s00374-005-0006-0.
[7] RASSE D P, RUMPEL C, DIGNAC M F. Is soil carbon mostly root carbon? Mechanisms for a specific stabilisation. Plant and Soil, 2005, 269(1): 341-356. doi:10.1007/s11104-004-0907-y.
[8] KLOTZBÜCHER T, KAISER K, GUGGENBERGER G, GATZEK C, KALBITZ K. A new conceptual model for the fate of lignin in decomposing plant litter. Ecology, 2011, 92(5): 1052-1062. doi:10. 1890/10-1307.1.
[9] COTRUFO M F, WALLENSTEIN M D, BOOT C M, DENEF K, PAUL E. The Microbial Efficiency-Matrix Stabilization (MEMS) framework integrates plant litter decomposition with soil organic matter stabilization: Do labile plant inputs form stable soil organic matter? Global Change Biology, 2013, 19(4): 988-995. doi:10.1111/ gcb.12113.
[10] 王楠, 陈殿元, 张晋京, 姜帅, 付加禹, 杨溥原, 刘占宇. 施氮水平对基础肥力不同的玉米田土壤有机碳组分数量的影响. 玉米科学, 2016, 24(6): 114-119. doi:10.13597/j.cnki.maize.science. 20160619.
WANG N, CHEN D Y, ZHANG J J, JIANG S, FU J Y, YANG P Y, LIU Z Y. Effect of nitrogen applied levels on the amounts of organic C components from corn field soils with different basic fertilities. Journal of Maize Sciences, 2016, 24(6): 114-119. doi:10.13597/j.cnki. maize.science.20160619. (in Chinese)
[11] 盖霞普, 刘宏斌, 杨波, 王洪媛, 翟丽梅, 雷秋良, 武淑霞, 任天志. 不同施肥年限下作物产量及土壤碳氮库容对增施有机物料的响应. 中国农业科学, 2019, 52(4): 676-689. doi:10.3864/j.issn.0578-1752. 2019.04.009.
GAI X P, LIU H B, YANG B, WANG H Y, ZHAI L M, LEI Q L, WU S X, REN T Z. Responses of crop yields, soil carbon and nitrogen stocks to additional application of organic materials in different fertilization years. Scientia Agricultura Sinica, 2019, 52(4): 676-689. doi:10.3864/j.issn.0578-1752.2019.04.009. (in Chinese)
[12] 郭策, 高雪莹, 王鸿斌, 隋标, 赵兰坡, 赵兴敏. 玉米秸秆添加对不同母质黑钙土有机碳含量及团聚体稳定性的影响. 吉林农业大学学报, 2021. http://kns.cnki.net/kcms/detail/22.1100.S. 20200602. 1039.006.html.
GUO C, GAO X Y, WANG H B, SUI B, ZHAO L P, ZHAO X M. Effects of maize straw incorporation on the content of organic carbon and stability of aggregates in Chernozem derived from different parent materials. Journal of Jilin Agricultural University, 2021. http:// kns.cnki.net/kcms/detail /22.1100.S.20200602.1039.006.html. (in Chinese)
[13] GE T D, LI B Z, ZHU Z K, HU Y J, YUAN H Z, DORODNIKOV M, JONES D L, WU J S, KUZYAKOV Y. Rice rhizodeposition and its utilization by microbial groups depends on N fertilization. Biology and Fertility of Soils, 2017, 53(1): 37-48. doi:10.1007/s00374-016- 1155-z.
[14] WU L, XU H, XIAO Q, HUANG Y P, SULEMAN M M, ZHU P, KUZYAKOV Y, XU X L, XU M G, ZHANG W J. Soil carbon balance by priming differs with single versus repeated addition of glucose and soil fertility level. Soil Biology and Biochemistry, 2020, 148: 107913. doi:10.1016/j.soilbio.2020.107913.
[15] WEI L, GE T D, ZHU Z K, LUO Y, YANG Y H, XIAO M L, YAN Z F, LI Y H, WU J S, KUZYAKOV Y. Comparing carbon and nitrogen stocks in paddy and upland soils: Accumulation, stabilization mechanisms, and environmental drivers. Geoderma, 2021, 398: 115121. doi:10.1016/j.geoderma.2021.115121.
[16] 张玉铭, 胡春胜, 陈素英, 王玉英, 李晓欣, 董文旭, 刘秀萍, 裴林, 张惠. 耕作与秸秆还田方式对碳氮在土壤团聚体中分布的影响. 中国生态农业学报(中英文), 2021, 29(9): 1558-1570. doi:10.13930/ j.cnki.cjea.200791.
ZHANG Y M, HU C S, CHEN S Y, WANG Y Y, LI X X, DONG W X, LIU X P, PEI L, ZHANG H. Effects of tillage and straw returning method on the distribution of carbon and nitrogen in soil aggregates. Chinese Journal of Eco-Agriculture, 2021, 29(9): 1558-1570. doi:10. 13930/j.cnki.cjea.200791. (in Chinese)
[17] 陈春兰, 陈安磊, 魏文学, 张文钊, 傅心赣, 周华军, 秦红灵. 长期施肥对红壤稻田剖面土壤碳氮累积的影响. 水土保持研究, 2021, 28(2): 14-20. doi:10.13869/j.cnki.rswc.2021.02.003.
CHEN C L, CHEN A L, WEI W X, ZHANG W Z, FU X G, ZHOU H J, QIN H L. Effect of long-term fertilization on accumulation of soil carbon and nitrogen in reddish paddy soil profiles. Research of Soil and Water Conservation, 2021, 28(2): 14-20. doi:10.13869/j.cnki.rswc. 2021.02.003. (in Chinese)
[18] AN T T, SCHAEFFER S, LI S Y, FU S F, PEI J B, LI H, ZHUANG J, RADOSEVICH M, WANG J K. Carbon fluxes from plants to soil and dynamics of microbial immobilization under plastic film mulching and fertilizer application using13C pulse-labeling. Soil Biology and Biochemistry, 2015, 80: 53-61. doi:10.1016/j.soilbio. 2014.09.024.
[19] CONRAD R, KLOSE M, YUAN Q, LU Y H, CHIDTHAISONG A. Stable carbon isotope fractionation, carbon flux partitioning and priming effects in anoxic soils during methanogenic degradation of straw and soil organic matter. Soil Biology and Biochemistry, 2012, 49: 193-199. doi:10.1016/j.soilbio.2012.02.030.
[20] BLAUD A, LERCH T Z, CHEVALLIER T, NUNAN N, CHENU C, BRAUMAN A. Dynamics of bacterial communities in relation to soil aggregate formation during the decomposition of13C-labelled rice straw. Applied Soil Ecology, 2012, 53: 1-9. doi:10.1016/j.apsoil.2011. 11.005.
[21] CASTELLANO M J, MUELLER K E, OLK D C, SAWYER J E, SIX J. Integrating plant litter quality, soil organic matter stabilization, and the carbon saturation concept. Global Change Biology, 2015, 21(9): 3200-3209. doi:10.1111/gcb.12982.
[22] 徐虎, 张敬业, 蔡岸冬, 王小利, 张文菊. 外源有机物料碳氮在红壤团聚体中的残留特征. 中国农业科学, 2015, 48(23): 4660-4668. doi:10.3864/j.issn.0578-1752.2015.23.007.
XU H, ZHANG J Y, CAI A D, WANG X L, ZHANG W J. Retention characteristic of carbon and nitrogen from amendments in different size aggregates of red soil. Scientia Agricultura Sinica, 2015, 48(23): 4660-4668. doi:10.3864/j.issn.0578-1752.2015.23.007. (in Chinese)
[23] 谢柠桧, 安婷婷, 李双异, 孙良杰, 裴久渤, 丁凡, 徐英德, 付时丰, 高晓丹, 汪景宽. 外源新碳在不同肥力土壤中的分配与固定. 土壤学报, 2016, 53(4): 942-950. doi:10.11766/trxb201512240476.
XIE N H, AN T T, LI S Y, SUN L J, PEI J B, DING F, XU Y D, FU S F, GAO X D, WANG J K. Distribution and sequestration of exogenous new carbon in soils different in fertility. Acta Pedologica Sinica, 2016, 53(4): 942-950. doi:10.11766/trxb201512240476. (in Chinese)
[24] LEHMANN J, KLEBER M. The contentious nature of soil organic matter. Nature, 2015, 528(7580): 60-68. doi:10.1038/nature16069.
[25] KUZYAKOV Y. Priming effects: Interactions between living and dead organic matter. Soil Biology and Biochemistry, 2010, 42(9): 1363-1371. doi:10.1016/j.soilbio.2010.04.003.
[26] WILLIAMS M A, MYROLD D D, BOTTOMLEY P J. Carbon flow from13C-labeled straw and root residues into the phospholipid fatty acids of a soil microbial community under field conditions. Soil Biology and Biochemistry, 2006, 38(4): 759-768. doi:10.1016/j. soilbio.2005.07.001.
[27] KONG A Y Y, SCOW K M, CÓRDOVA-KREYLOS A L, HOLMES W E, SIX J. Microbial community composition and carbon cycling within soil microenvironments of conventional, low-input, and organic cropping systems. Soil Biology and Biochemistry, 2011, 43(1): 20-30. doi:10.1016/j.soilbio.2010.09.005
[28] 杨艳华, 苏瑶, 何振超, 喻曼, 陈喜靖, 沈阿林. 还田秸秆碳在土壤中的转化分配及对土壤有机碳库影响的研究进展. 应用生态学报, 2019, 30(2): 668-676. doi:10.13287/j.1001-9332.201902. 026.
YANG Y H, SU Y, HE Z C, YU M, CHEN X J, SHEN A L. Transformation and distribution of straw-derived carbon in soil and the effects on soil organic carbon pool: A review. Chinese Journal of Applied Ecology, 2019, 30(2): 668-676. doi:10.13287/j.1001-9332. 201902.026. (in Chinese)
[29] 李忠徽. 有机肥在黄土高原土壤中的碳、氮周转特征[D]. 杨凌: 西北农林科技大学, 2018.
LI Z H. Characteristics of soil carbon and nitrogen turnover with organic fertilizer application on the Loess Plateau[D]. Yangling: Northwest A & F University, 2018. (in Chinese)
[30] 王敬, 程谊, 蔡祖聪, 张金波. 长期施肥对农田土壤氮素关键转化过程的影响. 土壤学报, 2016, 53(2): 292-304. doi:10.11766/ trxb201507130273.
WANG J, CHENG Y, CAI Z C, ZHANG J B. Effects of long-term fertilization on key processes of soil nitrogen cycling in agricultural soil: a review. Acta Pedologica Sinica, 2016, 53(2): 292-304. doi:10.11766/trxb201507130273. (in Chinese)
[31] LI Y K, LI B, GUO W Z, WU X P. Effects of nitrogen application on soil nitrification and denitrification rates and N2O emissions in greenhouse. Journal of Agricultural Science and Technology, 2015, 17(2): 519-530.
[32] ZHOU L Y, ZHOU X H, ZHANG B C, LU M, LUO Y Q, LIU L L, LI B. Different responses of soil respiration and its components to nitrogen addition among biomes: a meta-analysis. Global Change Biology, 2014, 20(7): 2332-2343. doi:10.1111/gcb.12490.
[33] 马力, 杨林章, 肖和艾, 殷士学, 夏立忠, 李运东, 刘国华. 长期施肥和秸秆还田对红壤水稻土氮素分布和矿化特性的影响. 植物营养与肥料学报, 2011, 17(4): 898-905.
MA L, YANG L Z, XIAO H A, YIN S X, XIA L Z, LI Y D, LIU G H. Effects of long-term fertilization and straw returning on distribution and mineralization of nitrogen in paddy soils in subtropical China. Plant Nutrition and Fertilizer Science, 2011, 17(4): 898-905. (in Chinese)
[34] 武星魁, 施卫明, 徐永辉, 闵炬. 长期不同化肥氮用量对设施菜地土壤氮素矿化和硝化作用的影响. 土壤, 2021. http://kns.cnki.net/ kcms/detail/32.1118.P.20211015.1726.002.html.
WU X K, SHI W M, XU Y H, MIN J. Effects of long-term different chemical nitrogen rates on soil nitrogen mineralization and nitrification in greenhouse vegetable field. Soils, 2021. http://kns.cnki.net/kcms/detail/32.1118.P.20211015.1726.002.html. (in Chinese)
[35] 任书杰, 曹明奎, 陶波, 李克让. 陆地生态系统氮状态对碳循环的限制作用研究进展. 地理科学进展, 2006, 25(4): 58-67. doi:10. 3969/j.issn.1007-6301.2006.04.007.
REN S J, CAO M K, TAO B, LI K R. The effects of nitrogen limitation on terrestrial ecosystem carbon cycle: a review. Progress in Geography, 2006, 25(4): 58-67. doi:10.3969/j.issn.1007-6301.2006.04. 007. (in Chinese)
[36] 安嫄嫄, 马琨, 王明国, 马占旗. 玉米秸秆还田对土壤团聚体组成及其碳氮分布的影响. 西北农业学报, 2020, 29(5): 766-775. doi:10. 7606/j.issn.1004-1389.2020.05.014.
AN Y Y, MA K, WANG M G, MA Z Q. Effect of maize straw returning to field on soil aggregates and their carbon and nitrogen distributions. Acta Agriculturae Boreali-Occidentalis Sinica, 2020, 29(5): 766-775. doi:10.7606/j.issn.1004-1389.2020.05.014. (in Chinese)
[37] 葛顺峰, 许海港, 季萌萌, 姜远茂. 土壤碳氮比对平邑甜茶幼苗生长和碳氮分配的影响. 植物生态学报, 2013, 37(10): 942-949. doi:10.3724/SP.J.1258.2013.00097.
GE S F, XU H G, JI M M, JIANG Y M. Effects of soil C:N on growth and distribution of nitrogen and carbon ofseedlings. Chinese Journal of Plant Ecology, 2013, 37(10): 942-949. doi:10. 3724/SP.J.1258.2013.00097. (in Chinese)
[38] 丘清燕, 梁国华, 黄德卫, 陈小梅. 森林土壤可溶性有机碳研究进展. 西南林业大学学报, 2013, 33(1): 86-96. doi:10.3969/j.issn.2095- 1914.2013.01.016.
QIU Q Y, LIANG G H, HUANG D W, CHEN X M. Advances in studies on soluble organic carbon in forest soils. Journal of Southwest Forestry College, 2013, 33(1): 86-96. doi:10.3969/j.issn.2095-1914. 2013.01.016. (in Chinese)
[39] COTRUFO M F, SOONG J L, HORTON A J, CAMPBELL E E, HADDIX M L, WALL D H, PARTON W J. Formation of soil organic matter via biochemical and physical pathways of litter mass loss. Nature Geoscience, 2015, 8(10): 776-779. doi:10.1038/ ngeo2520.
[40] RUBINO M, DUNGAIT J A J, EVERSHED R P, BERTOLINI T, ANGELIS P D, D’ONOFRIO A, LAGOMARSINO A, LUBRITTO C, MEROLA A, TERRASI F, COTRUFO M F. Carbon input belowground is the major C flux contributing to leaf litter mass loss: Evidences from a13C labelled-leaf litter experiment. Soil Biology and Biochemistry, 2010, 42(7): 1009-1016. doi:10.1016/ j.soilbio.2010.02. 018.
Carbon and Nitrogen Fixation Characteristics of Maize Root and Straw Residues in Brown Soil Under High and Low Fertility
LI JiaYan, SUN LiangJie, MA Nan, WANG Feng, WANG JingKuan
College of Land and Environment, Shenyang Agricultural University/Key Laboratory of Cultivated Land Conservation in Northeast China, Ministry of Agriculture and Rural Affairs, Shenyang 110866
【Objective】Straw returning to the field is one of important measures to increase soil carbon (C) fixation and to improve soil nutrient status. Studying the C and nitrogen (N) fixation characteristics of different parts of maize residues in the soil is of great significance for clarifying the C and N sequestration mechanism under straw returning. 【Method】This study was based on the long-term experiment station of Shenyang Agricultural University. The soils treated with no fertilization and organic fertilizer combined with chemical fertilizers were collected as low fertility (LF) and high fertility (HF) soils, respectively, and combined with13C and15N double-labeled maize residues. Maize stalk and leaf part (S) as well as root part (R) are mixed with collected soils, respectively, and incubated at 25℃. In the experiment, the samples were taken on the 1st, 30th, 60th, 180thand 360thdays to determine the total organic C (SOC), total N (TN) content, and their isotopic abundances, and to analyze C and N fixing dynamics of different parts of maize residues in the soil with different fertility levels. 【Result】Adding maize residues significantly increased soil SOC, and could still increase by 14.0% after one year. After adding maize residues, a small part of N in the soil system might be lost by denitrification, and both added N deriving from maize residues and native N in soil were contributed in the lost. Compared with the addition of root residues, the addition of straw residues was more conducive to retaining the added residual C and N, which had a stronger effect on stimulating the local C decomposition and N loss. In contrast, the root residues tended to be decomposed, while the native soil C and N were relatively protected. Although the fixation of added residual C in low-fertility soil was higher than that in high-fertility soil, the fixed added residual C presented a greater contribution to the promotion of C pool in the low-fertility soil. Under the treatment of residues addition, C/N and13C/15N (representing residue-deriving C/N in the soil) in low-fertility soil were significantly higher than those in high-fertility soil. However, the results showed that13C/15N was not the main factor limiting the decomposition and fixation of residues in low-fertility soil, which might be related to the distinctive soil microbial community favoring of utilizing the specific substrate under the long-term substrate selection. 【Conclusion】Adding maize residues from different parts of the soil could significantly increase soil carbon and nitrogen levels, but the immobilization strategies of new carbon/nitrogen in the residues and soil old carbon/nitrogen were different. The low-fertility soil had higher capacity to fix exogenous carbon and less fertility, and their fixation of residues in different parts was not affected by the limitation of C/N from exogenous residues in this study.
maize residue; soil fertility level; soil organic carbon and total nitrogen fixation; stable isotope labeling

10.3864/j.issn.0578-1752.2022.23.008
2021-11-10;
2022-12-24
国家自然科学基金(41977086)、国家重点研发计划(2021YFD1500202)
李佳燕,E-mail:jylfearless@126.com。通信作者孙良杰,E-mail:sunlj@syau.edu.cn。通信作者汪景宽,E-mail:jkwang@syau.edu.cn
(责任编辑 李云霞)
