玉米大豆根茬混合后的腐解特性*
2018-07-31武云霞杜勇利李淑贤覃思思温冰消黄家乐刘卫国杨文钰
王 莉, 周 涛, 刘 婷, 武云霞, 杜勇利, 李淑贤, 高 阳, 覃思思, 温冰消, 黄家乐, 刘卫国**, 杨文钰**
玉米大豆根茬混合后的腐解特性*
王 莉1, 周 涛1, 刘 婷1, 武云霞2, 杜勇利1, 李淑贤1, 高 阳1, 覃思思1, 温冰消1, 黄家乐1, 刘卫国1**, 杨文钰1**
(1. 四川农业大学农学院 成都 611130; 2. 四川农业大学水稻研究所 成都 611130)
玉米/大豆套作可显著提高粮食产量和养分利用效率。研究间套作作物根茬分解、养分释放规律及其对土壤生物学特性的影响, 对阐释该系统中作物养分高效利用具有重要意义。本研究采用室内培养方式, 控制根茬总量为2%(2 g根茬+98 g土壤), 分别设置单独的大豆根茬(S)和玉米根茬(M)及两种根茬按3∶1、1∶1和1∶3混合(分别表示为SM 3∶1、SM 1∶1和SM 1∶3)共5个不同根茬配比处理和1个不加根茬处理(CK), 动态测定根茬矿化速率, 碳、氮含量和土壤微生物量碳等指标。研究结果表明: 培养前9 d, 根茬矿化速率最快, 而后矿化速率逐渐降低, 到培养60 d后所有处理根茬矿化速率趋于稳定。整个培养周期内玉米根茬CO2累积释放量显著高于大豆根茬处理, 但SM 1∶3处理的CO2累积释放量始终高于其他处理。培养结束后, SM 1∶3处理的有机碳矿化量显著高于其他处理。根茬总碳含量在前10 d无显著变化, 10~60 d时显著降低, 后趋于平稳。培养结束后SM 1∶3处理的根茬碳含量相比初始值降低最多, 降幅达到24.8%, 其次是玉米根茬(M)处理, 降幅为21.4%, 大豆根茬(S)处理碳含量降低最少, 为9.7%。根茬总氮含量在前10 d显著降低, 10~100 d总氮含量显著增加。培养结束后大豆根茬(S)总氮含量最高, SM 1∶3处理总氮含量最低。土壤微生物量碳含量在培养周期内呈先增加后降低而后趋于平稳的变化规律。培养结束后与CK相比, SM 1∶3、SM 1∶1、M、S和SM 3∶1处理的土壤微生物量碳含量分别增加89.4%、58.8%、47.1%、41.2%和37.5%。因此, 玉米、大豆根茬混合后在土壤中的矿化速率、养分释放速率明显高于单一根茬处理, 且有利于土壤微生物的繁殖。在本试验所选的3种配比中, SM 1∶3的配置效果最佳。
玉米; 大豆; 根茬腐解; 养分释放; 土壤微生物量碳
间套作是一种基于生物多样性的生态农业种植体系, 在缓解粮食安全、保持土地可持续利用方面起到重要作用[1]。大量研究表明, 间套作不仅能提高粮食产量, 还能高效利用氮、磷等养分, 维持土壤肥力[2]。长期研究发现, 禾本科与豆科植物套作不仅能提高磷肥的利用效率, 同时能维持土壤磷含量在合理水平, 有利于土地资源可持续利用[3]。同时, 豆科植物与禾本科植物间套作, 受益于二者根系互作, 禾本科作物吸收豆科植物根际氮素, 解除由于高氮对豆科植物结瘤形成的氮阻遏现象, 从而提高整个体系的氮肥利用效率[4-5]。作物间的根系互作不仅直接有利于其养分吸收, 也通过调控土壤微生物群落促进土壤养分活化进而有利于植物吸收[6]。目前, 大量的研究致力于解析间套作作物间根系互作对整个体系增产增效的机理[2]。但是间套作体系下关于作物根茬分解、养分释放影响土壤生物化学特性变化的研究较少。间套作体系相对单作增加碳的固定主要来源于根系碳固定的贡献[7], 根系中碳氮又是影响根系分解、养分释放的主要因素。因此研究间套作作物根茬分解、养分释放对理解间套作土壤养分变化规律具有重要意义。
根茬是农田生态系统中土壤有机物归还的主要来源。禾本科与非禾本科间套作系统中, 作物根茬分解可能受由高质量和低质量残茬不同组分混合的互作, 增加其养分释放、转化[8]。衡量残茬质量的指标, 包括C/N比、木质素、纤维素含量等, 将不同的残茬混合, 会产生“残茬混合效应”, 即与单独残茬的平均矿化速率相比, 不同残茬混合后会促进或者抑制残茬自身的矿化分解[9-10]。这种现象经常发生在两种不同质量的根茬混合后的分解过程中[9], 如氮丰富的残茬会促进氮不足的残茬矿化[11-13]。在我国西南地区大力推广的玉米(L.)/大豆(L.)套作体系中, 玉米大豆仅共生35 d左右, 玉米收获后大豆单独生长100 d左右, 玉米根茬养分释放和对根区土壤环境的改变极大地影响着大豆的生长和养分吸收。同时在间套作体系中采用分带轮作的方式(即: 前茬为玉米后茬为大豆, 如此往复), 作物产量和养分吸收优于长期定位种植。研究表明, 玉米大豆根茬的碳氮比差异较大, 其分解速率存在较大差异。因此研究玉米与大豆根茬混合后的分解、养分释放规律, 对于理解玉米大豆套作体系土壤养分变化、养分供应具有重要意义。
本研究采用室内培养的方式, 将玉米和大豆根茬按不同比例混合后添加于长期种植玉米大豆套作的土壤中进行培养。通过测定根茬的分解速率, 碳、氮含量变化, 以及土壤微生物量碳变化, 探讨间套作体系下作物根系分解、养分释放的规律, 为丰富禾本科与豆科间套作体系土壤肥力可持续理论作贡献。
1 材料与方法
1.1 试验设计
以不同的玉米大豆根茬配比为研究因素, 同时设不加根茬的土壤作为对照, 设单独的大豆(S)、玉米(M)根茬, 及大豆玉米根茬按3∶1(SM 3∶1)、1∶1(SM 1∶1)、1∶3(SM 1∶3)比例混合培养以及不加根茬(CK)的空白对照, 共6个处理, 每个处理重复3次。培养试验开始前测定土壤含水量, 加蒸馏水至含水量为土壤田间持水量的80%, 预培养15 d以恢复土壤微生物活性。称取土样98 g(按烘干土计算), 根茬按2%的重量比(根茬总量为2 g)与土壤混合均匀后装入培养瓶, 在25 ℃培养箱中培养。在培养的第1 d、2 d、3 d、4 d、5 d、6 d、7 d、8 d、9 d、12 d、14 d、16 d、20 d、25 d、30 d、35 d、40 d、45 d、50 d、60 d、80 d、100 d取样测定并计算培养期内各处理CO2释放量, 每个处理重复3次, 并于培养的第0 d、10 d、30 d、60 d、100 d取各处理中的3个重复测定土壤微生物量碳以及剩余根茬的总氮和总碳含量。
1.2 试验材料
玉米、大豆根茬与土壤均采自四川农业大学仁寿试验基地, 该试验田常年采用玉米大豆套作种植模式, 土壤类型为紫色土。采集试验田0~20 cm的土壤, 剔除作物根、石块等杂物, 自然风干, 磨细过2 mm筛备用。土样的基础理化性状为: 全氮1.3 g×kg-1, 速效氮115 mg×kg-1, 速效磷15.2 mg×kg-1, 速效钾118 mg×kg-1, 有机质1.98 g×kg-1, pH 6.75, C/N为8.7。试验所用根茬基本特性如表1所示。
玉米灌浆期, 砍去地上部, 用铁锹在试验田收集0~20 cm深度的玉米根茬, 带回实验室后洗去泥土, 90 ℃杀青0.5 h, 60 ℃烘干, 用剪刀将其剪成1 cm长的小段。大豆R7时, 剪去地上部, 用铁锹在试验田收集0~15 cm深度的大豆根茬, 带回实验室后洗去泥土, 90 ℃杀青0.5 h, 60 ℃烘干, 用剪刀将其剪成1 cm长的小段。

表1 试验用作物根茬的基本特性
1.3 分析项目及测定方法
根茬有机碳矿化量通过土壤CO2释放量计算。CO2释放量采用碱液吸收法测定[14], 将盛有10 mL 1 mol×L-1NaOH的塑料瓶和土样置于同一外瓶中, 加盖密封, 置于25 ℃恒温培养箱中。内瓶用细塑料线悬挂于外瓶中, 保证内瓶不与土接触。采样的同时打开外瓶数分钟更新瓶中的空气, 并用称重法保持其含水量。1 mol×L-1BaCl2沉淀, 1 mol×L-1盐酸溶液滴定剩余NaOH溶液, 根据NaOH消耗量计算培养期间CO2释放量。
根茬有机碳矿化量计算公式为:
=60×[(10–(–0)) (1)
式中:为有机碳矿化量[mg(CO2-C)×kg-1(soil)],为盐酸含量,为各处理滴定剩余NaOH消耗的盐酸量(mL),0为滴定对照处理土壤消耗NaOH消耗的盐酸量(mL) 。
土壤微生物量碳(soil microbial biomass carbon, SMBC)测定采用氯仿熏蒸浸提法[15], 用0.5 mol×L-1K2SO4浸提(水土比5∶1), 用TOC仪测定。土壤微生物量碳以熏蒸和未熏蒸土壤的碳含量之差除以转化系数EC得到(EC= 0.45)。
根茬、土壤全氮采用杜马斯全自动定氮仪直接测定, 全碳用TOC仪直接测定。在培养的第0 d、10 d、30 d、60 d、100 d将根茬从土壤中挑选出来, 65 ℃烘干、磨细过100目筛备用。
1.4 数据处理方法
数据采用Microsoft Excel 2010进行处理和作图, 利用SPSS 19.0进行方差分析。用LSD法比较不同处理间根茬有机碳矿化量、碳含量、氮含量以及土壤微生物量碳的差异。
2 结果与分析
2.1 不同根茬配比处理土壤CO2释放动态变化
不同根茬配比处理土壤CO2释放速率如图1所示。培养前9 d各处理的CO2释放速率均较高, 而后释放速率逐渐降低, 到培养60 d后所有处理CO2释放速率均趋于稳定。其中, 添加根茬处理的CO2释放速率显著高于未添加处理, 而不同根茬配比处理间CO2释放速率无明显差异。添加根茬的土壤CO2释放量与对照土壤CO2释放的差值反映了培养过程中根茬有机碳的表观矿化量。各处理根茬有机碳矿化量随时间变化呈逐渐增加趋势, 培养前9 d的增长量最大, 但各处理间的差异并不明显(图1)。随着培养时间延长, 根茬有机碳矿化量增加速率变慢, 但SM 1∶3处理根茬有机碳矿化量始终高于其他处理, 培养结束时, SM 1∶3处理根茬有机碳矿化量显著高于其他处理, 而其他处理间差异不显著。
S: 大豆根茬; M: 玉米根茬; SM 3∶1: 大豆根茬∶玉米根茬=3∶1; SM 1∶1: 大豆根茬∶玉米根茬=1∶1; SM 1∶3: 大豆根茬∶玉米根茬=1∶3; CK: 未加根茬。曲线上方浮动靶(LSD值)表示各处理的<0.05水平差异显著。S: soybean root residue; M: maize root residue; SM 3∶1: mixture of soybean root residue and maize root residue in the weight ratio of 3∶1; SM 1∶1: mixture of soybean root residue and maize root residue in the weight ratio of 1∶1; SM 1∶3: mixture of soybean root residue and maize root residue in the weight ratio of 1∶3; CK: soil incubated without crop root residue. LSD (0.05) among different treatments is shown by floating bars.
2.2 腐解过程中根茬的总碳含量动态变化
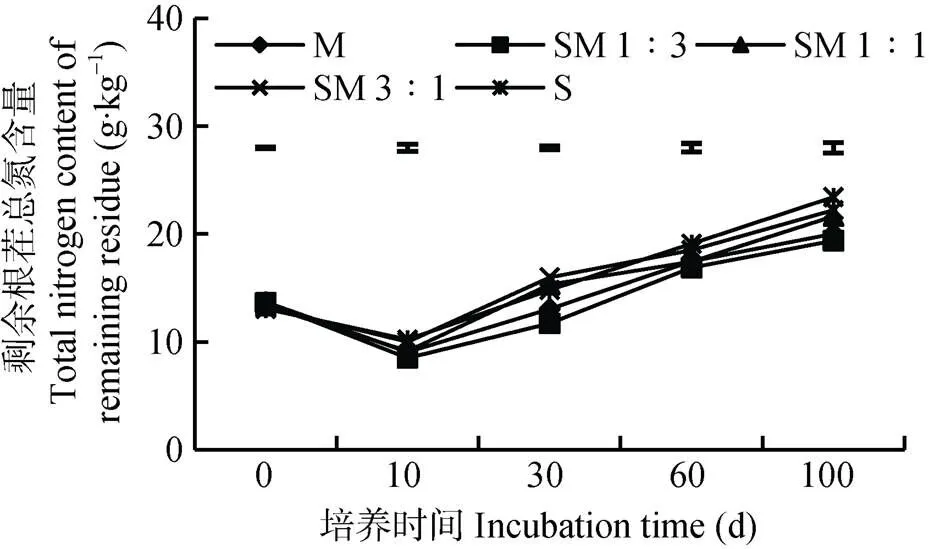
腐解过程中根茬的总碳含量变化总体分为3个阶段, 0~10 d根茬总碳含量无显著变化, 10~60 d根茬总碳含量显著下降, 而60~100 d各处理的总碳含量变化趋于平稳(图2)。大豆根茬的初始碳含量显著高于玉米根茬, 各处理的初始碳含量分别为S>SM 3∶1>SM 1∶1>SM 1∶3>M。从培养第10 d开始SM 1∶3处理的碳含量显著低于S处理, 而后各处理碳含量整体呈现SM 1∶3 图2 不同配比处理根茬腐解过程中总碳含量动态变化 S: 大豆根茬; M: 玉米根茬; SM 3∶1: 大豆根茬∶玉米根茬=3∶1; SM 1∶1: 大豆根茬∶玉米根茬=1∶1; SM 1∶3: 大豆根茬∶玉米根茬=1∶3; CK: 未加根茬。曲线上方浮动靶(LSD值)表示各处理的0.05水平差异显著。S: soybean root residue; M: maize root residue; SM 3∶1: mixture of soybean root residue and maize root residue in the weight ratio of 3∶1; SM 1∶1: mixture of soybean root residue and maize root residue in the weight ratio of 1∶1; SM 1∶3: mixture of soybean root residue and maize root residue in the weight ratio of 1∶3; CK: soil incubated without crop root residue. LSD (0.05) among different treatments is shown by floating bars. 腐解过程中各处理根茬的总氮含量变化总体分为两个阶段, 0~10 d总氮含量显著降低, 10~100 d总氮含量显著增加(图3)。大豆根茬初始总氮含量略低于玉米根茬, 但各玉米、大豆根茬配比处理间无显著差异。从培养第10 d开始, SM 1∶3处理的根茬总氮含量显著低于其他处理, 随着培养时间延长, 各处理间的总氮含量总体呈现SM 1∶3 图3 不同配比处理根茬腐解过程中根茬的总氮含量动态变化 Fig. 3 Dynamics of total nitrogen contents of remaining root residues of mixtures with different ratios of maize and soybean root residues S: 大豆根茬; M: 玉米根茬; SM 3∶1: 大豆根茬∶玉米根茬=3∶1; SM 1∶1: 大豆根茬∶玉米根茬=1∶1; SM 1∶3: 大豆根茬∶玉米根茬=1∶3; CK: 未加根茬。曲线上方浮动靶(LSD值)表示各处理的0.05水平差异显著。S: soybean root residue; M: maize root residue; SM 3∶1: mixture of soybean root residue and maize root residue in the weight ratio of 3∶1; SM 1∶1: mixture of soybean root residue and maize root residue in the weight ratio of 1∶1; SM 1∶3: mixture of soybean root residue and maize root residue in the weight ratio of 1∶3; CK: soil incubated without crop root residue. LSD (0.05) among different treatments is shown by floating bars. 由图4可知, 土壤微生物量碳含量在培养周期内呈先增加后降低而后趋于平稳的变化规律。且添加根茬处理土壤微生物量碳含量在培养过程中均显著高于未添加根茬处理。在整个培养过程中, SM 1∶3处理土壤SMBC含量最高, 其次是SM 1∶1处理。培养100 d时, 与空白相比, SM 1∶3增加89.4%, SM 1∶1增加58.8%, M增加47.1%, S增加41.2%, SM 3∶1增加37.5%。 图4 不同根茬配比处理下土壤微生物量碳含量(SMBC)动态变化 S: 大豆根茬; M: 玉米根茬; SM 3∶1: 大豆根茬∶玉米根茬=3∶1; SM 1∶1: 大豆根茬∶玉米根茬=1∶1; SM 1∶3: 大豆根茬∶玉米根茬=1∶3; CK: 未加根茬。曲线上方浮动靶(LSD值)表示各处理的0.05水平差异显著。S: soybean root residue; M: maize root residue; SM 3∶1: mixture of soybean root residue and maize root residue in the weight ratio of 3∶1; SM 1∶1: mixture of soybean root residue and maize root residue in the weight ratio of 1∶1; SM 1∶3: mixture of soybean root residue and maize root residue in the weight ratio of 1∶3; CK: soil incubated without crop root residue. LSD (0.05) among different treatments is shown by floating bars. 根茬施入土壤后的分解过程是微生物主导的生物化学过程。而微生物的繁殖主要依赖于环境中的碳和氮源。植物残体中包括易分解组分(如糖类、淀粉、脂肪等)和难分解组分(如木质素、多酚等)[16]。因此植物残体在土壤中培养初期, 易分解组分快速分解, 促进了微生物的生长。本研究结果显示, 在培养初期根茬总氮含量迅速下降, 同时伴随高速率的CO2释放和快速增长的土壤微生物量碳, 而根茬的总碳含量并没有明显变化。可能是因为在根茬矿化分解前期, 氮作为限制营养元素, 微生物的生长繁殖需要大量的氮源, 导致根茬的氮含量急剧减少, 而根茬碳含量略微增加[17]。随着培养时间延长, 根茬分解速率变慢。因为培养一段时间后, 易分解组分先被微生物利用, 难分解组分后矿化, 表现出氮素的利用快于碳的利用, 这与蔡苗等[18]的研究结果一致。同时培养后期, 根茬碳含量急剧下降, 而总氮含量急剧增加, 可能是经过前10 d的培养, 土壤微生物大量繁殖(由微生物量碳指标可证), 而微生物生长繁殖需要消耗大量碳源。根茬中总碳含量占35%~40%左右, 而总氮含量仅占1.3%左右, 碳含量的改变极易改变氮含量。微生物大量生长繁殖时消耗了大量的碳源, 导致剩余根茬的氮含量增加。 作物残茬矿化速率与其碳、氮含量及C/N比密切相关[19]。作物残茬C/N比较低时, 会影响植物养分有效性、土壤物理生物学特性, 矿化也会更快[20]。氮含量通过影响微生物的生理学适应性来影响残茬前期腐解速度, 因此初始氮含量较高(或C/N比低)的残茬分解速度更快[21-22]。前人研究玉米大豆根茬矿化分解特性时发现, 大豆根茬矿化分解的速率高于玉米, 主要得益于大豆的C/N低于玉米[23-24]。而本试验结果显示, 玉米根茬的分解速度快于大豆, 这与前人的研究结果相矛盾。可能是因为本研究中, 玉米取样时间为玉米灌浆期初期(根系具有较强活力, 衰老不明显), 大豆为R7时期(根系基本失活, 完全衰老), 因此测得玉米根茬的氮含量高于大豆根茬, 而根茬总碳含量为大豆高于玉米, 从而导致大豆根茬的C/N比高于玉米, 同时大豆根茬木质素含量显著高于玉米。Vachon等[23]发现残茬木质素、纤维素含量与其降解速率呈反比。这与本试验中大豆木质素含量高分解速度慢的结果一致。 不同质量的作物残茬, 其化学性质有很大差异, 而残茬腐解过程中的微生物量、胞外酶活性以及腐解过程中的副产品包括CO2和可溶性无机氮等都与其化学性质有关[21,25]。Salamanca等[21]发现, 生物活动在残茬腐解后期有重要作用, 残茬腐解过程中, 混合后残茬相对于单一残茬腐解速度更快。Chapman等[8]发现高质量和低质量作物残茬混合后的互作会通过增强动物区系的活动和残茬间的养分转换来影响残茬腐解。本研究发现玉米根茬的质量优于大豆, 将二者按一定比例混合后其分解速率较玉米大豆根茬本身有较大差异。其中SM 1∶3处理的根茬分解速率明显快于其他处理, 表现为更多的碳、氮释放和土壤微生物量碳显著增加。说明SM 1∶3处理根茬矿化分解最快, 可能是因为两种根茬混合后产生了“协同效应”, 即有不同化学物理属性的另一种残茬组分存在会通过形成更好的通气条件来允许养分转换从而改善根茬腐解的微环境[21]。在玉米大豆套作体系中, 玉米的生物量远高于大豆, 作物根茬向土壤输入的碳大部分来自于玉米, 因此玉米在该系统中占据主导地位[23]。Cong等[26]发现将C/N比不同的蚕豆(L.)和玉米的根茬混合后, 产生了一种正根茬混合效应, 即混合培养比单独培养的根茬分解速率快2%。在本试验中, 向玉米根茬中添加一点具有与之不同特性的大豆根茬, 特别是玉米∶大豆=3∶1的配比, 发现其矿化速率并不是两者在数学上的简单计算, 而是同时高于两者单独培养的矿化速率。因为大豆根茬木质素含量高, 分解速度慢, 其在土壤中增加土壤孔隙从而使通气性增加, 从而有利于整个处理的根茬分解。因此, 在间套作体系中, 特别是禾本科和豆科植物根系互作后的根茬分解速率和根茬的养分释放速率明显高于单作。同时玉米大豆根系混合更有利于土壤微生物的繁殖, 有利于改善土壤养分有效性。 混合后的玉米、大豆根茬分解速率、养分释放速率及其对土壤微生物增殖的促进能力明显强于单一玉米或大豆根茬, 在本试验所选的3种配比中, SM 1∶3的配置效果最佳。两种作物根茬混合后不仅可以促进自身的养分释放, 同时促进根际微生物增殖, 进而达到提高土壤养分(如磷)有效性的作用。明确混合玉米大豆根茬的分解和养分释放规律, 有助于进一步理解禾本科和豆科作物套作体系土壤肥力可持续理论。 [1] BROOKER R W, BENNETT A E, CONG W F, et al. Improving intercropping: A synthesis of research in agronomy, plant physiology and ecology[J]. New Phytologist, 2015, 206(1): 107–117 [2] LI L, TILMAN D, LAMBERS H, et al. Plant diversity and overyielding: Insights from belowground facilitation of intercropping in agriculture[J]. New Phytologist, 2014, 203(1): 63–69 [3] XIA H Y, WANG Z G, ZHAO J H, et al. Contribution of interspecific interactions and phosphorus application to sustainable and productive intercropping systems[J]. Field Crops Research, 2013, 154: 53–64 [4] LI L, SUN J H, ZHANG F S, et al. Root distribution and interactions between intercropped species[J]. Oecologia, 2006, 147(2): 280–290 [5] LI Q Z, SUN J H, WEI X J, et al. Overyielding and interspecific interactions mediated by nitrogen fertilization in strip intercropping of maize with faba bean, wheat and barley[J]. Plant and Soil, 2011, 339(1/2): 147–161 [6] TANG X Y, PLACELLA S A, DAYDÉ F, et al. Phosphorus availability and microbial community in the rhizosphere of intercropped cereal and legume along a P-fertilizer gradient[J]. Plant and Soil, 2016, 407(1/2): 119–134 [7] CONG W F, HOFFLAND E, LI L, et al. Intercropping enhances soil carbon and nitrogen[J]. Global Change Biology, 2015, 21(4): 1715–1726 [8] CHAPMAN K, WHITTAKER J B, HEAL O W. Metabolic and faunal activity in litter of tree mixtures compared with pure stands[J]. Agriculture, Ecosystems & Environment, 1988, 24: 33–40 [9] WARDLE D A, BONNER K I, NICHOLSON K S. Biodiversity and plant litter: Experimental evidence which does not support the view that enhanced species richness improves ecosystem function[J]. Oikos, 1997, 79(2): 247–258 [10] HÄTTENSCHWILER S, TIUNOV A V, SCHEU S. Biodiversity and litter decomposition in terrestrial ecosystems[J]. Annual Review of Ecology, Evolution, and Systematics, 2005, 36: 191–218 [11] HARGUINDEGUY N P, BLUNDO C M, GURVICH D E, et al. More than the sum of its parts? Assessing litter heterogeneity effects on the decomposition of litter mixtures through leaf chemistry[J]. Plant and Soil, 2008, 303(1/2): 151–159 [12] VOS V C A, VAN RUIJVEN J, BERG M P, et al. Leaf litter quality drives litter mixing effects through complementary resource use among detritivores[J]. Oecologia, 2013, 173(1): 269–280 [13] HANDA I T, AERTS R, BERENDSE F, et al. Consequences of biodiversity loss for litter decomposition across biomes[J]. Nature, 2014, 509(7499): 218–221 [14] 文启孝. 土壤有机质研究法[M]. 北京: 农业出版社, 1984: 318 WEN Q X. Research Method of Soil Organic Matter[M]. Beijing: China Agriculture Press, 1984: 318 [15] 吴金水, 林启美, 黄巧云, 等. 土壤微生物生物量测定方法及其应用[M]. 北京: 气象出版社, 2006: 150 WU J S, LIN Q M, HUANG Q Y, et al. Soil Microbial Biomass-Methods and Application[M]. Beijing: China Meteorological Press, 2006: 150 [16] 胡希远, KUEHNE R F. 秸秆在土壤内分解初期氮素矿化与固持的模拟测定[J]. 应用生态学报, 2005, 16(2): 243–248 HU X Y, KUEHNE R F. Simulation of nitrogen mineralization and immobilization of crop straw during its initial decomposition in soil[J]. Chinese Journal of Applied Ecology, 2005, 16(2): 243–248 [17] MARY B, RECOUS S, DARWIS D, et al. Interactions between decomposition of plant residues and nitrogen cycling in soil[J]. Plant and Soil, 1996, 181(1): 71–82 [18] 蔡苗, 董燕婕, 李佰军, 等. 不同施氮处理玉米根茬在土壤中矿化分解特性[J]. 生态学报, 2013, 33(14): 4248–4256CAI M, DONG Y J, LI B J, et al. Decomposition characteristics of maize roots derived from different nitrogen fertilization fields under laboratory soil incubation conditions[J]. Acta Ecologica Sinica, 2013, 33(14): 4248–4256 [19] 王芸, 李增嘉, 韩宾, 等. 保护性耕作对土壤微生物量及活性的影响[J]. 生态学报, 2007, 27(8): 3384–3390 WANG Y, LI Z J, HAN B, et al. Effects of conservation tillage on soil microbial biomass and activity[J]. Acta Ecologica Sinica, 2007, 27(8): 3384–3390 [20] SHARMA A R, BEHERA U K. Recycling of legume residues for nitrogen economy and higher productivity in maize ()-wheat () cropping system[J]. Nutrient Cycling in Agroecosystems, 2009, 83(3): 197–210 [21] SALAMANCA E F, KANEKO N, KATAGIRI S. Effects of leaf litter mixtures on the decomposition ofandusing field and laboratory microcosm methods[J]. Ecological Engineering, 1998, 10(1): 53–73 [22] BOOTH M S, STARK J M, RASTETTER E. Controls on nitrogen cycling in terrestrial ecosystems: A synthetic analysis of literature data[J]. Ecological Monographs, 2005, 75(2): 139–157 [23] VACHON K, OELBERMANN M. Crop residue input and decomposition in a temperate maize-soybean intercrop system[J]. Soil Science, 2011, 176(4): 157–163 [24] SCHMATZ R, RECOUS S, AITA C, et al. Crop residue quality and soil type influence the priming effect but not the fate of crop residue C[J]. Plant and Soil, 2017, 414(1/2): 229–245 [25] MCDANIEL M D, GRANDY A S, TIEMANN L K, et al. Crop rotation complexity regulates the decomposition of high and low quality residues[J]. Soil Biology and Biochemistry, 2014, 78: 243–254 [26] CONG W F, HOFFLAND E, LI L, et al. Intercropping affects the rate of decomposition of soil organic matter and root litter[J]. Plant and Soil, 2015, 391(1/2): 399–411 Decomposition characteristics of mixed maize and soybean root residues* WANG Li1, ZHOU Tao1, LIU Ting1, WU Yunxia2, DU Yongli1, LI Shuxian1, GAO Yang1, QIN Sisi1, WEN Bingxiao1, HUANG Jiale1, LIU Weiguo1**, YANG Wenyu1** (1. College of Agronomy, Sichuan Agricultural University, Chengdu 611130, China; 2. Institute of Rice Science, Sichuan Agricultural University, Chengdu 611130, China) Maize/soybean intercropping system could potentially improve crop yield and nutrient-use efficiency. It is pivotal to elucidate nutrient efficiency of crop root residue decomposition, nutrient release and the related effects on soil biological characteristics in intercropping processes. In this laboratory incubation study, we set different combined ratios of maize and soybean root residues, including sole soybean (S), sole maize (M) root residues, S∶M=3∶1(SM 3∶1), S∶M=1∶1 (SM 1∶1), S∶M=1∶3 (SM 1∶3), with soil without residues (CK) as the control. The ratio of total weight of residues to soil in each treatment was 2∶98, in unit of gram (g). We dynamically measured the mineralization rate of residues, contents of total carbon and nitrogen of remained root residues and SMBC (soil microbial biomass carbon) content. The results showed that the mineralization rate of root residues was fastest during 0-9 days after incubation, which then gradually decreased after 9 days. After 60 days of incubation, the mineralization rate of root residues in all the treatments stabilized. During the whole incubation period, the cumulative release of CO2from maize roots was higher than that from soybean roots, but the cumulative release of CO2under SM 1∶3 treatment was always higher than the other treatments. The cumulative release of CO2under SM 1∶3 treatment was significantly higher than that under other treatments at the end of incubation. The content of total carbon in root residues had no significant change in the first 10 days, but decreased significantly during 10-60 days of incubation, after which it stabilized. At the end of incubation, total carbon content under SM 1∶3 treatment decreased by a maximum of 24.8% from the initial value, followed by maize root residue treatment (which decreased by 21.4%), and the decrease in carbon content of the soybean root residue treatment was minimum, which was 9.7%. Total nitrogen content decreased significantly in the first 10 days of incubation, and then increased significantly until the end of incubation. Total nitrogen content of soybean root residues was highest at the end of incubation, and SM 1∶3 treatment had the lowest. SMBC content first increased and then decreased during the incubation, followed by a steady change. At the end of incubation, SMBC content of SM 1∶3, SM 1∶1, M, S and SM 3∶1 were 89.4%, 58.8%, 47.1%, 41.2% and 37.5% higher than CK, respectively. Hence, the mixtures of maize and soybean root residues had higher mineralization and nutrient release than sole maize and soybean root residues. This was beneficial to the reproduction of soil microorganisms. Among the three ratios selected in this experiment, the SM 1∶3 had the best effects. Maize; Soybean; Root residue decomposition; Nutrition release; Soil microbial biomass carbon s: YANG Wenyu, E-mail: mssiyanawy@sicau.edu.cn; LIU Weiguo, E-mail: lwgsy@126.com Mar. 29, 2018; May 19, 2018 S158 A 1671-3990(2018)08-1190-07 10.13930/j.cnki.cjea.180316 * 国家自然科学基金项目(31771728, 31671626)资助 杨文钰, 主要从事作物高产优质高效栽培理论与技术研究, E-mail: mssiyanawy@sicau.edu.cn; 刘卫国, 主要从事作物高产优质高效栽培理论与技术研究, E-mail: lwgsy@126.com 王莉, 主要从事作物高产优质高效栽培与技术研究。E-mail: 724368238@qq.com 2018-03-29 2018-05-19 * This study was supported by the National Natural Science Foundation of China (31771728, 31671626). 王莉, 周涛, 刘婷, 武云霞, 杜勇利, 李淑贤, 高阳, 覃思思, 温冰消, 黄家乐, 刘卫国, 杨文钰. 玉米大豆根茬混合后的腐解特性[J]. 中国生态农业学报, 2018, 26(8): 1190-1196 WANG L, ZHOU T, LIU T, WU Y X, DU Y L, LI S X, GAO Y, QIN S S, WEN B X, HUANG J L, LIU W G, YANG W Y. Decomposition characteristics of mixed maize and soybean root residues[J]. Chinese Journal of Eco-Agriculture, 2018, 26(8): 1190-1196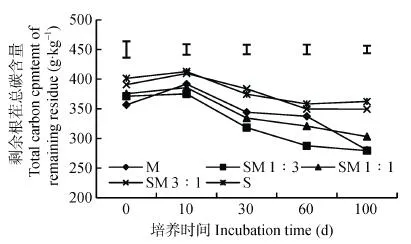
2.3 腐解过程中根茬的总氮含量动态变化
2.4 土壤微生物量碳(SMBC)含量动态变化

3 讨论
3.1 根茬在土壤中的分解特性
3.2 不同根茬特性对其分解速率的影响
3.3 不同配比大豆玉米根茬的分解变化差异
4 结论
