甲状腺滤泡性肿瘤及合并甲状腺乳头状癌患者的临床特征分析
2022-02-01周力潘钢彭友
周力 潘钢 彭友
甲状腺癌是内分泌系统中最常见的恶性肿瘤,近年来发病率不断升高[1]。根据GLOBOCAN 2020的统计,全球甲状腺癌发病率占恶性肿瘤的3.0%,在女性中占恶性肿瘤的5.1%[2]。甲状腺滤泡性肿瘤主要包括甲状腺滤泡癌(follicular thyroid carcinoma,FTC)、恶性潜能未定的肿瘤(undetermined malignant potential,UMP)、甲状腺滤泡性腺瘤(follicular adenomas,FA)[3]。虽然甲状腺滤泡性肿瘤和甲状腺乳头状癌(papillary thyroid carcinoma,PTC)均起源于滤泡上皮细胞,但两者同时发生却不多见。本文就甲状腺滤泡性肿瘤及合并PTC患者的临床特征进行回顾性分析,旨为甲状腺滤泡性肿瘤的诊治决策提供帮助,现报道如下。
1 对象和方法
1.1 对象 回顾2010年1月至2021年12月在杭州市第一人民医院接受手术治疗的76例甲状腺滤泡性肿瘤患者的临床资料,其中18例(23.68%)患者合并PTC。进一步整理患者的临床资料,记录患者人口学特征资料(性别、年龄)、临床病理学资料[PTC肿瘤大小、滤泡性肿瘤大小、是否合并桥本甲状腺炎(Hashimoto's thyroiditis,HT)等情况]。同时,本研究还收集患者实验室检查结果,包括T3、T4、游离三碘甲状腺原氨酸(serum free triiodothyronine,FT3)、游离甲状腺素(free thyroid hormone,FT4)、促甲状腺激素(thyroid stimulating hormone,TSH)、甲状腺球蛋白(thyroglobulin,TG)、甲状腺球蛋白抗体(thyroglobulin antibody,TGAb)、甲状腺过氧化物酶抗体(thyroid peroxidases antibody,TPOAb)。患者病理检查结果均由2位高年资病理科医师诊断,如2位医师诊断结果不统一,由第3位病理科医师共同参与诊断。本研究经本院医学伦理委员会批准。
1.2 方法
1.2.1 实验室指标检测 抽取患者清晨空腹外周静脉血3 ml,3 000 r/min离心10 min,分离血清。TG指标使用罗氏cobase 601电化学发光免疫分析仪通过电化学发光免疫分析法检测;T3、T4、FT3、FT4、TSH、TGAb、TPOAb等甲状腺功能指标采用西门子ADVIA Centaur XP化学发光免疫分析仪通过直接化学发光免疫分析法检测。所有操作均参照操作手册采用标准化操作方法进行。
1.2.2 手术方式 参照美国甲状腺学会的2015版分化型甲状腺癌诊治指南[4],结合患者术前评估情况制定手术方案。若单侧PTC患者合并同侧滤泡性肿瘤,且肿瘤无侵犯周围组织,则行患侧腺叶+同侧中央区淋巴结清扫;若单侧PTC合并对侧滤泡性肿瘤,则行甲状腺全切(近全切)+同侧中央区淋巴结清扫;若穿刺明确或影像学检查提示侧颈区淋巴结转移,则行侧颈区淋巴结清扫,范围常规包括Ⅱ、Ⅲ、Ⅳ及Ⅴb区淋巴结,Ⅰ、Ⅴa区有淋巴结转移时加做清扫,保留副神经、胸锁乳突肌、颈内动静脉等重要结构。全程采用精细化被膜解剖技术,常规暴露颈段喉返神经,尽量保留其分支,避免刺激、牵拉以及电刀、超声刀的热损伤。尽量原位保留甲状旁腺及血供。
1.3 观察指标 (1)分析甲状腺滤泡性肿瘤患者的基线资料;(2)比较3种不同类型的甲状腺滤泡性肿瘤患者的临床特征;(3)比较3种不同类型甲状腺滤泡性肿瘤合并PTC患者的临床特征;(4)比较甲状腺滤泡性肿瘤合并PTC患者与单纯甲状腺滤泡性肿瘤患者的临床特征;(5)分析甲状腺滤泡性肿瘤合并PTC的患者手术方式及术后病理诊断。
1.4 统计学处理 采用SPSS 22.0统计软件。正态分布的计量资料以表示,多组间比较采用单因素方差分析,两两比较采用LSD-t检验,两组间比较采用两独立样本t检验;非正态分布的计量资料以M(P25,P75)表示,多组间比较采用Kruskal-WallisH检验,两组间比较采用Mann-WhitneyU检验;计数资料以频数和构成比表示,组间比较采用χ2检验或Fisher确切概率法。P<0.05为差异有统计学意义。
2 结果
2.1 甲状腺滤泡性肿瘤患者基线资料 76例甲状腺滤泡性肿瘤患者中男18例,女58例;年龄(57.78±14.11)岁;FTC 30例,UMP 15例,FA 31例。术前,患者T3水平为(1.07±0.20)μg/L,T4水平为(83.78±16.95)μg/L,FT3水平为(4.64±0.61)ng/L,FT4水平为(16.36±2.67)ng/L;TSH水平为1.69(1.25,2.53)mU/L,TG水平为86.17(7.78,480.80)ng/ml,TGAb水平为25.25(15.00,51.25)kU/L,TPOAb 水平为 29.0(28.0,46.7) kU/L;滤泡性肿瘤直径(23.62±12.19)mm,19例患者合并HT。
2.2 3种不同类型的甲状腺滤泡性肿瘤患者临床特征比较 FTC、UMP、FA患者性别、年龄、术前T3、T4、FT3、FT4、TSH水平及是否合并HT、滤泡性肿瘤直径、是否合并PTC等比较差异均无统计学意义(均P>0.05)。FTC、UMP、FA患者术前TG水平比较差异有统计学意义(P<0.05),两两比较,FTC患者术前TG水平高于FA患者(P<0.05),而UMP患者与FTC、FA患者比较差异均无统计学意义(均P>0.05)。见表1。

表1 3种不同类型的甲状腺滤泡性肿瘤患者临床特征比较
2.3 3种不同类型的甲状腺滤泡性肿瘤合并PTC患者临床特征比较 18例甲状腺滤泡性肿瘤合并PTC患者中男4例,女14例;年龄(50.61±17.48)岁;FTC 7例,UMP 3例,FA 8例;滤泡性肿瘤直径(22.39±10.56)mm;PTC直径3(1,18)mm。FTC合并PTC、UMP合并PTC、FA合并PTC患者性别、年龄、术前T3、T4、FT3、FT4、TSH水平及是否合并HT、滤泡性肿瘤直径、是否合并PTC等比较差异均无统计学意义(均P>0.05)。FTC合并PTC、UMP合并PTC、FA合并PTC患者术前TG水平比较差异均有统计学意义(均P<0.05),两两比较,FTC合并PTC患者术前TG水平高于FA合并PTC患者(P<0.05),而UMP合并PTC患者与FTC合并PTC、FA合并PTC患者比较差异均无统计学意义(均P>0.05)。见表2。
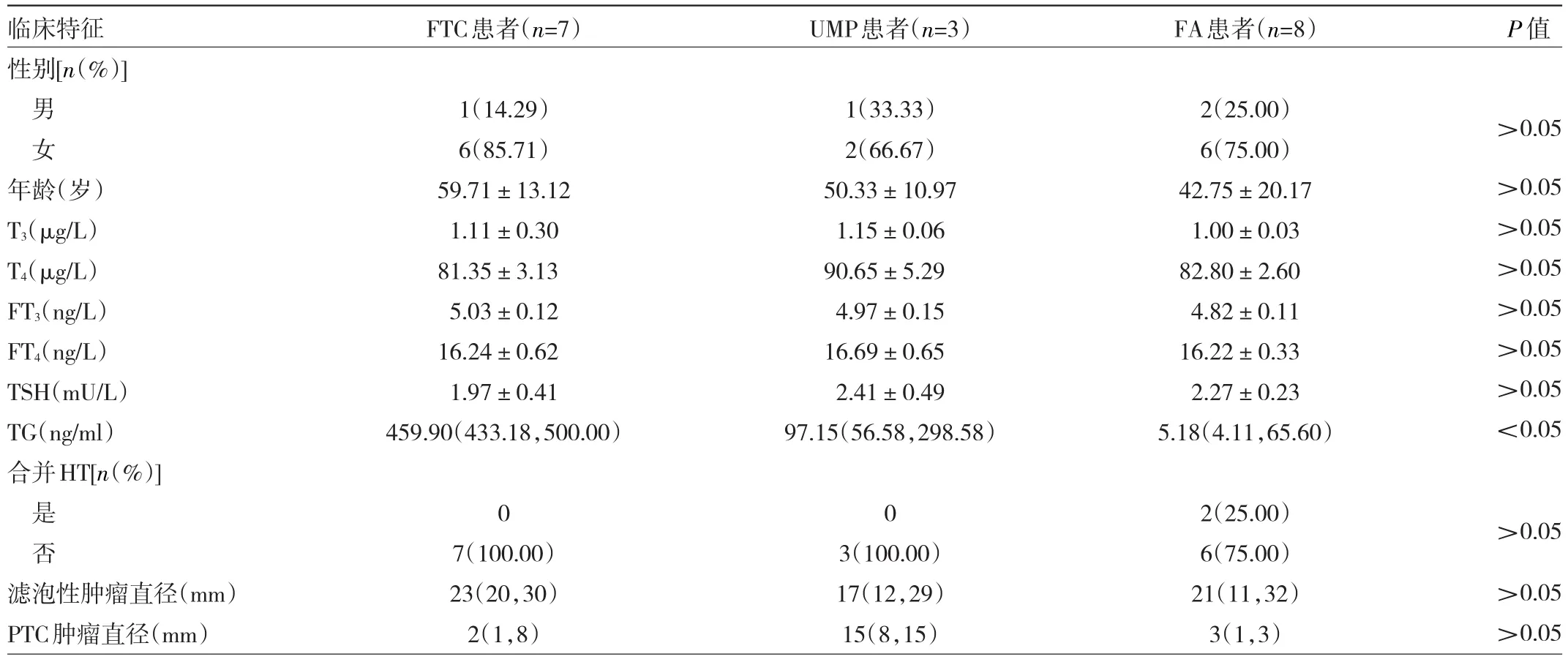
表2 3种不同类型的甲状腺滤泡性肿瘤合并PTC患者临床特征比较
2.4 甲状腺滤泡性肿瘤合并PTC患者与单纯甲状腺滤泡性肿瘤患者临床特征比较 甲状腺滤泡性肿瘤合并PTC患者与单纯甲状腺滤泡性肿瘤患者性别、年龄、术前T3、T4、FT3、FT4、TSH、TG水平及是否合并HT、滤泡性肿瘤类型比较差异均无统计学意义(均P>0.05),见表3。
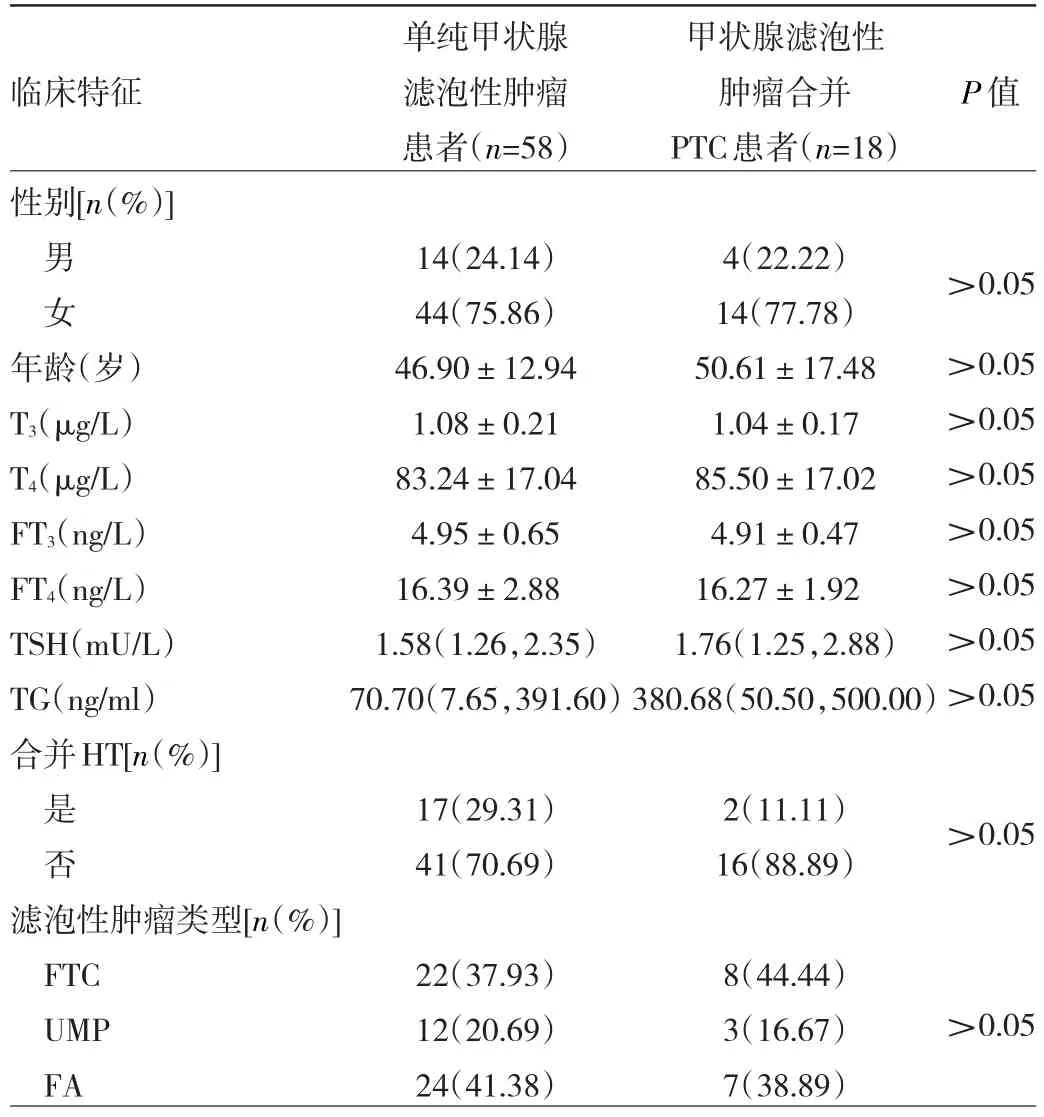
表3 甲状腺滤泡性肿瘤合并PTC患者与单纯甲状腺滤泡性肿瘤患者临床特征比较
2.5 甲状腺滤泡性肿瘤合并PTC患者手术方式及术后病理诊断分析 18例甲状腺滤泡性肿瘤合并PTC患者中4例术前考虑为甲状腺滤泡性肿瘤而仅接受单侧腺叶切除未行中央区淋巴结清扫,其余14例均接受PTC同侧中央区淋巴结清扫,另有2例行同侧侧颈区淋巴结清扫。18例甲状腺滤泡性肿瘤合并PTC患者中10例为术中或术后病理发现直径1~2 mm的微小病灶。14例淋巴结清扫患者中,6例发生中央区淋巴结转移,其中2例发生侧颈区淋巴结转移。单因素分析,甲状腺滤泡性肿瘤合并PTC患者淋巴结转移仅与PTC大小有关(P<0.05),淋巴结转移者PTC病灶较大,见表4。

表4 有无淋巴结转移的甲状腺滤泡性肿瘤合并PTC患者临床特征比较
3 讨论
PTC与甲状腺滤泡性肿瘤是甲状腺结节的常见类型。大多数患者表现为无症状,通常表现为孤立、无痛、肿大的颈部肿块。结节较大时通常可触摸到甲状腺肿块,超声检查有助于评估肿瘤的性质、大小及范围。甲状腺滤泡性肿瘤多为单个甲状腺结节出现,两者并发比较少见。其中FTC合并PTC者更是罕见,国内的文献报道不多[5-8]。国外的报道中对于此类病例也很有限,多数为个案报道[9-15]。本研究通过回顾性分析本院11年的甲状腺滤泡性肿瘤病例,合并PTC的发生率为23.68%(18/76)。而多数病例是在手术后的病理检查中偶然发现PTC病灶而确诊的。本文共纳入了18例甲状腺滤泡性肿瘤合并PTC的患者,不论FTC、UMP、FA,其合并的PTC病灶大部分为甲状腺微小乳头状癌,其中有10例肿瘤直径为1~2 mm小病灶,这与Kim等[16]的报道相符。虽然甲状腺滤泡性肿瘤合并PTC少见,但临床医师及病理科医师应准确评估,避免遗漏病灶。
PTC及甲状腺滤泡性肿瘤均起源于滤泡上皮细胞,对于多种甲状腺肿瘤共存的现象,不同的学者们对其发生机制提出了多种假说。有报道称RAS突变可同时发生于滤泡型PTC与FTC[17],提示同一种癌基因突变可驱动不同的肿瘤类型。也有观点认为相同的致癌因素是导致多瘤并存的原因[18]。肿瘤的多克隆起源的观点在近年来被逐渐认可,Kim等[16]报道称甲状腺髓样癌(medullary thyroid carcinoma,MTC)、FTC以及Graves病并发PTC的概率相近,病理证实不同肿瘤病灶被正常甲状腺组织分隔开来,多瘤并存只是一个巧合。本研究中,PTC和滤泡性肿瘤均为独立病灶,更倾向于多瘤病灶是偶然发生的假说。此外,甲状腺滤泡性肿瘤合并PTC患者与单纯甲状腺滤泡性肿瘤患者的基线资料比较差异均无统计学意义,似乎更支持多瘤偶发的可能。但具体机制尚不明确,有待更大样本量的研究阐明。
本研究进一步对3种类型的甲状腺滤泡性肿瘤的临床特点进行了分析比较。在所有滤泡性肿瘤中,3种滤泡性肿瘤的术前TG水平差异有统计学意义,同时在甲状腺滤泡性肿瘤合并PTC患者中,3种滤泡性肿瘤的术前TG水平也存在统计学差异。进一步两两比较,FTC患者术前TG水平高于FA患者,而UMP患者与FTC、FA患者比较差异均无统计学意义;FTC合并PTC患者术前TG水平高于FA合并PTC患者,而UMP合并PTC患者与FTC合并PTC、FA合并PTC患者比较差异均无统计学意义。Lee等[19]对164例穿刺无法明确诊断的滤泡性肿瘤进行分析,发现TG与滤泡性肿瘤的良恶性具有相关性,当TG的截断值选定为187.5 ng/ml时,对于滤泡性肿瘤良恶性鉴别的灵敏度和特异度分别为0.548和0.901(AUC=0.748,P<0.05)。王宗平等[20]通过对125例滤泡性肿瘤的回顾性分析,也认为TG对于滤泡性肿瘤良恶性的鉴别具有高特异度。基于上述研究,对于甲状腺滤泡性肿瘤合并PTC的患者,评估术前TG水平有助于鉴别滤泡性肿瘤的良恶性。
对于滤泡性肿瘤,因难以通过术前穿刺或术中冷冻病理检查明确鉴别良恶性,目前最新的指南推荐至少行单侧腺叶切除术,不推荐常规行中央区淋巴结清扫[21]。而对于滤泡性肿瘤合并PTC的患者,其处理原则应当遵循DTC的手术原则。对于术前明确PTC的,单侧PTC合并同侧滤泡性肿瘤且癌灶均局限于腺体内的,宜采用单侧腺叶及峡部切除+同侧中央区淋巴结清扫;单侧PTC合并对侧滤泡性肿瘤,应当行甲状腺全(近全)切除+同侧中央区淋巴结清扫。本研究中共有8例患者符合上述情形,考虑到术后长期的TSH抑制治疗,结合TG水平的评估,对于恶性可能低的滤泡性肿瘤,尽可能的保留部分对侧腺体。而对于病理检查偶然发现合并PTC的患者,往往病灶微小,淋巴结转移率低,本研究中的10例患者中,仅有1例发生了中央区淋巴结转移,且淋巴结转移灶直径均<0.1 cm。因而对于此类病例,无需再次手术行中央区淋巴结清扫,与患者充分沟通后行随访观察。
本研究不足之处为回顾性分析,其中FTC 30例,UMP 15例,18例合并PTC,近10余年预后均良好,有待后续长期随访中进一步探究滤泡性肿瘤合并PTC的临床特征与预后的意义。
综上所述,甲状腺滤泡性肿瘤合并PTC较为少见,其发生机制尚不明确。术前TG水平有助于鉴别PTC合并甲状腺滤泡性肿瘤的良恶性,判断甲状腺滤泡性肿瘤的疾病程度。
